2. 云南省大理州动物疫病预防控制中心, 大理 671005;
3. 内蒙古阿拉善右旗动物疫病预防控制中心, 阿拉善右旗 737300;
4. 内蒙古阿拉善左旗宗别立镇综合保障和技术推广中心, 阿拉善左旗 753421;
5. 江苏省人兽共患病学重点实验室 江苏高校动物重要疫病与人兽共患病防控协同创新中心, 扬州 225000
2. Animal Disease Prevention and Control Center of Dali Prefecture, Yunnan Province, Dali 671005, China;
3. Animal Disease Prevention and Control Center of Alxa Youqi, Inner Mongolia, Alxa Youqi 737300, China;
4. Comprehensive Security and Technology Promotion Center in Zongbieli Town, Alxa Zuoqi, Inner Mongolia, Alxa Zuoqi 753421, China;
5. Jiangsu University's Collaborative Innovation Center for the Prevention and Control of Important Animal Diseases and Zoonosis, Jiangsu Key Laboratory of Zoonosis, Yangzhou 225000, China
布鲁氏菌病(以下简称“布病”)是由布鲁氏菌感染引起的人畜共患传染病,人主要是通过直接或间接接触患病动物或动物产品而感染[1]。近十年,全国人间布病病例数呈上升趋势,畜间布病流行严重地区高达15个省(区),防控形势十分严峻[2]。准确诊断是布病防控的关键环节[3]。目前布病检测常用的血清学方法主要有虎红平板凝集试验(RBT)、试管凝集试验(SAT)、全乳环状反应(MRT)、荧光偏振试验(FPA)、补体结合试验(CFT)和酶联免疫吸附试验(ELISA)等[4-5]。ELISA方法作为实验室常用的检测方法之一,具有操作简单快速、高通量、结果判断简单等优点。在众多血清学检测方法中,世界动物卫生组织(WOAH)推荐FPA、间接ELISA(iELISA)和微量法补体结合试验(mCFT)作为确诊方法,竞争ELISA(cELISA)、RBT作为初筛方法[6]。而现行国家标准《动物布鲁氏菌病诊断技术(GB/T18646—2018)》推荐RBT和iELISA初筛,SAT、CFT和cELISA确诊[7],这显然与WOAH对诊断方法的选择不同。在初筛与确诊方法的选用策略上,本实验室的原则与WOAH一致,认为主要检测IgG类抗体的方法应作为确诊方法,可检测IgM抗体的方法应作为初筛方法。基于上述原则,本研究的净化策略是cELISA初筛、iELISA确诊,原因是iELISA主要检测IgG类抗体,而cELISA可同时检测血清中特异性IgM和IgG抗体[8]。
为验证本研究提出的“初筛—确诊”方法的科学性与准确性,本研究采用动物布病cELISA抗体检测试剂盒、牛布病iELISA抗体检测试剂盒,对西北牛场的布病阳性群体进行布病抗体检测,根据检测结果对阳性群体进行“检—淘”,最终以感染群体的净化效果来评估此方法的可行性,旨在为当前动物布病监测净化提供方案与参考。
1 材料与方法 1.1 血清样品牛血清共3 271份,收集自西北某规模化奶牛场。
1.2 主要试剂和仪器动物布病竞争ELISA抗体检测试剂盒,批号202303;牛布病间接ELISA抗体检测试剂盒,批号202303;mCFT用补体、溶血素、抗原、多功能酶标与荧光偏振仪(TECAN SPARK CYTO)、洗板机(Ts-20)等均由中国农业科学院北京畜牧兽医研究所农业农村部动物生物安全风险预警及防控重点实验室(北方)提供。布病阳性血清标准品(牛源,1000 ICFTU)购自英国NIBSC。
1.3 2种检测方法灵敏度的测定用1 mL生理盐水将布病阳性血清标准品复溶。再用生理盐水将血清进行1 ∶10、1 ∶12.5、1 ∶25、1 ∶50、1 ∶100等5个不同稀释度备用,即血清抗体含量分别为100、80、40、20、10 IU ·mL-1。采用cELISA、iELISA分别检测5个不同稀释度布病阳性血清标准品,每个稀释度重复3次,结果取其平均值,比较各方法之间的检测灵敏度。cELISA、iELISA按试剂盒说明书操作。各检测方法的判定标准如下:动物布病cELISA判定标准为抑制率百分比(percent of inhibitive,PI)值≥30%时,为布病抗体阳性(+);PI%值<30%时,为布病抗体阴性(-);牛布病iELISA判定标准为阳性百分比(样品OD值/阳对照OD值*100%,即P%值)≥20%时,为牛布病抗体阳性(+);P%值<20%时,为牛布病抗体阴性(-)。
1.4 临床样品的检测1.4.1 cELISA和iELISA检测 按照试剂盒说明书进行操作和结果判定。
1.4.2 mCFT检测 根据WOAH《陆生动物疾病疫苗和诊断手册》的方法[6],在测定溶血素、补体、抗原最佳使用浓度的基础上,将待检牛血清、阳性对照血清和阴性对照血清在96孔深孔稀释板中用生理盐水作1 ∶4倍稀释,放入水浴锅中灭能,56 ℃灭能30 min。然后取96孔U型底微孔板按表 1进行临床样品的检测。结果判定时,阳性血清加抗原对照孔和溶血素对照孔,须完全抑制溶血;阳性血清不加抗原对照孔和其他对照孔完全溶血,试验成立。被检临床血清不加抗原对照孔应完全溶血,表明反应结果符合要求,可判定被检临床血清加抗原检测孔结果[9]。溶血程度>50%判为阴性;溶血程度≤50%判为阳性。本方法检测灵敏度为当血清中含有抗体不低于20 ICFTU ·mL-1可检测为阳性。
|
|
表 1 临床样品的检测方法 Table 1 Testing methods for clinical samples |
经cELISA初筛、iELISA检测均为阳性的,判定为阳性动物。严格按照《布鲁氏菌病防治技术规范》进行无害化处理;若初筛为阳性的,确诊为阴性的,判定为可疑动物,应将可疑动物进行隔离消毒,禁止配种,在1个月后重新采样检测,cELISA和iELISA同时复检结果阳性的判定为阳性动物;复检结果为阴性的,判定为健康动物,对于健康动物应进行消毒后继续观察。可疑动物和阴性动物应在1个月后重新检测,直至3次检测全部转阴后判定为净化成功。
1.6 结果准确性的验证对上述检测结果进行分析,在“检—淘”模式多次筛选后,在个体阳性率低于2%[10]或全部转阴后用mCFT检测方法对iELISA确诊结果进行复核。
2 结果 2.1 2种检测方法灵敏度测定结果将布病阳性血清标准品(牛源)稀释成5个不同稀释度,用cELISA和iELISA进行检测,确定2种检测方法的灵敏度(表 2)。结果发现,2种检测方法检测灵敏度结果一致,即布病阳性血清标准品稀释1 ∶50(即20 ICFTU ·mL-1)均检测为阳性;布病阳性血清标准品稀释1 ∶100(即10 ICFTU ·mL-1)均检测为阴性,即cELISA、iELISA均和mCFT检测灵敏度一致。
|
|
表 2 2种布病抗体检测方法灵敏度检测结果 Table 2 Sensitivity test results of two antibody detection methods for brucellosis |
采用cELISA抗体检测试剂盒对840份牛血清进行检测,cELISA检出的阳性样品476份,阳性率为56.67%。结果见表 3。
|
|
表 3 “初筛—确诊”净化方式对布病阳性牛群结果统计表 Table 3 Results of the purification method of "preliminary screening-confirmed diagnosis" on positive cattle herds with brucellosis |
采用iELISA抗体检测试剂盒对840份牛血清进行确诊检测,iELISA检测阳性样品297份,阳性率为35.36%。cELISA检测阳性样品476份样品完全覆盖iELISA检测的297份阳性样品。结果见表 3。
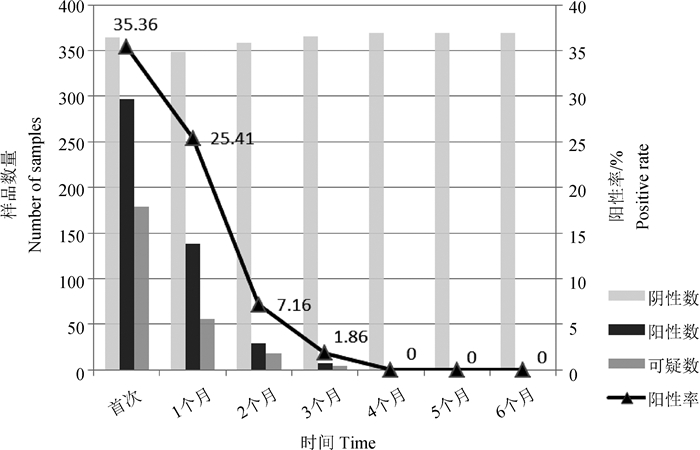
2.4 检测和净化结果根据判定标准要求,cELISA、iELISA同时检测阳性的,判定为抗体阳性,cELISA阳性但iELISA阴性的判定为可疑,在第1次采样1个月后重新采样进行检测。在第3个月时,由于前期“检—淘”方式已将大部分阳性动物进行处理,仅有11份样品为阳性或可疑(7+4)。在第4个月进行检测时场群个体已全部转阴,为了进一步确定净化结果,又在第5、6个月连续两个月对全群重新检测,结果均为阴性。至此,6个月后该场群最终实现布病牛群净化。与首次相同,每次cELISA方法检测到的阳性样本均覆盖了iELISA检测的阳性样本。具体结果如表 3和图 1所示。
|
图 1 “初筛—确诊”净化方式下牛群布病净化效果图 Fig. 1 Purification effect diagram of bovine brucellosis under the "preliminary screening-confirmed diagnosis" purification method |
在第3个月采用mCFT对检测为阳性或可疑的11份(7+4)血清和365份阴性血清进行复核确诊。7份阳性血清经mCFT复核为阳性,4份可疑血清均为阴性;365份阴性血清样品经mCFT复核全部为阴性。iELISA与mCFT的结果符合率为100%。第4个月、第5个月、第6个月样本也均为阴性。结果见表 4。
|
|
表 4 mCFT复核结果记录表 Table 4 Review results of mCFT |
目前我国布病防控面临的主要问题之一就是如何实现快速、准确的诊断,为布病防控提供有效方法。布鲁氏菌病的诊断方法分为病原学方法和血清学方法[11],其中血清学方法目前仍是布鲁氏菌病的临床诊断和监测的最主要检测方法[12]。我国现行的动物布鲁氏菌病诊断技术标准(GB/T18646— 2018)规定了多种动物布鲁氏菌病血清学检测方法,其中虎红平板凝集试验适合初筛,而国标中规定试管凝集试验作为确诊方法,但其敏感性和特异性均较差,容易造成错检和漏检。其他方法如ELISA和FPA等虽然简单快速,但受限于基层试验能力和设备的缺乏,加之各个试剂盒的检测标准不一致,在使用时仍需进一步验证推广。同时,国标中在初筛与确诊方法的选择上与国际推荐方法不同,容易造成漏检或误杀,用于布病净化时往往因不能及时将阳性与可疑动物隔离出群而导致净化失败[13]。
在布病净化策略上,“免疫-检测-淘汰”的模式在国外布病净化过程中被普遍使用,并已在多个国家证明其价值,国外的检测方法多使用补体结合试验和ELISA试验等方法[14]。但是我国的净化难度相较而言要困难许多,首先我国的动物饲养量巨大且流通频繁,加之原有检测方法和能力不足,虽然在上世纪实现布病疫情的控制,但近年来随着经济发展,布病的感染病例数居高不下,证明了原有的净化策略存在严重问题,亟需使用新的检测手段进行场群的布病净化[15]。
本研究根据不同检测方法检测抗体类型的不同,采用cELISA初筛、iELISA确诊。所使用试剂盒的检测灵敏度也被有效控制与mCFT一致,即当血清中布鲁氏菌抗体含量不低于20 ICFTU ·mL-1时,检测为阳性;抗体含量低于20 ICFTU ·mL-1时,检测为阴性。因此在同一检测灵敏度条件下,cELISA方法由于竞争法的原理可检测更多的抗体类型,比只能检出IgG类抗体的iELISA检出更多阳性样品,并能覆盖iELISA检测的阳性[16]。虽然cELISA方法能筛选到更多的阳性样品,但是由于IgM抗体本身的非特异性,从而存在假阳性,因此仅cELISA检测为阳性的判定为可疑动物[17-18]。可疑动物在本研究的再次采样检测中大部分检测结果显示阴性,因此验证了cELISA方法仅适合于作为初筛的方法,确保群体里可疑动物及时被隔离出群。
在本研究中,当两种方法的灵敏度相同时,采用cELISA初筛和iELISA确诊的组合方式检测,当cELISA与iELISA检测结果一致便可直接判定为阳性或阴性;当仅cELISA方法检测为阳性,则判为可疑;全面消毒隔离30 d后再次进行采样检测,结果表明在实施上述净化策略下,牛群个体阳性率从开始的35.71%持续下降,3个月后实现了对于群体布病的有效控制(阳性率为1.86%),4个月后实现布病感染群体的全面净化,使得该群体近一半的动物能够留存,大大降低了经济损失。在“检—淘”模式下,采取严格的消毒措施同样重要,对受到污染的圈舍、地面、饲养工具以及周边环境进行彻底消毒[19],是保证净化策略取得成效的有力措施。
需要说明的是,本研究使用的新型净化策略的核心是两个试剂盒(竞争ELISA和间接ELISA)的灵敏度与补体结合试验一致,且使用策略与WOAH的要求相同。如果使用其他商品化试剂盒,如其灵敏度、检测原理和使用方法不一致,是无法使用研究中的净化策略进行布病净化。所以使用本研究中的策略进行布病净化工作,需要首先评价检测方法的灵敏度等重要参数,做好效果评价才能使用。同时,目前的净化措施虽然可以做到全群净化,但仍会带来一定的经济损失,所以预防和控制布病流行和传播的关键点还是要做好群体免疫以及加强生物安全意识和管理措施,阻止疫情的发生和传播。
4 结论本研究采用与mCFT相同灵敏度的cELISA和iELISA诊断方法,按照“cELISA初筛—iELISA确诊”的策略,在短时间内实现了对于布病严重流行牛群的净化,避免了全群扑杀的重大经济损失。本研究所推荐的检测方法适用于布病阳性场的全面净化,具有可操作性和临床使用价值。
| [1] |
CORBEL M J. Brucellosis: an overview[J]. Emerg Infect Dis, 1997, 3(2): 213-221. DOI:10.3201/eid0302.970219 |
| [2] |
农业农村部. 农业农村部关于印发《全国畜间人兽共患病防治规划(2022—2030年)》的通知农牧发〔2022〕31号[J]. 中华人民共和国农业农村部公报, 2022, 17-25. |
| [3] |
DENG Y M, LIU X Y, DUAN K F, et al. Research progress on brucellosis[J]. Curr Med Chem, 2019, 26(30): 5598-5608. DOI:10.2174/0929867325666180510125009 |
| [4] |
SHAKIR R. Brucellosis[J]. J Neurol Sci, 2021, 420: 117280. DOI:10.1016/j.jns.2020.117280 |
| [5] |
刘佳音, 姜海. 我国布鲁氏菌病诊断方法应用及思考[J]. 中华流行病学杂志, 2021, 42(1): 160-163. LIU J Y, JIANG H. Application and thinking of diagnostic methods of brucellosis in China[J]. Chinese Journal of Epidemiology, 2021, 42(1): 160-163. (in Chinese) |
| [6] |
WOAH. Brucellosis, manual of diagnostic tests and vaccines for terrestrial animals[M]. World Organization for Animal Health, 2022.
|
| [7] |
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. GB/T 18646—2018动物布鲁氏菌病诊断技术[S]. 北京: 中国标准出版社, 2018. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China, Standardization Administration of the People's Republic of China. GB/T 18646—2018 Diagnostic techniques for animal brucellosis[S]. Beijing: Standards Press of China, 2018. (in Chinese) |
| [8] |
ALLAN G S, CHAPPEL R J, WILLIAMSON P, et al. A quantitative comparison of the sensitivity of serological tests for bovine brucellosis to different antibody classes[J]. J Hyg (Lond), 1976, 76(2): 287-298. DOI:10.1017/S0022172400055182 |
| [9] |
蒋卉, 冯宇, 秦玉明, 等. 布鲁氏菌病微量补体结合试验的方法改进和应用[J]. 中国农业科学, 2022, 55(8): 1676-1684. JIANG H, FENG Y, QIN Y M, et al. Method improvement and its application of micro complement fixation test for brucellosis[J]. Scientia Agricultura Sinica, 2022, 55(8): 1676-1684. (in Chinese) |
| [10] |
农业部办公厅. 常见动物疫病免疫推荐方案(试行)[Z]. 农业部, 2014. Office of the Ministry of Agriculture. Recommended Immunization Scheme for Common Animal Diseases (Trial)[Z]. Ministry of Agriculture, 2014. (in Chinese) |
| [11] |
NAN W L, ZHANG Y Y, TAN P F, et al. A rapid cycleave PCR method for distinguishing the vaccine strain Brucella abortus A19 in China[J]. J Vet Diagn Invest, 2016, 28(3): 214-218. DOI:10.1177/1040638716640315 |
| [12] |
白翠, 马晓媛, 王楠, 等. 畜间布鲁氏菌病的血清学检测方法[J]. 吉林畜牧兽医, 2021, 42(1): 84. BAI C, MA X Y, WANG N, et al. Serological detection method for brucellosis in livestock[J]. Jilin Animal Husbandry and Veterinary Medicine, 2021, 42(1): 84. (in Chinese) |
| [13] |
应清香, 李鹤, 岑晓鹏, 等. 规模奶牛场布病净化措施探讨[J]. 中国畜禽种业, 2017, 13(2): 126-127. YING Q X, LI H, CEN X P, et al. Exploration of measures for purifying brucellosis in large-scale dairy farms[J]. The Chinese Livestock and Poultry Breeding, 2017, 13(2): 126-127. (in Chinese) |
| [14] |
ZHANG N, HUANG D S, WU W, et al. Animal brucellosis control or eradication programs worldwide: A systematic review of experiences and lessons learned[J]. Prev Vet Med, 2018, 160: 105-115. DOI:10.1016/j.prevetmed.2018.10.002 |
| [15] |
JIANG H, O'CALLAGHAN D, DING J B. Brucellosis in China: history, progress and challenge[J]. Infect Dis Poverty, 2020, 9(1): 55. DOI:10.1186/s40249-020-00673-8 |
| [16] |
MEMISH Z A, ALMUNEEF M, MAH M W, et al. Comparison of the brucella standard agglutination test with the ELISA IgG and IgM in patients with brucella bacteremia[J]. Diagn Microbiol Infect Dis, 2002, 44(2): 129-132. DOI:10.1016/S0732-8893(02)00426-1 |
| [17] |
DEL POZO J S G, ORTUÑO S L, NAVARRO E, et al. Detection of IgM antibrucella antibody in the absence of IgGs: a challenge for the clinical interpretation of brucella serology[J]. PLoS Negl Trop Dis, 2014, 8(12): e3390. DOI:10.1371/journal.pntd.0003390 |
| [18] |
PRINCE H E, LOPEZ J, YEH C, et al. Performance characteristics of the Euroimmun enzyme-linked immunosorbent assay kits for Brucella IgG and IgM[J]. Diagn Microbiol Infect Dis, 2009, 65(2): 99-102. DOI:10.1016/j.diagmicrobio.2009.06.002 |
| [19] |
杨倩. 规模化养殖场消毒剂的种类及消毒误区分析[J]. 今日畜牧兽医, 2023, 39(2): 45-46, 58. YANG Q. Analysis of the types of disinfectants and disinfection misconceptions in large-scale aquaculture farms[J]. Today Animal Husbandry and Veterinary Medicine, 2023, 39(2): 45-46, 58. (in Chinese) |
(编辑 范子娟)



