2. 绵羊健康养殖与人兽共患病防控协同创新中心, 石河子 832000;
3. 天康生物制药有限公司, 乌鲁木齐 830011;
4. 石河子大学 动物疾病防控兵团重点实验室, 石河子 832000
2. Collaborative Innovation Center for Healthy Breeding and Prevention and Control of Human-Veterinary Diseases in Sheep, Shihezi 832000, China;
3. Tiankang Biopharmaceutical Co., Ltd., Urumchi 830011, China;
4. Key Laboratory of Animal Disease Prevention and Control Corps, Shihezi University, Shihezi 832000, China
布鲁氏菌病(brucellosis,简称“布病”)是一种全球性的人兽共患病,严重危害人类和哺乳动物的健康,同时也严重影响畜牧业发展[1-2]。在我国的养牛产业中,布鲁氏菌对牛的危害十分严重。感染布鲁氏菌后,公牛会出现睾丸炎、附睾炎等症状,精子质量也会明显下降;母牛则可能会出现流产等症状[3-4]。目前,疫苗接种是防控布病重要手段之一,我国主要使用A19疫苗株来预防牛布鲁氏菌病[5-6]。尽管A19疫苗具有良好的免疫效果,但仍然存在一定的毒力残留,从而导致母牛流产和人类感染的风险[7-8]。
Ⅳ型分泌系统(type four secretion systems,T4SS)是布鲁氏菌重要的毒力因子之一,布鲁氏菌依赖于VirB操纵子编码的T4SS系统在宿主细胞中存活和复制引起机体发病[9-10]。在细胞感染期间,布鲁氏菌T4SS系统可被迅速激活,释放效应物改变细胞内囊泡转运途径,诱导宿主免疫应答,从而促进布鲁氏菌在宿主细胞内的复制,诱导持续感染[11]。BtpA是T4SS系统分泌的重要效应物之一,其与MAL相互作用,竞争TLR 4受体,抑制NF-κB的活化和DC的成熟,从而有助于布鲁氏菌在细胞内存活。纯化的BtpA蛋白还能抑制CD8+ T细胞介导的杀伤反应,其可能还参与调控获得性免疫反应[12-14]。本研究通过构建A19ΔBtpA缺失株探究BtpA的功能,包括对布鲁氏菌胞内存活、黏附和侵袭以及体外应激的影响。此外,还将A19株和A19ΔBtpA缺失株免疫小鼠,以研究缺失BtpA对布鲁氏菌A19株免疫原性的影响。这些研究结果将为进一步探究布鲁氏菌的致病机制和开发基因缺失株疫苗提供理论基础和数据支持。
1 材料与方法 1.1 实验动物雌性6~8周龄ICR小鼠购自新疆医科大学动物试验中心。
1.2 主要材料牛种布鲁氏菌A19疫苗株购自天康生物股份有限公司;大肠杆菌DH5α感受态细胞、pUC57载体和RAW264.7细胞均由绵羊健康养殖与人兽共患病防控协同创新中心保存;T4 DNA连接酶、琼脂糖凝胶回收试剂盒、DNA Marker均购自TaKaRa公司; 质粒DNA小提试剂盒购自天根生化科技(北京)有限公司;电击杯购自Bio-Rad公司;布鲁氏菌间接酶联免疫抗体检测试剂盒购自哈尔滨平河生物技术有限公司;小鼠IFN-γ酶联免疫斑点测定法(ELISpot)检测试剂盒购自北京欣博盛生物科技有限公司。
1.3 BtpA自杀质粒的构建1.3.1 引物设计与合成 于NCBI中搜索牛种布鲁氏菌A19 BtpA基因的上、下游同源臂基因和卡那霉素抗性基因,通过Primer Premier 6.0设计BtpA基因的上、下游同源臂、Kan基因和BtpA引物,由青岛睿博兴科生物技术有限公司进行合成,引物序列见表 1。
|
|
表 1 目的基因扩增引物序列 Table 1 Sequence of primers for amplification of target gene |
1.3.2 自杀质粒构建与鉴定 以热灭活牛种布鲁氏菌A19为模板,使用引物A上-F、A上-R和A下-F、A下-R分别扩增BtpA上游同源臂(BtpA-N)和下游同源臂(BtpA-C),用K-F和K-R扩增卡那霉素抗性基因(K)。PCR反应完成后, 用1.0%琼脂糖凝胶电泳验证,验证正确后进行胶回收。采用巢式PCR方法,将BtpA-N、Kana和BtpA-C基因按照1 ∶1 ∶1的比例进行混合,第1阶段以胶回收的BtpA-N、Kana和BtpA-C基因片段为模板进行PCR扩增;第2阶段以第1阶段的PCR产物为模板, 用引物A上-F和A下-R扩增全长,然后回收全长片段。PCR扩增产物通过1.0%琼脂糖凝胶电泳验证,验证正确后进行胶回收。将获得的融合片段与pUC57载体质粒相3 ∶1连接,构建pUC57-BtpA-Kan自杀质粒。自杀质粒转化大肠杆菌DH5α感受态细胞后,涂布于氨苄、卡那霉素抗性的LB固体培养基上,筛选阳性菌落。阳性菌落用A上-F和A下-R引物进行菌液PCR鉴定,鉴定成功后交由青岛睿博兴科生物技术有限公司进行基因测序鉴定。
1.4 布鲁氏菌A19ΔBtpA缺失株构建及筛选将布鲁氏菌A19株培养至对数生长期(OD600 nm≈0.6),冰上孵育10~15 min,离心收菌后用无菌去离子水清洗2遍,用15%甘油水清洗1遍,最后用适量的15%甘油水重悬菌体,以制备布鲁氏菌感受态细胞。将构建pUC57-BtpA-Kan自杀质粒用去离子水进行洗脱后,取3~8 μL的质粒(质粒浓度控制在500~1 500 ng ·μL-1)加入布鲁氏菌感受态中,混匀冰浴10 min后加入到提前预冷的电击杯,1 800 V电压电击后加入1 mL 37 ℃预热的布鲁氏菌液体培养基,于37 ℃、170 r ·min-1摇床中培养24 h后涂布于带有kana抗性的布鲁氏菌固体培养板上,37 ℃,培养48 h后挑取阳性菌落。对阳性菌落进行连续传代后进行PCR鉴定,鉴定正确的即为布鲁氏菌A19ΔBtpA缺失株。
1.5 qRT-PCR检测A19ΔBtpA缺失株BtpA mRNA转录水平将布鲁氏菌A19株和鉴定成功的A19ΔBtpA缺失株培养至对数生长期(OD600 nm≈0.6),热灭活,RNA提取试剂盒进行RNA的提取,并用反转录试剂盒反转录成cDNA。采用Roche LightCycler480®荧光实时定量PCR仪,以提取的A19株和A19ΔBtpA缺失株细菌cDNA为模板,16 S为内参基因,检测BtpA mRNA转录水平。引物序列见表 2,反应条件:95 ℃ 30 s,95 ℃ 5 s,60 ℃ 10 s,72 ℃ 15 s,40个循环。用2-ΔΔCt法进行相对定量分析。在同样的条件下进行3个试验重复。
|
|
表 2 qRT-PCR引物序列 Table 2 Sequences of qRT-PCR primers |
从布鲁氏菌固体培养板上挑取的A19株和A19ΔBtpA缺失株单克隆菌落接种至20 mL布鲁氏菌液体培养基中, 于37 ℃、180 r ·min-1摇床中培养至OD600 nm≈0.5,然后分别稀释至OD60 nm≈0.2,于37 ℃、180 r ·min-1摇床中培养。每2 h取一次样,检测浓度,直至各菌繁殖进入平台期。
A19株和A19ΔBtpA缺失株分别取1×108个菌数接种于58 ℃、pH 4.5、pH 11.5和含有1.5 mol ·L-1 NaCl的布鲁氏菌液体培养基以及正常的布鲁氏菌液体培养基中,在37 ℃、180 r ·min-1摇床中培养30 min。离心收菌后用PBS重悬,1 000倍稀释后涂布于布鲁氏菌固体培养基上,37 ℃倒置培养48 h后CFU计数。
1.7 布鲁氏菌A19和A19ΔBtpA缺失株胞内存活和黏附侵袭试验培养的小鼠巨噬细胞RAW264.7以1×106 ·孔-1接种于6孔板中,培养至贴壁形成单层细胞。将处于对数生长期的布鲁氏菌A19和A19ΔBtpA以100 ∶1的MOI侵染细胞,37 ℃、5% CO2培养箱内孵育1 h。加入含有2.5%庆大霉素继续孵育45 min。PBS清洗3次,加入含10% FBS的DMEM在0、4、12、24、48 h后弃去培养基,PBS清洗3次,用0.01% Trition X-100裂解细胞,释放出胞内菌,稀释100倍后涂布于布鲁氏菌固体培养基上,CFU计数。
将A19株和A19ΔBtpA缺失株以100 ∶1的MOI浸染RAW264.7细胞,在浸染15、30和45 min后用庆大霉素杀死胞外菌。PBS清洗3遍,用0.01% Triton X-100裂解细胞, 稀释100倍后涂布于布鲁氏菌固体培养基,CFU计数。
1.8 动物试验将4~6周龄ICR雌性小鼠分组,分别为A19、A19ΔBtpA和PBS组,分别免疫小鼠,每小组8只。将A19和A19ΔBtpA以2.5×105 ·只-1腹腔注射接种小鼠,小鼠免疫后第7、14、21、28、35天进行断尾采血,离心分离血清,-20 ℃保存备用。
1.8.1 间接ELISA检测小鼠体内布鲁氏菌特异性抗体 小鼠断尾采血,采集第7、14、21、28天时间段的小鼠血清,使用小鼠布鲁氏菌抗体检测试剂盒检测免疫小鼠体内布鲁氏菌抗体含量,监测免疫小鼠体液免疫水平。
1.8.2 ELISpot检测小鼠脾淋巴细胞IFN-γ表达水平 于免疫第21天后处死小鼠,分离脾脏,参照小鼠淋巴细胞分离试剂盒说明书获得小鼠淋巴细胞并计数。将分离的小鼠脾淋巴细胞稀释为2×106 ·mL-1,加入ELISpot板中,再分别加入10 μL ConA(100 μg ·mL-1)、10 μL A19和A19ΔBtpA(1× 105 ·孔-1)、和10 μL PBS,分别作为ConA刺激的A19、A19ΔBtpA和PBS组(A19+ConA、A19ΔBtpA+ConA和PBS+ConA)、A19组、A19ΔBtpA组和PBS对照组,每组重复3孔。37 ℃培养24 h后,加入含0.5%胎牛血清的PBS稀释至1 μg ·mL-1的IFN-γ抗体(R4-6A2-biotin)100 μL孵育2 h;再加入100 μL链霉亲和素-辣根过氧化物酶(1 ∶1 000),室温孵育1 h后,加入100 μL底物溶液(BCIP/NBT-plus)显色,直至有明显斑点出现,用自来水冲洗终止反应。利用AELVIS ELISpot Reader计数斑点。
1.8.3 流式细胞术检测小鼠脾IFN-γ阳性CD4+和CD8+T淋巴细胞 于免疫第21天后随机各组处死小鼠,分离脾,参照“1.8.2”相同方法获得小鼠淋巴细胞。分别加入2 μL FITC anti-mouse CD4+、PE anti-mouse CD8+和PerCP/Cyanien5.5 anti-mouse IFN-γ抗体,室温避光孵育15~30 min;100 μL全血加入2 mL 1×红细胞裂解液,避光裂解8~12 min。加1 mL PBS,1 000 r ·min-1离心5 min,洗涤细胞,离心后弃上清;用流式细胞仪测定分析T淋巴细胞亚群,得到脾细胞中CD4+、CD8+ T淋巴细胞数量。
1.8.4 流式细胞术检测小鼠脾淋巴CD4+/CD8+T细胞表达水平 参照“1.8.2”方法分离小鼠淋巴细胞,孵育FITC anti-mouse CD4+和PE anti-mouse CD8+抗体,用流式细胞仪测定分析T淋巴细胞亚群,得到脾细胞中CD4+、CD8+ T淋巴细胞数量。
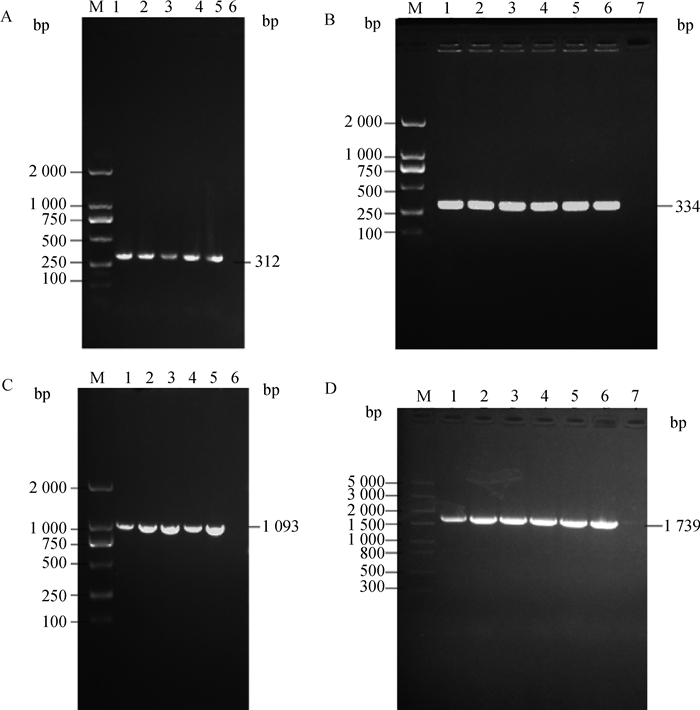
2 结果 2.1 pUC57-BtpA-Kan自杀质粒构建与鉴定以布鲁氏菌A19株和HemH质粒作为模板,分别对BtpA-N、BtpA-C和Kana基因进行特异性扩增。结果显示,扩增产物分别为312、334和1 093 bp的特异性条带(图 1A、B、C),与预期片段大小相符,表明扩增成功。将3个扩增片段按照浓度1 ∶1 ∶1的比例混合进行巢式PCR,结果显示,融合片段大小为1 739 bp(图 1D),与预期片段大小相符。融合片段连接pUC57载体后,转化大肠杆菌DH5α感受态细胞,经菌液PCR鉴定,结果与预期大小一致,将阳性的菌液进行测序,其相似性为100%,表明自杀质粒构建成功。
|
A. BtpA-N基因片段扩增;B. BtpA-C基因片段扩增;C. Kana基因片段扩增;D. BtpA-N、Kana和BtpA-C片段融合基因片段扩增 A. Amplification of BtpA-N gene fragments; B. Amplification of BtpA-C gene fragments; C. Amplification of Kana gene fragments; D. Amplification of BtpA-N, Kana and BtpA-C fragment fusion gene fragments 图 1 目的基因片段扩增 Fig. 1 Amplification of target gene fragments |
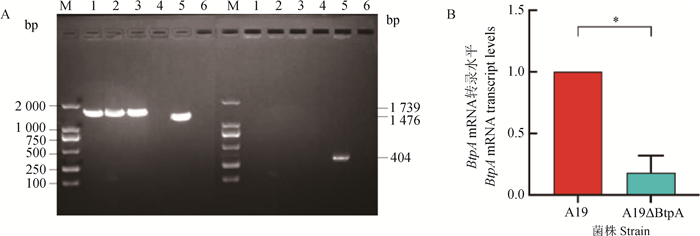
对电转化后阳性菌落进行PCR鉴定,根据琼脂糖凝胶电泳显示成功扩增出1 793bp自杀质粒基因,成功扩增出1 476 bp亲本株基因(图 2A),A19株的扩增片段略小于构建的BtpA基因缺失株。用引物BtpA-F和BtpA-R从亲本株中扩增出大小为404 bp内部基因(图 2A), 而BtpA基因缺失株无法扩增出内部基因。表明布鲁氏菌BtpA基因缺失株A19ΔBtpA构建成功。使用qRT-PCR检测A19ΔBtpA缺失株BtpA mRNA转录水平,以布鲁氏菌A19和A19ΔBtpA株菌液为cDNA模板,16S为内参基因。结果如图 2B所示,与亲本株A19相比,A19ΔBtpA缺失株BtpA基因表达水平显著降低(P < 0.05),成功缺失掉BtpA基因。
|
A. A19ΔBtpA缺失株PCR验证;B. A19ΔBtpA缺失株BtpA mRNA转录水平。*. P < 0.05,**. P < 0.01,***. P < 0.001, 下同 A. Results of PCR validation of Brucella abortus A19ΔBtpA deletion strain; B. BtpA mRNA transcript levels in A19ΔBtpA deletion strains. *. P < 0.05, **. P < 0.01, ***. P < 0.001, the same as below 图 2 布鲁氏菌A19ΔBtpA缺失株鉴定 Fig. 2 Identification of Brucella abortus A19ΔBtpA deletion strain |
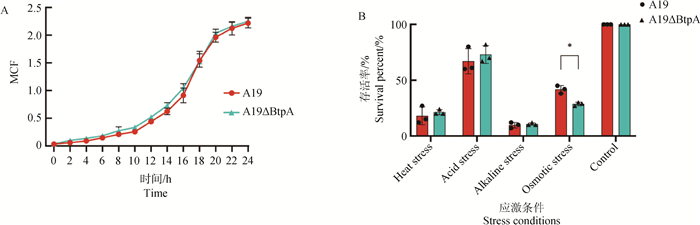
由图 3 A可知A19株和A19ΔBtpA缺失株生长曲线总体趋势一致,在10 h左右达到对数生长期,在20 h左右达到平台期。图 3B检测了在高温、酸性、碱性和高渗应激条件下,布鲁氏菌A19和A19ΔBtpA缺失株的生存率,在高温、酸性和碱性应激条件下,A19和A19ΔBtpA缺失株生存率没有差异,而在高渗应激条件下,A19ΔBtpA缺失株的生存率要显著低于A19株。
|
A. A19株和A19ΔBtpA缺失株的生长曲线;B. 不同应激条件下A19株和A19ΔBtpA缺失株生存情况 A. Growth curves of A19 strain and A19ΔBtpA deletion strain; B. Survival of A19 strain and A19ΔBtpA deletion strain under different stress conditions 图 3 A19株和A19ΔBtpA缺失株的生长曲线和体外应激 Fig. 3 Growth curves and in vitro stress of the A19 strain and the A19ΔBtpA deletion strain |
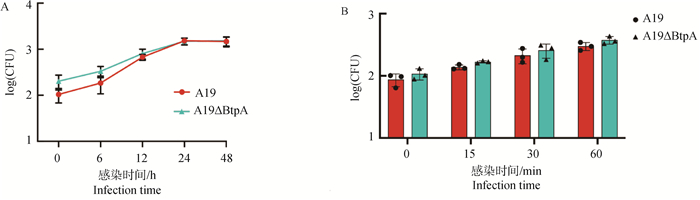
通过对A19株和A19ΔBtpA缺失株各个时间段在巨噬细胞的胞内存活和黏附侵袭数量发现,亲本株A19和缺失株A19ΔBtpA总体趋势无明显差异(图 4A、B)。
|
A. A19株和A19ΔBtpA缺失株胞内生存情况;B. A19株和A19ΔBtpA缺失株黏附侵袭情况 A. Intracellular survival of A19 strain and A19ΔBtpA deletion strain; B. Adhesion invasion of A19 strain and A19ΔBtpA deletion strain 图 4 A19株和A19ΔBtpA缺失株的胞内生存和黏附侵袭 Fig. 4 Intracellular survival and adhesive invasion in A19 strain and A19ΔBtpA deletion strain |
小鼠血清中的布鲁氏菌特异性抗体水平检测结果显示,在不同时间点,A19和A19ΔBtpA组布鲁氏菌特异性抗体水平均极显著高于PBS对照组,而A19与A19ΔBtpA组之间诱导抗体水平趋势相同(图 5),说明A19ΔBtpA缺失株同样可以诱导小鼠产生与A19株相当的布鲁氏菌特异性抗体IgG。
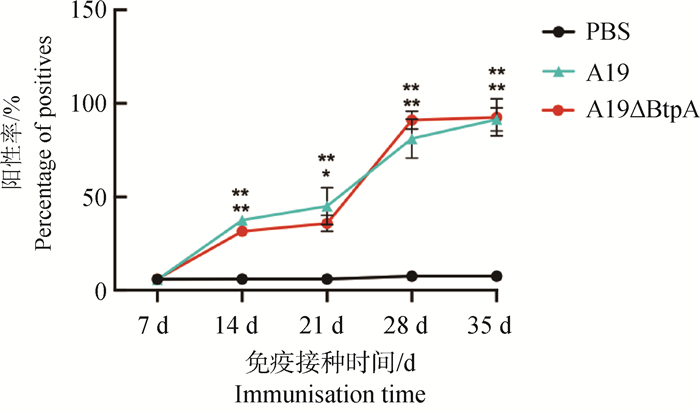
|
图 5 间接ELISA检测小鼠特异性抗体IgG Fig. 5 Indirect ELISA for detection of mouse-specific antibody IgG |
ELISpot检测结果表明,与PBS组相比,A19和A19ΔBtpA组淋巴细胞IFN-γ表达水平极显著升高(P < 0.01;P < 0.001,图 6)。与A19组相比,A19ΔBtpA组淋巴细胞IFN-γ表达水平显著升高(P < 0.05,图 6)。
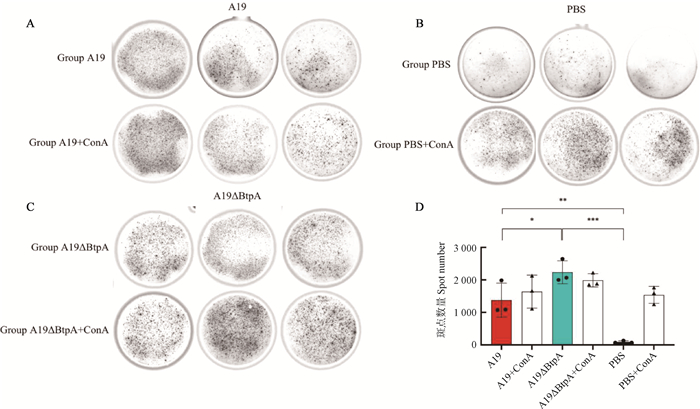
|
A. A19株ELISpot检测结果;B. 阴性对照组ELISpot检测结果;C. A19ΔBtpA缺失株ELISpot检测结果;D. ELISpot检测结果柱形图 A. ELISpot test results of A19 strain; B. ELISpot test results of negative control; C. ELISpot test results of A19ΔBtpA deletion strain; D. Bar graph of ELISpot test results 图 6 ELISpot检测小鼠淋巴细胞IFN-γ表达水平 Fig. 6 ELISpot detection of IFN-γ expression level in mouse lymphocytes |
流式细胞仪检测结果显示,A19组和A19ΔBtpA组IFN-γ阳性CD4+和CD8+T淋巴细胞极显著高于PBS组(P < 0.001,图 7、8);A19ΔBtpA组IFN-γ阳性CD4+和CD8+T淋巴细胞显著高于A19组(P < 0.05,图 7、8)。
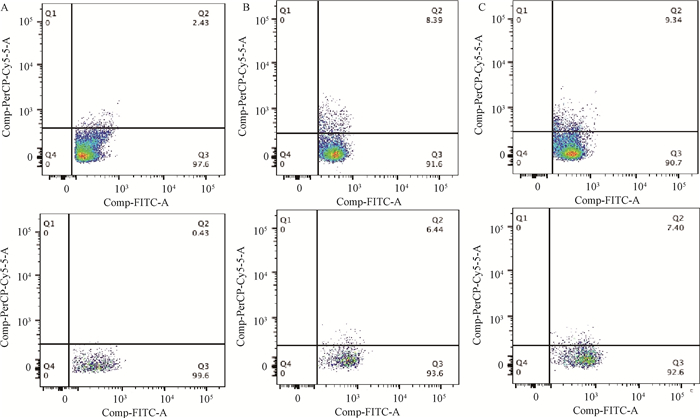
|
A. PBS组IFN-γ阳性CD4+和CD8+ T淋巴细胞;B. A19组IFN-γ阳性CD4+和CD8+ T淋巴细胞;C. A19ΔBtpA组IFN-γ阳性CD4+和CD8+ T淋巴细胞 A. IFN-γ expression level of CD4+ and CD8+ T lymphocytes in PBS group; B. IFN-γ expression level of CD4+ and CD8+ T lymphocytes in A19 group; C. IFN-γ expression level of CD4+ and CD8+ T lymphocytes in A19ΔBtpA group 图 7 小鼠IFN-γ阳性CD4+和CD8+T淋巴细胞流式图 Fig. 7 Flow chart of IFN-γ expression levels in mouse CD4+ and CD8+ T lymphocytes |
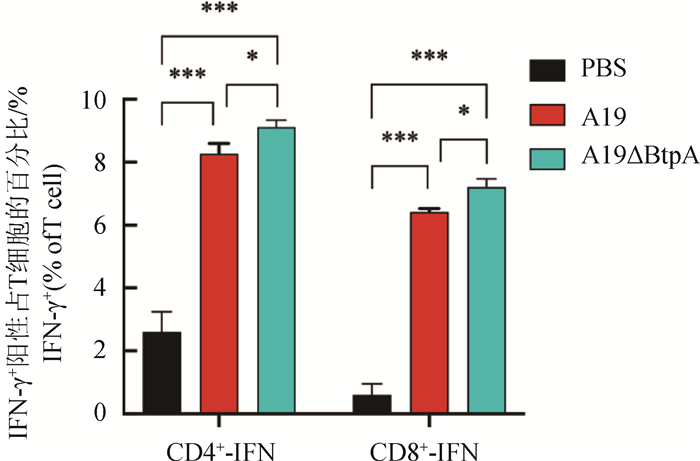
|
图 8 小鼠IFN-γ阳性CD4+和CD8+T淋巴细胞比较 Fig. 8 Comparison of IFN-γ expression levels in mouse CD4+ and CD8+ T lymphocytes |
流式细胞仪检测结果显示,A19组和A19ΔBtpA组CD4+/CD8+T细胞比值极显著高于PBS组(P < 0.001,图 9、10);A19ΔBtpA组CD4+/CD8+T细胞比值显著高于A19组(P < 0.05,图 9、10)。
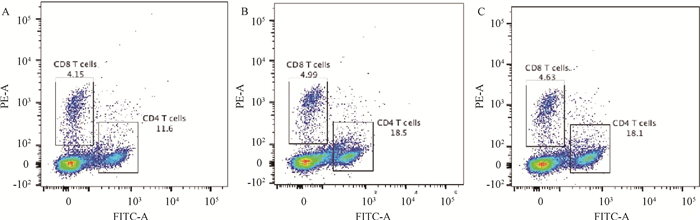
|
A. PBS组CD4+/CD8+ T淋巴细胞分群;B. A19组CD4+/CD8+ T淋巴细胞分群;C. A19ΔBtpA组CD4+/CD8+ T淋巴细胞分群 A. CD4+/CD8+ T-lymphocyte fraction in PBS group; B. CD4+/CD8+ T-lymphocyte fraction in A19 group; C. CD4+/CD8+ T-lymphocyte fraction in A19ΔBtpA group 图 9 小鼠T淋巴细胞亚群分类流式图 Fig. 9 Flow chart of mouse T lymphocyte subpopulation classification |
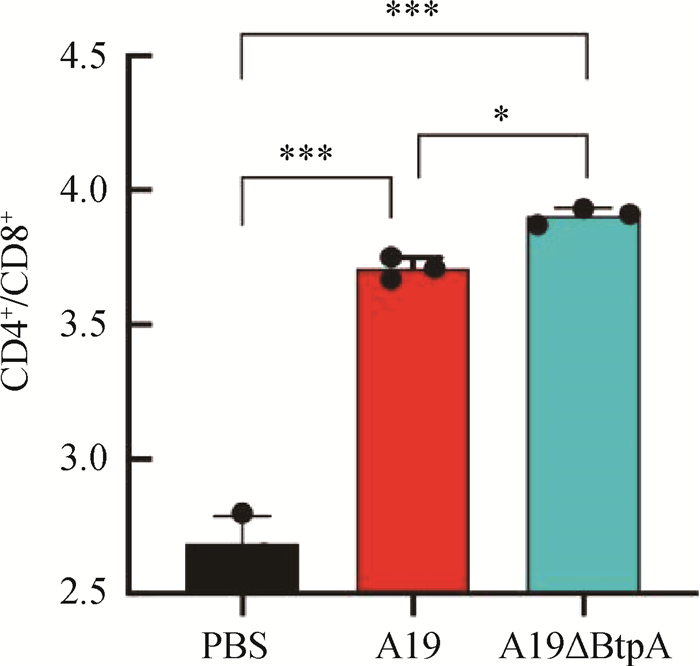
|
图 10 小鼠T淋巴细胞CD4+/CD8+比较 Fig. 10 Comparison of CD4+/CD8+ in mouse T lymphocytes |
BtpA作为布鲁氏菌T4SS系统中的重要分泌蛋白之一,在抑制宿主细胞免疫应答和布鲁氏菌细胞内持续感染中发挥着重要作用[15]。本研究发现,在牛种布鲁氏菌A19株中缺失BtpA后,并没有对A19株的体外生长、黏附侵袭,以及在巨噬细胞内生存产生影响。Salcedo等[16]在牛种布鲁氏菌S2308株上缺失BtpA基因后侵染小鼠骨髓源性细胞(BMDC)后,发现BtpA基因的缺失不影响S2308株侵染BMDC细胞。尽管BtpA被认为是布鲁氏菌的重要毒力因子,但在牛种布鲁氏菌的体外增殖过程中并不是必需的。另外,BtpB与BtpA相似,都是作为布鲁菌分泌的一种具有Toll受体结构域的毒力因子[17],李俊玫[18]的研究表明,在猪种布鲁氏菌S2株中缺失BtpB并不会影响S2株的体外生长,以及对山羊肺泡巨噬细胞的侵染,这说明Toll受体结构域的毒力因子可能只对布鲁氏菌持续性感染有重要帮助,而不影响布鲁氏菌体外增殖。在体外模拟布鲁氏菌在细胞内可能遇到高温、酸性、碱性和高渗压力应激环境,检测缺失株和亲本株生存率,发现在高渗压力下,A19ΔBtpA株生存率显著低于A19株,说明BtpA可能与布鲁氏菌A19株抵抗高渗环境压力有关,具体过程还需进一步研究。
布鲁氏菌A19株是一种减毒疫苗,具有良好稳定的免疫效果。为了确定在A19株中缺失BtpA基因是否会影响其免疫原性,本研究对A19株和A19ΔBtpA缺失株免疫小鼠后进行了研究,结果显示,从免疫开始后的第7—35天,A19ΔBtpA缺失株和A19株都能引起小鼠产生高滴度的布鲁氏菌特异性抗体IgG,并且趋势基本一致,这表明布鲁氏菌A19株中缺失BtpA基因不会影响其诱导宿主体液免疫。虽然先天免疫是抵御病原菌的第一道防线,但是布鲁氏菌作为胞内寄生菌入侵机体后,主要发挥适应性免疫应答的作用。IFN-γ在机体抵御布鲁氏菌入侵中扮演重要角色,动物感染布鲁氏菌后,IFN-γ主要由CD4+细胞和CD8+细胞分泌,从而激活宿主巨噬细胞,提高其清除布鲁氏菌的能力,抑制细胞内布鲁氏菌的复制和存活[19-20]。本研究通过ELISpot和流式细胞术检测小鼠脾脏淋巴细胞的IFN-γ表达水平,发现A19ΔBtpA组诱导的IFN-γ水平显著高于A19组,且A19ΔBtpA组中小鼠IFN-γ阳性CD4+和CD8+ T淋巴细胞都要显著高于A19组。此外,A19ΔBtpA组小鼠的CD4+/CD8+ T淋巴细胞比值也明显高于A19组,这表明A19ΔBtpA缺失株相比A19株在诱导小鼠产生Th1型免疫应答时具有更好的效果。通过初期研究发现,A19ΔBtpA缺失株具有一定成为布鲁氏菌新型基因缺失疫苗的潜力,但还需要进一步深入研究,本研究后续工作还将进一步探究A19ΔBtpA缺失株的安全性和免疫保护效能。
4 结论BtpA基因对牛种布鲁氏菌A19株的体外增殖没有影响,可能与A19株对高渗环境压力的抗性有一定关联。A19ΔBtpA缺失株能诱导小鼠产生高滴度的布鲁氏菌特异性抗体IgG。与A19株相比,A19ΔBtpA缺失株可以更好地诱导小鼠Th1型免疫应答,因此,A19ΔBtpA缺失株有望为开发布鲁氏菌新型基因缺失疫苗提供理论基础和数据支持。
| [1] |
黄天鹏, 郭旭, 孙长云, 等. 呼伦贝尔地区牛体表寄生蜱中羊种布鲁氏菌的分离与鉴定[J]. 中国农业科学, 2022, 55(2): 415-424. HUANG T P, GUO X, SUN C Y, et al. Isolation and identification of Brucella melitensis from Ticks on Cattle Surface in Hulunbuir Area[J]. Scientia Agricultura Sinica, 2022, 55(2): 415-424. (in Chinese) |
| [2] |
MATHUR S, BANAI M, COHEN D. Natural Brucella melitensis infection and rev. 1 vaccination induce specific Brucella O-polysaccharide antibodies involved in complement mediated Brucella cell killing[J]. Vaccines (Basel), 2022, 10(2): 317. DOI:10.3390/vaccines10020317 |
| [3] |
覃克斯, 余科, 李丽. 牛布鲁氏菌病的净化处置及防控[J]. 中国畜牧业, 2023(12): 92-93. QIN K S, YU K, LI L. Decontamination and disposal of bovine brucellosis and its prevention and control[J]. China Animal Industry, 2023(12): 92-93. (in Chinese) |
| [4] |
穆国冬, 薛智洋, 陆彪, 等. 家畜布鲁氏菌病的综合防控措施及疫苗研究进展[J]. 吉林畜牧兽医, 2021, 42(12): 9-10. MU G D, XUE Z Y, LU B, et al. Comprehensive preventive and control measures for brucellosis in domestic animals and progress in vaccine research[J]. Jilin Animal Husbandry and Veterinary Medicine, 2021, 42(12): 9-10. (in Chinese) |
| [5] |
王姝懿, 赵学亮, 孙柯, 等. 布鲁氏菌A19疫苗株全基因组测序及比较基因组学分析[J]. 中国人兽共患病学报, 2019, 35(11): 1002-1008. WANG S Y, ZHAO X L, SUN K, et al. Whole-genome sequencing and comparative genomics analysis of Brucella vaccine strain A19[J]. Chinese Journal of Zoonoses, 2019, 35(11): 1002-1008. (in Chinese) |
| [6] |
袁方, 王晓芳, 邵丽玮, 等. 我国养牛业布鲁氏菌病现状及其疫苗研究进展[J]. 黑龙江畜牧兽医, 2023(7): 37-42. YUAN F, WANG X F, SHAO L W, et al. Current situation and vaccine research progress of Brucellosis in cattle industry in China[J]. Heilongjiang Animal Science and Veterinary Medicine, 2023(7): 37-42. (in Chinese) |
| [7] |
董浩, 王宁, 汪宇, 等. 奶牛免疫布鲁氏菌A19疫苗后的抗体变化和排菌情况监测[J]. 中国动物检疫, 2022, 39(11): 130-135. DONG H, WANG N, WANG Y, et al. Surveillance of immune antibodies and bacterial excretion in dairy cows immunized with Brucella A19 vaccines[J]. China Animal Health Inspection, 2022, 39(11): 130-135. (in Chinese) |
| [8] |
HOU H H, LIU X F, PENG Q S. The advances in brucellosis vaccines[J]. Vaccine, 2019, 37(30): 3981-3988. DOI:10.1016/j.vaccine.2019.05.084 |
| [9] |
常攀, 边巴央拉, 索朗斯珠, 等. 布鲁氏菌鞭毛和毒力因子及疫苗研究进展[J]. 动物医学进展, 2023, 44(8): 82-90. CHANG P, BIANBA Y L, SUOLANG S Z, et al. Progress on flagella, virulence factors and vaccines of Brucella[J]. Progress in Veterinary Medicine, 2023, 44(8): 82-90. (in Chinese) |
| [10] |
杨琴, 邓肖玉, 谢珊珊, 等. 牛种布鲁氏菌Ⅳ型分泌系统对巨噬细胞内质网应激和细胞凋亡的影响[J]. 畜牧兽医学报, 2022, 53(4): 1192-1200. YANG Q, DENG X Y, XIE S S, et al. Effects of Brucella bovis Type IV secretion system on endoplasmic reticulum stress and apoptosis of macrophages[J]. Acta Veterinaria et Zootechnica Sinica, 2022, 53(4): 1192-1200. (in Chinese) |
| [11] |
XIONG X, LI B W, ZHOU Z X, et al. The VirB system plays a crucial role in Brucella intracellular infection[J]. Int J Mol Sci, 2021, 22(24): 13637. DOI:10.3390/ijms222413637 |
| [12] |
ROOP Ⅱ R M, BARTON I S, HOPERSBERGER D, et al. Uncovering the hidden credentials of Brucella virulence[J]. Microbiol Mol Boil Rev, 2021, 85(1): e00021-19. |
| [13] |
文志, 韩艳秋, 王俊瑞. 布鲁氏菌毒力因子研究进展[J]. 微生物学通报, 2021, 48(3): 842-848. WEN Z, HAN Y Q, WANG J R. Virulence factors of Brucella: a review[J]. Microbiology China, 2021, 48(3): 842-848. (in Chinese) |
| [14] |
ALAIDAROUS M, VE T, CASEY L W, et al. Mechanism of bacterial interference with TLR4 signaling by Brucella Toll/interleukin-1 receptor domain-containing protein TcpB[J]. J Biol Chem, 2014, 289(2): 654-668. DOI:10.1074/jbc.M113.523274 |
| [15] |
邱润辉, 关飞虎, 王梓行, 等. 布鲁氏菌分泌蛋白BMCO基因缺失株的构建及生物学特性研究[J]. 中国畜牧兽医, 2022, 49(5): 1630-1640. QIU R H, GUAN F H, WANG Z H, et al. Construction and biological characteristics of Brucella secreting protein BMCO gene deletion strain[J]. China Animal Husbandry & Veterinary Medicine, 2022, 49(5): 1630-1640. (in Chinese) |
| [16] |
SALCEDO S P, MARCHESINI M I, DEGOS C, et al. BtpB, a novel Brucella TIR-containing effector protein with immune modulatory functions[J]. Front Cell Infect Microbiol, 2013, 3: 28. |
| [17] |
乔连江, 杨森, 张萍, 等. 布鲁氏菌16M BtpA和BtpB真核表达载体的构建及在293T细胞中的表达[J]. 动物医学进展, 2021, 42(7): 12-17. QIAO L J, YANG S, ZHANG P, et al. Construction of Brucella 16M BtpA and BtpB eukaryotic expression vectors and its expression in 293T cells[J]. Progress in Veterinary Medicine, 2021, 42(7): 12-17. (in Chinese) |
| [18] |
李俊玫. 布鲁氏菌BtpB缺失株构建及其对山羊肺泡巨噬细胞NLRP3炎性体的影响[D]. 杨凌: 西北农林科技大学, 2019. LI J M. Construction of Brucella BtpB deletion strain and its effect on NLRP3 inflammasome in Goat alveolar macrophages[D]. Yangling: Northwest A & F University, 2019. (in Chinese) |
| [19] |
谢士杰, 彭小薇, 冯宇, 等. 布鲁氏菌逃避宿主免疫机制的研究进展[J]. 生命科学, 2019, 31(9): 871-878. XIE S J, PENG X W, FENG Y, et al. Mechanism of Brucella evading from host immune response[J]. Chinese Bulletin of Life Sciences, 2019, 31(9): 871-878. (in Chinese) |
| [20] |
冯宇, 丁家波. 布鲁氏菌免疫应答研究进展[J]. 生命科学, 2016, 28(9): 1067-1074. FENG Y, DING J B. Research advance on immune response against Brucella[J]. Chinese Bulletin of Life Sciences, 2016, 28(9): 1067-1074. (in Chinese) |
(编辑 白永平)



