繁殖性能是衡量家畜生产水平的重要经济指标,直接影响养殖户的经济效益,提高家畜的繁殖性能对于促进我国畜牧业的发展具有重要意义。卵泡发育是影响雌性哺乳动物繁殖性能的重要因素之一[1]。在雌性哺乳动物刚出生时,卵巢拥有大量的卵泡储备,然而随着动物的生长发育,体内的卵泡逐渐凋亡闭锁,仅有少量的优势卵泡能够破裂排出可用于受精的卵母细胞,因此动物的卵泡发育并不是一个高效的过程[2-4]。了解卵泡发育的机制对于提高动物的繁殖性能具有重要意义。卵泡主要由颗粒细胞、卵母细胞及膜细胞组成[5]。颗粒细胞在卵泡的发育中发挥重要作用,其通过间隙连接与卵母细胞和膜细胞进行信号传递和物质交换,还可以通过旁分泌调节卵母细胞的生长[6]。此外,颗粒细胞还能够表达促卵泡激素、黄体生成素/绒毛膜促性腺激素等多种激素的受体从而使初级卵泡对性腺轴激素具有应答功能[7]。许多研究表明,颗粒细胞的凋亡是造成卵泡闭锁的重要因素之一[8-9]。因此探究颗粒细胞的增殖凋亡机制对于全面了解卵泡发育具有重要意义。
雄激素受体(androgen receptor, AR)属于核受体超家族中的类固醇受体,能够与雄激素结合作为转录因子调控基因的表达[10]。通过对不同发育阶段的卵泡进行测序,发现AR基因表达贯穿卵泡发育的全过程,并在卵泡发育不同阶段呈现出不同表达趋势,主要表现为在大卵泡中低表达,而在小卵泡中高表达,表明AR可能参与调控卵泡的发育[11-12]。卵泡颗粒细胞AR特异性敲除小鼠表现出卵泡闭锁率高、繁殖力低等情况[13]。此外,在猪卵泡颗粒细胞中AR能够与miR-126互作参与调控猪卵泡颗粒细胞中促卵泡生成素受体的表达[14]。这些结果表明AR在卵泡颗粒细胞中发挥着重要功能。恩杂鲁胺(enzalutamide)是一种AR拮抗剂,能够与雄激素竞争性结合AR使其失去转录活性,因此能够被用于AR功能的探索[15]。
探究AR在卵泡颗粒细胞增殖凋亡中的作用对于全面了解卵泡发育的分子机制具有重要意义。本研究通过利用恩杂鲁胺探索AR在卵泡发育过程中对颗粒细胞增殖凋亡的影响,以期为全面了解卵巢卵泡发育机制和卵泡相关疾病的治疗提供参考。
1 材料与方法 1.1 山羊卵泡颗粒细胞的分离与培养山羊屠宰后找到卵巢组织并取下卵巢,然后分别在75%的酒精和含2%青霉素-链霉素双抗溶液的生理盐水中灭菌,之后放入37 ℃含2%双抗溶液的生理盐水中保存运输。回到实验室后在已提前30 min紫外灭菌的生物安全柜中分离卵泡颗粒细胞。简而言之,首先,对运输回来的卵巢进行消毒,结束后将卵巢放入37 ℃含2%双抗的DMEM培养基中,然后使用注射器刺破卵泡使卵泡中的颗粒细胞释放出来,之后收集DMEM培养液并过70 μm的细胞筛,过筛结束后室温静置15 min;然后1 000 r ·min-1条件下离心10 min,离心结束后弃去上清,使用3 mL含2%双抗的DMEM培养基重悬细胞,再次离心并弃上清;接着使用10 mL完全培养基(配方:90% DMEM/F12+10% FBS+1% 双抗+1% 100×ITS-A)重悬细胞,并将其接种于细胞培养皿中;最后将细胞放在5% CO2,饱和湿度和37 ℃的细胞培养箱中静置培养,培养24 h后弃去未贴壁的细胞并更换新的完全培养基,之后每48 h更换一次培养基直至细胞长到80%左右后进行细胞传代与冻存。
1.2 CCK8细胞增殖检测将生长状态良好的山羊卵泡颗粒细胞接种于96孔板中,其中96孔板外围一圈孔只加入完全培养基不加入细胞,防止中央液体的挥发影响试验结果,细胞铺板完成后置于细胞培养箱中静置培养24 h后进行试验。试验分为试验组与对照组,试验组分为4个不同浓度梯度处理的恩杂鲁胺培养液培养,恩杂鲁胺浓度分别为20、40、60、80 μmol ·L-1,对照组则采用恩杂鲁胺的溶剂DMSO处理,每组对照组的DMSO加入量与恩杂鲁胺溶液加入量相同,每个处理至少有4个生物学重复。然后在24、48、72 h时向每个细胞培养孔中分别加入10 μL的CCK8试剂,1 h后用酶标仪检测培养液450 nm处的吸光度值,吸光度值越大代表细胞的增殖活力越强。
1.3 EDU细胞增殖检测按照Cell-LightTM EDU Apollo In Vitor Kit说明书进行EDU细胞增殖检测。简而言之,将配置好的EDU溶液加入细胞培养液中孵育2 h,取出培养液,然后使用细胞固定液对细胞进行固定30 min,通透液通透10 min,PBS洗涤。然后进行Apollo染色,PBS洗涤之后,使用Hoechst染料进行细胞核DNA染色。倒置荧光显微镜下观察细胞染色情况。
1.4 活细胞Caspase3活性与细胞凋亡检测将细胞接种于24孔板中,使用恩杂鲁胺处理后,吸除细胞培养液,使用PBS洗涤细胞。然后加入192 μL的Annexin V-mCherry Binding Buffer,5 μL的Annexin V-mCherry,2 μL的Hoechst 33342和1 μL的GreenNucTMcaspase3 Substrate, 轻轻混匀,室温避光孵育30 min。倒置荧光显微镜下观察细胞荧光发光情况。
1.5 RNA的提取与cDNA的合成使用Trizol法提取细胞总RNA。首先,使用0.25%的胰酶消化、离心收集细胞,弃去上清并加入800 μL的Trizol,室温裂解5 min,之后加入160 μL氯仿,离心收集上层水相,然后加入等体积的异丙醇,室温静置10 min,离心弃去异丙醇,75%乙醇洗涤沉淀,干燥,无菌无酶水溶解,-80 ℃保存。细胞总RNA按照艾科瑞生物公司的EVO M-MLV反转录试剂盒的说明书进行反转录,取1 μg总RNA使用gDNA Clean Reaction Mix、EVO M-MLV RT Reaction Mix进行反转录。反应条件:37 ℃,15 min;85 ℃,5 s。
1.6 引物的设计与合成登录NCBI搜索山羊PCNA、CCND1、MKI67、BAX、BCL2、CASP3和β-ACTIN基因的CDS区序列,使用NCBI中的pick primers在线软件进行引物设计,设计时设置引物至少跨一个外显子,以防止基因组干扰。所有引物均由生工生物工程有限公司合成,合成引物及序列见表 1。
|
|
表 1 实时荧光定量PCR基因引物序列 Table 1 Real-time fluorescence quantitative PCR gene primer sequences |
以cDNA为模板,按照诺维赞ChamQ SYBR qPCR Master Mix (Low ROX Premixed)说明书进行实时荧光定量PCR。反应体系如下,2×ChamQ SYBR qPCR Master Mix (Low ROX Premixed)10 μL,上、下游引物(10 μmol ·L-1)各0.4 μL,cDNA 1 μL,ddH2O 8.2 μL。反应程序为:95 ℃ 30 s;95 ℃ 10 s,60 ℃ 30 s,40个循环;95 ℃ 15 s,60 ℃ 60 s,95 ℃ 15 s。以β-Actin作为内参,结果使用2-△△CT法进行计算。
1.8 蛋白提取与Western blot检测按照RIPA裂解缓冲液Ⅲ的说明提取细胞总蛋白,然后用改良型BCA蛋白检测试剂盒定量检测总蛋白浓度。根据测定的蛋白浓度使用RIPA裂解缓冲液Ⅲ调整每个样品的蛋白以使各样品浓度大概一致,然后向每个蛋白样品中加入4×Protein SDS PAGE loading buffer,在100 ℃下变性10 min。变性蛋白质经10% SDS-PAGE凝胶电泳分离后转移至0.45 μm聚偏二氟乙烯(PVDF)膜上。用Quick blockTM blocking buffer for western blot封闭10 min后,使用1×TBST洗膜5次,每次5 min。洗膜结束后,向PVDF膜中加入一抗,4 ℃冰箱中孵育过夜,洗膜,之后用相应的二抗在室温下孵育1 h,洗膜,最后使用超敏ECL化学发光试剂盒在对应仪器中观察蛋白条带。
1.9 统计分析所有数据均以“平均值±标准差(SD)”表示,至少有3个独立重复。两组或多组之间的差异分析分别采用t检验和单因素方差分析,所有分析均在GraphPad Prism9中完成。“*”代表P<0.05,“ **”代表P<0.01,“ ***”代表P<0.001,“ ****”代表P<0.000 1。
2 结果 2.1 不同浓度AR抑制剂恩杂鲁胺对颗粒细胞增殖的影响为了探索恩杂鲁胺最适细胞培养浓度,分别使用含20、40、60、80 μmol ·L-1浓度的恩杂鲁胺对山羊卵泡颗粒细胞进行培养。药物处理48 h后,在显微镜下对山羊卵泡颗粒细胞的生长状况进行观察,由图 1可知,随着恩杂鲁胺浓度的升高,山羊卵泡颗粒细胞的密度逐渐降低,说明在该试验中恩杂鲁胺对卵泡颗粒细胞的增殖具有一定的抑制作用。

|
图 1 48 h时不同浓度梯度恩杂鲁胺培养条件下山羊卵泡颗粒细胞生长图(40×) Fig. 1 Growth graph of goat ovarian granulosa cells under different concentration gradient enzalutamide culture conditions at 48 h (40×) |
此外,为了探索不同时间点条件下恩杂鲁胺对山羊卵泡颗粒细胞增殖的影响,还使用CCK8对上述4个恩杂鲁胺培养浓度条件下的山羊卵泡颗粒细胞的增殖情况进行了检测。由图 2可知,与对照组相比,不同浓度的恩杂鲁胺均能在不同程度上抑制山羊卵泡颗粒细胞的增殖。且随着浓度的提升,细胞的增殖活性逐渐降低,特别在80 μmol ·L-1浓度条件下,颗粒细胞的增殖活性最差,这可能是由于DMSO浓度过高影响了细胞的增殖。结合细胞生长状态观察及CCK8检测结果,后续试验选用40 μmol ·L-1的恩杂鲁胺细胞培养浓度对山羊卵泡颗粒细胞进行培养,并在48 h时收样。
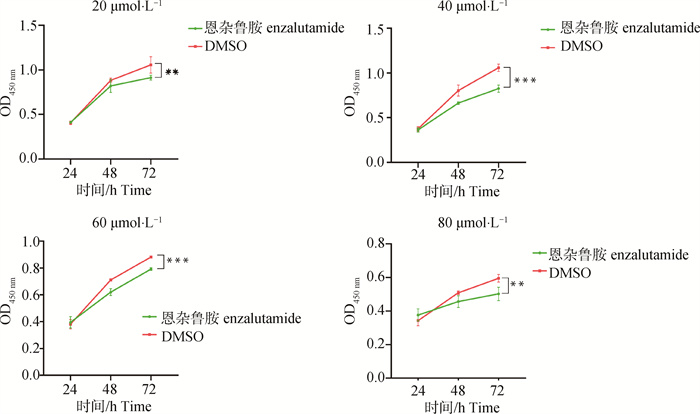
|
“ **”和“ ***”代表 72 h时,恩杂鲁胺处理组与DMSO处理组OD值差异显著性,其中“ **”代表P<0.01,“ ***”代表P<0.001 " **" and " ***" represent the significance of the difference in OD values between the enzalutamide-treated group and the DMSO-treated group at 72 h, where " **" represents P < 0.01 and " ***" represents P < 0.001 图 2 不同浓度梯度恩杂鲁胺培养条件下24、48和72 h时山羊卵泡颗粒细胞CCK8增殖检测 Fig. 2 CCK8 proliferation assay of goat ovarian granulosa cells at 24, 48, and 72 h under different concentrations of enzalutamide culture conditions |
EDU是一种胸腺嘧啶核苷类似物,能够在细胞增殖时替代胸腺嘧啶插入正在复制的DNA链中,通过使用Apollo荧光染料与结合到DNA双链上的EDU特异性反应,利用免疫荧光技术能够检测出细胞的增殖状况,其相较于CCK8技术,能够更直观的反映出细胞的增殖活力。由图 3可知,在48 h时,与空白对照和DMSO对照组相比,40 μmol ·L-1恩杂鲁胺处理条件下山羊卵泡颗粒细胞增殖活力被显著抑制(P<0.01),表明AR活性能够影响山羊卵泡颗粒细胞的增殖能力。
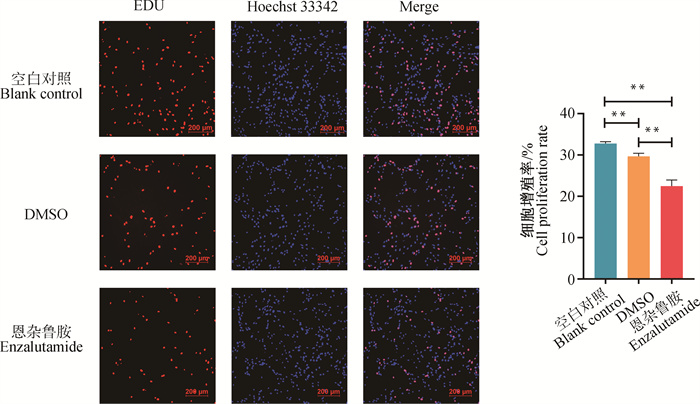
|
图 3 48 h时40 μmol ·L-1恩杂鲁胺处理条件下山羊卵泡颗粒细胞EDU增殖检测 Fig. 3 Detection of EDU proliferation of goat ovarian granulosa cells treated with 40 μmol ·L-1 enzalutamide at 48 h |
细胞的增殖受到严格的基因表达调控,研究测定了40 μmol ·L-1恩杂鲁胺培养液对卵泡颗粒细胞部分增殖相关基因表达的影响。如图 4A所示,与空白对照和DMSO对照组相比,恩杂鲁胺处理显著降低了山羊卵泡颗粒细胞中MKI67 (P<0.01)、CCND1 (P<0.01)和PCNA (P<0.01)基因mRNA水平。蛋白表达检测结果显示(图 4B),恩杂鲁胺能够显著抑制PCNA (P<0.01)和CCND1 (P<0.05)蛋白的表达。WNT信号通路在细胞的增殖中发挥重要功能,β-catenin作为WNT经典信号通路中的关键蛋白,能够通过影响下游TCF/LEF家族基因的表达影响细胞的增殖[16-18]。因此,研究对β-catenin的蛋白水平变化进行了检测,结果表明,与空白对照和DMSO对照组相比,40 μmol ·L-1恩杂鲁胺处理组的β-catenin蛋白表达量显著降低(P<0.05)。这些结果表明,AR活性被抑制后,细胞增殖相关基因的转录与翻译会被抑制,从而使颗粒细胞的增殖受到影响。
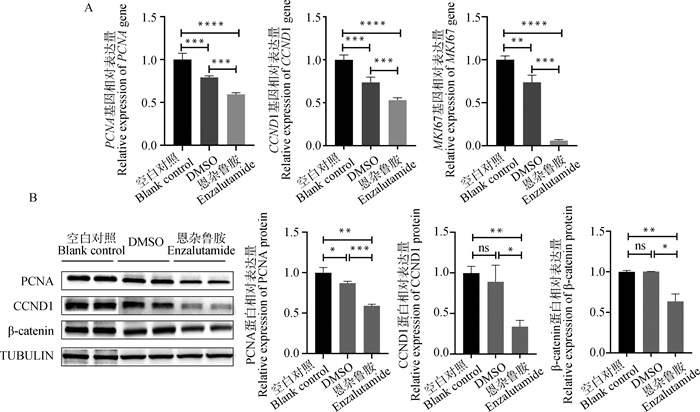
|
A. qRT-PCR检测40 μmol ·L-1恩杂鲁胺处理条件下山羊卵泡颗粒细胞PCNA、CCND1和MKI67基因mRNA相对表达水平;B. Western blot法检测40 μmol ·L-1恩杂鲁胺处理条件下山羊卵泡颗粒细胞PCNA、CCND1和β-catenin蛋白相对表达水平 A. qRT-PCR to detect the relative expression levels of PCNA, CCND1 and MKI67 genes in goat ovarian granulosa cells under 40 μmol ·L-1 enzalutamide treatment; B. Western blot to detect the relative expression levels of PCNA, CCND1 and β-catenin proteins in goat ovarian granulosa cells under 40 μmol ·L-1 enzalutamide treatment 图 4 48 h时40 μmol ·L-1恩杂鲁胺处理条件下山羊卵泡颗粒细胞增殖相关基因表达检测 Fig. 4 Proliferation genes expression assay in goat ovarian granulosa cells under 40 μmol ·L-1 enzalutamide treatment condition at 48 h |
了解卵泡颗粒细胞的凋亡调控对于理解卵泡发育具有重要意义[19]。本研究使用了活细胞Caspase3活性与Annexin V细胞凋亡检测试剂盒来探究AR抑制剂对颗粒细胞凋亡的影响。由图 5可知,与空白对照和DMSO处理组相比,恩杂鲁胺处理组的山羊卵泡颗粒细胞拥有较多的绿色荧光与红色荧光,Caspase3活化比率显著上升(P<0.05),表明AR抑制剂恩杂鲁胺能够诱导山羊卵泡颗粒细胞发生凋亡。
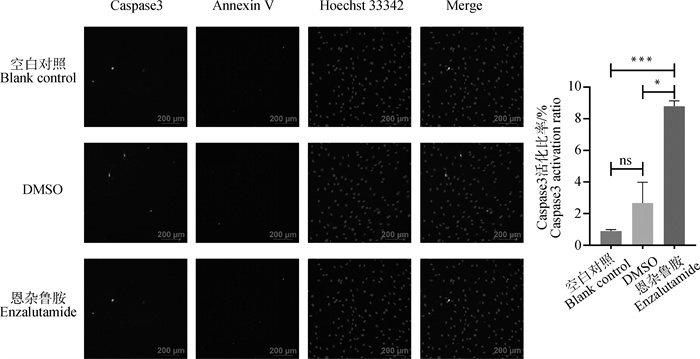
|
图 5 48 h时40 μmol ·L-1恩杂鲁胺处理条件下山羊卵泡颗粒细胞凋亡检测 Fig. 5 Detection of apoptosis in goat ovarian follicular granulosa cells under the treatment condition of 40 μmol ·L-1 enzalutamide for 48 h |
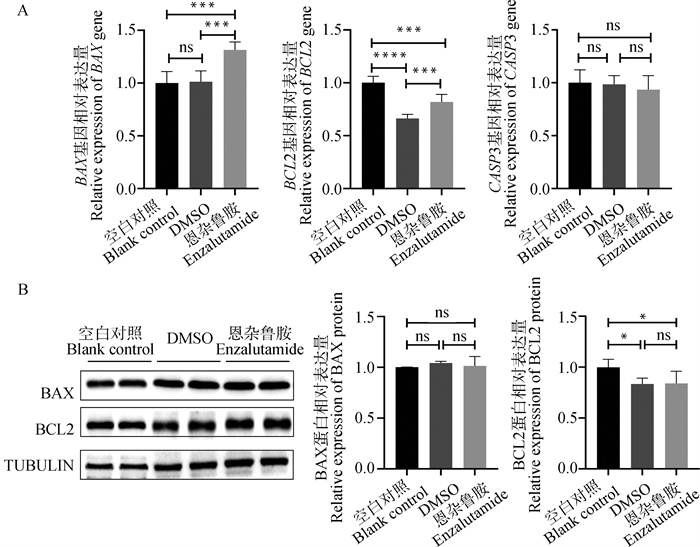
使用qRT-PCR探究恩杂鲁胺对山羊卵泡颗粒细胞凋亡标志基因BAX、BCL2和CASP3基因表达的影响,结果如图 6A所示,与空白对照相比,恩杂鲁胺处能够显著提高BAX(P<0.01)基因的mRNA水平,并降低BCL2(P<0.01)基因的mRNA表达;而与DMSO对照相比,恩杂鲁胺能够同时提高BAX (P<0.01)和BCL2(P<0.01)基因的mRNA表达水平;此外,结果显示,CASP3基因的mRNA水平在3组间无显著差异。研究还对BAX和BCL2蛋白表达水平进行了检测(图 6B),发现与空白对照组相比,DMSO和恩杂鲁胺处理条件下BCL2蛋白表达均显著下降,但与DMSO处理组相比,恩杂鲁胺处理对BCL2蛋白表达无显著影响,表明,DMSO的存在可能能够影响BCL2蛋白的表达。BAX蛋白检测结果表明,BAX蛋白的表达在3组间差异不显著。总的来说,这些结果表明,40 μmol ·L-1的恩杂鲁胺培养液并不显著影响山羊卵泡颗粒细胞中BAX和BCL2蛋白表达。
|
A. qRT-PCR检测40 μmol ·L-1恩杂鲁胺处理条件下山羊卵泡颗粒细胞BAX、BCL2和CASP3基因mRNA相对表达量。B. Western blot法检测40 μmol ·L-1恩杂鲁胺处理条件下山羊卵泡颗粒细胞BAX和BCL2蛋白相对表达量 A. qRT-PCR to detect the relative mRNA expression of BAX, BCL2 and CASP3 genes in goat ovarian granulosa cells under the condition of 40 μmol ·L-1 enzalutamide treatment; B. Western blot to detect the relative proteins expression of BAX and BCL2 in goat ovarian granulosa cells under the condition of 40 μmol ·L-1 enzalutamide treatment 图 6 48 h时40 μmol ·L-1恩杂鲁胺处理条件下山羊卵泡颗粒细胞凋亡基因表达检测 Fig. 6 Detection of apoptotic genes expression in goat ovarian granulosa cells under 40 μmol ·L-1 enzalutamide treatment condition at 48 h |
卵泡的发育是一个十分复杂的过程,在这个过程中,颗粒细胞在不断的增殖分化与凋亡,从而响应卵泡的发育,颗粒细胞的增殖凋亡受到众多基因的调控[20-22]。研究发现,AR的表达贯穿卵泡发育的整个过程,但在小卵泡中表达量高,在大卵泡中表达量较低。此外,异常的AR活性可能导致卵泡发育障碍和多囊卵巢的形成[23]。因此,这些研究表明,AR可能参与卵泡发育的调控,且在其中发挥重要作用。
AR在动物的生理活动中起着至关重要的调节作用。在雄性动物中,AR能够调节精子的生成、睾丸功能的维持以及调控骨骼肌肉的发育等[24-26];在雌性动物中,AR参与调控卵泡发育和排卵过程,还在子宫内膜和子宫平滑肌中发挥作用,并参与调节月经周期、子宫收缩和妊娠等重要生理过程[27-29]。AR的功能发挥依赖于雄激素的存在,作为类固醇受体,其通过与雄激素结合后进入细胞核内并与受体形成复合物,这个复合物进一步调控基因的转录和翻译过程,从而影响细胞的功能和表型[30-31]。恩杂鲁胺是一种AR抑制剂,其能够阻断雄激素与AR的结合,抑制AR的转录活性并促进AR的降解。在这项研究中,利用恩杂鲁胺抑制卵泡颗粒细胞中的AR的活性后,CCK8和EDU结果显示卵泡颗粒细胞的增殖活性被抑制,表明AR能够参与调控卵泡颗粒细胞的增殖活性。MKI67是一种标志细胞增殖的核蛋白,高MKI67表达通常表示细胞处于增殖状态,而低MKI67表达则可能表示细胞停止或减缓增殖[32]。抑制AR活性后,细胞增殖相关基因MKI67的转录水平受到抑制,表明细胞的增殖状态受到抑制,这与EDU和CCK8的检测结果是一致的。说明颗粒细胞中AR的活性能够调节细胞的增殖活性。
细胞增殖受到细胞周期的调控。研究表明,细胞周期进程由一个复杂的基因网络调控,其中PCNA在细胞周期中起到了重要的调控作用[33]。PCNA是DNA聚合酶δ和ε的辅助因子,在S期DNA复制过程中,PCNA结合到DNA链上形成一个滑动夹持结构,促进DNA聚合酶的稳定结合并提高其活性[34-35]。此外,PCNA还能够与细胞周期蛋白依赖激酶、细胞周期抑制蛋白等蛋白相相互作用调节细胞周期的进程[36-37]。本研究发现抑制AR活性能够降低PCNA和CCND1基因的表达,说明AR能够调节PCNA和CCND1基因的表达,从而影响细胞周期的进程,进而参与调控颗粒细胞的增殖。细胞的增殖还受到多条信号通路的调控,其中WNT信号通路在卵泡发育过程中扮演重要角色,抑制WNT信号通路会导致卵泡发育不良,早期闭锁卵泡增多,同时还会造成卵母细胞分化异常,影响卵泡质量[38-40]。β-catenin是经典WNT信号通路的中心蛋白,当WNT信号被激活时,β-catenin向细胞核转移,促进CCND1、c-MYC等基因的表达从而促进颗粒细胞的增殖,调控卵泡的生长发育[41]。使用恩杂鲁胺抑制AR活性后,山羊卵泡颗粒细胞中的β-catenin蛋白表达水平降低,表明AR可能参与经典WNT信号通路的调控,但具体的调控机制还需要进一步探索。
卵泡发育的过程中常常伴随着颗粒细胞的凋亡,适度的颗粒细胞凋亡对于优势卵泡的选择、营养物质的供应以及生长因子的调节具有积极作用,但凋亡过多或凋亡缺失都可能会对卵泡发育产生不利影响[42-43]。因此,维持适度的颗粒细胞凋亡水平是卵泡发育正常进行的关键之一。研究表明,AR在细胞的生存和死亡中发挥重要调控作用。Huang等[44]发现沉默AR的表达能够促进肾缺血再灌注模型小鼠的肾脏Caspase 3的表达促进细胞凋亡;而Lin等[45]研究表明AR能够通过PIRH2-p53-p21促进前列腺癌细胞的凋亡。因此,AR对细胞凋亡的调节受到细胞环境和细胞外刺激影响。在我们的研究中,恩杂鲁胺抑制AR活性后,山羊卵泡颗粒细胞中Caspase 3蛋白活性增加,细胞膜上的磷脂酰丝氨酸外翻变多,细胞凋亡比率升高,表明恩杂鲁胺抑制AR活性后能够促进山羊卵泡颗粒细胞的凋亡。但AR对山羊卵泡颗粒细胞凋亡的调控似乎并不依赖于BCL2家族成员介导的线粒体凋亡途径,这是因为抑制AR活性后虽然上调了BAX和BCL2的mRNA水平, 但并没有改变BAX和BCL2蛋白的表达。因此,AR可能通过死亡受体凋亡途径或内质网主导的细胞凋亡途径调控山羊卵泡颗粒细胞凋亡。
4 结论抑制山羊卵泡颗粒细胞中AR的活性能够影响β-catenin、PCNA、CCND1和Caspase 3等基因的表达从而抑制山羊卵泡颗粒细胞的增殖和促进山羊卵泡颗粒细胞凋亡。
| [1] |
ZHANG T J, BASANG W D, CHANG W H, et al. Dynamics of apoptosis-related gene expression during follicular development in yak[J]. J Anim Physiol Anim Nutr (Berl), 2021, 105(6): 1002-1013. DOI:10.1111/jpn.13527 |
| [2] |
KUMARIYA S, UBBA V, JHA R K, et al. Autophagy in ovary and polycystic ovary syndrome: role, dispute and future perspective[J]. Autophagy, 2021, 17(10): 2706-2733. DOI:10.1080/15548627.2021.1938914 |
| [3] |
刘杰, 许香萍, 邓铭, 等. miR-144-5p靶向WNT5a对山羊卵巢颗粒细胞增殖、凋亡的影响[J]. 畜牧兽医学报, 2023, 54(6): 2421-2435. LIU J, XU X P, DENG M, et al. Effect of miR-144-5p targeting WNT5a on the proliferation and apoptosis of goat ovarian granulosa cells[J]. Acta Veterinaria et Zootechnica Sinica, 2023, 54(6): 2421-2435. (in Chinese) |
| [4] |
TELFER E E, GROSBOIS J, ODEY Y L, et al. Making a good egg: human oocyte health, aging, and in vitro development[J]. Physiol Rev, 2023, 103(4): 2623-2677. DOI:10.1152/physrev.00032.2022 |
| [5] |
LI H, HUANG X, CHANG X W, et al. S100-A9 protein in exosomes derived from follicular fluid promotes inflammation via activation of NF-κB pathway in polycystic ovary syndrome[J]. J Cell Mol Med, 2020, 24(1): 114-125. DOI:10.1111/jcmm.14642 |
| [6] |
CLARKE H. Control of mammalian oocyte development by interactions with the maternal follicular environment[M]//KLOC M. Oocytes: Maternal Information and Functions. Cham: Springer, 2017: 17-41.
|
| [7] |
DUFFY D M, KO C, JO M, et al. Ovulation: parallels with inflammatory processes[J]. Endocr Rev, 2019, 40(2): 369-416. DOI:10.1210/er.2018-00075 |
| [8] |
DU X, LI Q Q, YANG L, et al. SMAD4 activates Wnt signaling pathway to inhibit granulosa cell apoptosis[J]. Cell Death Dis, 2020, 11(5): 373. DOI:10.1038/s41419-020-2578-x |
| [9] |
李碧筠, 黄思艺, 王钰锟, 等. SMAD7对山羊卵泡颗粒细胞增殖、凋亡的影响[J]. 畜牧兽医学报, 2022, 53(8): 2548-2557. LI B J, HUANG S Y, WANG Y K, et al. Effects of SMAD7 on proliferation and apoptosis of goat follicular granulosa cells[J]. Acta Veterinaria et Zootechnica Sinica, 2022, 53(8): 2548-2557. (in Chinese) |
| [10] |
WASMUTH E V, BROECK A V, LACLAIR J R, et al. Allosteric interactions prime androgen receptor dimerization and activation[J]. Mol Cell, 2022, 82(11): 2021-2031. e5. DOI:10.1016/j.molcel.2022.03.035 |
| [11] |
ASTAPOVA O, MINOR B M N, HAMMES S R. Physiological and pathological androgen actions in the ovary[J]. Endocrinology, 2019, 160(5): 1166-1174. DOI:10.1210/en.2019-00101 |
| [12] |
BURGER H G. Androgen production in women[J]. Fertil Steril, 2002, 77 Suppl 4: S3-S5. |
| [13] |
PRIZANT H, GLEICHER N, SEN A. Androgen actions in the ovary: balance is key[J]. J Endocrinol, 2014, 222(3): R141-R151. DOI:10.1530/JOE-14-0296 |
| [14] |
DU X, LI Q Q, PAN Z X, et al. Androgen receptor and miRNA-126* axis controls follicle-stimulating hormone receptor expression in porcine ovarian granulosa cells[J]. Reproduction, 2016, 152(2): 161-169. DOI:10.1530/REP-15-0517 |
| [15] |
STERNBERG C N. Enzalutamide, an oral androgen receptor inhibitor for treatment of castration-resistant prostate cancer[J]. Future Oncol, 2019, 15(13): 1437-1457. DOI:10.2217/fon-2018-0940 |
| [16] |
KATOH M, KATOH M. WNT signaling and cancer stemness[J]. Essays Biochem, 2022, 66(4): 319-331. DOI:10.1042/EBC20220016 |
| [17] |
COLOZZA G, KOO B K. Wnt/β-catenin signaling: structure, assembly and endocytosis of the signalosome[J]. Dev Growth Differ, 2021, 63(3): 199-218. DOI:10.1111/dgd.12718 |
| [18] |
MUKHERJEE S, LUEDEKE D M, MCCOY L, et al. SOX transcription factors direct TCF-independent WNT/β-catenin responsive transcription to govern cell fate in human pluripotent stem cells[J]. Cell Rep, 2022, 40(8): 111247. DOI:10.1016/j.celrep.2022.111247 |
| [19] |
GAO Y, CHEN J, JI R, et al. USP25 regulates the proliferation and apoptosis of ovarian granulosa cells in polycystic ovary syndrome by modulating the PI3K/AKT pathway via deubiquitinating PTEN[J]. Front Cell Dev Biol, 2021, 9: 779718. DOI:10.3389/fcell.2021.779718 |
| [20] |
LI H Y, WANG X F, MU H B, et al. Mir-484 contributes to diminished ovarian reserve by regulating granulosa cell function via YAP1-mediated mitochondrial function and apoptosis[J]. Int J Biol Sci, 2022, 18(3): 1008-1021. DOI:10.7150/ijbs.68028 |
| [21] |
XING J S, QIAO G, LUO X, et al. Ferredoxin 1 regulates granulosa cell apoptosis and autophagy in polycystic ovary syndrome[J]. Clin Sci (Lond), 2023, 137(6): 453-468. DOI:10.1042/CS20220408 |
| [22] |
WEI X L, ZHENG L P, TIAN Y P, et al. Tyrosine phosphatase SHP2 in ovarian granulosa cells balances follicular development by inhibiting PI3K/AKT signaling[J]. J Mol Cell Biol, 2022, 14(7): mjac048. DOI:10.1093/jmcb/mjac048 |
| [23] |
RODRIGUEZ PARIS V, BERTOLDO M J. The mechanism of androgen actions in PCOS etiology[J]. Med Sci (Basel), 2019, 7(9): 89. |
| [24] |
CHRISTIN-MAITRE S, YOUNG J. Androgens and spermatogenesis[J]. Ann Endocrinol (Paris), 2022, 83(3): 155-158. DOI:10.1016/j.ando.2022.04.010 |
| [25] |
WALKER W H. Androgen actions in the testis and the regulation of spermatogenesis[M]//CHENG C Y, SUN F. Molecular Mechanisms in Spermatogenesis. Cham: Springer, 2021: 175-203.
|
| [26] |
MARCHIORETTI C, ZANETTI G, PIRAZZINI M, et al. Defective excitation-contraction coupling and mitochondrial respiration precede mitochondrial Ca2+ accumulation in spinobulbar muscular atrophy skeletal muscle[J]. Nat Commun, 2023, 14(1): 602. DOI:10.1038/s41467-023-36185-w |
| [27] |
YU K, HUANG Z Y, XU X L, et al. Estrogen receptor function: impact on the human endometrium[J]. Front Endocrinol (Lausanne), 2022, 13: 827724. DOI:10.3389/fendo.2022.827724 |
| [28] |
WALTERS K A, SIMANAINEN U, HANDELSMAN D J. Molecular insights into androgen actions in male and female reproductive function from androgen receptor knockout models[J]. Hum Reprod Update, 2010, 16(5): 543-558. DOI:10.1093/humupd/dmq003 |
| [29] |
ZHANG Y H, HU M, YANG F, et al. Increased uterine androgen receptor protein abundance results in implantation and mitochondrial defects in pregnant rats with hyperandrogenism and insulin resistance[J]. J Mol Med (Berl), 2021, 99(10): 1427-1446. DOI:10.1007/s00109-021-02104-z |
| [30] |
JAMROZE A, CHATTA G, TANG D G. Androgen receptor (AR) heterogeneity in prostate cancer and therapy resistance[J]. Cancer Lett, 2021, 518: 1-9. DOI:10.1016/j.canlet.2021.06.006 |
| [31] |
AHMAD I, NEWELL-FUGATE A E. Role of androgens and androgen receptor in control of mitochondrial function[J]. Am J Physiol Cell Physiol, 2022, 323(3): C835-C846. DOI:10.1152/ajpcell.00205.2022 |
| [32] |
ZHANG A L, WANG X J, FAN C F, et al. The role of Ki67 in evaluating neoadjuvant endocrine therapy of hormone receptor-positive breast cancer[J]. Front Endocrinol (Lausanne), 2021, 12: 687244. DOI:10.3389/fendo.2021.687244 |
| [33] |
ARBEL M, CHOUDHARY K, TFILIN O, et al. PCNA loaders and unloaders-one ring that rules them all[J]. Genes (Basel), 2021, 12(11): 1812. DOI:10.3390/genes12111812 |
| [34] |
GONZÁLEZ-MAGAÑA A, BLANCO F J. Human PCNA structure, function and interactions[J]. Biomolecules, 2020, 10(4): 570. DOI:10.3390/biom10040570 |
| [35] |
ACHARYA N, PATEL S K, SAHU S R, et al. 'PIPs' in DNA polymerase: PCNA interaction affairs[J]. Biochem Soc Trans, 2020, 48(6): 2811-2822. DOI:10.1042/BST20200678 |
| [36] |
MANSILLA S F, DE LA VEGA M B, CALZETTA N L, et al. CDK-independent and PCNA-dependent functions of p21 in DNA replication[J]. Genes (Basel), 2020, 11(6): 593. DOI:10.3390/genes11060593 |
| [37] |
SHENG C B, MENDLER I H, RIEKE S, et al. PCNA-mediated degradation of p21 coordinates the DNA damage response and cell cycle regulation in individual cells[J]. Cell Rep, 2019, 27(1): 48-58. e7. DOI:10.1016/j.celrep.2019.03.031 |
| [38] |
LI L Y, SHI X J, SHI Y, et al. The signaling pathways involved in ovarian follicle development[J]. Front Physiol, 2021, 12: 730196. DOI:10.3389/fphys.2021.730196 |
| [39] |
ABEDINI A, ZAMBERLAM G, LAPOINTE E, et al. WNT5a is required for normal ovarian follicle development and antagonizes gonadotropin responsiveness in granulosa cells by suppressing canonical WNT signaling[J]. FASEB J, 2016, 30(4): 1534-1547. DOI:10.1096/fj.15-280313 |
| [40] |
王鹏, 韩海银, 李文韬, 等. 可变剪接体WNT4-β对山羊卵泡颗粒细胞增殖和激素分泌的影响[J]. 畜牧兽医学报, 2022, 53(10): 3480-3489. WANG P, HAN H Y, LI W T, et al. Effect of alternative splicing WNT4-β on follicular granulosa cell proliferation and hormone secretion in goats[J]. Acta Veterinaria et Zootechnica Sinica, 2022, 53(10): 3480-3489. (in Chinese) |
| [41] |
WANG W W, TENG J, HAN X, et al. miR-458b-5p regulates ovarian granulosa cells proliferation through Wnt/β-catenin signaling pathway by targeting catenin beta-1[J]. Anim Biosci, 2021, 34(6): 957-966. DOI:10.5713/ajas.20.0392 |
| [42] |
MANABE N, GOTO Y, MATSUDA-MINEHATA F, et al. Regulation mechanism of selective atresia in porcine follicles: regulation of granulosa cell apoptosis during atresia[J]. J Reprod Dev, 2004, 50(5): 493-514. DOI:10.1262/jrd.50.493 |
| [43] |
ZHONG L L, LUO Y, ZHOU F, et al. The effects of natural products and bioactive ingredients of traditional Chinese medicine on apoptosis of ovarian granulosa cells[J]. J Appl Toxicol, 2023, 43(6): 772-788. DOI:10.1002/jat.4406 |
| [44] |
HUANG G M, YAO Q, YE Z F, et al. Gender differential expression of AR/miR-21 signaling axis and its protective effect on renal ischemia-reperfusion injury[J]. Front Cell Dev Biol, 2022, 10: 861327. DOI:10.3389/fcell.2022.861327 |
| [45] |
LIN Y T, LU Z Y, KOKONTIS J, et al. Androgen receptor primes prostate cancer cells to apoptosis through down-regulation of basal p21 expression[J]. Biochem Biophys Res Commun, 2013, 430(1): 289-293. DOI:10.1016/j.bbrc.2012.10.135 |
(编辑 郭云雁)



