2. 上海市农业科学院畜牧兽医研究所 上海市农业遗传育种重点实验室,上海 201106;
3. 农业农村部畜禽资源(猪)评价利用重点实验室,上海 201106;
4. 上海种猪工程技术研究中心,上海 201302
2. Shanghai Key Laboratory of Agricultural Genetics and Breeding, Institute of Animal Husbandry and Veterinary Science, Shanghai Academy of Agricultural Sciences, Shanghai 201106, China;
3. Key Laboratory of Livestock and Poultry Resources (Pig) Evaluation and Utilization, Ministry of Agriculture and Rural Affairs, Shanghai 201106, China;
4. Shanghai Engineering Research Center of Breeding Pig, Shanghai 201302, China
玻璃化冷冻法是公认的安全有效的卵母细胞冷冻保存方法之一[1],已广泛应用于人、牛、羊等[2-4]哺乳动物的卵母细胞冷冻保存。与牛、羊等家畜相比,猪卵母细胞的特点是胞浆内脂质含量相对较高,是细胞抗冻能力差内因之一。超微结构观察发现,冷冻可造成卵母细胞的皮质颗粒迁移异常和细胞骨架损伤,但二者是否存在关联尚不为人所知[5]。目前为止,猪卵母细胞的冷冻保存至今仍处于试验研究阶段[6]。皮质颗粒是卵母细胞所特有的一种细胞器,它在保证卵母细胞单精子受精及胚胎正常发育中起着重要作用。皮质颗粒的大量增殖外迁并沿质膜线性排列是卵母细胞胞质充分成熟的一个重要标志。
细胞松弛素B(CB)作为细胞骨架稳定剂,已运用于卵母细胞的冷冻保护过程中,可稳定细胞骨架,提高冻后存活与发育能力[7-8]。尽管关于CB目前已有一些研究报道,大部分提出了CB影响细胞的成熟率和发育率等指标,关于细胞骨架在体外成熟培养过程中的迁移如何影响皮质颗粒的迁移,两者之间如何关联仍然有大部分空白。
本试验创新点在于除了CB对卵母细胞骨架作用的影响之外,CB对于GV期卵母细胞进行预处理后,通过荧光染色后荧光共聚焦显微镜观察,探讨了不同分组不同时间点(22、28、36、44 h)细胞骨架与皮质颗粒的定位变化。基于此,本研究拟在猪GV期卵母细胞玻璃化冷冻前进行CB孵育处理,玻璃化冷冻保存-解冻后体外成熟培养,检测其微丝骨架与皮质颗粒荧光染色共定位、44 h细胞核染色统计卵母细胞成熟过程的分布时期(GV、GVBD、MⅠ、MⅡ)、体外成熟率、GSH水平和孤雌激活后的胚胎发育潜能,评价冻后细胞骨架损伤和皮质颗粒异常迁移之间的相关性,并探讨CB能否通过改善细胞骨架状态,提高冻后卵母细胞的皮质颗粒迁移能力,继而改善GV期冻卵的体外成熟与后续胚胎发育。
1 材料与方法 1.1 试验分组猪卵母细胞分组处理如下:新鲜猪GV期卵母细胞(Fresh)、冷冻GV期卵母细胞(Vitrified)、冷冻前添加7.5 μg·mL-1 CB孵育0.5 h的猪GV期卵母细胞(Vitrified+CB)。成熟培养22、28、36和44 h分别为22 H、28 H、36 H、44 H时间点。每组30枚细胞,每组设置3个重复。
1.2 试剂1.2.1 玻璃化冷冻-解冻液配制 冷冻平衡液(冷Ⅰ)配比为EG∶DMSO∶FBS∶TCM-199=0.75∶0.75∶2∶6.5。玻璃化冷冻液(冷Ⅱ)配比为EG∶ DMSO∶FBS: 蔗糖=1.5 mL∶1.5 mL∶2 mL∶1. 368 g,TCM-199定容至10 mL。每10 mL解冻液I中含1.026 g蔗糖,2 mL FBS,TCM-199定容至10 mL,混匀。每10 mL解冻液II中含0.513 g蔗糖,2 mL FBS,TCM-199定容至10 mL,混匀。TCM-199:FBS=9∶1配置孵育液。
1.2.2 电激活液配制 首先称取0.010 0 g PVA溶于70 mL的胚胎水中,水温加热至80 ℃使其完全溶解,待温度降至室温后加入5.465 2 g甘露醇溶解。搅拌的同时缓慢加入100×的CaCl2、MgCl2、HEPES溶液1 mL,用胚胎水定容至100 mL,调节pH至7.2,超净台内用0.22 μm滤器过滤分装,4 ℃保存,1个月内用完。
1.2.3 试验试剂 TCM-199、胎牛血清(foetal bovine serum,FBS)购自于美国Gibco。人绒毛膜促性腺激素(human chorionic gonadotropin,HCG)及孕马血清性腺激素(pregnant mare serum gonadotropin,PMSG)购自宁波第三激素制品有限公司。细胞骨架F-actin荧光探针购自江苏凯基生物公司,GSH和GSSG试剂盒购自碧云天公司(Beyotime),猪卵泡液(porcine follicular liquid,pFF)由本试验室自制。其他试剂购自美国Sigma。
1.3 卵巢采集与CB处理所采集猪卵巢样品来自上海市嘉定区五丰上食屠宰场的健康经产母猪,采集卵巢数量120~150枚·次-1。自屠宰场采集新鲜猪卵巢放入装有39 ℃加青链霉素生理盐水的保温瓶内保温,1 h内送至实验室。利用10 mL注射器抽吸卵巢表面2~6 mm卵泡,收集卵泡液,沉淀30 min以上,弃上清,沉淀置于倒置显微镜下挑选卵丘-卵母细胞复合体(cumulus-oocyte complexes, COCs),使用TCM-199洗涤3次,置于直径30 mm盛有TCM-199的培养皿中备用。本研究试验组为玻璃化冷冻前在体外成熟培养液中添加终浓度为7.5 μg·L-1的CB对猪GV期卵母细胞进行预处理0.5 h。
1.4 猪GV期卵母细胞的玻璃化冷冻-解冻卵母细胞于冷冻平衡液中平衡5 min, 移入玻璃化冷冻液,30 s后装载至Cryotop载杆,立即投入液氮,于液氮下插入冷冻套管中,转移至液氮罐中冻存。解冻时,将Cryotop细胞装载区提出液氮面并立即置入39 ℃解冻液I中,5 min后将卵母细胞移入解冻液II孵育5 min,再移入孵育液中洗涤3次后孵育2 h获得冷冻-解冻卵母细胞,放入体外成熟培养液培养。成熟后的COCs置于2 mg·L-1透明质酸酶中反复吹打,直至颗粒细胞完全洗脱,Medium-199洗涤3次后备用。以上涉及溶液配制参照蔡绍莉等[9-10]的研究。
1.5 卵母细胞体外成熟培养取1 mL FBS、1 mL pFF、100 μL 1 000 IU·mL-1 PMSG、100 μL 1 000 IU·mL-1 hCG、100 μL双抗、100 μL 6.9 mg·mL-1 L-Cys、10 μL 10 μg·mL-1 EGF、4 μL 25 μg·mL-1 FGF、2 μL 100 μg·mL-1 IGF溶于8 mL TCM-199中混匀配置成熟培养液(IVM)[9]。新鲜或解冻后的COCs置于细胞成熟培养液中培养44 h,培养条件39 ℃、50 mL·L-1 CO2和饱和湿度[9]。成熟后的COCs置于2 mg·L-1透明质酸酶中反复吹打,直至颗粒细胞完全洗脱,TCM-199洗涤3次后备用。
1.6 皮质颗粒-微丝荧光共定位将各时期(22 H、28 H、36 H、44 H)已洗脱颗粒细胞的卵母细胞以1%链酶蛋白酶处理消化透明带(zona pellucida,ZP),4%多聚甲醛固定10 min,PBS洗涤3次,通透溶液(PBS中为0.01%(w/v)Triton X-100)处理10 min,封闭(PBS中7.5%(w/v)BSA)处理30 min,并在100 μg·mL-1 FITC标记的小扁豆凝集素(LCA-FITC, Sigma, L9262)中在避光孵育1 h。含0.1% Triton X-100的PBS洗涤3~5 min,于含1% BSA的PBS预孵育固定的细胞20~30 min,以减少非特异性背景。取5 μL LCA-FITC原液加入200 μL含1%BSA的PBS中预染色细胞。选择合适的染色液体积室温下孵育1 h,PBS洗涤两遍。利用1 μg·mL-1 Hoechst 33342染色5 min后细胞压片,激光扫描共聚焦显微镜观察。
1.7 ImageJ荧光分析对于多通道照片的荧光共定位可以通过一系列不同的参数进行表征,现在常用的两种参数是皮尔森系数(Pearson correlation coefficient, PCC)和曼德斯共定位系数(Manders’ colocalization coefficients, MCC),其中MCC这一参数使用最为广泛。MCC最明显的优势在于它比PCC更直观地衡量共定位情况,能够显示荧光之间的重叠比例。对于PCC不能很好测量的非线性比例的情况,MCC也能很好表征,MCC分析也更适合于3D共定位分析。参考公式如下:
| $ \begin{aligned} & M_1=\frac{\sum\nolimits_i R_{i, { colocal }}}{\sum\nolimits_i R_i} ; \\ & M_2=\frac{\sum\nolimits_i G_{i, { colocal }}}{\sum\nolimits_i R_i} 。\end{aligned} $ |
Manders系数(M1, fraction of blue overlapping green;M2,fraction of green overlapping blue) 表示为两通道荧光的共定位程度相关性[11]。M1、M2代表一种物质与另一种物质共定位的部分占该物质总量的比例,与每个颜色通道中共定位像素或体素的荧光量成正比,值范围为0~1,表示位于另一个颜色通道中强度高于零(或阈值)的像素的通道中的强度分数。这两个共定位系数被定义为不依赖于信号的强度系数,即使在两个组件中的信号强度不同也可以确定共定位情况。其中如果G>0,Ri,colocal=Ri,如果Gi=0,Ri,colocal=0;如果Ri>0,Gi,colocal=Gi,如果Ri=0,Gi,colocal=0。M1和M2与图像的每个组件中的共定位对象的荧光量成正比,相对于该组件中的总荧光[12]。
1.8 卵母细胞存活率检测至少30个卵母细胞于终浓度为5 μg·mL-1二乙酸荧光素(fluorescein diacetate, FDA)工作液中39 ℃孵育15 min,PBS洗3遍,置于荧光显微镜下检测,激发后观察到荧光的视为活细胞,未观察到荧光的视为无活性细胞。
1.9 卵丘扩散及卵母细胞成熟率检测各组猪GV期卵母细胞经44 h体外成熟培养后,于显微镜下检测卵丘扩散程度。利用0.1%透明质酸酶洗脱颗粒细胞后,观察卵母细胞第一极体排出情况,排出第一极体的视为卵母细胞成熟。
1.10 卵母细胞GSH含量检测1.10.1 制作标准曲线 将10 mmol·L-1 GSSG储备液用蛋白去除试剂M溶液依次稀释为15、10、5、2、1、0.5 μmol·L-1 GSSG溶液。取此6个浓度GSSG溶液做标准曲线,酶标仪测定A412,每5 min测定一次或实时测定,共测定25 min,测得5个数据。本次测定需同时测定总谷胱甘肽含量和GSSG含量,由于两者的检测体系不同,须分别单独做出标准曲线。
1.10.2 细胞检测样品的制备 PBS洗涤细胞一次,离心收集细胞,吸尽上清,加入细胞沉淀体积3倍量的蛋白去除试剂M溶液,充分漩涡震荡。利用液氮和37 ℃水浴对样品进行两次快速冻融。4 ℃放置5 min后4 ℃、10 000 g离心10 min。取离心管内上清测定总谷胱甘肽。
1.10.3 样品中总谷胱甘肽含量的计算 反应25 min后仅测定一次吸光度,样品对照标准曲线即可计算出总谷胱甘肽(标准曲线计算得到的GSSG浓度×2)或GSSG的含量。
1.11 卵母细胞发育能力检测经体外成熟培养的猪卵母细胞置于电激活液中洗涤3次,移入铺有电激活液的0.5 mm激活槽中电激活,激活参数为1.2 kV·cm-1、30 μs、一次脉冲。电激活后,卵母细胞经胚胎培养液(PZM-3)[9, 13-14]洗涤3次并移入PZM-3中,39 ℃、50 mL·L-1 CO2饱和湿度下培养,2 d观察卵裂、5 d观察桑椹胚、7 d观察囊胚形成情况。
1.12 数据统计每个试验至少使用30枚卵母细胞,每个试验独立重复3次。采用SPSS 16.0对数据执行单因素方差分析,LSD多重比较,结果以“平均值±标准误”表示,P<0.05代表组间差异显著,P<0.01代表组间差异极显著。
2 结果 2.1 新鲜卵母细胞中微丝-皮质颗粒间存在共迁移不同组别成熟后不同时间点(22H、28H、36H、44H)细胞骨架与皮质颗粒荧光共定位图像见图 1A-D。新鲜组4个时期荧光定位结果显示,细胞骨架与皮质颗粒有同步向质膜迁移的趋势。通过ImageJ统计MCC系数(图 1E-H),MCC共定位系数趋近于1,证明体外成熟过程中皮质颗粒与细胞微丝骨架由胞质内部向质膜存在同步迁移,44H完成迁移则标志着胞质成熟,研究证明新鲜组细胞微丝骨架与皮质颗粒在体外成熟过程中细胞内的定位与迁移具有一定程度的共定位和同步性。
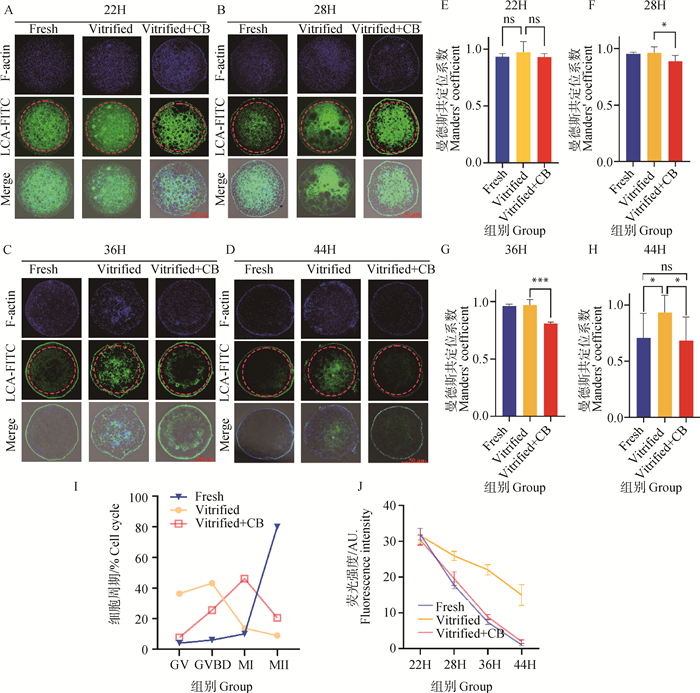
|
A、B、C、D.22 H、28 H、36 H、44 H微丝与皮质颗粒荧光共定位图像及复合图像,标尺=50 μm。E、F、G、H.分别对应A、B、C、D的荧光共定位系数统计图。I.44 H各组卵母细胞所处发育阶段对应细胞数量百分比统计图。J.各时间点各组卵母细胞内部胞质(A、B、C、D红色虚线内)皮质颗粒LCA-FITC荧光强度统计图。*.P<0.05; **. P<0.01; ***.P<0.001,下同 A, B, C, D. The fluorescence confocal images of cytoskeleton and cortical granules staining at 22 H, 28 H, 36 H and 44 H, Scale bar=50 μm. E, F, G, H. The fluorescence colocalization correlation maps of A, B, C and D. I. The distribution of maturation stages of different groups of cells during 44 H in vitro maturation. J. The line diagram of fluorescence intensity comparison of LCA-FITC cortical granules in red circular dotted lines at different time points.*.P < 0.05; **. P < 0.01; ***.P < 0.001, the same as below 图 1 卵母细胞微丝骨架与皮质颗粒荧光染色图、时期分布和荧光强度统计图 Fig. 1 Fluorescence staining image, period distribution and fluorescence intensity statistical image of microfilament skeleton and cortical granules in oocytes |
图 1A-D Vitrified组荧光图像显示,冷冻卵母细胞中,皮质颗粒与微丝由胞质内部向质膜迁移过程中两者均表现为不均匀分布,迁移至质膜的进程受阻,发生迁移障碍,甚至迁移停滞。根据图 1E-H统计结果,冷冻卵母细胞体外成熟培养过程中,皮质颗粒与微丝的迁移共定位系数MCC系数趋近于1,表明皮质颗粒与微丝的迁移在冻后成熟过程的迁移依然具有同步性。
经44 h成熟培养,各组卵母细胞核染后统计细胞所处时期(GV、GVBD、M Ⅰ、M Ⅱ),统计见图 1I。结果显示,与新鲜组相比,冻后细胞停滞于GVBD期及以前比例过高(80% vs. 10%,P<0.01),这表明在皮质颗粒和微丝共定位初期,冷冻导致细胞发生迁移障碍,44H细胞第一极体排出率低((8.13±0.30)% vs. (89.0± 1.29)%,P<0.01),成熟发育停滞。
各组各时期卵母细胞内部胞质(图 1A、B、C、D红色虚线内)皮质颗粒染色荧光强度统计图见图 1J。结果显示,44H冷冻卵母细胞内部胞质荧光强度极显著高于新鲜组(14.99±2.92 vs. 1.09±0.25,P<0.01),这表明冷冻卵母细胞皮质颗粒仍停留在胞质内部,不能完全迁移至质膜,皮质颗粒迁移完成率较低,细胞质未成熟,导致细胞成熟率低。
2.3 CB减轻冷冻引起的皮质颗粒-微丝共迁移障碍CB处理的冷冻卵母细胞(Vitrified+CB)皮质颗粒与微丝的迁移同步率(共定位系数M)在28 H、36 H、44 H均显著低于冷冻组(图 1E-H),且在成熟培养终点44 H,其皮质颗粒与微丝已基本完成至质膜的迁移(图 1D),内部胞质荧光强度显著低于冷冻卵母细胞(vitrified),与新鲜组差异不显著(图 1J)。证实了细胞骨架稳定剂CB预处理可改善冷冻卵母细胞成熟培养期间的皮质颗粒-微丝共迁移障碍。
冷冻卵母细胞中皮质颗粒-微丝在22 H、28 H、36 H的共定位率与新鲜卵母细胞差异不显著(P>0.05)(图 1E-H),核染统计结果显示80%冷冻卵母细胞发育停滞在GV期与GVBD期(图 1I);该结果揭示了,冷冻引起皮质颗粒-微丝共迁移障碍的主要形式并非破坏皮质颗粒-微丝的空间共定位关系,而是以阻碍二者的迁移为主。
与冷冻卵母细胞相比,CB预处理可显著提升卵母细胞达到MII期的比例(图 1I),即冻前CB预处理可促进冷冻卵母细胞成熟。另外,Vitrified+CB组细胞成熟培养后,仍有46.2%的卵母细胞处于MⅠ期(图 1I),证实较高比例的Vitrified+CB卵母细胞发育进程停滞在MI向MII期过渡(36-44H)阶段;此时期Vitrified+CB组皮质颗粒-微丝共定位率与同期的新鲜与冷冻卵母细胞相比均极显著降低(P<0.01)(图 1G),暗示了CB处理的冷冻卵母细胞未成熟可能与MI期后发生的微丝-皮质颗粒共定位率降低有关,导致部分细胞成熟进程在此时受阻。
2.4 冷冻导致卵母细胞存活率降低卵母细胞存活率检测结果见图 2。结果显示,冷冻卵母细胞存活率显著低于新鲜组(27.91% vs. 98.25%,P<0.01)。CB处理组的卵母细胞冻后存活率由27.91%提高至44.12%(P<0.01)。表明冷冻会导致卵母细胞死亡率升高,而玻璃化冷冻前添加CB孵育0.5 h能上调冷冻后卵母细胞的存活率。
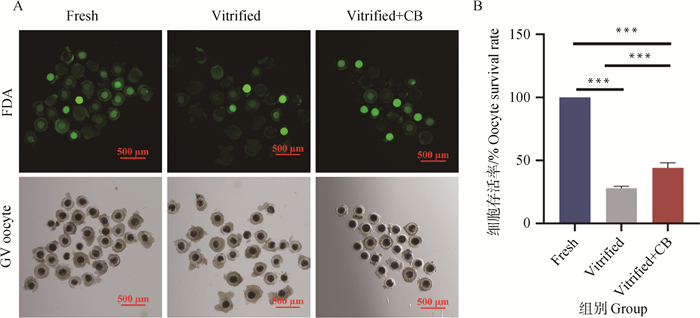
|
A. FDA染色荧光影像。FDA染色后,具有细胞活性的卵母细胞可被检测到绿色荧光,新鲜组标尺=500 μm,其他组别标尺=500 μm。B.卵母细胞存活率统计学分析 A.Image of FDA staining, green fluorescence can be detected in living oocytes, scale bar=500 μm in fresh group, scale bar=500 μm in other groups. B. Statistical analysis of oocyte viability 图 2 猪卵母细胞存活率检测 Fig. 2 Determination of porcine oocyte survival rate |
图 3结果表明,Fresh组卵丘扩散程度最好,第一极体排出率也最高(89%±1.29 vs. 8.13%±0.30,P<0.01)。而经CB处理后,Vitrified+CB组的卵母细胞经体外成熟培养后卵丘均匀扩散程度相较Vitrified组有所改善,其第一极体排出率相较于Vitrified组差异显著((26.79±2.37)% vs. (8.13±0.30)%,P<0.01)。
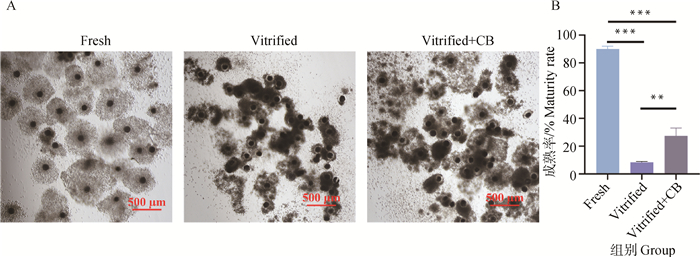
|
A.卵母细胞卵丘扩散,标尺=500 μm。B.卵母细胞第一极体排出率统计学分析 A.Cumulus diffusion of oocytes, Scale bar=500 μm. B. Statistical analysis of oocyte maturation rates 图 3 猪卵母细胞卵丘扩散与第一极体排出率检测 Fig. 3 Detection of cumulus diffusion and discharge rate of the first polar body detection of porcine oocytes |
卵母细胞胞内GSH含量检测结果如图 4。结果表明,新鲜组GSH含量最高,较冷冻卵母细胞组差异极显著(139.32±0.03 vs.7.27±0.79,P<0.01)。添加CB的冷冻试验组GSH含量高于冷冻组,GSH水平(23.12±2.65 vs.7.27±0.79,P<0.01)显著提高。
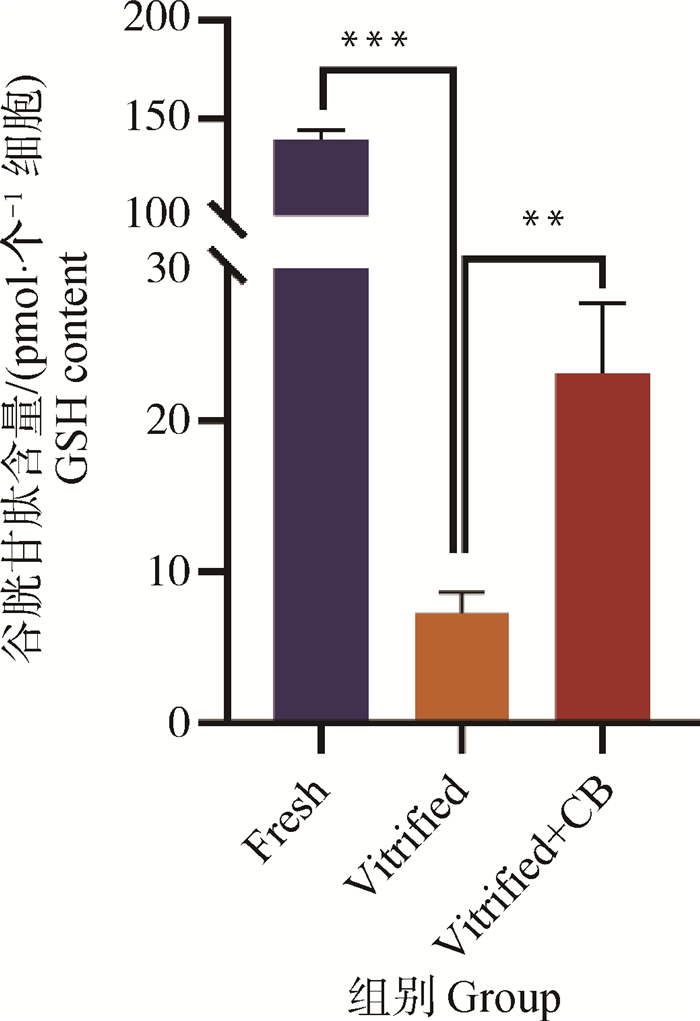
|
图 4 猪卵母细胞GSH水平检测 Fig. 4 Detection of GSH level in porcine oocytes |
卵母细胞孤雌激活后的体外发育能力检测结果见图 5。结果表明,添加CB可以上调冻后猪GV期卵母细胞体外成熟后的发育率,卵裂率由5.64%提高至20.91%(P<0.01),桑椹胚率由1.78%提高8.72%(P<0.01),囊胚率由0.41%提高至5.00%(P<0.05)。
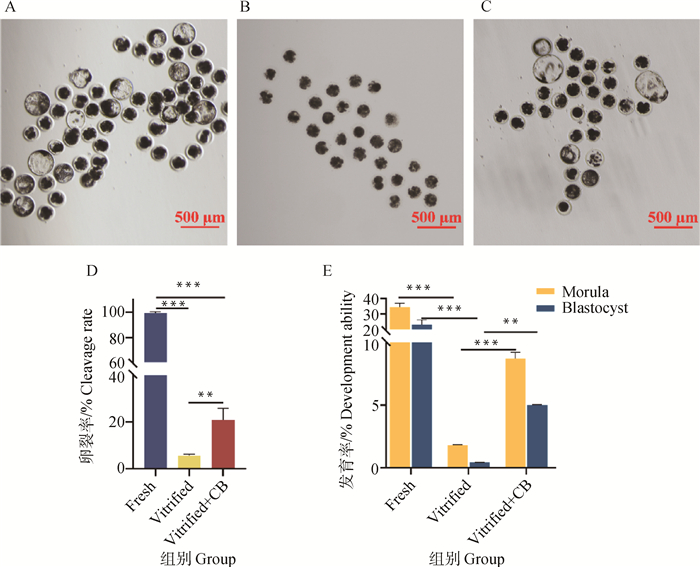
|
A.猪卵母细胞新鲜7 d发育图,标尺=500 μm。B.猪卵母细胞冷冻7 d发育图,标尺=500 μm。C.猪卵母细胞玻璃化冷冻加CB组7 d发育图,标尺=500 μm。D.猪卵母细胞2 d卵裂统计学分析。E.猪卵母细胞7 d发育能力统计学分析 A.Image of development of porcine oocytes in fresh group at 7 d, scale bar=500 μm. B. Image of development of porcine oocytes development in vitrified freezing group at 7 d, scale bar=500 μm. C. Image of development of porcine oocytes at 7 d in experimental group, scale bar=500 μm. D. Statistical analysis of cleavage at 2 d. E. Statistical analysis of developmental ability at 7 d 图 5 猪卵母细胞发育能力检测 Fig. 5 Detection of porcine oocyte development ability |
猪卵母细胞冻后造成的细胞骨架损伤是猪卵母细胞冷冻效率低下的重要原因之一,尽管目前冷冻猪卵母细胞复原后可获得存活后代,但尚不足以得以推广和应用[15]。稳定细胞骨架已成为提高猪卵母细胞冷冻效率的一个重要途径[16]。CB是从霉菌中提取的代谢物,是一种真菌代谢产物,研究最多的微丝定向剂之一,具有多种生物学功能[17-19]。有研究发现,CB在许多生物实例中可以诱导细胞DNA片段化而不会造成质膜损伤,该发现支持了CB通过其对肌动蛋白丝的作用诱导DNA片段化的解释,CB能够修饰与DNA合成相关的多种细胞功能,证明CB能够在许多细胞系中诱导DNA片段化[20]。据Dobrinsky等[21]报道,超低温冷冻保存扰乱了胚胎细胞膜和微丝的有序结构,使这些微丝系统得到重构,形成新的骨架系统以支撑整个细胞。CB是肌动蛋白聚合的抑制剂,结合在F-肌动蛋白的正(+)端,阻止F-肌动蛋白的功能。有研究表明,用CB对肌动蛋白的功能进行研究发现在细胞质中肌动蛋白构成细胞骨架的微丝,与胞质流动、变形运动、细胞形态的维持、细胞膜的动态变化、细胞器的运动等多种生命活动有关[22]。CB应用于小鼠,在卵泡浆内单精子注射(ICSI)期间对小鼠卵母细胞进行CB处理可提高胚胎存活率,而不会损害发育,CB是一种有毒的微丝抑制剂,已知可重构细胞骨架并增强卵母细胞的柔韧性,CB已被广泛用于核转移试验,以提高显微操作的成功率,CB不干扰纺锤体旋转、第二极体形成或原核迁移,对微管无影响[23]。此外,CB影响小鼠纺锤体移植后重构卵细胞骨架及囊胚发育[24]。尽管目前已有一些CB应用于卵母细胞上的研究报道,本研究创新点在于除了探究CB对卵母细胞骨架作用的影响之外[25-27],CB对于GV期卵母细胞进行预处理后,探讨了不同分组不同时间点(22、28、36、44 h)细胞骨架与皮质颗粒的定位变化,结果表明,细胞骨架与皮质颗粒存在共定位且在CB处理组,即添加CB对于细胞内骨架重构均匀皮质颗粒的分布具有一定的积极作用。
减数分裂过程中肌动蛋白和微管网络驱动卵母细胞中的染色体聚集[28]。人类和猪卵母细胞中的肌动蛋白和微管网络在核膜破裂后不久依次将染色体聚集在一个簇中,以确保它们被减数分裂纺锤体完全捕获[28]。通过免疫细胞化学和激光扫描共聚焦显微镜对猪卵母细胞成熟过程中体内和体外的微管和微丝组织进行成像,观察到微丝是细胞皮层周围相对较厚的均匀区域,并且在生发囊泡阶段卵母细胞的整个细胞质中也发现了微丝,生发囊泡分解后,微丝集中在雌性染色质附近[29]。在前中期,微丝被染色质移动到外围位置。在中期I,卵皮层中存在两个结构域,一个粗丝区和一个细丝区,染色体位于皮层的粗微丝结构域中,这些结果表明,微管和微丝都与猪卵母细胞生发囊泡破裂后的染色体动力学和减数分裂成熟密切相关[29-30]。
与细胞骨架共定位分布的皮质颗粒,其迁移与核成熟是分离的两个过程,皮质颗粒的迁移更可能反映的是胞质成熟,皮质颗粒迁移方式为皮质区附近的皮质颗粒先聚集到质膜下, 在皮质区附近形成不连续的环,然后其它皮质颗粒逐渐移向皮质区, 最后在质膜下形成一个单层[29-30]。本试验使用小扁豆凝集素LCA-FITC荧光探针、Hoechst333342、F-actin细胞骨架蓝色荧光探针对各试验组进行荧光染色,测试了CB处理引起的卵母细胞皮质颗粒与细胞微丝骨架定位的变化,结果表明在细胞成熟过程中细胞微丝骨架与皮质颗粒均由胞质向质膜迁移,这与Fuku等[31]的研究结果一致。在44 H体外成熟时间点处,新鲜组胞内细胞骨架迁移至质膜下排布,与武彩红等[30, 32]的研究结果一致;经CB处理后的猪卵母细胞共定位MCC系数与新鲜组(Fresh)对比差异不显著(P>0.05),与冷冻组对比差异显著(P<0.05),表明添加CB可以促进冻后44 h体外成熟过程中细胞微丝骨架与皮质颗粒的共迁移顺利进行,与新鲜组共迁移速率基本保持一致。而图 1I和图 1J结果表明,尽管在44 H时,冷冻组共定位系数高于其它组别,但其体外成熟进程和皮质颗粒迁移大多受阻,细胞多停留于GVBD期,因此皮质颗粒多分布于胞质内部而无法向质膜层均匀迁移,卵母细胞成熟进程阻滞。该结果证明,CB对冻后细胞微丝骨架可起到有效保护作用。
哺乳动物的卵母细胞与相邻的体细胞之间以相互依赖的方式生长发育。一般而言,卵丘细胞负责收集细胞增殖与代谢相关的转录物,而颗粒细胞则负责细胞分化和信号转导相关的转录物[33-34]。与颗粒细胞相比,卵丘细胞表现出更高的细胞增殖率,更高的抗缪勒氏激素(AMH)表达水平,并且具有分泌透明质酸用于卵丘扩展的高能力[34]。卵丘细胞与卵母细胞之间有多种方式相互交流对话,主要是通过缝隙连接蛋白和旁分泌因子,形成卵母细胞生长发育的微环境,并贯穿于整个卵泡发育过程。卵丘细胞通过缝隙连接蛋白向卵子传递一些小分子物质,参与卵母细胞胞浆和胞核的成熟,此外还改善体外卵母细胞的发育潜能[33]。对于GV期卵母细胞的玻璃化冷冻,卵丘细胞在玻璃化过程中对于细胞的保护作用更大,更利于细胞解冻后的IVM培养。
本研究通过对各组预处理卵母细胞的成熟率统计,发现玻璃化冷冻前用7.5 μg·mL-1CB孵育30 min的冷冻猪GV期卵母细胞成熟率最高,发育潜能大,这与Fujihira等[35]用浓度7.5 μg·mL-1 CB处理30 min卵母细胞的玻璃化冷冻效果最好结论一致。Isachenko等[36]报道, 成熟卵母细胞经7.5 μg·mL-1 CB处理后,能改善冷冻后的发育,这与本试验添加CB后孤雌激活发育率对比冷冻组,卵裂率((20.91±2.84)% vs. (5.64± 0.37)%, P<0.01)和囊胚率((5.00±0.03)% vs. (0.41±0.01)%, P<0.05) 得到显著提高,结果一致。两者均表明7.5 μg·mL-1 CB冻前预处理可以提高冻后GV期卵母细胞体外成熟率和改善冻后发育的作用。通过检测冻后猪GV期卵母细胞存活率,添加CB解冻后细胞存活率明显高于冷冻组(44.11% vs. 27.91%,P<0.01),证明CB确实起到保护细胞的作用,有益于降低细胞在冷冻过程中受到的损伤。这与Somfai等[37]报道CB可能会提高固体表面(SSV)玻璃化冷冻猪卵母细胞成熟后的存活率和发育率结果一致。
CB冻前处理猪GV期卵母细胞是否会影响到卵母细胞成熟和体外发育是本研究重点之一。GSH是细胞中最重要的抗氧化剂巯基化合物,在细胞抗氧化、蛋白质巯基保护和氨基酸跨膜转运中起重要作用,通过检测各试验组卵母细胞内GSH和GSSG含量,能够很好地反映细胞所处的氧化还原状态,是细胞胞质成熟的一个重要指标[38-39]。本研究结果表明,经CB处理的玻璃化冷冻细胞经体外成熟到MⅡ期的GSH含量较冷冻组(47.10±3.05 vs. 17.17±0.47,P<0.05)有显著提升,表明CB预处理冻前猪GV期卵母细胞可以上调其冻后成熟过程抗氧化能力,从而显著提升冷冻效率,这可能是CB提升冷冻效率的关键原因之一。De Matos等[40]报道, 体外成熟卵母细胞GSH含量的增加能改善胚胎的质量和发育能力。这与本研究结果一致。
4 结论本研究证实了通过添加CB可有效影响细胞微丝骨架与皮质颗粒的迁移程度,微丝细胞骨架对卵母细胞体外成熟过程中胞内皮质颗粒由内部向质膜迁移有一定的调节作用,且两者存在一定共定位关系,冻前添加CB稳定细胞骨架改善了因玻璃化冷冻造成的细胞骨架损伤,减轻了冷冻引起的细胞骨架异常分布,缓解了由冷冻引起的皮质颗粒-微丝迁移障碍,进而提升了细胞抗冻能力,表现为促进胞质成熟的同时,提高了冷冻卵母细胞存活率、核成熟率与胚胎体外发育潜能,从而显著提升冷冻效率。本研究为CB于玻璃化冷冻猪GV期卵母细胞前添加能稳定细胞骨架的应用提供了理论和现实依据。
| [1] |
WHITTINGHAM D G. Fertilization in vitro and development to term of unfertilized mouse oocytes previously stored at -196 ℃[J]. J Reprod Fertil, 1977, 49(1): 89-94. DOI:10.1530/jrf.0.0490089 |
| [2] |
MUKAIDA T, MATSUBARA T, TAKAHASHI K, et al. Birth after vitrified human oocytes using cryoloop technique[J]. Fertil Steril, 2005, 84(S1): S454. |
| [3] |
GUTNISKY C, MORADO S, GADZE T, et al. Morphological, biochemical and functional studies to evaluate bovine oocyte vitrification[J]. Theriogenology, 2020, 143: 18-26. DOI:10.1016/j.theriogenology.2019.11.037 |
| [4] |
BRAIR V L, MAIA A L R, CORREIA L F L, et al. Gene expression patterns of in vivo-derived sheep blastocysts is more affected by vitrification than slow freezing technique[J]. Cryobiology, 2020, 95: 110-115. DOI:10.1016/j.cryobiol.2020.05.009 |
| [5] |
周悦, 吴亚辉, 卢俊求, 等. 玻璃化冷冻对猪卵母细胞超微结构的影响[J]. 中国兽医杂志, 2015, 51(8): 3-6. ZHOU Y, WU Y H, LU J Q, et al. Effects of Vitrification on ultrastructure of porcine oocytes[J]. Chinese Journal of Veterinary Medicine, 2015, 51(8): 3-6. (in Chinese) |
| [6] |
唐毓, 杨镒峰, 张颖, 等. 猪卵母细胞玻璃化冷冻保存的研究进展[J]. 中国畜牧杂志, 2022, 58(8): 13-19. TANG Y, YANG Y F, ZHANG Y, et al. Research progress on vitrification cryopreservation of porcine oocytes[J]. Chinese Journal of Animal Science, 2022, 58(8): 13-19. (in Chinese) |
| [7] |
刘跃男, 金一, 方南洙, 等. 抗冻剂、CB和离心极化对猪GV期卵母细胞冷冻效率的影响[J]. 西北农林科技大学学报: 自然科学版, 2009, 37(1): 29-33, 38. LIU Y N, JIN Y, FANG N Z, et al. Effects of centrifugal polarization, CB and cryoprotectants on freezing efficiency of oocytes at GV stage in pigs[J]. Journal of Northwest A&F University: Natural Science Edition, 2009, 37(1): 29-33, 38. (in Chinese) |
| [8] |
SMITH G F, RIDLER M A C, FAUNCH J A. Action of cytochalasin B on cultured human lymphocytes[J]. Nature, 1967, 216(5120): 1134-1135. DOI:10.1038/2161134a0 |
| [9] |
蔡绍莉, 徐皆欢, 何孟纤, 等. 毛喉素对猪卵母细胞降脂及冷冻保护效果研究[J]. 畜牧兽医学报, 2023, 54(1): 178-188. CAI S L, XU J H, HE M Q, et al. Effects of Forskolin on lipid degradation and cryopreservation of porcine oocytes[J]. Acta Veterinaria et Zootechnica Sinica, 2023, 54(1): 178-188. (in Chinese) |
| [10] |
屠平光, 范雅婷, 黄剑锋, 等. 不同培养体系对金华猪卵母细胞体外成熟的影响[J]. 浙江畜牧兽医, 2020, 45(2): 4-5. TU P G, FAN Y T, HUANG J F, et al. The influence on in vitro oocytes maturation of Jinhua pig in different cultivation system[J]. Zhejiang Journal Animal Science and Veterinary Medicine, 2020, 45(2): 4-5. (in Chinese) |
| [11] |
DUNN K W, KAMOCKA M M, MCDONALD J H. A practical guide to evaluating colocalization in biological microscopy[J]. Am J Physiol Cell Physiol, 2011, 300(4): C723-C742. DOI:10.1152/ajpcell.00462.2010 |
| [12] |
MANDERS E M M, VERBEEK F J, ATEN J A. Measurement of co-localization of objects in dual-colour confocal images[J]. J Microsc, 1993, 169(3): 375-382. DOI:10.1111/j.1365-2818.1993.tb03313.x |
| [13] |
BOLTE S, CORDELIÈRES F P. A guided tour into subcellular colocalization analysis in light microscopy[J]. J Microsc, 2006, 224(3): 213-232. DOI:10.1111/j.1365-2818.2006.01706.x |
| [14] |
方园. 猪早期胚胎体外培养体系优化及对干细胞建系影响的研究[D]. 哈尔滨: 东北农业大学, 2022. FANG Y. Optimization of in vitro culture system of porcine early embryo and its influence on the establishment of embryonic stem cell lines[D]. Harbin: Northeast Agricultural University, 2022. (in Chinese) |
| [15] |
张德福, 刘东, 汤琳琳, 等. 地方猪种种质资源长期保存技术研究进展[J]. 上海农业学报, 2005, 21(2): 104-107. ZHANG D F, LIU D, TANG L L, et al. Research on techniques of long-term conservation of local pig breeds[J]. Acta Agriculturae Shanghai, 2005, 21(2): 104-107. (in Chinese) |
| [16] |
戴建军, 芮荣, 武彩红, 等. 猪GV期卵母细胞玻璃化冷冻保存技术研究[J]. 西北农林科技大学学报: 自然科学版, 2007, 35(8): 34-38. DAI J J, RUI R, WU C H, et al. Study on vitrification of porcine GV stage oocytes[J]. Journal of Northwest A&F University: Natural Science Edition, 2007, 35(8): 34-38. (in Chinese) |
| [17] |
戴建军, 李婉君, 蔡绍莉, 等. 猪卵母细胞冷冻保存技术优化研究进展[J]. 上海畜牧兽医通讯, 2023(1): 1-9. DAI J J, LI W J, CAI S L, et al. Research advances in optimization of cryopreservation technology for porcine oocytes[J]. Shanghai Journal of Animal Husbandry and Veterinary Medicine, 2023(1): 1-9. (in Chinese) |
| [18] |
高妍, 郑毅, 官员. 猪胚胎冷冻技术的研究历程与未来展望[J]. 中国猪业, 2020, 15(2): 40-44, 50. GAO Y, ZHENG Y, GUAN Y. The research process and future prospect of porcine embryo freezing technology[J]. China Swine Industry, 2020, 15(2): 40-44, 50. (in Chinese) |
| [19] |
KOLBER M A, BROSCHAT K O, LANDA-GONZALEZ B. Cytochalasin B induces cellular DNA fragmentation[J]. FASEB J, 1990, 4(12): 3021-3027. |
| [20] |
KOBAYASHI M, ITO J, SHIRASUNA K, et al. Comparative analysis of cell-free DNA content in culture medium and mitochondrial DNA copy number in porcine parthenogenetically activated embryos[J]. J Reprod Dev, 2020, 66(6): 539-546. |
| [21] |
DOBRINSKY J R, PURSEL V G, LONG C R, et al. Birth of piglets after transfer of embryos cryopreserved by cytoskeletal stabilization and vitrification[J]. Biol Reprod, 2000, 62(3): 564-570. |
| [22] |
高达. 卵泡大小对山羊卵母细胞皮质颗粒分布与迁移的影响[D]. 泰安: 山东农业大学, 2010. GAO D. Effect of follicle size on cortical granules micration and distribution of goat oocytes[D]. Tai'an: Shandong Agricultural University, 2010. (in Chinese) |
| [23] |
HU L L, SHEN X H, ZHENG Z, et al. Cytochalasin B treatment of mouse oocytes during intracytoplasmic sperm injection (ICSI) increases embryo survival without impairment of development[J]. Zygote, 2012, 20(4): 361-369. |
| [24] |
王启航, 王伟, 王伟周, 等. 不同浓度CB对小鼠纺锤体移植后重构卵细胞骨架及囊胚发育影响的研究[J]. 河北医科大学学报, 2023, 44(2): 129-136. WANG Q H, WANG W, WANG W Z, et al. Effects of different concentrations of CB on the reconstruction of egg cytoskeleton and embryo development after spindle transplantation in mice[J]. Journal of Hebei Medical University, 2023, 44(2): 129-136. (in Chinese) |
| [25] |
SELDEN S C, SCHWARTZ S M. Cytochalasin B inhibition of endothelial proliferation at wound edges in vitro[J]. J Cell Biol, 1979, 81(2): 348-354. |
| [26] |
TRENDOWSKI M, MITCHELL J M, CORSETTE C M, et al. Chemotherapy with cytochalasin congeners in vitro and in vivo against murine models[J]. Invest New Drugs, 2015, 33(2): 290-299. |
| [27] |
ZHUAN Q R, LI J, DU X Z, et al. Antioxidant procyanidin B2 protects oocytes against cryoinjuries via mitochondria regulated cortical tension[J]. J Anim Sci Biotechnol, 2022, 13(1): 95. |
| [28] |
NIKALAYEVICH E, TERRET M E. Meiosis: actin and microtubule networks drive chromosome clustering in oocytes[J]. Curr Biol, 2023, 33(7): R272-R274. |
| [29] |
KIM N H, FUNAHASHI H, PRATHER R S, et al. Microtubule and microfilament dynamics in porcine oocytes during meiotic maturation[J]. Mol Reprod Dev, 1996, 43(2): 248-255. |
| [30] |
武彩红, 张斌, 芮荣, 等. 猪卵母细胞中细胞骨架的激光共聚焦显微技术[J]. 江苏农业科学, 2008, 36(3): 187-189. WU C H, ZHANG B, RUI R, et al. Laser confocal microscope technology of cytoskeleton in porcine oocyte[J]. Jiangsu Agricultural Sciences, 2008, 36(3): 187-189. (in Chinese) |
| [31] |
FUKU E, XIA L, DOWNEY B R. Ultrastructural changes in bovine oocytes cryopreserved by vitrification[J]. Cryobiology, 1995, 32(2): 139-156. |
| [32] |
KAMOSHITA M, KATO T, FUJIWARA K, et al. Successful vitrification of pronuclear-stage pig embryos with a novel cryoprotective agent, carboxylated ε-poly-L-lysine[J]. PLoS One, 2017, 12(4): e0176711. |
| [33] |
FAHY G M, WOWK B. Principles of cryopreservation by vitrification[M]//WOLKERS W F, OLDENHOF H. Cryopreservation and Freeze-Drying Protocols. 3rd ed. New York: Springer, 2015: 21-82.
|
| [34] |
毛晓燕. 人卵母细胞成熟过程中卵丘细胞与卵母细胞关系的研究进展[J]. 同济大学学报: 医学版, 2018, 39(5): 123-127. MAO X Y. Recent research progress on interaction between cumulus cells and oocytes in process of human oocyte maturation[J]. Journal of Tongji University: Medical Science, 2018, 39(5): 123-127. (in Chinese) |
| [35] |
FUJIHIRA T, KISHIDA R, FUKUI Y. Developmental capacity of vitrified immature porcine oocytes following ICSI: effects of cytochalasin B and cryoprotectants[J]. Cryobiology, 2004, 49(3): 286-290. |
| [36] |
ISACHENKO V, SOLER C, ISACHENKO E, et al. Vitrification of immature porcine oocytes: effects of lipid droplets, temperature, cytoskeleton, and addition and removal of cryoprotectant[J]. Cryobiology, 1998, 36(3): 250-253. |
| [37] |
SOMFAI T, DINNYÉS A, SAGE D, et al. Development to the blastocyst stage of parthenogenetically activated in vitro matured porcine oocytes after solid surface vitrification (SSV)[J]. Theriogenology, 2006, 66(2): 415-422. |
| [38] |
LUBERDA Z. The role of glutathione in mammalian gametes[J]. Reprod Biol, 2005, 5(1): 5-17. |
| [39] |
MONGE M E, MARTINEFSKI M R, BOLLINI M, et al. UHPLC-HRMS-based analysis of S-hydroxymethyl-glutathione, GSH, and GSSG in human cells[M]//PAPA S, BUBICI C. Metabolic Reprogramming: Methods and Protocols. New York: Humana, 2023: 117-132.
|
| [40] |
DE MATOS D G, FURNUS C C, MOSES D F, et al. Stimulation of glutathione synthesis of in vitro matured bovine oocytes and its effect on embryo development and freezability[J]. Mol Reprod Dev, 1996, 45(4): 451-457. |
(编辑 郭云雁)



