鸡的羽毛作为皮肤最复杂的衍生物,具有复杂的颜色和图案,是进化生物学和发育生物学的重要研究对象[1],在拟态、防护日光灼伤和吸引异性等方面也起着很重要的作用[2];鸡的羽色性状是分辨不同品种和类群的重要外貌特征,鲜艳且整齐均一的鸡更受到消费市场的青睐[3],呈现出重要的经济效益[4-5],因而羽色成为选种的重要性状之一。研究鸡羽色的遗传机制有助于肉蛋鸡选育[6]、家禽起源进化和遗传资源保护研究[7]。
鸡的羽色性状多种多样[8-10],芦花羽就是其中之一。目前,有关鸡芦花羽性状的形成机制研究众多,但都是单独研究常染色芦花羽或者性连锁芦花羽其中一种,尚未有文章将两者的形成机制进行系统地梳理、比对。本文总结了常染色体芦花羽和性连锁芦花羽形成的分子机制,着重从基因组的角度探讨了芦花羽图案形成和颜色深浅背后的遗传调控机制,为我国芦花性状地方鸡种的起源进化、种质特性评价及品种保护和培育提供理论依据。
1 鸡的芦花羽表型定义芦花鸡因其羽毛远看像是芦苇一样而得名芦花羽,常见的芦花羽主要呈现出不同颜色相间排列的条纹,故又称“横斑羽”。芦花羽在羽毛颜色上呈现多种变异,包括黑色、白色、褐色等不同的色彩。鸡的芦花羽分为常染色体芦花羽和性连锁芦花羽两种类型,常见的具有常染色体芦花羽的品种包括Fayoumi、Campine和Westfälische Totleger(图 1A),具有性连锁芦花羽的品种相对较少,最常见的是Barred Plymouth Rock、French Coucou de Rennes (图 1B)[11-12]。我国目前常见的含有芦花表型的地方鸡和商用配套系有汶上芦花鸡、白芦花文昌鸡、黑芦花文昌鸡、坝上长尾芦花鸡、广西鸿光芦花鸡(图 1C),均为性连锁芦花鸡。从全身羽毛看,常染色体芦花鸡的芦花羽多分布在除头部、颈部以外的其他部位,分布较凌乱;性连锁芦花鸡的芦花羽则在全身均匀分布。从单根羽毛看(图 1D),性连锁芦花羽的横斑条纹伴随着色素沉着的完全缺失,而常染色体芦花羽表现为深色和浅色的横斑条纹以不规则的方式交替排列。

|
A.常染色体芦花鸡[14-16]:a. Fayoumi;b. Campine;c. Westfälische Totleger。B.性连锁芦花鸡[17-18]:a. Barred Plymouth Rock;b. French Coucou de Rennes。C.我国常见的几种芦花鸡[19]:a. 汶上芦花鸡;b. 白芦花文昌鸡;c.黑芦花文昌鸡;d. 坝上长尾芦花鸡;e. 广西鸿光芦花鸡。D.单根芦花羽:a.常染色体芦花羽[20];b. 性连锁芦花羽[18] A. Autosomal barring chicken[14-16]: a. Fayoumi; b. Campine; c. Westfälische Totleger. B. Sex-linked barring chicken[17-18]: a. Barred Plymouth Rock; b. French Coucou de Rennes. C. The most common chickens in China[19]: a. Wenshang Luhua chicken; b. Wenchang White Luhua chicken; c. Wenchang Black Luhua chicken; d. Bashang long-tail Luhua chicken; e. Guangxi Hongguang Luhua chicken. D. The single barring feather: a. Autosomal barring[20]; b. Sex-linked barring[18] 图 1 芦花鸡全身羽毛和单根羽毛表型图 Fig. 1 Pictures of whole body and single feather of the Luhua chicken |
目前有关芦花羽表型的定义已有诸多研究,研究历程如表 1所示。其中,受到广泛认可的是Schwochow于2017年提出的定义:常染色体芦花羽表现为白或褐色背景羽色的黑色条纹,条纹略微凌乱,不规则。而性连锁芦花羽表现为褐或黑色背景羽色的白色条纹,条纹较规则[13]。
|
|
表 1 芦花羽表型定义研究历程 Table 1 History of barring phenotype definition |
羽色性状是化学和光学两个相互关联过程的结果[23]。羽毛的微小结构在光线的干涉或衍射下会产生结构色,黑色素和类胡萝卜素构成鸡羽色的化学色素色。类胡萝卜素需要从外界摄取,而黑色素可以在自身毛囊黑素细胞合成[24]。黑素细胞由神经嵴细胞发育而来,在羽毛发生时期,羽原基处的黑素细胞将树突伸出并达到最外层的羽小枝,在树突缩回的过程中,由外而内地向羽小枝和羽枝的角质细胞运送黑素小体;随着羽枝、羽小枝的形成,黑素小体进入羽片表皮层,并在此沉积不同含量和种类的黑色素,树突缩回之后的细胞发生退变,随着羽芽的生长会分化形成新的黑素细胞。以上过程任一环节的改变都有可能影响芦花羽的图案形成及颜色深浅。
2.1 鸡芦花羽图案形成机制鸡常染色体芦花羽和性连锁芦花羽的图案虽然都是不同颜色横斑条纹交替排列,但其形成的分子遗传机制却不同,通过对相关基因、基因座进行遗传分子层面的分析,可以更好地理解其形成机制。
2.1.1 常染色体芦花羽图案形成机制 最初,常染色体芦花羽被认为是db基因座(dlution of Black,黑色素稀释基因座)、E基因座(extension,黑色素扩散基因座)和pg基因座(pattern Gene,图案基因座)多个等位基因共同作用的结果[25-27]。2018年,聂昌盛等[28]提出常染色体上的芦花产生深色和明亮的色素交替沉着,是在db和pg两个基因座联合作用下形成。2021年,Schwochow等[20]通过回交试验发现db等位基因不是常染色体芦花羽表型所必需的,db变异与常染色体芦花羽规则度和颜色深浅程度有关,与芦花羽的形成无关。很可能携带db基因座的个体其表型更能吸引育种工作人员,导致db被误认为是形成常染色体芦花羽所必需的。因此,常染色体芦花羽羽色性状主要是在pg基因座的作用下形成的,但是否还存在其他基因座的共同作用尚有待探究。
2002年,Prum和Williamson[29]提出羽毛内色素沉着模式可能是由图灵反应-扩散模型引起的,其原理是短程可扩散激活因子与长程可扩散抑制因子相结合,激活因子促进其自身的表达和抑制因子的表达,抑制因子比激活因子更快地扩散到邻近细胞并抑制激活因子的功能,从而形成重复的斑点或条纹图案。目前,已有诸多研究表明ASIP(刺鼠信号蛋白)基因在调控羽色图案的图灵模型中扮演着抑制因子的角色,在真皮细胞中表达的ASIP与黑色素细胞相互作用可以影响色素条纹出现[30],而且ASIP在毛囊中不同位置的表达也会造成羽色图案的改变[31, 32]。正常情况下,黑色素的生成过程中黑素皮质素受体1基因(MC1R)需要与α-促黑素细胞激素(α-MSH)和促肾上腺皮质激素(ACTH)两个配体共同作用,α-MSH和ACTH与黑色素细胞膜上的MC1R基因结合后[33],使与受体偶联的G蛋白由无活性的二磷酸鸟苷(GDP)型转变为有活性的三磷酸鸟苷(GTP)型,激活膜上的腺苷酸环化酶系统,三磷酸腺苷(ATP)转变为环腺苷酸(cAMP),cAMP进一步激活酪氨酸激酶,活化酪氨酸酶(TYR)。TYR催化黑色素细胞内的酪氨酸生成多巴,多巴在黑素体内聚积到一定量后释放黑色素。如果细胞中的TYR过量,多巴及多巴醌将通过各自的通道合成真黑色素;如果黑色素细胞中的TYR过少,酪氨酸则转化为半胱氨酰多巴,从而导致褐黑素的广泛表达[21]。2021年,Schwochow等[20]通过对鸡常染色体芦花羽羽色性状的研究发现,MC1R基因编码区存在L133Q突变,该突变可能导致常染色体色素沉积障碍。ASIP是MC1R的抑制因子,它会和α-MSH竞争与MC1R的结合[34]。ASIP与MC1R结合后会抑制TYR的表达从而阻碍真黑素的形成[35]。在常染色体芦花羽形成过程(图 2)中,ASIP(长程可扩散抑制因子)比α-MSH(短程可扩散激活因子)更快地扩散到邻近细胞并抑制邻近细胞MC1R的功能,进而降低黑色素细胞中的TYR含量,促进褐黑素的表达,从而促进横斑条纹中非黑色条纹的形成。
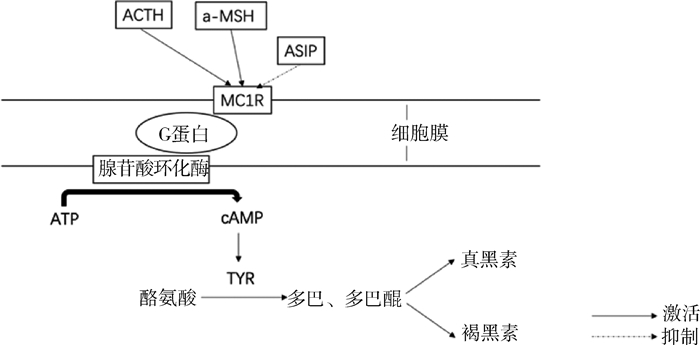
|
图 2 常染色体芦花羽表型形成机制 Fig. 2 Formation mechanism of autosomal barring phenotype |
2.1.2 性连锁芦花羽图案形成机制 鸡的性连锁横斑羽色表型最早是Spillman提出来的,他把横斑等位基因标记为B*B,野生型标记为B*N[36]。性连锁横斑羽色表型为不完全显性遗传,具有剂量效应,B基因纯合个体的白色横纹宽度大于杂合子及半合子个体[21]。James[37]通过连锁作图将B等位基因定位到了Z染色体的长臂末端,而后Dorshorst和Ashwell[38]又将其定位到Z染色体长臂末端的355 kb的范围内。2010年,Hellström等[22]通过测序技术及精细作图技术将B基因定位到Z染色体上的CDKN2A/B基因座(图3),提出性别连锁芦花是由编码INK4b和ARF转录本的CDKN2A/B位点控制的,并在该基因座上发现了4个SNPs位点,但是是否有其中一种或两种或两种以上CDKN2A突变的联合作用导致性连锁芦花羽表型尚不确定。
目前获得最广泛认可的性连锁芦花表型的形成机制是由Thalmann等[18]于2017年提出的,在纯色羽毛中,色素祖细胞从羽毛基底部向上迁移,在羽枝区开始表达CDKN2A,诱导黑色素细胞进行分化并产生色素,同时会有源源不断未分化的黑色素细胞进行补充。而在性连锁的芦花羽毛中,CDKN2A基因编码的肿瘤抑制蛋白(ARF)表达上调可能导致色素细胞过早的分化,使得羽毛在持续生长过程中,羽枝区因缺乏未分化的黑色素细胞及时进行补充和产生色素,从而产生白色条纹。当未分化的黑色素细胞被完全耗尽时,黑素祖细胞开始进行新的补充,因此形成了黑白相间的横斑条纹。总之,性连锁芦花羽与常染色体芦花羽的图案形成机制不同,性连锁芦花羽横斑条纹的非黑色部分的形成是因为缺乏可以产生黑色素的黑色素细胞,从而导致了色素沉着的完全缺失,一般在表型上表现为白色横斑条纹;而常染色体芦花羽横斑条纹的非黑色部分的形成则是因为黑色素的生成受到抑制,但可以产生黑色素的黑色素细胞并不缺乏。
2.2 鸡芦花羽颜色深浅形成机制黑色素是决定鸟类羽色最基础也是最普遍的色素。黑色素最后是否能成功沉积到皮肤或羽毛中主要取决于3个阶段[39]:黑色素细胞的发育、黑色素的生成、黑色素的沉积[40-41]。性连锁芦花羽和常染色体芦花羽羽色性状的图案形成机制不同,但颜色深浅的形成机制相似,都是通过黑色素沉积过程中的关键基因来影响色素沉着程度[32, 42],如CDKN2A/B、SLC45A2、TYR等。目前已有的相关研究主要集中在黑色素细胞的发育、黑色素的生成两个阶段[43-45]。
2.2.1 黑色素细胞的发育 黑色素是在黑色素细胞内的一种溶酶体类细胞器黑素小体中合成的,而黑色素细胞最早来源于神经嵴细胞。头部黑色素细胞由颜面神经嵴细胞分化形成,躯干及四肢的黑色素细胞由躯干神经嵴细胞分化形成[46]。神经嵴细胞起源于神经上皮,其会先进入一个迁移停滞区[47],然后进入背外侧或者腹侧迁徙路线,到达胚胎的确切位置[48]。在迁移开始之前,神经嵴细胞先分化为成黑素细胞。当成黑素细胞沿着背外侧路径迁移到指定位置时,它们继续分化为黑素细胞并产生黑色素[49]。此过程即为黑色素细胞的发育阶段。目前已知的这一阶段的关键基因有:内皮素受体B家族(EDNRB/EDNRB2)、肥大干细胞因子受体(KIT)、性别决定区盒基因(SOX10)、细胞周期蛋白依赖性激酶抑制剂2A/B(CDKN2A/B)[22, 39, 47, 50]。
CDKN2A/B基因属于细胞周期依赖性激酶抑制因子基因家族,在细胞周期调控中起关键作用,它编码ARF和INK4蛋白[51]。CDKN2A基因位于鸡的Z染色体上,且编码ARF转录本。ARF蛋白对细胞周期有调控作用,它通过与小鼠双微体2同源物(MDM2)结合,保护转录因子p53免于降解[51]。p53是一种控制细胞周期启动的因子,可激活下游靶基因导致黑色素细胞过早分化,从而导致成熟黑色素细胞丧失,进而促进白色条纹的形成[51-53]。Schwochow[18]发现,鸡性连锁横斑等位基因的演变涉及CDKN2A基因表达量和其所编码蛋白的改变,将芦花表型(表 2)分为极端稀释的芦花表型(B 0)、经典芦花表型(B 1)、有一定稀释度的芦花表型(B 2)。相比于经典芦花,弱稀释芦花、强稀释芦花的芦花颜色变浅的程度逐渐加强。SNP1、SNP2是分别位于启动子、内含子的非编码突变,与表型几乎完全相关;SNP3、SNP4是位于外显子的错义突变,对应的ARF蛋白的改变分别是V9D(缬氨酸->天冬氨酸)、R10C(精氨酸->半胱氨酸),所有性连锁芦花羽都携带SNP3、SNP4这两个错义突变之一。B0、B1和B2中的非编码突变SNP1、SNP2造成了编码ARF蛋白的CDKN2A的表达呈现组织特异性上调,ARF的增加抑制MDM2介导的转录因子p53降解。B1和B2等位基因中的错义突变SNP3或SNP4很可能削弱ARF和MDM2间的相互作用,抵消部分ARF表达上调的抑制效果。SNP3比SNP4能更大程度地限制SNP1、SNP2对色素稀释的影响,这与纯合子条件下B2比B1表型显示出更浅的色素沉着的观察结果一致。周成浩等[54]基于基因组测序技术对汶上芦花鸡这一经典芦花鸡群在遗传进化过程中的选择信号进行了分析,筛选到9个基因与CDKN2B形成了1个特殊的蛋白质互作网络,其中包含5个与酪氨酸合成代谢相关的基因:PTPRQ、PTPN11、PTPN7、YES1和SRMS。其中,PTPRQ、PTPN11、PTPN7的功能与蛋白酪氨酸磷酸酶活性相关;YES1和SRMS的功能与跨膜受体蛋白酪氨酸激酶信号通路、肽基-酪氨酸自磷酸化等相关。以上这些研究说明,CDKN2A/B可能通过调控黑色素细胞的增殖分化、酪氨酸合成代谢来影响芦花羽颜色深浅。
|
|
表 2 不同稀释程度的性连锁芦花羽表型及突变位点 Table 2 Phenotype and mutation sites of sex-linked barring at different dilution levels |
2.2.2 黑色素的生成 黑色素会在黑素小体中开始生成,其前体物质多巴在酪氨酸酶的催化下会形成多巴、多巴醌,进而形成真黑素、褐黑素[55],黑色素在黑素小体中合成完毕后就开始为最后阶段的沉积做准备。此过程即为黑色素细胞的生成。已知的黑色素生成阶段的关键基因有:黑素皮质素受体1(MC1R)、a-黑色素刺激素(α-MSH)、刺鼠信号蛋白(ASIP)、酪氨酸酶相关基因(TYR/TYRP1)、小眼转录因子(MITF)、黑素小体特异性蛋白(PMEL17)、水溶载体45家族第二成员(SLC45A2)[34, 39, 56-57]。
Agouti基因编码的ASIP信号蛋白可以通过抑制MC1R与其配体α-MSH的结合,导致真黑素的形成被抑制,促进褐黑素的产生。这一黑色素合成过程中,TYR是一个关键的限速酶。Yang等[34]在探讨MC1R、TYR和ASIP基因在灰羽、黑羽、白羽、芦花羽、麻羽等几种不同羽色鸡群羽毛颜色的形成分化过程中扮演的重要角色时,发现TYR基因外显子1上检测到3个突变位点(C47G、T120C、T172C)与鸡羽色的形成有较强相关性,其中的T172C突变导致第58位苯丙氨酸被亮氨酸取代(Phe58Leu),且该突变在横斑羽群体中呈现完全多态现象。该试验还发现,MC1R、TYR和ASIP基因的突变与鸡的羽色表型有一定相关性,是影响鸡羽色性状的重要基因,其中,MC1R和TYR在颜色分化中发挥关键作用。以上研究可能说明,ASIP与MC1R和TYR之间存在互为抑制作用,ASIP主要是通过与α-MSH相结合来调控真黑色素和褐黑色素的合成,在芦花羽羽色深浅的形成中发挥重要作用。
溶质载体家族包括SLC24A5、SLC45A2、SLC26A4等,这些基因作为黑素小体的结构基因,发挥着维持黑素小体的形态结构并保证其内环境稳态的作用[58]。宋素芳等[59]以“豫粉1号”H系为研究对象,其颈部背侧具有黑白相间的芦花色羽毛,颈部腹侧为白色羽毛,具有伴性遗传特点,通过测定SLC45A2在颈部背侧和颈部腹侧的相对表达量,发现SLC45A2在颈部背侧浅芦花和腹侧白色中的表达量差异显著。刘小辉[60]发现,黑羽与白羽、麻羽、芦花羽、银灰色羽等羽色鸡的毛囊转录组存在中度差异,羽色黑色区域大小以及羽色深浅可能和SLC45A2、SLC24A5、TYR等10个基因的表达水平相关,提示芦花羽颜色深浅与酪氨酸代谢、黑素原生成通路有关。以上这些研究说明,SLC45A2可能通过调控黑色素细胞的合成进而影响芦花羽颜色深浅。
3 鸡的芦花羽在生产中的应用性连锁芦花羽性状具有伴性遗传的特性,控制该性状的基因CDKN2A位于Z染色体上,Z染色体上的伴性基因B除了对羽毛颜色有影响外,还对胫色有稀释作用,表现出剂量效应。因此,当前芦花表型的应用主要指性连锁芦花羽这一表型在实际生产中的应用。某些地区的市场偏爱横斑表型的公鸡,可根据市场需求对特定的羽色或羽色基因进行选择,培育符合市场的、外观一致性高的新品种或商用配套系。
芦花性状(B)对非芦花性状(b)为显性。许继国和张细权[61]曾通过剔除隐性白羽公鸡中的杂合子个体(ZBZb),建立芦花纯系,然后利用含有芦花基因的隐性白羽母鸡与地方黄羽种公鸡进行杂交,使得F1代的公鸡全为芦花表型,以此来提高鸡场经济效益[53]。同样,也可以根据需要剔除含芦花基因的鸡群,建立非芦花表型的纯系鸡群。
利用羽色伴性基因的遗传规律建立自别雌雄品系,省时省力,且准确率高达98%以上,能为生产带来很大便利。鸡的性别决定类型为ZW型,雌性性染色体组成为ZW,雄性为ZZ。杂交试验中,当用非芦花公鸡(ZbZb)与芦花母鸡(ZBW)交配时,理论上,F1代中的公鸡全部是芦花鸡(ZBZb),母鸡全部是非芦花鸡(ZbW),当F1代自群繁殖时,在F2代的两性中,芦花鸡和非芦花鸡各占一半。成年芦花鸡的性连锁芦花羽的羽毛色素沉着表型为羽毛黑白条纹相间,公鸡斑纹白色宽于黑色,母鸡斑纹宽窄较一致,而刚孵化的雏鸡几乎全身为黑色绒毛,头上有白色斑点,公雏的斑点要比母雏的大[61],可用于鉴定小鸡出生时的性别。
4 小结与展望本文综述了芦花羽形成的遗传调控机制研究进展,全面探讨了其图案和颜色深浅的形成机制。影响鸡羽色的基因座位有20多个,它们之间的相互作用决定了鸡的羽毛颜色[62-63]。从色素沉积来看芦花羽的形成机制,探究黑色素沉积过程中的关键基因、信号通路在不同羽色鸡群之间的差异,可以使不同羽色间的互作效应机制更加清晰。从个体全身分布部位及比例来看芦花羽的形成机制,目前相关研究多集中于单根或局部羽毛上,而在全身构成上的研究还较少,如有些品种芦花鸡的芦花羽在全身分布上是否具有部位特异性有待探究,同一品种芦花鸡不同部位芦花羽的色素沉着程度是否有关联也尚不清楚。此外,目前对于芦花羽羽色性状的研究主要集中在何种基因型导致的该表型上,而缺乏对具体分子过程的探究。图灵模式是生物物理学的基础,产生于短程激活和长程抑制过程。Alessio和Gupta[64]在图灵模式中通过化学梯度推动胶体粒子扩散,发现扩散泳动使胶体粒子产生的图案比生物化学图灵图案更清晰、更稳定,因此提出可以用胶体扩散泳动的基本物理过程来量化生物体内的色素图案形成过程,这一方法的发现或许有助于我们研究芦花羽颜色深浅形成的分子机制。除此之外,还有很多现代分子生物学技术和测序技术、生物信息学技术在快速发展,这些将促使人们能够深入分析黑素细胞的增殖、迁移和分化过程,以及他们和再生羽毛毛囊内邻近组织细胞的相互作用,进一步辨别芦花羽图案和颜色深浅形成背后的分子遗传机制。
| [1] |
DRISKELL R R, CLAVEL C, RENDL M, et al. Hair follicle dermal papilla cells at a glance[J]. J Cell Sci, 2011, 124(8): 1179-1182. DOI:10.1242/jcs.082446 |
| [2] |
谢文燕, 王修启, 严会超, 等. 家禽羽毛生长发育规律及其调控机制[J]. 动物营养学报, 2017, 29(10): 3452-3459. XIE W Y, WANG X Q, YAN H C, et al. Poultry feathers: growth, development and regulation mechanism[J]. Chinese Journal of Animal Nutrition, 2017, 29(10): 3452-3459. (in Chinese) |
| [3] |
SARAGIH H T S G, PERDAMAIAN A B I, SADIMAN, et al. Plumage colours Stability in Inbreed Pelung Chicken[J]. BIO Web Conf, 2021, 33: 01005. DOI:10.1051/bioconf/20213301005 |
| [4] |
HAFEZ R D A, HADZIMA-NYARKO M, AHMED S M, et al. Recycled chicken feather sand as a partial replacement for natural sand for producing eco-friendly mortar[J]. Buildings, 2023, 13(2): 421. DOI:10.3390/buildings13020421 |
| [5] |
周泽宇, 张夕霏, 孟婕, 等. 鸡羽色研究现状及发展[J]. 河北科技师范学院学报, 2022, 36(3): 68-72, 80. ZHOU Z Y, ZHANG X F, MENG J, et al. Research status and development of chicken feather color[J]. Journal of Hebei Normal University of Science & Technology, 2022, 36(3): 68-72, 80. (in Chinese) |
| [6] |
KANAKACHARI M, ASHWINI R, CHATTERJEE R N, et al. Embryonic transcriptome unravels mechanisms and pathways underlying embryonic development with respect to muscle growth, egg production, and plumage formation in native and broiler chickens[J]. Front Genet, 2022, 13: 990849. DOI:10.3389/fgene.2022.990849 |
| [7] |
KAUR S, KUMAR S, KUMAR P. Association between plumage colour and body weight in native chickens[J]. J Anim Res, 2021, 11(3): 527-537. |
| [8] |
LI R T, WANG X L, WANG Y X, et al. Research note: combined analysis of BSA-Seq based mapping and RNA-Seq reveals candidate genes associated with sub-columbian plumage in h line chickens[J]. Poult Sci, 2023, 102(6): 102665. DOI:10.1016/j.psj.2023.102665 |
| [9] |
HUA G Y, CHEN J F, WANG J, et al. Genetic basis of chicken plumage color in artificial population of complex epistasis[J]. Anim Genet, 2021, 52(5): 656-666. DOI:10.1111/age.13094 |
| [10] |
CHO E, KIM M, MANJULA P, et al. A retroviral insertion in the tyrosinase (TYR) gene is associated with the recessive white plumage color in the Yeonsan Ogye chicken[J]. J Anim Sci Technol, 2021, 63(4): 751-758. DOI:10.5187/jast.2021.e71 |
| [11] |
吴日富, 瞿浩, 严霞, 等. 家鸡羽色性状遗传调控机制研究进展[J]. 中国畜牧兽医, 2022, 49(5): 1806-1816. WU R F, QU H, YAN X, et al. Research progress on the genetic regulation mechanism of feather color traits in domestic chickens[J]. China Animal Husbandry & Veterinary Medicine, 2022, 49(5): 1806-1816. (in Chinese) |
| [12] |
FUNK E R, SPELLMAN G M, WINKER K, et al. The genetic basis of plumage coloration and elevation adaptation in a clade of recently diverged alpine and arctic songbirds[J]. Evolution, 2023, 77(3): 705-717. DOI:10.1093/evolut/qpac064 |
| [13] |
SMYTH JR J R, BOISSY R E, FITE K V. The DAM chicken: a model for spontaneous postnatal cutaneous and ocular amelanosis[J]. J Hered, 1981, 72(3): 151-156. DOI:10.1093/oxfordjournals.jhered.a109462 |
| [14] |
DANIELS T. Fayoumi chickens[EB/OL]. Poultry Keeper, (2015-03-25)[03-21]. https://poultrykeeper.com/chicken-breeds/fayoumi-chickens/.
|
| [15] |
DANIELS T. Campine chickens[EB/OL]. Poultry Keeper, (2023-03-25)[03-21]. https://en.wikipedia.org/wiki/Campine_chicken.
|
| [16] |
WESTFÄLISCHE-TOTLEGER. Westfälische totleger[EB/OL]. Jugendseite Westfalen. http://jugendseite-westfalen.de/Rassegefluegel-lexikon/huehner/Westfaelische%20Totleger.html.
|
| [17] |
HATCHERY D. Barred-plymouth-rock[EB/OL]. Caldwell: Dunlap Hatchery Poultry. [2015-03-21]. https://www.dunlaphatcherypoultry.com/product/barred-plymouth-rock/.
|
| [18] |
THALMANN D S, RING H, SUNDSTRÖM E, et al. The evolution of Sex-linked barring alleles in chickens involves both regulatory and coding changes in CDKN2A[J]. PLoS Genet, 2017, 13(4): e1006665. DOI:10.1371/journal.pgen.1006665 |
| [19] |
符蓉. 利用CDKN2A基因上的SNP标记建立鸡芦花基因的分子检测技术[D]. 广州: 华南农业大学, 2019. FU R. Genotyping method for sex-linked barring in chicken with the SNP markers in CDKN2A gene[D]. Guangzhou: South China Agricultural University, 2019. (in Chinese) |
| [20] |
SCHWOCHOW D, BORNELÖV S, JIANG T X, et al. The feather pattern autosomal barring in chicken is strongly associated with segregation at the MC1R locus[J]. Pigment Cell Melanoma Res, 2021, 34(6): 1015-1028. DOI:10.1111/pcmr.12975 |
| [21] |
何艺平, 许继国, 谢袖娟, 等. 鸡羽色性状基因座研究进展[J]. 广东农业科学, 2014, 41(9): 129-134. HE Y P, XU J G, XIE X J, et al. Research progress of feather color loci in Gallus gallus domestica[J]. Guangdong Agricultural Sciences, 2014, 41(9): 129-134. (in Chinese) |
| [22] |
HELLSTRÖM A R, SUNDSTRÖM E, GUNNARSSON U, et al. Sex-linked barring in chickens is controlled by the CDKN2A/B tumour suppressor locus[J]. Pigment Cell Melanoma Res, 2010, 23(4): 521-530. DOI:10.1111/j.1755-148X.2010.00700.x |
| [23] |
D'ALBA L, KIEFFER L, SHAWKEY M D. Relative contributions of pigments and biophotonic nanostructures to natural color production: a case study in budgerigar (Melopsittacus undulatus) feathers[J]. J Exp Biol, 2012, 215(Pt 8): 1272-1277. |
| [24] |
ROULIN A, DUCREST A L. Genetics of colouration in birds[J]. Semin Cell Dev Biol, 2013, 24(6-7): 594-608. DOI:10.1016/j.semcdb.2013.05.005 |
| [25] |
CAREFOOT W C. Effect of the eumelanin restrictor Db on plumage pattern phenotypes of the domestic fowl[J]. Br Poult Sci, 1985, 26(3): 409-412. DOI:10.1080/00071668508416829 |
| [26] |
ANDERSSON L, BED'HOM B, CHUONG C M, et al. The genetic basis for pigmentation phenotypes in poultry[M]//AGGREY S E, ZHOU H J, TIXIER-BOICHARD M, et al. Advances in Poultry Genetics and Genomics. London: Burleigh Dodds Science Publishing, 2020: 67-106.
|
| [27] |
CAREFOOT W C. Inheritance of the barred plumage pattern of the Silver Campine Fowl, together with its relationship to other patterned fowl[J]. Br Poult Sci, 1999, 40(2): 217-220. DOI:10.1080/00071669987629 |
| [28] |
聂昌盛, 曲鲁江. 鸡色素沉积相关性状遗传基础的研究进展[J]. 中国畜牧杂志, 2018, 54(6): 6-12. NIE C S, QU L J. Advances in genetic research of pigment traits in chicken[J]. Chinese Journal of Animal Science, 2018, 54(6): 6-12. (in Chinese) |
| [29] |
PRUM R O, WILLIAMSON S. Reaction-diffusion models of within-feather pigmentation patterning[J]. Proc Biol Sci, 2002, 269(1493): 781-792. DOI:10.1098/rspb.2001.1896 |
| [30] |
INABA M, JIANG T X, LIANG Y C, et al. Instructive role of melanocytes during pigment pattern formation of the avian skin[J]. Proc Natl Acad Sci U S A, 2019, 116(14): 6884-6890. DOI:10.1073/pnas.1816107116 |
| [31] |
INABA M, CHUONG C M. Avian pigment pattern formation: developmental control of macro- (across the body) and micro- (within a feather) level of pigment patterns[J]. Front Cell Dev Biol, 2020, 8: 620. DOI:10.3389/fcell.2020.00620 |
| [32] |
LIN S J, FOLEY J, JIANG T X, et al. Topology of feather melanocyte progenitor niche allows complex pigment patterns to emerge[J]. Science, 2013, 340(6139): 1442-1445. DOI:10.1126/science.1230374 |
| [33] |
FAN Y K, WU X W, LI Y M, et al. Effect of polymorphisms in the 5'-flanking sequence of MC1R on feather color in Taihang chickens[J]. Poult Sci, 2022, 101(12): 102192. DOI:10.1016/j.psj.2022.102192 |
| [34] |
YANG C W, RAN J S, YU C L, et al. Polymorphism in MC1R, TYR and ASIP genes in different colored feather chickens[J]. 3 Biotech, 2019, 9(5): 203. DOI:10.1007/s13205-019-1710-z |
| [35] |
RODRIGUES A R, ALMEIDA H, GOUVEIA A M. Intracellular signaling mechanisms of the melanocortin receptors: current state of the art[J]. Cell Mol Life Sci, 2015, 72(7): 1331-1345. DOI:10.1007/s00018-014-1800-3 |
| [36] |
SPILLMAN W J. Spurious allelomorphism: results of some recent investigations[J]. Amer Nat, 1908, 42(501): 610-615. DOI:10.1086/278980 |
| [37] |
JAMES B J. Linear relationship of the loci for barring, dermal melanin inhibitor, and recessive white skin on the chicken Z chromosome[J]. Poult Sci, 1988, 67(4): 530-533. DOI:10.3382/ps.0670530 |
| [38] |
DORSHORST B J, ASHWELL C M. Genetic mapping of the sex-linked barring gene in the chicken[J]. Poult Sci, 2009, 88(9): 1811-1817. DOI:10.3382/ps.2009-00134 |
| [39] |
席洋. 基于基因组和转录组测序揭示鸭黑色和褐色羽形成的分子机制[D]. 雅安: 四川农业大学, 2020. XI Y. Genome and transcriptome sequencing reveal the molecular mechanism of black and brown plumage phenotypes in ducks[D]. Yaan: Sichuan Agricultural University, 2020. (in Chinese) |
| [40] |
LI R T, WANG Y X, LIU Y H, et al. Effects of SLC45A2 and GPNMB on melanin deposition based on transcriptome sequencing in chicken feather follicles[J]. Animals, 2023, 13(16): 2608. DOI:10.3390/ani13162608 |
| [41] |
FU Q H, WANG P, ZHANG Y R, et al. Effects of dietary inclusion of asiaticoside on growth performance, lipid metabolism, and gut microbiota in yellow-feathered chickens[J]. Animals, 2023, 13(16): 2653. DOI:10.3390/ani13162653 |
| [42] |
ANDERSSON L. Mutations in domestic animals disrupting or creating pigmentation patterns[J]. Front Ecol Evol, 2020, 8: 116. DOI:10.3389/fevo.2020.00116 |
| [43] |
DU W Y, YANG Z L, XIAO C, et al. Identification of genes involved in regulating the development of feathered feet in chicken embryo[J]. Poult Sci, 2023, 102(9): 102837. DOI:10.1016/j.psj.2023.102837 |
| [44] |
QI Y, ZHANG X, PANG Y, et al. Identification of polymorphism in the MC1R gene and its association with the melanin content in feathers of Chinese yellow quails[J]. Braz J Poult Sci, 2023, 25(2): 1-6. |
| [45] |
JI G G, ZHANG M, TU Y J, et al. Molecular regulatory mechanisms in chicken feather follicle morphogenesis[J]. Genes, 2023, 14(8): 1646. DOI:10.3390/genes14081646 |
| [46] |
SQUARE T A. Neural crest cell development and evolution[D]. Boulder: University of Colorado, 2017.
|
| [47] |
WEHRLE-HALLER B, MELLER M, WESTON J A. Analysis of melanocyte precursors in Nf1 mutants reveals that MGF/KIT signaling promotes directed cell migration independent of its function in cell survival[J]. Dev Biol, 2001, 232(2): 471-483. DOI:10.1006/dbio.2001.0167 |
| [48] |
LIN J Y, FISHER D E. Melanocyte biology and skin pigmentation[J]. Nature, 2007, 445(7130): 843-850. DOI:10.1038/nature05660 |
| [49] |
FAAS L, ROVASIO R A. Distribution patterns of neural-crest-derived melanocyte precursor cells in the quail embryo[J]. Anat Rec, 1998, 251(2): 200-206. DOI:10.1002/(SICI)1097-0185(199806)251:2<200::AID-AR7>3.0.CO;2-1 |
| [50] |
GUNNARSSON U, KERJE S, BED'HOM B, et al. The Dark brown plumage color in chickens is caused by an 8.3-kb deletion upstream of SOX10[J]. Pigment Cell Melanoma Res, 2011, 24(2): 268-274. DOI:10.1111/j.1755-148X.2011.00825.x |
| [51] |
KIM S H, MITCHELL M, FUJII H, et al. Absence of p16INK4a and truncation of ARF tumor suppressors in chickens[J]. Proc Natl Acad Sci U S A, 2003, 100(1): 211-216. DOI:10.1073/pnas.0135557100 |
| [52] |
HAUPT Y, MAYA R, KAZAZ A, et al. Mdm2 promotes the rapid degradation of p53[J]. Nature, 1997, 387(6630): 296-299. DOI:10.1038/387296a0 |
| [53] |
SHARPLESS N E. INK4a/ARF: A multifunctional tumor suppressor locus[J]. Mutat Res, 2005, 576(1-2): 22-38. DOI:10.1016/j.mrfmmm.2004.08.021 |
| [54] |
周成浩, 殷建玫, 李国辉, 等. 基于简化基因组测序技术的汶上芦花鸡选择信号分析[J]. 农业生物技术学报, 2022, 30(12): 2385-2395. ZHOU C H, YIN J M, LI G H, et al. Selection signal analysis of Wenshang barred chicken (Gallus gallus) based on RAD-seq technology[J]. J Agric Biotechnol, 2022, 30(12): 2385-2395. (in Chinese) |
| [55] |
KOBAYASHI T, URABE K, WINDER A, et al. Tyrosinase related protein 1 (Trp1) functions as a DHICA oxidase in melanin biosynthesis[J]. EMBO J, 1994, 13(24): 5818-5825. DOI:10.1002/j.1460-2075.1994.tb06925.x |
| [56] |
NAM I S, OH M G, NAM M S, et al. Specific mutations in the genes of MC1R and TYR have an important influence on the determination of pheomelanin pigmentation in Korean native chickens[J]. J Adv Vet Anim Res, 2021, 8(2): 266-273. DOI:10.5455/javar.2021.h511 |
| [57] |
LE L, ESCOBAR I E, HO T, et al. SLC45A2 protein stability and regulation of melanosome pH determine melanocyte pigmentation[J]. Mol Biol Cell, 2020, 31(24): 2687-2702. DOI:10.1091/mbc.E20-03-0200 |
| [58] |
张静. 鹅羽色相关候选基因ASTP和TYRP1基因克隆、表达及SNP检测[D]. 重庆: 西南大学, 2015. ZHANG J. Molecular Clonging, expression and SNP detection on ASIP andTYRP1 in the candidate genes of goose plumage color[D]. Chongqing: Southwest University, 2015. (in Chinese) |
| [59] |
宋素芳, 宋幸辉, 蔺成刚, 等. SLC45A2基因在"豫粉1号"浅芦花羽色中的表达及酪氨酸对其在黑色素细胞中表达量的影响[J]. 中国畜牧杂志, 2019, 55(9): 64-67. SONG S F, SONG X H, LIN C G, et al. Expression of SLC45A2 in columbian plume color of "Yufen Ⅰ" chicken and effect of tyrosine on its expression in melanocytes[J]. Chinese Journal of Animal Science, 2019, 55(9): 64-67. (in Chinese) |
| [60] |
刘小辉. 坝上长尾鸡资源保护及羽色多样性分子遗传基础[D]. 保定: 河北农业大学, 2018. LIU X H. Resources protection and molecular genetic basis of plumage color diversity of Bashang long-tail chickens[D]. Baoding: Hebei Agricultural University, 2018. (in Chinese) |
| [61] |
许继国, 张细权. 鸡芦花羽色性状的遗传和应用[J]. 养禽与禽病防治, 2011(8): 4-5. XU J G, ZHANG X Q. Heredity and application of feather color traits in Luhua chicken[J]. Poultry Husbandry and Disease Control, 2011(8): 4-5. (in Chinese) |
| [62] |
WANG H E, WEN J H, LI H Y, et al. Candidate pigmentation genes related to feather color variation in an indigenous chicken breed revealed by whole genome data[J]. Front Genet, 2022, 13: 985228. DOI:10.3389/fgene.2022.985228 |
| [63] |
杨晓燕. 乌骨鸡肤色遗传研究[D]. 北京: 中国农业大学, 2004. YANG X Y. Genetic research on skin color of black-bone chicken[D]. Beijing: China Agricultural University, 2004. (in Chinese) |
| [64] |
ALESSIO B M, GUPTA A. Diffusiophoresis-enhanced Turing patterns[J]. Sci Adv, 2023, 9(45): eadj2457. DOI:10.1126/sciadv.adj2457 |
(编辑 郭云雁)



