麻旺鸭,因原产于重庆市土家族苗族自治县麻旺镇而得名,属于蛋鸭优良品种[1],2000年被当地畜牧兽医局发现。2009年10月15日,农业部第1278号公告将麻旺鸭确认为国家级畜禽遗传源。目前, 划定3个麻旺鸭保护区,区内有麻旺鸭核心保种场1个、扩繁场10个、孵抱户200余个。但是,由于酉阳县地处武陵山区,距离主城区较远,麻旺鸭养殖人员的素质整体不高,对麻旺鸭的疫病防控能力欠缺。
作者在麻旺鸭核心保种场调查发现,现阶段麻旺鸭群发生细菌性疾病的比例较低,但随着交通运输逐渐繁忙和人类活动逐渐频繁,麻旺鸭发生细菌性传染病的风险在增大。除了鸭传染性浆膜炎疫苗,还没有鸭的其他常发细菌性疾病疫苗。因此,摸清麻旺鸭群细菌对常见抗菌药物的敏感性,可以为麻旺鸭细菌性疾病发生后的治疗提供数据支撑和技术储备。大肠杆菌是鸭肠道的常见细菌。测定大肠杆菌对常用抗菌药物的敏感性不仅可以为大肠杆菌病的发生提供用药指导,还可以间接为其他病原菌引起的传染病提供用药参考。根据对重庆市食品动物源肠杆菌科细菌耐药基因研究显示,在重庆市食品动物分离的沙门菌广泛携带β-内酰胺酶基因和质粒介导的喹诺酮耐药(plasmid-mediated quinolone resistance,PMQR)基因[2]。基于此,作者想了解麻旺鸭源大肠杆菌是否也广泛携带这两类耐药基因。作者在麻旺鸭的核心保种场和3个扩繁场采集了麻旺鸭的肛拭子,从中分离出大肠杆菌,然后测定了分离菌株对25种抗菌药物的敏感性,同时检测了分离菌株中β-内酰胺酶基因和PMQR基因携带情况,以期为麻旺鸭细菌性疾病发生后的治疗提供用药参考。
1 材料与方法 1.1 主要试剂、培养基及参考菌株BPW培养基、MH肉汤培养基购自青岛高科技工业园海博生物技术有限公司,麦康凯琼脂培养基购自北京奥博星生物技术有限责任公司,药敏纸片购自杭州微生物试剂有限公司,PowerPol 2×PCR Mix购自武汉爱博泰克(ABclonal)生物科技有限公司,DL2000 DNA marker购自宝生物工程(大连)有限公司。大肠杆菌ATCC®* 25922由西南大学动物医学院动物支原体学实验室保存。
1.2 样品采集与处理2023年2月,在酉阳县麻旺鸭核心保种场和3个扩繁场采集泄殖腔拭子样品,其中,在核心保种场采样100份,在扩繁场1、扩繁场2、扩繁场3分别采样15、16、15份。采样时,用无菌棉签轻轻刮取鸭泄殖腔,将棉签折断置于装有1 mL BPW液体培养基的2 mL离心管。所有样品放置于带冰袋的泡沫箱,12 h内运回实验室。装有样品的离心管涡旋振荡15 s,使样品在BPW培养基充分分散,取0.1 mL粪便样品加入10 mL LB液体培养基,37 ℃ 220 r ·min-1培养6~12 h。培养的菌液划线接种麦康凯平板,37 ℃培养18~24 h。挑取有大肠杆菌典型菌落特征的单菌落进行革兰染色,油镜下观察细菌形态。
1.3 大肠杆菌临床菌株的PCR检测将革兰染色疑似为大肠杆菌的菌落接种10 mL LB液体培养基,37 ℃ 220 r ·min-1摇床培养6~8 h。取1.5 mL菌液置于2 mL灭菌离心管,12 000 r ·min-1室温离心2 min,弃上清;加入1 mL灭菌ddH2O,重悬菌液后12 000 r ·min-1室温离心2 min,弃上清。加入50 μL灭菌ddH2O,重悬菌液。105 ℃处理10 min,12 000 r ·min-1室温离心2 min,吸取上清液作为PCR反应的DNA模板。
根据大肠杆菌phoA基因(GenBank No. NZ_JAACYX010 000 057.1)设计特异性引物phoA-F:5′-CGATTCTGGAAATGGCAAAAG-3′和phoA-R:5′-CGTGATCAGCGGTGACTATGAC-3′。引物由重庆擎科兴业生物技术有限公司合成。PCR反应体系:PowerPol 2×PCR Mix 12.5 μL,phoA-F(10 μmol ·L-1)1 μL,phoA-R(10 μmol ·L-1)1 μL,模板DNA 1 μL,ddH2O 9.5 μL,总反应体系25 μL。PCR反应条件:98 ℃预变性5 min;98 ℃变性20 s,58 ℃退火20 s,72 ℃延伸30 s,共30个循环;最后72 ℃延伸5 min。
1.4 药物敏感性试验根据美国临床和实验室标准协会(CLSI)抗菌药物敏感性试验标准,采用纸片扩散法对大肠杆菌分离株进行药物敏感性试验。共使用25种抗菌药物。以大肠杆菌ATCC®* 25922作为质控菌株。结果根据CLSI M100-S32[3]和VET08Ed4E[4]判定。
1.5 β-内酰胺酶基因和PMQR基因检测PCR检测分离菌株中β-内酰胺酶基因和PMQR基因携带情况。检测的β-内酰胺酶基因包括blaTEM[2]、blaCTX-M[2]、blaSHV[5]、blaOXA(blaOXA-1、blaOXA-2、blaOXA-10)[2]、blaCMY(CMY-1-F/CMY-1-R检测blaCMY2、blaCMY12-blaCMY18、blaCMY-25、blaCMY-30-blaCMY31、blaCMY-97、blaCMY-109、blaCMY-116、blaCMY162,CMY-2-F/CMY-2-R检测blaCMY-100和blaCMY-104,CMY-1-F/CMY-1-R检测blaCMY-19)[2]、blaPSE[6]、blaPER[6]、blaVEB[7]、blaGES(blaGES-1-blaGES-9,blaGES-11)[7],检测的PMQR基因包括qnrA[8]、qnrB[2]、qnrC[9]、qnrD[2]、qnrVC(共两对引物)[2]、qnrS[2]、aac(6′)-Ib-cr[2]、oqxA[10]、oqxB[10]、qepA[2]。引物由重庆擎科兴业生物技术有限公司合成。相应的反应参数根据文献报道设定(表 1)。扩增出的基因送生工生物工程(上海)股份有限公司重庆分公司测序并在NCBI进行序列比对。
|
|
表 1 PCR扩增β-内酰胺酶和PMQR基因的相关参数 Table 1 The parameters for PCR amplification of β-lactamase and PMQR genes |
采用GraphPad Prism 8.0统计分析软件进行分析,使用卡方检验(Chi-square test)比较各养殖场多重耐药菌株比例之间的显著性差异。
2 结果 2.1 菌株分离鉴定通过选择性培养基增菌培养、革兰染色和分子生物学鉴定,在采集的146份样品中分离到146株大肠杆菌。分离的大肠杆菌在麦康凯平板上形成圆形凸起、表面光滑湿润的桃红色菌落(图 1A);经革兰染色后镜检可见红色、杆状的革兰阴性菌(图 1B);所有菌株均能扩增出大肠杆菌特异性的phoA基因(图 1C)。
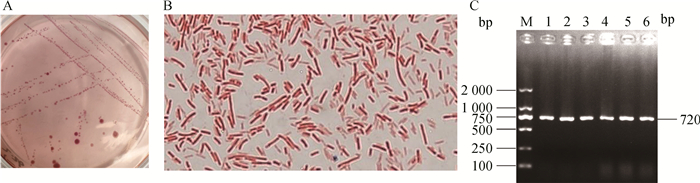
|
A. 大肠杆菌在麦康凯平板的菌落形态;B. 大肠杆菌革兰染色后的细菌形态(1 000×);C. PCR扩增大肠杆菌特异的phoA基因(M. DL2000 DNA相对分子质量标准;1~6. 样品) A. Colony morphology of E. coli on MacConkey plate; C. Bacterial morphology of E. coli after Gram staining (1 000×); C. Amplification of the phoA gene from E. coli by PCR (M. DL2000 DNA marker; 1-6. Samples) 图 1 大肠杆菌的分离鉴定 Fig. 1 Isolation and identification of E. coli |
146株大肠杆菌临床分离株对25种抗菌药物的耐药情况见表 2。分离菌株对不同药物的耐药率有较大差异。对氨苄西林(66.4%)、头孢唑啉(50%)的耐药率超过50%;对头孢噻吩、亚胺培南、链霉素、四环素、多西环素、甲氧苄啶的耐药率在30%~50%,分别为38.4%、43.2%、35.6%、44.5%、32.2%、41.8%;对庆大霉素、阿米卡星、氧氟沙星完全敏感;对头孢西丁、头孢他啶、头孢吡肟、氨曲南、妥布霉素、环丙沙星、诺氟沙星、依诺沙星和恩诺沙星的耐药率不超过5%。
|
|
表 2 麻旺鸭源大肠杆菌临床分离株的耐药情况 Table 2 Antimicrobial resistance profiles of E. coli isolates recovered from Mawang ducks |
从不同的药物种类来看,分离菌株对部分β-内酰胺类(氨苄西林、头孢噻吩、头孢唑啉、亚胺培南)、氨基糖苷类(链霉素)、四环素类(四环素、多西环素)和磺胺类(甲氧苄啶、复方新诺明)药物耐药率较高,而对部分β-内酰胺类(头孢西丁、头孢他啶、头孢吡肟、氨曲南)和氨基糖苷类(庆大霉素、阿米卡星、妥布霉素)、氟喹诺酮类药物较为敏感。各养殖场分离菌株对不同抗菌药物的耐药趋势和总体的耐药趋势相同,但扩繁场2的分离菌株对各个药物的耐药率整体高于其余3个养殖场。
2.3 大肠杆菌多重耐药情况146株临床分离菌株中有76株为多重耐药菌,占总菌株数的52.1%(图 2)。从不同养殖场来看,3个扩繁场的多重耐药菌比例均高于核心保种场,特别是从扩繁场2分离的菌株的多重耐药菌数占81.3%,但各养殖场的多重耐药菌比例没有显著差异(P>0.05)。
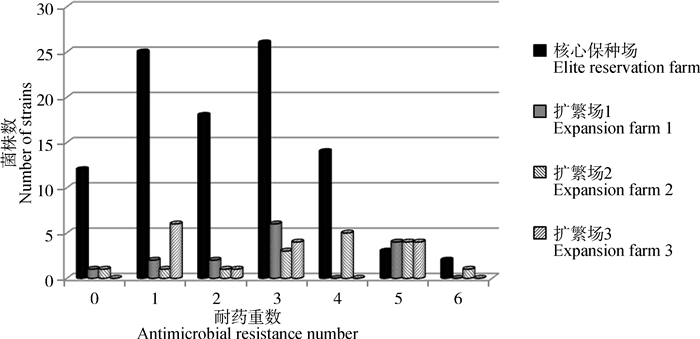
|
图 2 不同养殖场大肠杆菌的多重耐药情况 Fig. 2 Multi-drug resistance of Escherichia coli at different farms |
经PCR扩增和PCR产物测序,最终在111株(76.0%)大肠杆菌中检测到β-内酰胺酶基因,blaTEM、blaOXA和blaCTX-M基因检出率分别为74.0%(108株)、3.4%(5株)和1.4%(2株),未检测到blaSHV、blaCMY、blaPSE、blaPER、blaVEB、blaGES。PMQR基因阳性菌株有83株(56.8%),qnrS和aac(6′)-Ib-cr基因检出率分别为54.8%(80株)和4.1%(6株),未检测到其他PMQR基因(图 3)。
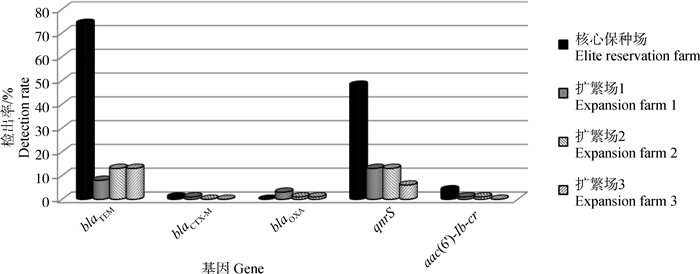
|
图 3 大肠杆菌临床分离株中β-内酰胺酶基因和PMQR基因检测结果 Fig. 3 Distribution of β-lactamase genes and PMQR genes in E. coli isolates |
分离菌株携带β-内酰胺酶基因和PMQR基因情况见表 3。146株大肠杆菌临床分离株中,15株不携带β-内酰胺酶基因和PMQR基因,分别有13、14、1、19、1、19、1株菌仅携带blaTEM-1、blaTEM-116、blaTEM-116、blaTEM-135、blaTEM-171、blaTEM-215、qnrS1、qnrS2基因;其余63株菌携带2~3个β-内酰胺酶基因和PMQR基因,有18种组合形式,最为流行是blaTEM-171+ qnrS1(24.0%,35株),其次是blaTEM-135+ qnrS1(3.4%,5株)和blaTEM-1+qnrS1(2.7%,4株),其余组合形式不超过3株菌。
|
|
表 3 大肠杆菌中β-内酰胺酶基因和PMQR基因分布 Table 3 Distribution of β-lactamase genes and PMQR genes in E. coli |
酉阳县地处武陵山区,是麻旺鸭的主要养殖区域。搞好疫病防控,特别是核心育种场的疫病防控是保种工作的重要内容。大肠杆菌是鸭的一种重要病原菌。目前,麻旺鸭的养殖仍以放养和开放式饲养为主,感染致病性大肠杆菌的风险较大。提前做好麻旺鸭体内大肠杆菌的耐药性监测,可以为麻旺鸭大肠杆菌病发生后的治疗提供资料储备。
饲养麻旺鸭的麻旺镇较为偏僻,人员流动相对较少,麻旺鸭发病也较少,所以养殖场很少用药。但本研究中在麻旺鸭分离的146株大肠杆菌对部分β-内酰胺类(氨苄西林、头孢噻吩、头孢唑啉、亚胺培南)和氨基糖苷类(链霉素)、四环素类、磺胺类药物的耐药率较高,这一研究结果和本实验室在重庆食品动物中分离的沙门菌耐药趋势相同[2]。2018年,陈春林等[11]从重庆市荣昌区、大足区、武隆县、黔江区、石柱县和酉阳县分离的鸡源大肠杆菌对卡那霉素、庆大霉素和头孢噻肟的耐药率均高于本研究。2020年,吕红林[12]对从重庆永川区、潼南区、铜梁区、江津区、北碚区等区县分离的大肠杆菌进行药物敏感性分析,发现猪、鸡源大肠杆菌对四环素的耐药率在90%以上,这个结果也远远高于本研究的结果。与从重庆[13]和四川[14]两个鸭场分离的大肠杆菌对氟喹诺酮类药物的耐药性相比,本研究分离的菌株对氟喹诺酮类药物的耐药率较低。随着乡村振兴持续推进,乡村旅游逐渐升温,酉阳县人员往来逐渐增多,必然会增加麻旺鸭患病的风险。了解麻旺鸭源细菌的耐药表型,对于麻旺鸭疫病防控具有积极意义。氨曲南和亚胺培南是人专用抗生素,本研究发现分离的大肠杆菌对这两种药物存在耐药,特别是对亚胺培南的耐药率达到43.2%。这可能是由于耐药菌株中存在这些药物的耐药基因。而这些耐药基因由细菌对其他β-内酰胺类药物(和氨曲南/亚胺培南有共同的耐药基因)的耐药获得[15-16],或者通过存在多种耐药基因的耐药质粒共转移获得[17]。
从麻旺鸭来源的大肠杆菌携带的β-内酰胺酶基因和本实验室分离的食品动物来源沙门菌中β-内酰胺酶基因的流行趋势相同[2],即blaTEM基因最为流行,而我国其他地区报道的肠杆菌科细菌中流行的β-内酰胺基因以blaCTX-M为主[18-19]。分离菌株对测定的5种喹诺酮类药物耐药率较低(不超过5%),但菌株中广泛携带PMQR基因(56.8%,83/146)。这可能和PMQR基因与其他耐药基因在同一耐药质粒的共转移有关[18, 20]。
上述结果提示,抗菌药物在食品动物的广泛使用造成耐药基因在不同区域内或者区域间广泛传播。为有效遏制动物源细菌耐药不断上升的趋势和兽药残留超标,更加全面提升畜禽绿色健康养殖的水平,农业农村部于2019年发布第194号公告,要求停止生产、经营、进口和使用部分药物饲料添加剂,对一些饲料添加剂的相关管理政策作出调整,并在2019年12月19日的第246号公告发布了药物饲料添加剂品种目录及使用规范,宣布废止仅有促生长用途的药物饲料添加剂等品种质量标准15个,注销相关兽药产品批准文号558个、进口兽药注册证书3个。此外,为确保“十四五”时期全国产出每吨动物产品兽用抗菌药的使用量持续下降的趋势,农业农村部于2021年10月21日发布《全国兽用抗菌药使用减量化行动方案(2021—2025年)》,要求到2025年末50%以上的规模养殖场实施养殖减抗行动。罗干等[21]对2014—2021年在重庆分离的大肠杆菌进行药物敏感性分析,发现2020—2021年分离的大肠杆菌的耐药率总体呈现下降趋势。减抗是一场持久战,希望通过在全国范围内开展兽用抗菌药使用减量化行动能切实减少耐药菌株的出现,保证畜牧业高质量发展,保障动物源性食品安全和公共卫生安全。
4 结论通过对重庆市酉阳县麻旺鸭泄殖腔中大肠杆菌的分离鉴定和药物敏感性检测,分析了麻旺鸭源大肠杆菌的耐药表型,对麻旺鸭临床用药具有一定参考意义。通过对大肠杆菌中β-内酰胺酶基因和PMQR基因的检测,发现blaTEM和qnrS基因在麻旺鸭源大肠杆菌中广泛流行。
| [1] |
张昌莲, 王阳铭, 邢豫川, 等. 麻旺鸭种质特性调查报告[J]. 上海畜牧兽医通讯, 2005(6): 26-27. ZHANG C L, WANG Y M, XING Y C, et al. Investigation report on germplasm characteristics of Mawang ducks[J]. Shanghai Journal of Animal Husbandry and Veterinary Medicine, 2005(6): 26-27. (in Chinese) |
| [2] |
LAI J C, MU H, ZHOU B Q, et al. BlaTEM-positive Salmonella enterica serovars Agona and Derby are prevalent among food-producing animals in Chongqing, China[J]. Front Microbiol, 2023, 14: 1011719. DOI:10.3389/fmicb.2023.1011719 |
| [3] |
Clinical and Laboratory Standards Institute. Performance standards for antimicrobial susceptibility testing: Thirty-second informational supplement M100-S32[M]. Wayne, PA: CLSI, 2022.
|
| [4] |
Clinical and Laboratory Standards Institute. Performance standards for antimicrobial disk and dilution susceptibility tests for bacteria isolated from animals, approved standard-fourth edition (VET08-A4)[M]. Wayne, PA: CLSI, 2019.
|
| [5] |
CHEN S, ZHAO S H, WHITE D G, et al. Characterization of multiple-antimicrobial-resistant Salmonella serovars isolated from retail meats[J]. Appl Environ Microbiol, 2004, 70(1): 1-7. DOI:10.1128/AEM.70.1.1-7.2004 |
| [6] |
QIAO J, ZHANG Q, ALALI W Q, et al. Characterization of extended-spectrum β-lactamases (ESBLs)-producing Salmonella in retail raw chicken carcasses[J]. Int J Food Microbiol, 2017, 248: 72-81. DOI:10.1016/j.ijfoodmicro.2017.02.016 |
| [7] |
DALLENNE C, DA COSTA A, DECRÉ D, et al. Development of a set of multiplex PCR assays for the detection of genes encoding important β-lactamases in Enterobacteriaceae[J]. J Antimicrob Chemother, 2010, 65(3): 490-495. DOI:10.1093/jac/dkp498 |
| [8] |
ROBICSEK A, STRAHILEVITZ J, SAHM D F, et al. qnr prevalence in ceftazidime-resistant Enterobacteriaceae isolates from the United States[J]. Antimicrob Agents Chemother, 2006, 50(8): 2872-2874. DOI:10.1128/AAC.01647-05 |
| [9] |
CATTOIR V, POIREL L, ROTIMI V, et al. Multiplex PCR for detection of plasmid-mediated quinolone resistance qnr genes in ESBL-producing enterobacterial isolates[J]. J Antimicrob Chemother, 2007, 60(2): 394-397. DOI:10.1093/jac/dkm204 |
| [10] |
KIM H B, WANG M H, PARK C H, et al. oqxAB encoding a multidrug efflux pump in human clinical isolates of Enterobacteriaceae[J]. Antimicrob Agents Chemother, 2009, 53(8): 3582-3584. DOI:10.1128/AAC.01574-08 |
| [11] |
陈春林, 冯刚, 秦杨, 等. 重庆地区鸡源大肠杆菌、沙门氏杆菌耐药性的测定与分析[J]. 黑龙江畜牧兽医, 2019(12): 85-88. CHEN C L, FENG G, QIN Y, et al. Determination and analysis of antimicrobial resistance of Escherichia coli and Salmonella isolated from chickens in Chongqing area[J]. Heilongjiang Animal Science and Veterinary Medicine, 2019(12): 85-88. (in Chinese) |
| [12] |
吕红林. 重庆部分养殖场猪鸡致病性大肠杆菌分离鉴定与耐药性分析[D]. 重庆: 西南大学, 2020. LV H L. Isolation, identification and drug resistance analysis of pathogenic Escherichia coli from some pig and chicken farms in Chongqing[D]. Chongqing: Southwest University, 2020. (in Chinese) |
| [13] |
徐俊杰, 文娟, 朱子凤, 等. 四川遂宁某鸭场大肠杆菌和沙门氏菌的分离鉴定及耐药性检测[J]. 黑龙江畜牧兽医, 2017(22): 112-114, 119. XU J J, WEN J, ZHU Z F, et al. Isolation, identification and antimicrobial resistance detection of Escherichia coli and Salmonella from a duck farm in Suining, Sichuan[J]. Heilongjiang Animal Science and Veterinary Medicine, 2017(22): 112-114, 119. (in Chinese) |
| [14] |
赵婵娟, 欧婧, 林发根. 重庆市万州区鸭场致病性大肠杆菌的分离鉴定与药敏试验[J]. 黑龙江畜牧兽医, 2016(22): 136-137, 300. ZHAO C J, OU J, LIN F G. Isolation, identification and antimicrobial sensitivity test of pathogenic Escherichia coli from duck farms in Wanzhou district, Chongqing[J]. Heilongjiang Aninal Science and Veterinary Medicine, 2016(22): 136-137, 300. (in Chinese) |
| [15] |
KHAN M R, AZAM S, AHMAD S, et al. Molecular characterization and epidemiology of antibiotic resistance genes of β-lactamase producing bacterial pathogens causing septicemia from tertiary care hospitals[J]. Antibiotics (Basel), 2023, 12(3): 617. DOI:10.3390/antibiotics12030617 |
| [16] |
JIANG T, LI G L, HUANG L Y, et al. Genomic and phylogenetic analysis of a multidrug-resistant blaNDM-carrying Klebsiella michiganensis in China[J]. Infect Drug Resist, 2023, 16: 3109-3116. DOI:10.2147/IDR.S409544 |
| [17] |
HE X H, XU L W, DAI H D, et al. Genomic characteristics of a multidrug-resistant ST648 Escherichia coli isolate co-carrying blaKPC-2 and blaCTX-M-15 genes recovered from a respiratory infection in China[J]. Infect Drug Resist, 2023, 16: 3535-3540. DOI:10.2147/IDR.S415846 |
| [18] |
ZHANG W H, LIN X Y, XU L, et al. CTX-M-27 producing Salmonella enterica serotypes Typhimurium and Indiana are prevalent among food-producing animals in China[J]. Front Microbiol, 2016, 7: 436. |
| [19] |
ZHANG C Z, DING X M, LIN X L, et al. The emergence of chromosomally located blaCTX-M-55 in Salmonella from foodborne animals in China[J]. Front Microbiol, 2019, 10: 1268. DOI:10.3389/fmicb.2019.01268 |
| [20] |
LI L, LIAO X P, LIU Z Z, et al. Co-spread of oqxAB and blaCTX-M-9G in non-Typhi Salmonella enterica isolates mediated by ST2-IncHI2 plasmids[J]. Int J Antimicrob Agents, 2014, 44(3): 263-268. DOI:10.1016/j.ijantimicag.2014.05.014 |
| [21] |
罗干, 邹宏, 任绍科, 等. 鸭源致病性大肠杆菌O抗原与毒力基因检测及药敏试验[J]. 中国畜牧兽医, 2023, 50(2): 713-721. LUO G, ZOU H, REN S K, et al. Detection of O-antigen, virulence gene and drug sensitivity test of pathogenic Escherichia coli from duck[J]. China Animal Husbandry & Veterinary Medicine, 2023, 50(2): 713-721. (in Chinese) |
(编辑 白永平)



