2. 重庆市畜牧科学院, 重庆 402460;
3. 西南大学医学研究院免疫学研究中心, 重庆 402460
2. Chongqing Academy of Animal Husbandry, Chongqing 402460, China;
3. Immunology Research Center, Institute of Medical Research, Southwest University, Chongqing 402460, China
猪流行性腹泻病毒(porcine epidemic diarrhea virus,PEDV)是引起猪流行性腹泻(porcine epidemic diarrhea, PED)的病原,它所引起的传染病临床上以新生仔猪水样腹泻、脱水、呕吐等为特征,病理变化主要集中在仔猪小肠,如小肠发胀透明,小肠绒毛萎缩坏死等。PED具有传染速度快、传染方式多、发病速度快等特点,发病仔猪死亡率接近100%[1]。PEDV属于冠状病毒科α冠状病毒属,是有囊膜的单股正链RNA病毒。病毒颗粒呈多形性,偏向于圆形,直径95~190 nm[2]。病毒基因组全长约28 kb,具有7个开放阅读框(open reading frame, ORF),分别编码4个结构蛋白,即纤突蛋白(S)、膜蛋白(M)、核衣壳蛋白(N)、包膜蛋白(E)和两个非结构蛋白[3]。目前,PEDV在全球范围呈现流行趋势,给养猪业造成了严重经济损失。
血管紧张素转换酶2(angiotensin converting enzyme 2,ACE2)是肾素-血管紧张素-醛固酮系统(RAAS)的调节因子,负责维持血压稳态和水盐平衡,ACE2不仅影响心血管系统,亦在其他器官组织中发挥作用,例如肝、肠道和骨骼肌功能等[4-6]。目前有研究表明,ACE2是新型冠状病毒(SARS-CoV-2)的特定功能受体[7],Wan等[8]发现SARS-CoV-2和严重急性呼吸综合征病毒(SARS-CoV)都通过与ACE2结合进入宿主细胞并感染。且ACE2表达水平与病毒复制水平相关。上调ACE2表达会增强SARS-CoV-2感染,降低ACE2表达会减轻SARS-CoV-2感染[9-10]。PEDV与SARS-CoV-2同为冠状病毒科病毒,ACE2有可能与PEDV进入宿主细胞这一过程有关。小肠作为PEDV攻击的靶器官,ACE2在仔猪胃肠道中的mRNA水平有较高表达,提示ACE2可能参与了断奶仔猪胃肠系统的生长发育[11]。另一项研究发现,ACE2主要分布在小肠皱襞和绒毛处,且在空肠上皮细胞的刷状缘、浆膜层和肌层均有显著表达,在肠绒毛中多定位于上皮细胞顶端[12]。而PEDV的复制水平上下变化是否与猪肠道ACE2表达水平有关,目前尚未完全定论。
在实验室前期研究中,对感染PEDV的仔猪小肠组织进行转录组分析。结果表明,感染PEDV后ACE2表达水平下调。本研究用PEDV感染IPEC-J2细胞,分别检测ACE2在mRNA及蛋白水平上表达情况,再通过过表达与抑制ACE2检测PEDV的感染变化水平,从而探究ACE2与PEDV感染之间的联系,为后续研究PEDV感染机制,防制猪流行性腹泻病奠定基础。
1 材料与方法 1.1 试验材料1.1.1 细胞及毒株 非洲绿猴肾细胞(Vero细胞)购自武汉大学中国典型培养物保藏中心;IPEC-J2细胞购自上海素尔生物技术有限公司;PEDV-LJX株、PEDV-N抗体由中国农业科学院兰州兽医研究所惠赠。
1.1.2 主要试剂 DMEM培养基、RPMI 1640培养基、青链霉素均购自美国Gibco公司;澳洲胎牛血清购自上海素尔科技有限公司;转染试剂购自北京全式金生物技术有限公司;RIPA(强)细胞裂解液、蛋白酶抑制剂(PMSF)、BCA蛋白浓度检测试剂盒均购自上海碧云天生物技术有限公司;兔抗ACE2多克隆抗体、鼠抗β-actin单克隆抗体、HRP-山羊抗鼠IgG(H+L)、HRP-山羊抗兔IgG(H+L)均购自美国Proteintech公司;RNAiso Plus、PrimeScriptTM RT Master Mix、SYBR®Premix Ex TaqTM Ⅱ购自TaKaRa公司。
1.2 方法1.2.1 转录组学测序 将6头3日龄无TGEV和PEDV感染的荣昌猪分为两组,即对照组和PEDV感染组,每组各3头。PEDV组仔猪灌喂PEDV病毒液10 mL(1×107 TCID50 ·mL-1),连续灌喂两次,每次间隔4 h,同时对照组仔猪灌喂10 mL 0.9% NaCl。待PEDV感染组仔猪出现明显症状后,对各组仔猪进行剖杀,分别取健康仔猪和发病腹泻仔猪的空肠,并用PBS溶液将肠道内容物清洗干净,液氮速冻后送往杭州联川生物技术股份有限公司进行转录组学测序,所得数据上传至联川生物云平台(https://www.omicstudio.cn/)进行分析。仔猪整个试验过程的处理按照西南大学动物伦理委员会制定的指南进行(CQLA-2020-0117)。
1.2.2 PEDV感染IPEC-J2细胞 将IPEC-J2细胞以每孔1.2×106细胞密度接种于6孔板中,直至细胞融合度达到约90%,弃掉培养液,用PBS洗涤细胞2次,每孔加入PEDV病毒液(MOI=0.1),每组设3个重复,培养2 h后,弃去病毒液,PBS洗涤2次后,每孔加入2 mL新鲜的1640基础培养基。
1.2.3 RT-qPCR法测定ACE2、PEDV N基因表达水平 按照RNAiso Plus说明书对细胞总RNA进行提取,测定RNA浓度后将提取的RNA根据TaKaRa公司PrimeScriptTM RT Master Mix说明书反转录扩增合成cDNA,并按照100 ng ·μL-1进行稀释。以稀释后的cDNA为模板,按照TaKaRa公司SYBR®Premix Ex TaqTM Ⅱ说明书利用特异性引物(表 1)进行检测,每组样品设立3个重复,并设立阴性对照。取平均Ct值,采用2-△△Ct法分析试验数据。
|
|
表 1 qPCR引物序列 Table 1 qPCR primer sequences |
1.2.4 Western blot法测定ACE2、PEDV N蛋白表达水平 使用RIPA(强)细胞裂解液从细胞中提取总蛋白,并使用BCA蛋白浓度检测试剂盒确定蛋白浓度。蛋白样品通过5%浓缩胶、8%分离胶进行SDS-PAGE电泳,并转移到PVDF膜上。利用5%脱脂奶粉进行封闭,随后将一抗过夜孵育,最后分别用HRP偶联山羊抗鼠IgG、HRP偶联山羊抗兔IgG作为二抗进行孵育。利用VILBER FX5成像系统获得曝光图像。分析目的蛋白及内参蛋白的灰度值,计算蛋白的相对表达量。
1.2.5 重组表达质粒的构建与鉴定,shRNA干扰质粒的构建与选择 重组表达质粒与shRNA干扰质粒由武汉金开瑞生物工程有限公司进行构建。重组表达质粒利用双酶切法进行鉴定。利用限制性核酸内切酶BamHⅠ、NheⅠ对pEGFP-ACE2进行酶切,酶切产物用1%琼脂糖凝胶电泳进行检测。
根据ACE2的全长序列设计shRNA干扰片段并构建干扰质粒,选择评分最高的3个分别连接到pLVX质粒上,shRNA序列如表 2。
|
|
表 2 shRNA干扰片段序列 Table 2 shRNA interference fragment sequences |
1.2.6 质粒转染 将细胞瓶中融合度为85%~95%且形态良好的IPEC-J2细胞以每孔1.2×106细胞接种于6孔细胞板中,待细胞密度达到70%时,根据全式金公司TransIntro®EL Transfection Reagent转染试剂的使用说明将ACE2过表达与干扰质粒进行转染,6 h后弃去转染复合物,用PBS洗涤细胞2次,并更换为维持培养基。
1.2.7 TCID50测定PEDV病毒滴度 将生长良好的Vero细胞按每孔4×104细胞接种于96孔板,于37 ℃,5% CO2培养箱中培养细胞至90%左右时,用PBS轻轻洗涤3次。分别用DMEM基础培养基将收集的病毒液按10-1~10-7的稀释度进行倍比稀释,于96孔板中每孔加入100 μL稀释后的病毒液,设立3组重复,每组设立6个复孔,从高至低浓度加入,同时设立阴性对照组。37 ℃、5%CO2孵育2 h后,弃去病毒液,用PBS清洗3次后更换为100 μL维持液继续培养,72 h后记录每个稀释度病变孔数,按照Reed-Muench公式计算各组的TCID50。
1.3 统计分析所有计算均使用GraphPad Prism 7.0进行。所有数据均用带有来自3个独立试验的平均值的标准误差表示。采用单因素方差分析(ANOVA)和t检验确定多组间的统计学差异。P<0.05表示差异显著(*),P<0.01表示差异极显著(**)。
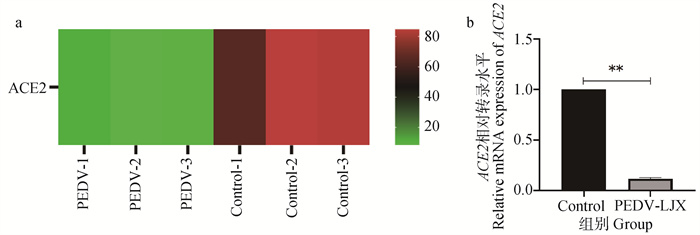
2 结果 2.1 转录组学分析PEDV感染仔猪肠道转录组学数据分析结果显示,与对照组相比,PEDV感染组ACE2表达水平显著下降(图 1a)。对转录组结果进行验证,采用仔猪肠道组织进行RT-qPCR,检测PEDV感染前后ACE2 mRNA表达水平的变化。结果显示,感染PEDV后ACE2转录水平显著下降(图 1b)。
|
a. PEDV感染仔猪肠道转录组学分析ACE2热图;b. RT-qPCR验证ACE2 mRNA表达水平, **. P<0.01 a. Transcriptomic analysis of the intestinal tract of PEDV-infected piglets ACE2 heat map; b. RT-qPCR to verify ACE2 mRNA expression level, **. P < 0.01 图 1 PEDV感染仔猪肠道转录组学分析结果 Fig. 1 Results of transcriptomic analysis of the intestinal tract of PEDV-infected piglets |
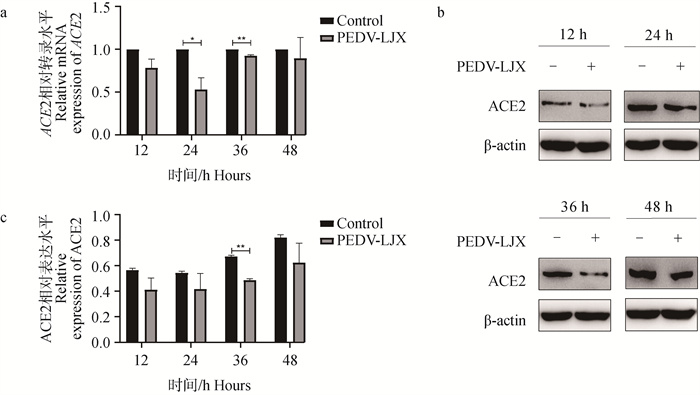
通过对4个时间点(12、24、36、48 h)的2个试验组(阴性对照组、PEDV-LJX组)进行RT-qPCR检测。结果显示,与阴性对照组相比,PEDV感染组ACE2 mRNA表达水平下降,在24、36 h时PEDV感染显著下降(P<0.05,P<0.01)(图 2a)。Western blot结果显示,与阴性对照组相比,PEDV感染组ACE2蛋白表达水平下降,在36 h时PEDV感染组显著下降(P<0.01)。综上所述,PEDV感染IPEC-J2细胞后,ACE2的表达水平降低(图 2b、c)。
|
a. RT-qPCR法测定PEDV感染IPEC-J2细胞后ACE2 mRNA表达量;b. Western blot法测定PEDV感染IPEC-J2细胞后ACE2蛋白结果图;c. 蛋白灰度分析ACE2表达量。*. P<0.05,**. P<0.01 a. Determination of ACE2 mRNA expression after PEDV infection of IPEC-J2 cells by RT-qPCR; b. Western blot assay for ACE2 protein after PEDV infection of IPEC-J2 cells; c. Protein grayscale analysis of ACE2 expression. *. P < 0.05, **. P < 0.01 图 2 PEDV感染IPEC-J2细胞对ACE2表达的影响 Fig. 2 Effect on ACE2 expression in PEDV infected IPEC-J2 cells |
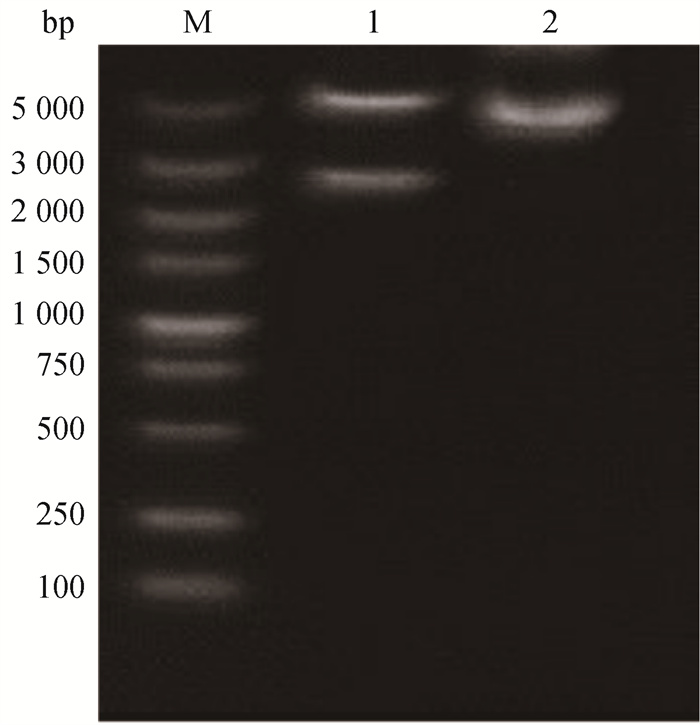
由于构建的过表达质粒中有NheⅠ与BamHⅠ酶切位点,利用限制性核酸内切酶NheⅠ与BamHⅠ对pEGFP-ACE2重组质粒进行双酶切鉴定。结果如图 3所示,在5 314和2 451 bp处各有一条带,重组质粒pEGFP-ACE2构建成功。测序结果表明ACE2片段插入位点正确。
|
M. DNA相对分子质量标准;1.双酶切(NheⅠ、BamHⅠ)重组pEGFP-ACE2质粒;2.重组pEGFP-ACE2质粒 M. DNA marker; 1. Double digestion (NheⅠ, BamHⅠ) of recombinant pEGFP-ACE2 plasmid; 2. Recombinant pEGFP-ACE2 plasmid 图 3 重组pEGFP-ACE2质粒的构建 Fig. 3 Construction of recombinant pEGFP-ACE2 plasmid |
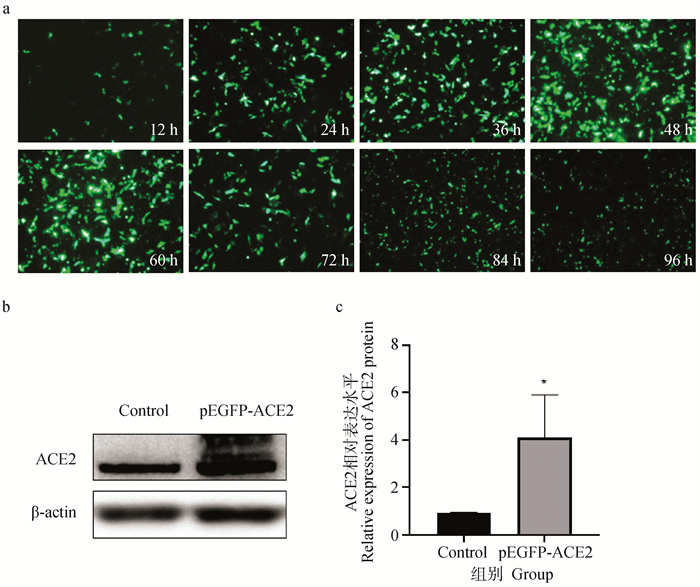
使用倒置荧光显微镜观察pEGFP-ACE2转染的IPEC-J2细胞。结果显示,在质粒转染后12~96 h内ACE2蛋白在IPEC-J2细胞中稳定表达(图 4a)。Western blot结果显示,与未转染组相比,转染pEGFP-ACE2组ACE2表达水平显著上调(P<0.05)(图 4b、c),重组质粒在48 h内可在IPEC-J2细胞中表达,能够用于后续试验。
|
a. 不同时间pEGFP-ACE2在IPEC-J2细胞的表达情况;b、c. Western blot法测定pEGFP-ACE2在IPEC-J2细胞表达ACE2蛋白水平,*. P<0.05 a. Expression of pEGFP-ACE2 in IPEC-J2 cells at different times; b, c. Western blot assay to determine pEGFP-ACE2 in IPEC-J2 cells expressing ACE2 protein level, *. P < 0.05 图 4 检测pEGFP-ACE2表达效果 Fig. 4 Detection of the effect of pEGFP-ACE2 expression |
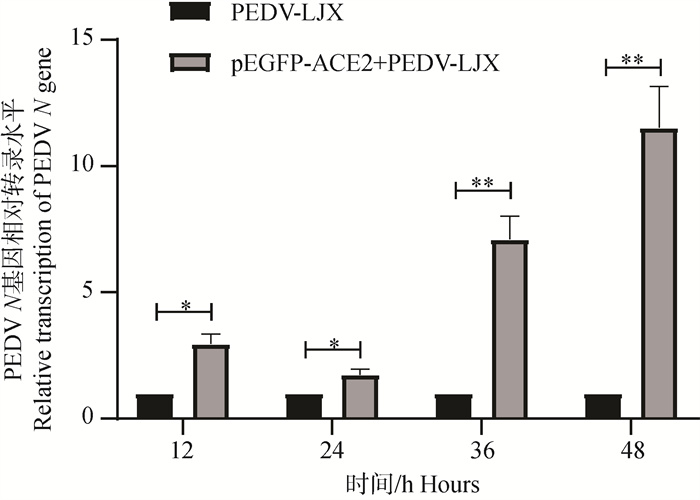
2.5.1 RT-qPCR检测过表达ACE2后PEDV N基因表达水平的变化 通过对4个时间点(12、24、36、48 h)的2个试验组(PEDV-LJX组、pEGFP-ACE2+PEDV-LJX组)进行RT-qPCR检测。结果显示,与对照组相比,在4个时间点过表达ACE2组PEDV N mRNA表达水平均显著上调(P<0.05,P<0.01)(图 5)。
|
*. P < 0.05, **. P < 0.01 图 5 过表达ACE2后PEDV N基因表达水平变化 Fig. 5 Changes in PEDV N gene expression level after overexpression of ACE2 |
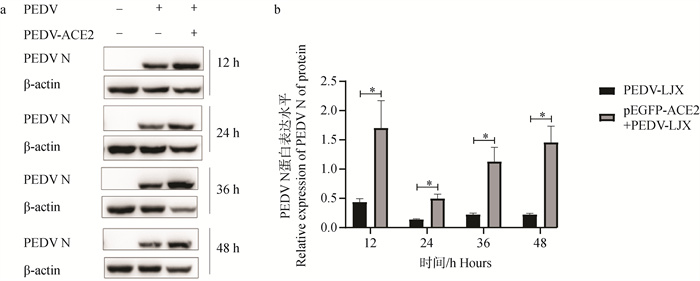
2.5.2 过表达ACE2后PEDV N蛋白表达水平的变化 采用Western blot对4个时间点(12、24、36、48 h)的2个试验组(PEDV-LJX组、pEGFP-ACE2+PEDV-LJX组)总蛋白检测。结果显示,与对照组相比,过表达ACE2组PEDV N蛋白表达水平呈上升趋势,并在24 h时显著上升(P<0.05)(图 6)。综上所述,过表达ACE2后PEDV N表达水平升高。
|
a.过表达ACE2后PEDV N蛋白表达量变化Western blot结果图;b. 蛋白灰度分析PEDV N蛋白表达量变化情况,*. P<0.05 a. Western blot results of changes in PEDV N protein expression after overexpression of ACE2; b. Protein grayscale analysis of PEDV N protein expression changes, *. P < 0.05 图 6 过表达ACE2后PEDV N蛋白表达水平变化 Fig. 6 Changes in PEDV N protein expression level after ACE2 overexpression |
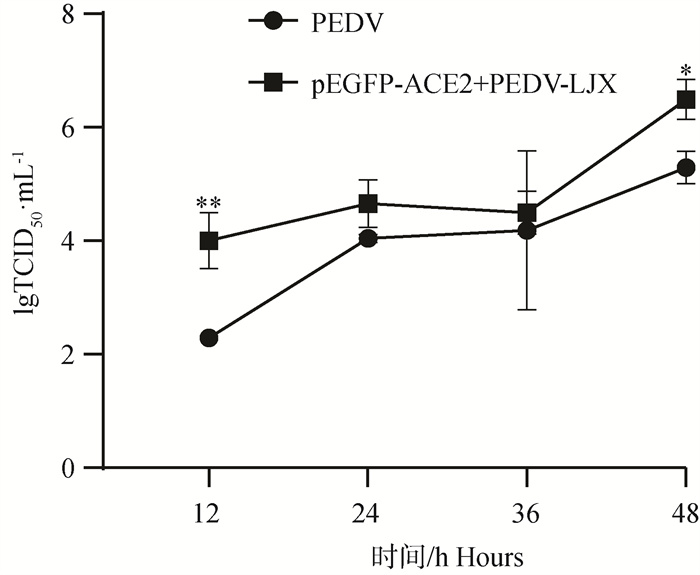
2.5.3 TCID50测定ACE2过表达后PEDV病毒滴度 对4个时间点(12、24、36、48 h)的2个试验组(PEDV-LJX组、pEGFP-ACE2+PEDV-LJX组)进行TCID50 试验。结果显示(图 7),ACE2过表达组的病毒滴度升高,且在12、48 h时显著高于PEDV攻毒组(P<0.05,P<0.01)。
|
*. P < 0.05, **. P < 0.01 图 7 过表达ACE2后攻毒PEDV TCID50结果 Fig. 7 Overexpression of ACE2 after attacking the toxic PEDV TCID50 results |
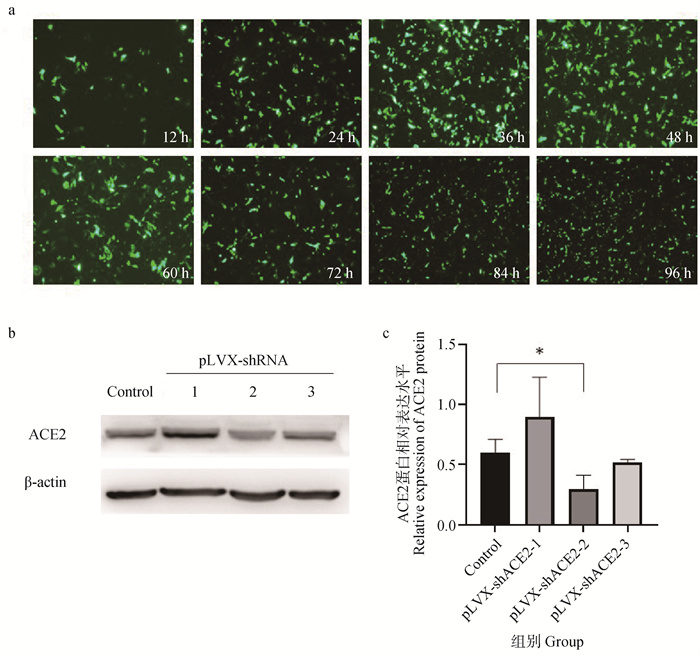
为了筛选出干扰效果最好的干扰质粒,将pLVX-shRNA-1、pLVX-shRNA-2、pLVX-shRNA-3分别转染至IPEC-J2细胞中,稳定表达24 h后,收集细胞总蛋白,利用Western blot检测细胞中ACE2的表达量变化情况。结果如图 8b、c显示,与未转染组相比,转染了pLVX-shRNA-2质粒的ACE2表达量下降最为显著(P<0.05),表明干扰质粒pLVX-shRNA-2能够使细胞内的ACE2表达水平下降。将pLVX-shRNA-2质粒转染至IPEC-J2细胞中,使用倒置荧光显微镜观察干扰质粒荧光表达情况,结果表示在12~96 h内质粒可以稳定表达(图 8a)。综上所述,pLVX-shRNA-2可用于后续试验中验证调控ACE2对PEDV感染IPEC-J2细胞的影响。
|
a. 不同时间经pLVX-shRNA-2干扰后ACE2在IPEC-J2细胞表达情况;b. 3个pLVX-shRNA在IPEC-J2细胞干扰表达ACE2蛋白后Western blot结果图;c. 蛋白灰度分析ACE2蛋白表达量变化情况,*. P<0.05 a. ACE2 expression in IPEC-J2 cells after pLVX-shRNA-2 interference at different times; b. Plot of Western blot results of three pLVX-shRNAs after interference with ACE2 protein expression in IPEC-J2 cells; c. Protein grayscale analysis of changes in ACE2 protein expression, *. P < 0.05 图 8 检测pLVX-shRNA表达效果 Fig. 8 Detection of the effect of pLVX-shRNA expression |
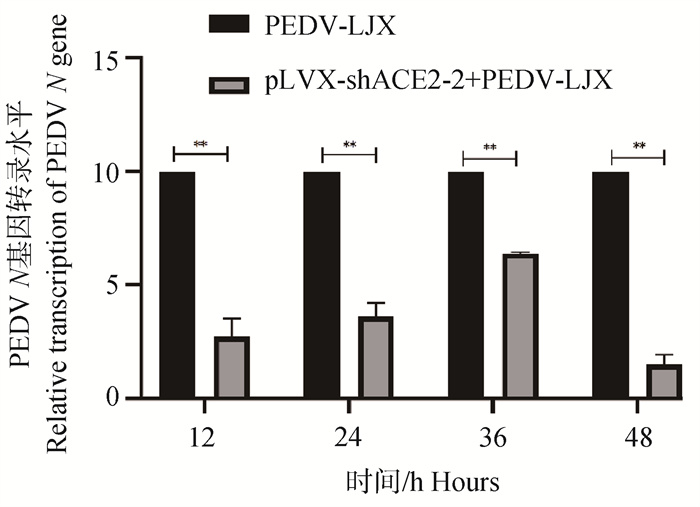
2.7.1 RT-qPCR检测干扰ACE2表达后PEDV N基因表达变化 通过RT-qPCR对不同时间点(12、24、36、48 h)对照组(PEDV-LJX组)和试验组(pLVX-shRNA2+PEDV-LJX组)的mRNA进行检测,以探究pLVX-shRNA2处理IPEC-J2细胞后对PEDV感染细胞的影响。分析结果如图 9所示,可以发现与对照组相比,pLVX-shRNA2+PEDV-LJX组PEDV N mRNA表达水平下降,且在12、24、36、48 h时均显著下降(P<0.01)。意味着ACE2下调能够抑制PEDV感染IPEC-J2细胞。
|
**. P < 0.01 图 9 干扰ACE2表达后PEDV N mRNA表达水平 Fig. 9 PEDV N mRNA expression level after interference with ACE2 expression |
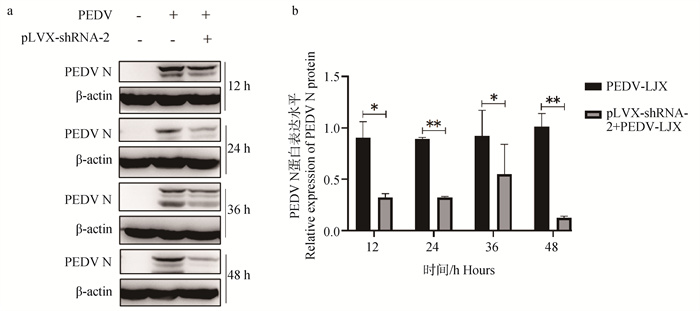
2.7.2 Western blot检测干扰ACE2表达后PEDV N蛋白表达变化 采集4个时间点(12、24、36、48 h)3个试验组(空白对照组、PEDV-LJX组、pLVX-shRNA-2+PEDV-LJX组)的总蛋白并进行Western blot试验以检测细胞内PEDV N蛋白表达的变化。结果如图 10所示,与对照组相比,pLVX-shRNA-2+PEDV组PEDV N蛋白表达量呈下降趋势,并在12、24、36、48 h时分别显著下降(P<0.05,P<0.01),意味着通过抑制ACE2表达能够下调PEDV感染IPEC-J2细胞水平。
|
a.干扰ACE2表达后PEDV N蛋白表达量变化Western blot结果图;b. 蛋白灰度分析PEDV N蛋白表达量变化情况, *. P<0.05,**. P<0.01 a. Western blot results of PEDV N protein expression changes after interference with ACE2 expression; b. Protein grayscale analysis of changes in PEDV N protein expression, *. P < 0.05, **. P < 0.01 图 10 干扰ACE2表达后PEDV N蛋白表达水平 Fig. 10 PEDV N protein expression level after interference with ACE2 expression |
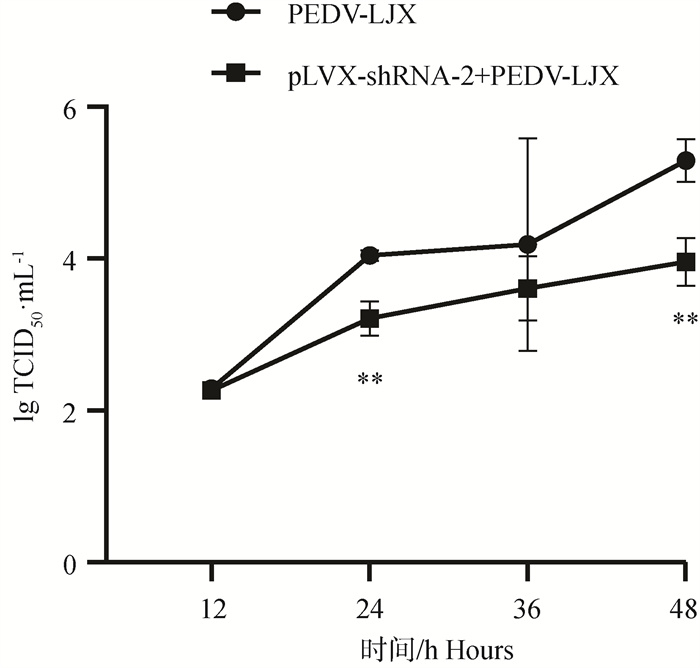
2.7.3 TCID50测定干扰ACE2表达后PEDV病毒滴度 采集4个时间点(12、24、36、48 h)2个试验组(PEDV-LJX组、pLVX-shRNA-2+PEDV组)细胞上清液进行TCID50测定。结果如图 11显示,相对于PEDV-LJX组,pLVX-shRNA-2+PEDV组病毒滴度有所下降,且在24、48 h时显著低于PEDV-LJX组(P<0.05,P<0.01)。即再次确证降低ACE2表达水平可抑制PEDV感染IPEC-J2细胞水平。
|
**. P < 0.01 图 11 干扰ACE2对PEDV在细胞上感染滴度的影响 Fig. 11 Effect of knockdown of ACE2 on the titer of PEDV infection on cells |
目前,猪流行性腹泻(PED)已被国家农业农村部列为二类疫病,自20世纪70年代出现以来,PED在世界大部分地区流行,引起以呕吐、腹泻和脱水为特征的传染性肠道疾病,导致新生仔猪死亡率高。在经过长时间的广泛传播后,PEDV进化出具有毒力、传染性和致病性更强的突变毒株,给全球养猪业带来了巨大的损失[13]。但市面上已有的疫苗保护效果较差,难以从根源上防控该病[14-15],而特效治疗药物尚未研发成功,且该病传染性强,药物治疗也将耗资巨大,并且更令人关注的是,病毒的变异性以及药物交叉保护的影响、耐药性的产生也是要面临的一大困难[16]。由此可见,加快对PEDV感染机制的研究,为研发抗病毒疫苗及有效药物奠定理论基础显得十分重要[17-18]。
PEDV进入细胞是通过其S蛋白与宿主细胞受体结合开始的,受体识别是病毒宿主范围和细胞嗜性的关键决定因素。先前的研究普遍认为,猪氨基肽酶(pAPN)是PEDV进入宿主细胞的受体[19-21],PEDV S蛋白通过与pAPN结合介导PEDV进入宿主细胞,而近几年的研究表明并非如此。Li等[22]认为pAPN不是猪流行性腹泻病毒进入细胞所必需的,此结论在Ji等[23]的研究中也得到了证实,因此pAPN可能仅在PEDV感染过程中发挥辅助性作用,真正的功能性受体还有待进一步探究。而目前已有研究表明,ACE2是SARS-CoV-2的特定功能受体[7]。在冠状病毒的传播中发挥重要作用。作为RAS的关键调节蛋白,ACE2除了能维持心血管功能的稳定性,还在调节先天免疫并影响肠道微生物群的组成,协助肠道物质的运输从而抵抗炎性损伤等方面发挥着重要作用[24]。ACE2在猪鼻黏膜中均无表达,但在猪小肠中广泛存在,尤其是上皮细胞的刷状缘和小肠绒毛的顶端,这使得其主要在肠道中发挥作用,因此可能更倾向于作为与猪肠道冠状病毒相结合的受体[25]。在先天免疫方面,有研究显示ACE2在猪小肠上皮细胞中作为跨膜蛋白表达,ACE2通过抑制NF-kB途径中p65的磷酸化水平和MAPK途径中的ERK1/2来发挥抗炎作用[26]。以上研究表明ACE2可以在肠道发挥作用且可以应答冠状病毒感染。
为了明确ACE2在冠状病毒PEDV感染过程中是否也发挥了一定的作用,本试验室前期通过转录组测序发现了在感染PEDV后,仔猪肠道中ACE2表达显著下调,基于此,作者研究了ACE2蛋白在PEDV感染后的表达水平。结果显示,PEDV感染IPEC-J2细胞后,ACE2的表达水平显著下降,与转录组测序结果一致。将ACE2过表达后PEDV感染上升,这与沈海燕等[27]研究结果相似,即PEDV在稳定表达ACE2的IPEC-J2细胞中比在IPEC-J2细胞中的增殖能力明显升高;而干扰ACE2表达会抑制PEDV在IPEC-J2细胞中的感染,使PEDV复制水平降低。试验结果提示,ACE2可能与PEDV感染有关,ACE2在PEDV感染过程中发挥重要作用。但ACE2在调控PEDV感染过程中的作用机制及PEDV S蛋白是否参与其中的互作或识别尚不明确,有待进一步研究。
4 结论猪流行性腹泻病毒(PEDV)感染猪小肠上皮细胞(IPEC-J2)后血管紧张素转换酶2(ACE2)在mRNA及蛋白水平表达均显著下调,过表达ACE2组能提高PEDV复制水平,抑制ACE2的表达,可降低PEDV复制水平。
| [1] |
李继堂. 猪流行性腹泻病毒致病机制和防治措施[J]. 猪业观察, 2020(3): 43-44. LI J T. Pathogenic mechanism and prevention measures of porcine epidemic diarrhea virus[J]. Swine Industry Outlook, 2020(3): 43-44. (in Chinese) |
| [2] |
张强敏, 郭福生, 尹燕博, 等. 猪流行性腹泻病毒分子生物学特征[J]. 中国病毒学, 2002, 17(4): 381-384. ZHANG Q M, GUO F S, YIN Y B, et al. Molecular biological traits of porcine epidemic diarrhea virus[J]. Virologica Sinica, 2002, 17(4): 381-384. (in Chinese) |
| [3] |
LI Z W, MA Z Q, LI Y, et al. Porcine epidemic diarrhea virus: molecular mechanisms of attenuation and vaccines[J]. Microb Pathog, 2020, 149: 104553. DOI:10.1016/j.micpath.2020.104553 |
| [4] |
WARNER F, RAJAPAKSHA H, SHACKEL N, et al. ACE2:from protection of liver disease to propagation of COVID-19[J]. Clin Sci (Lond), 2020, 134(23): 3137-3158. DOI:10.1042/CS20201268 |
| [5] |
PERLOT T, PENNINGER J M. ACE2-from the renin-angiotensin system to gut microbiota and malnutrition[J]. Microbes Infect, 2013, 15(13): 866-873. DOI:10.1016/j.micinf.2013.08.003 |
| [6] |
YAMAMOTO K, TAKESHITA H, RAKUGI H. ACE2, angiotensin 1-7 and skeletal muscle: review in the era of COVID-19[J]. Clin Sci (Lond), 2020, 134(22): 3047-3062. DOI:10.1042/CS20200486 |
| [7] |
LU R J, ZHAO X, LI J, et al. Genomic characterisation and epidemiology of 2019 novel coronavirus: implications for virus origins and receptor binding[J]. Lancet, 2020, 395(10224): 565-574. DOI:10.1016/S0140-6736(20)30251-8 |
| [8] |
WAN Y, SHANG J, GRAHAM R, et al. Receptor recognition by the novel coronavirus from Wuhan: an analysis based on decade-long structural studies of SARS coronavirus[J]. J Virol, 2020, 94(7): e00127-20. |
| [9] |
LEUNG J M, YANG C X, TAM A, et al. ACE-2 expression in the small airway epithelia of smokers and COPD patients: implications for COVID-19[J]. Eur Respir J, 2020, 55(5): 2000688. DOI:10.1183/13993003.00688-2020 |
| [10] |
SAMELSON A J, TRAN Q D, ROBINOT R, et al. BRD2 inhibition blocks SARS-CoV-2 infection by reducing transcription of the host cell receptor ACE2[J]. Nat Cell Biol, 2022, 24(1): 24-34. DOI:10.1038/s41556-021-00821-8 |
| [11] |
WRAPP D, WANG N S, CORBETT K S, et al. Cryo-EM structure of the 2019-nCoV spike in the prefusion conformation[J]. Science, 2020, 367(6483): 1260-1263. DOI:10.1126/science.abb2507 |
| [12] |
王珊珊, 黄瑜, 张树坤, 等. 血管紧张素转化酶2(ACE2)在仔猪体内的表达分布[J]. 畜牧与兽医, 2012, 44(S1): 175. WANG S S, HUANG Y, ZHANG S K, et al. Distribution of angiotensin-converting enzyme 2 expression in piglets[J]. Animal Husbandry & Veterinary Medicine, 2012, 44(S1): 175. (in Chinese) |
| [13] |
李志强, 闫书平, 纪晓霞, 等. 血管紧张素转换酶2在仔猪空肠中的分布表达及其与物质转运的关系[J]. 畜牧兽医学报, 2019, 50(8): 1676-1684. LI Z Q, YAN S P, JI X X, et al. Distribution and expression of angiotensin-converting enzyme 2 (ACE2) in the Jejunum of piglets and its relationship with substance transport[J]. Acta Veterinaria et Zootechnica Sinica, 2019, 50(8): 1676-1684. (in Chinese) |
| [14] |
LIN F, ZHANG H Y, LI L Q, et al. PEDV: insights and advances into types, function, structure, and receptor recognition[J]. Viruses, 2022, 14(8): 1744. DOI:10.3390/v14081744 |
| [15] |
敖翔, 赖守勋, 周建川, 等. 国内外猪流行性腹泻病毒和其他猪冠状病毒疫苗研究进展[J]. 养猪, 2020(1): 121-128. AO X, LAI S X, ZHOU J C, et al. Progress of research on vaccines against porcine epidemic diarrhea virus and other porcine coronaviruses at home and abroad[J]. Swine Production, 2020(1): 121-128. (in Chinese) |
| [16] |
韩瑞, 王清华, 闫鹏先, 等. 猪流行性腹泻基因工程疫苗研究进展[J]. 畜牧兽医科技信息, 2021(8): 10-12. HAN R, WANG Q H, YAN P X, et al. Progress of research on genetically engineered vaccine for porcine epidemic diarrhea[J]. Chinese Journal of Animal Husbandry and Veterinary Medicine, 2021(8): 10-12. DOI:10.3969/J.ISSN.1671-6027.2021.08.005 (in Chinese) |
| [17] |
TURLEWICZ-PODBIELSKA H, POMORSKA-MÓL M. Porcine coronaviruses: overview of the state of the art[J]. Virol Sin, 2021, 36(5): 833-851. DOI:10.1007/s12250-021-00364-0 |
| [18] |
董世娟, 谢春芳, 司伏生, 等. 猪流行性腹泻病毒免疫及疫苗研制[J]. 生物工程学报, 2021, 37(8): 2603-2613. DONG S J, XIE C F, SI F S, et al. Immunization against porcine epidemic diarrhea virus and vaccine development[J]. Chinese Journal of Biotechnology, 2021, 37(8): 2603-2613. (in Chinese) |
| [19] |
LI B X, GE J W, LI Y J. Porcine aminopeptidase N is a functional receptor for the PEDV coronavirus[J]. Virology, 2007, 365(1): 166-172. DOI:10.1016/j.virol.2007.03.031 |
| [20] |
CHEN L, LIN Y L, PENG G Q, et al. Structural basis for multifunctional roles of mammalian aminopeptidase N[J]. Proc Natl Acad Sci U S A, 2012, 109(44): 17966-17971. DOI:10.1073/pnas.1210123109 |
| [21] |
KAMAU A N, PARK J E, PARK E S, et al. Porcine amino peptidase N domain Ⅷ has critical role in binding and entry of porcine epidemic diarrhea virus[J]. Virus Res, 2017, 227: 150-157. DOI:10.1016/j.virusres.2016.10.004 |
| [22] |
LI W T, LUO R, HE Q G, et al. Aminopeptidase N is not required for porcine epidemic diarrhea virus cell entry[J]. Virus Res, 2017, 235: 6-13. DOI:10.1016/j.virusres.2017.03.018 |
| [23] |
JI C M, WANG B, ZHOU J Y, et al. Aminopeptidase-N-independent entry of porcine epidemic diarrhea virus into Vero or porcine small intestine epithelial cells[J]. Virology, 2018, 517: 16-23. DOI:10.1016/j.virol.2018.02.019 |
| [24] |
HASHIMOTO T, PERLOT T, REHMAN A, et al. ACE2 links amino acid malnutrition to microbial ecology and intestinal inflammation[J]. Nature, 2012, 487(7408): 477-481. DOI:10.1038/nature11228 |
| [25] |
LEAN F Z X, NÚÑEZ A, SPIRO S, et al. Differential susceptibility of SARS-CoV-2 in animals: Evidence of ACE2 host receptor distribution in companion animals, livestock and wildlife by immunohistochemical characterisation[J]. Transbound Emerg Dis, 2022, 69(4): 2275-2286. DOI:10.1111/tbed.14232 |
| [26] |
LI Z Q, WANG K, JI X X, et al. ACE2 suppresses the inflammatory response in LPS-induced porcine intestinal epithelial cells via regulating the NF-κB and MAPK pathways[J]. Peptides, 2022, 149: 170717. DOI:10.1016/j.peptides.2021.170717 |
| [27] |
沈海燕, 康桦华, 刘志成, 等. 猪流行性腹泻病毒在稳定表达猪ACE2基因的IPEC-J2细胞中的增殖研究[J]. 动物医学进展, 2020, 41(5): 38-43. SHEN H Y, KANG H H, LIU Z C, et al. Study on proliferation of a PEDV strain on IPEC-J2 cells stably expressing porcine ACE2[J]. Progress in Veterinary Medicine, 2020, 41(5): 38-43. (in Chinese) |
(编辑 孟培)



