2. 河南省长兴农牧有限公司, 开封 475131
2. Henan Changxing Agriculture and Animal Husbandry Co. LTD., Kaifeng 475131, China
河南斗鸡是我国珍贵的家禽品种资源,具有较高的食用和观赏价值[1-2]。河南斗鸡的原产地及中心产区为开封市,另外也有一些分布在洛阳、周口和郑州等地。2009年河南斗鸡被列入河南省畜禽遗传资源保护名录[3]。近年来围绕河南斗鸡种质资源,学者从河南斗鸡的组织结构特征[4]、血液生化指标[5]、行为学[6]、染色体组型[7]、蛋品质[8]、肉用性能与肉质特性[9]、遗传进化[10]等多方面开展了研究。国内由于长期将河南斗鸡定义为观赏品种且长期散养在民间,因此对其杂交配套利用研究较少。
相较其它品种,斗鸡肌肉更强健、发达,Ren等[11]通过基因组结合转录组分析揭示了潜在影响斗鸡肌肉发育的基因。Sun等[12]通过全基因组分析显示这可能与ISPD基因外显子2的Arg84Lys错义突变有关。Guo等[13]进一步的研究表明ISPD基因中Arg84Lys错义突变可促进鸡肌肉的良好发育,维持肌纤维稳定性。徐廷生等[14-15]的初步研究表明,将河南斗鸡和艾维茵二者做杂交,其杂交一代鸡肌肉丰满、肉质鲜美。
实际上,全球范围内已有一些成功利用斗鸡进行肉鸡改良的案例,如科尼什(cornish)是现代的一个肉用型品种,但事实上该鸡种是通过用印度的一个品种(Red Aseels)与英国的黑胸斗鸡杂交培育而成的[16]。日本也在斗鸡资源的开发利用上做了不少研究,Iwamoto等[17]对日本本地斗鸡与白洛克鸡杂交后代的研究表明,杂交斗鸡肌肉特性呈现了较显著的性别差异,并且在日本用其本地斗鸡与洛岛红鸡培育的杂交斗鸡已被作为一种品牌鸡肉成功地进行商业化的推广与应用[18]。
洛岛红鸡育成于美国洛德岛州,由红色马来斗鸡、褐色来航鸡和九斤黄鸡杂交而成,体型中等,属兼用型优质鸡种,肉质鲜美并且抗病能力强,常被用作现代高产蛋鸡的父系[19]。迄今为止,尚未见河南斗鸡与洛岛红鸡杂交的研究报道。
本试验以河南斗鸡及洛岛红鸡(父本)与河南斗鸡(母本)的回交后代为素材,研究导入25%洛岛红鸡血缘对河南斗鸡屠体指标、肌肉特性、血清生化指标及肌纤维发育和葡萄糖转运相关基因表达的影响,为河南斗鸡的新品系选育和配套利用提供参考依据。
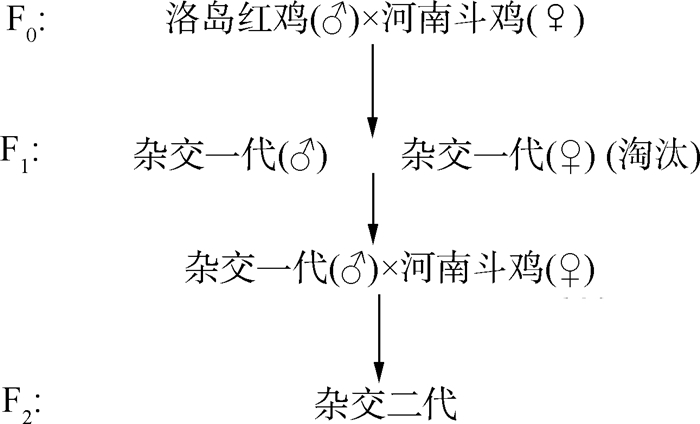
1 材料与方法 1.1 试验动物与设计从河南省开封斗鸡保种场选取同一批次饲养的120日龄纯种河南斗鸡及其杂交鸡各10羽,公母各半,共分为4组,每组5个重复,每个重复1只鸡。杂交斗鸡为纯种河南斗鸡导入了25%的洛岛红鸡血缘的后代,其杂交配套模式如图 1所示。
|
图 1 杂交模式图 Fig. 1 Hybridization pattern diagram |
试验鸡饲养于半开放式鸡舍、立体笼养,饲养期间鸡只的温度、光照模式参照蛋鸡进行管理,湿度控制在50%~55%,自由采食、饮水,日粮参照中国《NY/T 33—2004-鸡饲养标准》中的蛋用鸡饲料营养标准配制。试验鸡均严格执行基础免疫程序。
1.2 样品采集对选取的试验鸡禁食12 h后采取颈动脉放血法进行屠宰,并测定相关屠体指标。采集血液,待血液凝固后放入高速冷冻离心机(德国,5424R),2 000 r·min-1离心15 min,分离血清,并保存在-20 ℃待测。采集左侧部分胸肌与腿肌放入10%甲醛溶液固定以用于制作常规石蜡切片,剩余部分经液氮冷冻后转到-80 ℃保存以用于后续RNA的提取;取右侧全部胸肌与腿肌样品,保存在4 ℃下用于后续肉品质测定。
1.3 指标测定1.3.1 屠宰指标的测定 试验鸡屠宰指标的测定参照《NY/T 823—2020家禽生产性能名词术语和度量统计方法》[20]。测定指标包括宰前活重、屠体重、全净膛重、器官重、胸肌重和腿肌重,并计算屠宰率、全净膛率、器官指数、胸肌率和腿肌率。
1.3.2 肌肉品质测定 各选取3个不同位点测定胸肌、腿肌pH;取胸肌和腿肌样品,沿肌纤维方向修饰成长条形(1.5 cm×2.0 cm×3.5 cm)进行失水率、剪切力的测定。失水率的测定及计算参照Zhang等[21]方法;剪切力的测定参照国家农业部行业标准《NY/T 1180—2006肉嫩度的测定剪切力测定法》[22]。
1.3.3 肌肉组织学特性 胸/腿肌采用常规方法制备石蜡切片(厚度约为2 μm),进行苏木精-伊红(H.E.)染色,将石蜡切片倒置于10×10全自动生物显微镜(Motic, BA600-4)进行扫描,使用Image-pro Plus(IPP)软件进行图像分析。每张切片读取5个视野,每个视野选定20根肌纤维,取每根肌纤维长轴和短轴的平均值作为肌纤维直径;每张切片另取5个视野,每个视野选定5个面积的肌纤维数量,从而计算肌纤维密度。
1.3.4 血清生化指标 通过全自动生化分析仪(HITA-CHI Automatic Aralyzer 7600,日本)检测血清白蛋白(ALB)、球蛋白(GLO)、白蛋白与球蛋白比值(A/G)、胆固醇(CHO)、甘油三酯(TG)和低密度脂蛋白(LDL-C)的含量。
1.3.5 样品总RNA提取及cDNA合成 按照TRIZOL试剂说明书(南京诺唯赞)提取各组胸肌和腿肌的总RNA,采用超微量分光光度仪(美国NanoDrop公司)检测总RNA,OD260 nm/OD280 nm比值介于1.8~2.0之间为合格。以RNA为模板,参照反转录试剂盒说明书(HiScript Ⅲ 1st Strand cDNA Synthesis Kit+gDNA wiper,南京诺唯赞)进行反转录,反应步骤分为两步:第一步(除去基因组DNA)反应体系:RNase-free ddH2O 16 μL,4 × gDNA wiper Mix 4 μL,RNA 1 μg,在Eppendorf 5331PCR仪(德国Eppendorf公司)中进行42 ℃ 2 min的反应;第二步:第一步反应液16 μL,5 × HiScript III qRT SuperMix 4 μL,在Eppendorf 5331PCR仪中进行37 ℃ 15 min,85 ℃ 5 s的反应,获得样品的cDNA保存在-20 ℃备用。
1.4 实时荧光定量PCR利用Primer5.0设计引物,引物信息见表 1,引物由生工生物工程(上海)股份有限公司合成。以样品cDNA为模板,采用实时荧光定量PCR(Quantitative Real-time PCR, qRT-PCR)(美国Bio-Rad公司)检测目的基因的表达量。qRT-PCR采用SYBR Green染料法,反应体系为20 μL:2×ChamQ Universal SYBR qPCR Master Mix 10 μL,上、下游引物各0.4 μL,cDNA模板2 μL,RNase-free ddH2O 7.2 μL,在荧光定量PCR仪器上进行扩增。qRT-PCR反应程序:95 ℃ 30 s; 95 ℃ 5 s, 60 ℃ 30 s, 共39个循环。以β-actin为内参,每个体系均设置3个技术重复和4个生物学重复。数据采用2-ΔΔCt法计算目的基因的相对表达量[23]。
|
|
表 1 荧光定量PCR引物 Table 1 Primer sequence of different genes for qRT-PCR |
数据经Excel 2016初步处理后,采用SPSS 23.0生物统计软件进行双因素方差分析,并用Duncan多重比较进行显著性检验,分别进行同性别不同群体或同群体不同性别的比较分析。结果以“平均值±标准误(Mean±SEM)”表示。以P < 0.05差异显著,P < 0.01差异极显著为判断标准。
2 结果 2.1 杂交斗鸡的配套模式本试验杂交斗鸡的配套模式如图 1所示。所用杂交斗鸡是通过采用洛岛红公鸡(♂)与河南斗鸡母鸡(♀)进行杂交(F1代),并选取F1代公鸡(♂)与河南斗鸡母鸡(♀)进行回交得到F2代,并用F2代鸡只开展相关研究。F2杂交斗鸡含有25%的洛岛红鸡血缘。
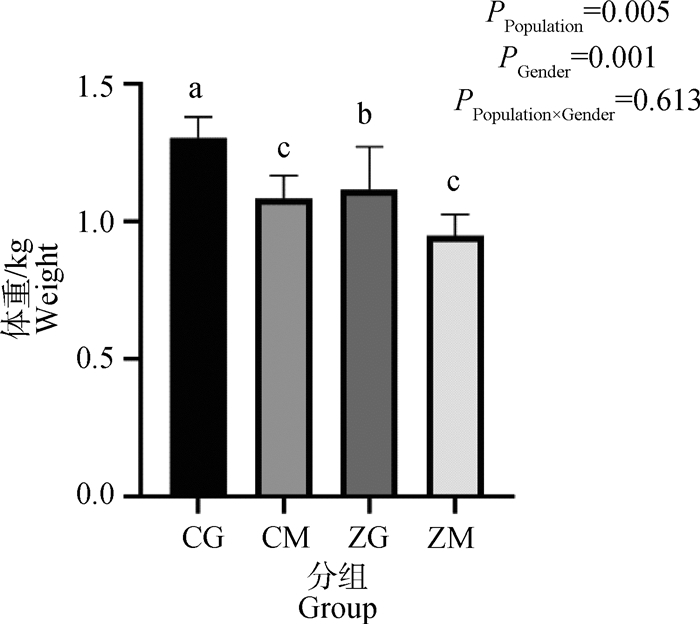
2.2 杂交斗鸡和河南斗鸡屠体指标的比较研究表明(图 2),120日龄时纯种河南斗鸡的体重显著高于杂交斗鸡(P=0.005),且两个群体公鸡的体重均显著高于母鸡(P=0.001)。但两个群体在全净膛率、屠宰率、胸肌率、腿肌率、心脏指数和肝脏指数上均无显著差异(P>0.05,表 2)。
|
不同字母表示差异显著(P < 0.05);无字母或含相同字母表示差异不显著(P>0.05)。CG.河南斗鸡公鸡;CM.河南斗鸡母鸡;ZG.杂交斗鸡公鸡;ZM.杂交斗鸡母鸡。n=5。下图同 Different letters indicate significant difference (P < 0.05); No letter or the same letter indicates no significant difference (P>0.05). CG. Henan fighting rooster; CM. Henan fighting hen; ZG. Crossbred fighting rooster; ZM. Crossbred fighting hens. n=5. Behind figures follow the same rules 图 2 杂交鸡和河南斗鸡宰前活重对比 Fig. 2 Comparison of live weight between hybrid chickens and Henan fighting chickens |
|
|
表 2 杂交斗鸡和河南斗鸡的屠体相关指标比较 Table 2 Comparison of slaughter indexes between hybrid chickens and Henan fighting chickens |
数据分析表明,在胸肌组织中(表 3),肌纤维直径呈现了显著的群体效应和性别效应,以母鸡的肌纤维直径显著高于公鸡(P=0.013),纯种斗鸡的肌纤维直径显著高于杂交斗鸡(P=0.014)。胸肌肌纤维密度指标的性别效应显著(P=0.000), 而其群体与性别间的互作效应不显著(P=0.056)。公鸡的胸肌肌纤维密度极显著高于母鸡(P=0.000)。杂交公鸡的胸肌肌纤维密度极显著高于纯种公鸡(P < 0.01)。而失水率、剪切力及pH几个指标在品种间及性别间均无显著差异(P>0.05)。
|
|
表 3 杂交斗鸡和纯种河南斗鸡胸肌肌肉特性相关指标的比较 Table 3 Comparisons of the pectoral muscle characteristics between hybrid chickens and Henan fighting chickens |
对腿肌的肌肉特性(表 4)相关数据分析表明,剪切力指标的性别效应显著(P=0.02),特别是纯种公鸡的剪切力显著高于纯种母鸡(P < 0.05)。腿肌的肌纤维密度呈现了显著的群体效应(P=0.002),以杂交母鸡的肌纤维密度显著高于纯种母鸡(P < 0.05),杂交公鸡的肌纤维密度极显著地高于纯种公鸡(P < 0.01)。此外杂交公鸡的腿肌肌纤维密度还显著高于杂交母鸡(P < 0.05)。
|
|
表 4 杂交斗鸡和纯种河南斗鸡腿肌肌肉特性相关指标比较 Table 4 Comparisons of the leg muscle characteristics between hybrid chickens and Henan fighting chickens |
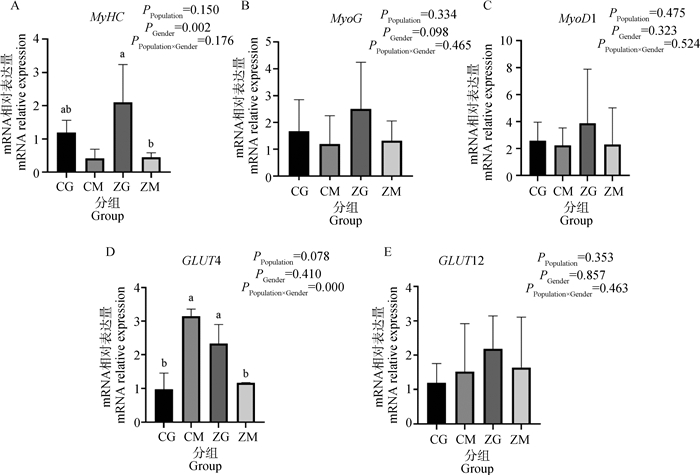
荧光定量结果显示(图 3),胸肌组织Myosin heavy chain (MyHC)基因的表达(图 3A)呈现了显著的性别效应(公鸡>母鸡,P=0.002),杂交公鸡MyHC基因的表达也略高于纯种公鸡(P=0.057)。Myogenin(MyoG)(图 3B)、Myogenic differentiation 1(MyoD1)基因(图 3C)和Glucose Transporter 12 gene(GLUT12)基因(图 3E)的表达在两个群体和性别间均无显著差异(P>0.05)。而胸肌Glucose Transporter 4(GLUT4)基因的表达(图 3D)呈现了显著的互作效应(P=0.000)。在同群体不同性别间(图 3D),胸肌GLUT4的表达水平在纯种河南斗鸡中以母鸡显著高于公鸡(P < 0.01),而其表达在杂交斗鸡中则以公鸡显著高于母鸡(P < 0.01)。在同性别不同群体中(图 3D),胸肌GLUT4基因的水平在公鸡中以杂交公鸡显著高于纯种公鸡(P < 0.01),而在母鸡中则以纯种母鸡显著高于杂交母鸡(P < 0.05)。MyHC基因在腿肌(图 4A)中的表达也呈现了显著的性别效应(公鸡>母鸡,P=0.023),纯种公鸡和杂交母鸡MyHC基因的表达量极显著高于纯种母鸡(P < 0.01)。而MyoG基因(图 4B)、MyoD1基因(图 4C)和GLUT12基因(图 4E)在腿肌中无显著的表达差异(P>0.05)。腿肌GLUT4(图 4D)的表达也如在胸肌中一样,呈现了显著的群体和性别间的交互效应(P=0.006),其中杂交母鸡腿肌GLUT4的表达极显著地高于杂交公鸡与纯种母鸡(P < 0.01),而纯种公鸡腿肌GLUT4的表达却略高于纯种母鸡和杂交公鸡(P>0.05)。
|
图 3 目的基因在杂交斗鸡和纯种河南斗鸡胸肌组织的表达量 Fig. 3 The expression level of target genes in pectoral muscles of hybrid chickens and Henan fighting chickens |

|
图 4 目的基因在在杂交斗鸡和纯种河南斗鸡腿肌组织的表达量 Fig. 4 The expression level of target genes in leg muscles of hybrid chickens and Henan fighting chickens |
进行杂交斗鸡和纯种河南斗鸡血清指标的分析发现(图 5),ALB在各组间差异不显著(P>0.05,图 5A)。血清GLO水平呈现极显著的群体间效应(杂交斗鸡>河南斗鸡,P=0.004), 特别是杂交公鸡的血清GLO水平极显著高于纯种公鸡(P < 0.01,图 5B)。而血清A/G比值呈现了显著的互作效应(P=0.013),其中纯种公鸡的血清A/G比值显著高于杂交公鸡(P < 0.05,图 5C)。血清CHO水平(图 5D)呈现显著的群体效应(杂交斗鸡>河南斗鸡,P=0.011)和性别效应(公鸡>母鸡,P=0.012),特别是杂交公鸡的血清CHO水平极显著高于杂交母鸡和纯种公鸡(P < 0.01)。血清TG水平也呈现了极显著的性别效应(公鸡>母鸡,P=0.002,图 5E),纯种公鸡的血清TG水平显著高于纯种母鸡(P < 0.05),杂交公鸡显著高于杂交母鸡(P < 0.05)。血清LDL-C显示了显著的群体效应(杂交斗鸡>河南斗鸡,P=0.014,图 5F),特别是杂交公鸡血清LDL-C显著地高于纯种公鸡(P < 0.05)。

|
图 5 杂交鸡和河南斗鸡血清生化指标比较 Fig. 5 Comparisons of serum biochemistry indexes between hybrid chickens and Henan fighting chickenss |
河南斗鸡作为珍贵的地方特色品种,为了防止其流失,养殖者极少直接将河南斗鸡作为食用资源,这极大地限制了该资源的利用。通过杂交配套拓展其利用途径十分必要。通过地方鸡种和高产的洛岛红鸡杂交不仅可以提高后代鸡只的产蛋性能/繁殖性能;也是培育小型优质肉鸡的有效模式,是实现后代鸡只多用途的有效配套方式。
3.1 杂交鸡和河南斗鸡屠体指标屠宰性能是衡量产肉性能经济价值的重要指标,也是养殖者追求的经济指标。屠宰率越高,表明畜禽的产肉能力越大。肉质性能良好的鸡群表现为屠宰率在80%以上,全净膛率在60%以上[24]。吴信生[25]对河南斗鸡屠宰研究发现,河南斗鸡屠宰率在90%左右,全净膛率在65%左右。本试验研究表明,引入25%的洛岛红血缘的杂交斗鸡群体在屠宰相关指标上与纯种河南斗鸡上没有显著的差异,其胸肌率和腿肌率在两个鸡种间也没有显著差异,说明各组的产肉性能总体较好,杂交后维持了原品种的良好优势。
3.2 杂交鸡和河南斗鸡肌肉品质特性常规肉品质指标包括pH、剪切力、失水率等几个重要指标。肌肉pH会影响到肉的质量。剪切力常用来反映肌肉嫩度的高低[26],剪切力越大,嫩度越差。而失水率是评价肌肉保水性的一项重要指标,失水率越大,保水性越差[27], 该指标的高低可以直接影响到肉的嫩度、多汁性等特性。本研究发现,总体来说导入25%洛岛红血缘对河南斗鸡pH、失水率和剪切力指标没有显著影响,但其腿肌剪切力在公母鸡均呈现以纯种斗鸡高于杂交斗鸡的趋势,这与人们反映河南斗鸡的肌肉更有嚼劲的说法相一致。
本研究发现,导入25%洛岛红血缘显著影响了斗鸡的肌纤维组织特性。胸肌肌纤维直径(纯种斗鸡>杂交鸡)和胸/腿肌肌纤维密度(纯种斗鸡 < 杂交鸡)均在两个群体间呈现了显著差异,表明25%洛岛红血缘的导入进一步提升了河南斗鸡的肉质指标。肌纤维特性指标在群体和性别间的显著差异,除了反映了不同群体和性别在肉品质上的差异外,也应该与河南斗鸡经过长期的战斗力选育有关。肌肉是力量的主要源泉,而河南斗鸡是我国著名的斗鸡品种,具有战斗鸡的称号,其打斗时通常是速战速决。鸡的胸肌富含白肌纤维,而腿肌则为混合型(含白肌纤维和红肌纤维),而白肌纤维也称为快肌,与肌肉的爆发力紧密相关,有研究表明,快肌纤维较慢肌纤维直径大[28],密度小,快肌纤维含有较多的收缩蛋白,并且由较大的运动神经元支配,神经纤维较粗,传导速度较快,力量较慢肌纤维强[29]。此外,还观察到纯种河南斗鸡公鸡的肌纤维密度仅仅略高于母鸡,而导入25%洛岛红血缘后进一步加大了胸、腿肌的肌纤维密度指标在性别间的差异(杂交公鸡>杂交母鸡,P < 0.01)。
3.3 目的基因的变化特性肌纤维特性(肌纤维直径和密度等)与肌肉品质密切相关[30-31],对肌纤维直径/密度与肉品质关系的研究表明,肌纤维直径越小,密度越大,肉品质越好[32-33]。针对观察到纯种斗鸡和杂交斗鸡在肌纤维特性上的显著差异,本研究采用荧光定量PCR进一步检测了与肌肉发育和葡萄糖转运紧密相关基因的表达。MyHC基因家族又称肌球蛋白重链基因家族,是肌肉收缩的主要功能蛋白,该基因已经成为肌肉纤维类型划分的主要分子标记[34],MyHC基因具有4种异构体,即MyHC Ⅰ、MyHC Ⅱa、MyHC Ⅱb和MyHC Ⅱx[35],其中本试验选用的鸡MyHC基因又称MyH1D,属快速型肌纤维,MyHC基因的表达量与肉质呈正相关[36]。MyoG和MyoD1基因都是生肌调节因子(MRFs)家族的成员,主要参与调控肌肉生长发育[37-38]。
选择性扫描分析发现,肉鸡经过几世代高强度的选择,其MyHC基因家族中的MyH1A、MyH1B和MyH1D基因受到显著影响[39]。本试验通过荧光定量PCR发现,MyHC基因在鸡胸肌和腿肌中的表达均以雄性高于雌性,而在鸡胸肌中不同群体间MyHC基因的表达均无显著差异。而MyoG及MyoD1基因的表达在群体和性别间均无显著差异。骨骼肌是摄取和利用葡萄糖的主要部位,GLUT4在促进骨骼肌葡萄糖吸收、维持整个机体血糖动态平衡中发挥着核心调控作用[40-41],另有研究表明,GLUT12可以促进多种己糖的转运[42]。在本试验中,GLUT12基因表达无显著差异,而鸡GLUT4基因在腿肌和腿肌的表达均呈现了显著的群体和性别的互作效应,且在胸肌和腿肌的表达模式完全不同。这显示25%洛岛红血缘的导入在改变斗鸡的肌纤维特性的同时,也进一步改变了葡萄糖摄取与利用模式,相关的机制有待进一步研究。
3.4 杂交鸡和河南斗鸡血清生化指标血清生化指标是衡量动物健康状况、氧化代谢、生理机能等的重要指标[43]。机体血清ALB水平能反映动物蛋白质合成代谢的情况[44]。血清GLO可以一定程度上反映机体内参与免疫反应的血清球蛋白水平,其含量的高低是评价机体免疫水平特别是体液免疫水平的重要指标[45]。A/G参数反映ALB/GLO的比值,该指标不仅能反映脾的功能状况,而且能作为衡量机体免疫机能的一项指标,在杂交鸡中A/G值减小,反映了机体特异性免疫应答水平的增强,提高了抗病能力[46]。本研究发现,25%洛岛红血缘的导入显著提高了机体血清球蛋白水平,降低了公鸡A/G比值,这与杂交可以提高动物机体免疫力、生活力相一致[19, 47]。血清中CHO、TG和LDL-C的含量是反映机体中脂质代谢的关键指标[48],LDL-C是机体转运脂质的脂蛋白颗粒,负责将肝合成的胆固醇转运至血液[49],对促进机体脂类代谢的平衡具有重要意义。本研究发现,这3个指标均以雄性显著高于雌性,表明25%洛岛红血缘的导入显著提高了河南斗鸡血清CHO和LDL-C的水平,特别是对雄性鸡的影响更大,其相关调控的分子机制还有待进一步研究。
4 结论通过杂交斗鸡与纯种河南斗鸡的比较表明,导入25%洛岛红鸡血缘后对河南斗鸡的多项屠宰指标无显著影响,但是显著提升了鸡只的血脂水平,提高了公鸡骨骼肌的肌纤维密度,显著影响了GLUT4的表达模式。
| [1] |
黄继亮. 河南斗鸡遗传资源的保护与利用进展[J]. 河南畜牧兽医, 2020, 13: 17-18. HUANG J L. Progress in the protection and utilization of genetic resources of Henan Game chicken[J]. Henan Animal Husbandry and Veterinary Science, 2020, 13: 17-18. (in Chinese) |
| [2] |
黄炎坤, 刘健, 杨朋坤, 等. 河南斗鸡保种现状与发展对策[J]. 家畜生态学报, 2016, 37(10): 84-87. HUANG Y K, LIU J, YANG P K, et al. Conservation status and developmental countermeasures of Henan game chicken[J]. Acta Ecologae Animalis Domastici, 2016, 37(10): 84-87. DOI:10.3969/j.issn.1673-1182.2016.10.017 (in Chinese) |
| [3] |
朱锐广. 宝贵的优质家禽资源-河南斗鸡[J]. 河南畜牧兽医: 市场版, 2015, 36(12): 28-29. ZHU R G. Valuable high-quality poultry resources-Henan cockfighting[J]. Henan Journal of Animal Husbandry and Veterinary Medicine, 2015, 36(12): 28-29. (in Chinese) |
| [4] |
毛振宾, 武大椿. 河南斗鸡一些器官的组织结构特征[J]. 豫西农专学报, 1991, 11(1): 26-28. MAO Z B, WU D C. Some fine structure characteristics of organs of Henan cockfighting[J]. Journal of Yuxi Agricultural College, 1991, 11(1): 26-28. (in Chinese) |
| [5] |
武大椿, 纪景仁. 河南斗鸡主要血液指标测定[J]. 豫西农专学报, 1985(1): 48-51. WU D C, JI J R. Determination of main blood parameters in Henan game chicken[J]. Journal of Yuxi Agricultural College, 1985(1): 48-51. (in Chinese) |
| [6] |
武大椿, 武艳丽, 张春玲. 对河南斗鸡行为的观察[J]. 豫西农专学报, 1989(1): 56-62. WU D C, WU Y L, ZHANG C L. Observation on the behavior of cockfighting in Henan[J]. Journal Yuxi Agricultural College, 1989(1): 56-62. (in Chinese) |
| [7] |
庞有志, 武大椿, 李顺成, 等. 河南斗鸡的染色体组型[J]. 豫西农专学报, 1991, 11(2): 17-20. PANG Y Z, WU D C, LI S C, et al. Chromosomal phenotype of Henan cockfighting[J]. Journal of Yuxi Agricultural College, 1991, 11(2): 17-20. (in Chinese) |
| [8] |
范佳英, 杨朋坤, 黄炎坤, 等. 河南斗鸡蛋品质分析[J]. 家畜生态学报, 2018, 39(12): 60-63, 73. FAN J Y, YANG P K, HUANG Y K, et al. Quality traits analysis on eggs of Henan game chicken[J]. Acta Ecologae Animalis Domastici, 2018, 39(12): 60-63, 73. (in Chinese) |
| [9] |
徐廷生, 雷雪芹, 袁志发. 河南斗鸡肉用性能与肉质特性研究[J]. 西北农业学报, 2001, 10(2): 25-27. XU T S, LEI X Q, YUAN Z F. Study on meat performance and quality of Henan game[J]. Acta Agriculturae Boreali-Occidentalis Sinica, 2001, 10(2): 25-27. DOI:10.3969/j.issn.1004-1389.2001.02.007 (in Chinese) |
| [10] |
殷建玫, 朱云芬, 薛倩, 等. 基于RAD-seq简化基因组测序的河南斗鸡遗传进化研究[J]. 家畜生态学报, 2020, 41(5): 11-15. YIN J M, ZHU Y F, XUE Q, et al. Study on genetic evolution mechanism of Henan game chicken based on RAD-seq[J]. Acta Ecologae Animalis Domastici, 2020, 41(5): 11-15. DOI:10.3969/j.issn.1673-1182.2020.05.003 (in Chinese) |
| [11] |
REN X F, GUAN Z, ZHAO X R, et al. Systematic selection signature analysis of Chinese gamecocks based on genomic and transcriptomic data[J]. Int J Mol Sci, 2023, 24(6): 5868. DOI:10.3390/ijms24065868 |
| [12] |
SUN Y F, ZHAO G P, LIU R R, et al. The identification of 14 new genes for meat quality traits in chicken using a genome-wide association study[J]. BMC Genomics, 2013, 14: 458. DOI:10.1186/1471-2164-14-458 |
| [13] |
GUO L J, ZHANG S Y, XU Y B, et al. A missense mutation in ISPD contributes to maintain muscle fiber stability[J]. Poult Sci, 2022, 101(11): 102143. DOI:10.1016/j.psj.2022.102143 |
| [14] |
徐廷生, 雷雪芹, 路德成, 等. 斗鸡及其杂交鸡肉质性状的研究[J]. 中国家禽, 2000, 22(3): 15-17. XU T S, LEI X Q, LU D C, et al. A study on the meat character of cock fighting and it's hybrid[J]. China Poultry, 2000, 22(3): 15-17. DOI:10.3969/j.issn.1004-6364.2000.03.006 (in Chinese) |
| [15] |
徐廷生, 雷雪芹, 武大椿, 等. 河南斗鸡与艾维茵肉鸡杂交一代的产肉性能测定[J]. 中国家禽, 1994, 16(1): 4-5. XU T S, LEI X Q, WU D C, et al. Determination of meat production performance of the hybrid generation of Henan fighting and Avian broiler[J]. China Poultry, 1994, 16(1): 4-5. (in Chinese) |
| [16] |
ABDELMANOVA A S, DOTSEV A V, ROMANOV M N, et al. Unveiling comparative genomic trajectories of selection and key candidate genes in egg-type Russian white and meat-type white Cornish chickens[J]. Biology (Basel), 2021, 10(9): 876. |
| [17] |
IWAMOTO H, KATOH F, GOTOH T, et al. Effects of parent Shamo cocks on the histochemical properties of M.iliotibialis lateralis and M.supracoracoideus on their crossbred broilers[J]. Br Poult Sci, 1998, 39(5): 589-595. DOI:10.1080/00071669888449 |
| [18] |
UEMOTO Y, SATO S, ODAWARA S, et al. Genetic mapping of quantitative trait loci affecting growth and carcass traits in F2 intercross chickens[J]. Poult Sci, 2009, 88(3): 477-482. DOI:10.3382/ps.2008-00296 |
| [19] |
杨宁. 家禽生产学[M]. 2版. 北京: 中国农业出版社, 2010. YANG N. Poultry production[M]. 2nd ed. Beijing: China Agriculture Press, 2010. (in Chinese) |
| [20] |
中华人民共和国农业部. 中华人民共和国农业行业标准NY/T 823—2004家禽生产性能名词术语和度量统计方法[J]. 中国禽业导刊, 2006, 23(15): 45-46. The Ministry of Agriculture of the People's Republic of China. Agricultural standards of the People's Republic of China-terms and statistical methods of measurement of poultry production performance[J]. Guide to Chinese Poultry, 2006, 23(15): 45-46. (in Chinese) |
| [21] |
ZHANG C, ZHAO X H, WANG L, et al. Resveratrol beneficially affects meat quality of heat-stressed broilers which is associated with changes in muscle antioxidant status[J]. Anim Sci J, 2017, 88(10): 1569-1574. DOI:10.1111/asj.12812 |
| [22] |
中华人民共和国农业部. NY/T 1180—2006肉嫩度的测定剪切力测定法[S]. 北京: 中国农业出版社, 2006. The Ministry of Agriculture of the People's Republic of China. NY/T 1180—2006 Determination of meat tenderness shear force method[S]. Beijing: China Agriculture Press, 2006. (in Chinese) |
| [23] |
LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method[J]. Methods, 2001, 25(4): 402-408. DOI:10.1006/meth.2001.1262 |
| [24] |
李正田, 刘丽仙, 佟荟全, 等. 茶花鸡体尺性状和屠宰性能的测定及相关性分析[J]. 中国家禽, 2016, 38(2): 47-49. LI Z T, LIU L X, TONG H Q, et al. Determination and correlation analysis of body size traits and slaughter performance of Camellia chicken[J]. China Poultry, 2016, 38(2): 47-49. (in Chinese) |
| [25] |
吴信生. 利用微卫星技术分析中国部分地方鸡品种遗传多样性及其与生产性能的关系[D]. 扬州: 扬州大学, 2004. WU X S. Study on genetic diversity in Chinese indigenous chicken breeds using microsatellite markers and the relationships between production performances and microsatellite loci[D]. Yangzhou: Yangzhou University, 2004. (in Chinese) |
| [26] |
HASHIZAWA Y, KUBOTA M, KADOWAKI M, et al. Effect of dietary vitamin E on broiler meat qualities, color, water-holding capacity and shear force value, under heat stress conditions[J]. Anim Sci J, 2013, 84(11): 732-736. DOI:10.1111/asj.12079 |
| [27] |
DEVATKAL S K, VISHNURAJ M R, KULKARNI V V, et al. Carcass and meat quality characterization of indigenous and improved variety of chicken genotypes[J]. Poult Sci, 2018, 97(8): 2947-2956. DOI:10.3382/ps/pey108 |
| [28] |
DOU M L, YAO Y, MA L, et al. The long noncoding RNA MyHC ⅡA/X-AS contributes to skeletal muscle myogenesis and maintains the fast fiber phenotype[J]. J Biol Chem, 2020, 295(15): 4937-4949. DOI:10.1074/jbc.RA119.010498 |
| [29] |
HOU Y R, SU L, SU R N, et al. Effect of feeding regimen on meat quality, MyHC isoforms, AMPK, and PGC-1α genes expression in the biceps femoris muscle of Mongolia sheep[J]. Food Sci Nutr, 2020, 8(5): 2262-2270. DOI:10.1002/fsn3.1494 |
| [30] |
JOO S T, KIM G D, HWANG Y H, et al. Control of fresh meat quality through manipulation of muscle fiber characteristics[J]. Meat Sci, 2013, 95(4): 828-836. DOI:10.1016/j.meatsci.2013.04.044 |
| [31] |
DRANSFIELD E, SOSNICKI A. Relationship between muscle growth and poultry meat quality[J]. Poult Sci, 1999, 78(5): 743-746. DOI:10.1093/ps/78.5.743 |
| [32] |
PICARD B, GAGAOUA M. Muscle fiber properties in cattle and their relationships with meat qualities: an overview[J]. J Agric Food Chem, 2020, 68(22): 6021-6039. DOI:10.1021/acs.jafc.0c02086 |
| [33] |
HUO W R, WENG K Q, GU T T, et al. Effect of muscle fiber characteristics on meat quality in fast-and slow-growing ducks[J]. Poult Sci, 2021, 100(8): 101264. DOI:10.1016/j.psj.2021.101264 |
| [34] |
SCHIAFFINO S. Muscle fiber type diversity revealed by anti-myosin heavy chain antibodies[J]. FEBS J, 2018, 285(20): 3688-3694. DOI:10.1111/febs.14502 |
| [35] |
HOU Y R, SU L, SU R N, et al. Effect of feeding regimen on meat quality, MyHC isoforms, AMPK, and PGC-1α genes expression in the biceps femoris muscle of Mongolia sheep[J]. Food Sci Nutr, 2020, 8(5): 2262-2270. DOI:10.1002/fsn3.1494 |
| [36] |
HU H M, WANG J Y, ZHU R S, et al. Effect of myosin heavy chain composition of muscles on meat quality in Laiwu pigs and Duroc[J]. Sci China C Life Sci, 2008, 51(2): 127-132. DOI:10.1007/s11427-008-0016-x |
| [37] |
DAVEGÅRDH C, BROHOLM C, PERFILYEV A, et al. Abnormal epigenetic changes during differentiation of human skeletal muscle stem cells from obese subjects[J]. BMC Med, 2017, 15(1): 39. DOI:10.1186/s12916-017-0792-x |
| [38] |
JIA H T, TSAY H J, SCHMIDT J. Analysis of binding and activating functions of the chick muscle acetylcholine receptor γ-subunit upstream sequence[J]. Cell Mol Neurobiol, 1992, 12(3): 241-258. DOI:10.1007/BF00712929 |
| [39] |
TAN X D, LIU R R, LI W, et al. Assessment the effect of genomic selection and detection of selective signature in broilers[J]. Poult Sci, 2022, 101(6): 101856. DOI:10.1016/j.psj.2022.101856 |
| [40] |
RICHTER E A. Is GLUT4 translocation the answer to exercise-stimulated muscle glucose uptake?[J]. Am J Physiol Endocrinol Metab, 2021, 320(2): E240-E243. DOI:10.1152/ajpendo.00503.2020 |
| [41] |
KLIP A, MCGRAW T E, JAMES D E. Thirty sweet years of GLUT4[J]. J Biol Chem, 2019, 294(30): 11369-11381. |
| [42] |
BERLTH F, MÖNIG S, PINTHER B, et al. Both GLUT-1 and GLUT-14 are independent prognostic factors in gastric adenocarcinoma[J]. Ann Surg Oncol, 2015, 22(S3): 822-831. |
| [43] |
GUO S C, LEI J X, LIU L L, et al. Effects of Macleaya cordata extract on laying performance, egg quality, and serum indices in Xuefeng black-bone chicken[J]. Poult Sci, 2021, 100(4): 101031. |
| [44] |
ZHU J J, LI L, DUAN Y S, et al. Prognostic role of pre-treatment serum ALB in patients with oropharyngeal cancer: a retrospective cohort study[J]. Front Oncol, 2022, 12: 924210. |
| [45] |
WILSON M R, VAN RAVENSTEIN E, MILLER N W, et al. cDNA sequences and organization of IgM heavy chain genes in two Holostean fish[J]. Dev Comp Immunol, 1995, 19(2): 153-164. |
| [46] |
CATTANEO L, LOPREIATO V, PICCIOLI-CAPPELLI F, et al. Plasma albumin-to-globulin ratio before dry-off as a possible index of inflammatory status and performance in the subsequent lactation in dairy cows[J]. J Dairy Sci, 2021, 104(7): 8228-8242. |
| [47] |
MESELE T L. Reproduction and production performance of improved chickens, their production constraints, and opportunities under Ethiopian conditions[J]. Trop Anim Health Prod, 2023, 55(4): 245. |
| [48] |
KRAUS A, ZITA L, KRUNT O, et al. Determination of selected biochemical parameters in blood serum and egg quality of Czech and Slovak native hens depending on the housing system and hen age[J]. Poult Sci, 2021, 100(2): 1142-1153. |
| [49] |
SHARMAN M J, FERNANDEZ M L, ZERN T L, et al. Replacing dietary carbohydrate with protein and fat decreases the concentrations of small LDL and the inflammatory response induced by atherogenic diets in the guinea pig[J]. J Nutr Biochem, 2008, 19(11): 732-738. |
(编辑 郭云雁)



