2. 洛阳市活载体生物材料与动物疫病防控重点实验室, 洛阳 471003;
3. 河南科技大学动物疫病与公共卫生重点实验室, 洛阳 471003;
4. 河南科技大学医学技术与工程学院, 洛阳 471003
2. Luoyang Key Laboratory of Live Carrier Biomaterial and Animal Disease Prevention and Control, Luoyang 471003, China;
3. The Key Laboratory of Animal Disease and Public Health, Henan University of Science and Technology, Luoyang 471003, China;
4. College of Medical Technology and Engineering, Henan University of Science and Technology, Luoyang 471003, China
许多革兰阴性菌对动物食品性安全和兽医公共卫生造成了巨大危害,例如大肠埃希菌(Escherichia coli,E. coli)、铜绿假单胞菌(Pseudomonas aeruginosa,P. aeruginosa)、鼠伤寒沙门菌(Salmonella Typhimurium,S. Typhimurium)、弗氏志贺菌(Shigella flexneri,S. flexneri)、幽门螺旋杆菌(Helicobacter pylori,H. pylori)、溶血性曼氏杆菌(Mannheimia haemolytica,M. haemolytica)[1],这些细菌均可以衍生一种外表为球形、脂质双层包裹的纳米颗粒,大小通常在20~250 nm[2],称为外膜囊泡(outer membrane vesicles,OMVs)。革兰阳性菌也可产生MVs,一般被称为细胞质膜小泡(cytoplasmic membrane vesicles,CMVs),如炭疽杆菌(Bacillus anthraci,B. anthraci)、枯草芽胞杆菌(Bacillus subtilis,B. subtilis)、金黄色葡萄球菌(Staphylococcus aureus,S. aureus)[3-4]。本文主要对革兰阴性菌进行讨论。革兰阴性菌衍生的OMVs通常源于外膜向外突出的泡状物或内溶素引发的爆炸性细胞裂解,其中存在着与亲本细菌相同的大部分成分(LPS、脂蛋白、PG、DNA、RNA等)[5]。最新研究表明,OMVs主要由基因毒性应激诱导释放[6],且OMVs释放量和组成会受压力因素(如温度、pH和抗生素)的影响[7-9]。到目前为止,已经证实革兰阴性菌中存在六种分泌系统,称为分泌系统I~VI(TSS1-6),而7型分泌系统仅存在分支杆菌(Mycobacterium)中[10]。最近,有研究学者认为OMVs是一个独立的分泌系统,又称为零型分泌系统(T0SS)[11],与其它分泌系统相比,还具有很多重要功能[12]:分泌脂质、疏水性及不溶性蛋白质,并使这些分子在水性介质中扩散。因此,T0SS能够远距离输送多种化学物质,这些物质作为溶质包含在囊泡管腔内,也可以结合到双层膜的中间,或者是与细胞壁结合,使囊泡内容物免受外部环境的影响。OMVs通过递送毒素、脂多糖(lipopolysaccharide,LPS)、DNA和RNA以及一些小分子化合物和金属离子等,大大增强了细菌的生存以及致病能力,使其在宿主定植和疾病发病机制中的作用越来越受到关注。因此,本文主要综述OMVs结构、分泌特性及致病机制的最新研究进展,为深入研究细菌致病机制以及开发新的抗菌策略提供理论指导。
1 OMVs的衍生、结构和组成 1.1 OMVs的衍生OMVs这一概念可以追溯到20世纪60年代,Bishop和Work[13]分析了在赖氨酸存在下,培养大肠杆菌突变体的上清液应无细胞存在,但这些突变体在赖氨酸限制条件下却衍生出大量的物质,当时称之为“细胞外脂糖肽”。且大部分细菌在各种生长条件下均可衍生OMVs,这表明OMVs的分泌可能是一个保守进化的过程[14]。
关于OMVs衍生机制,存在几种假说。第一个假说是肽聚糖(peptidoglycan,PG)和外膜相互交联。革兰阴性菌细胞壁主要由外膜、内膜以及夹在两膜中间的周质腔组成(图 1)。周质上方分布了一层薄PG,发挥着连接内外膜的作用。当细菌受到某些刺激后,脂蛋白(lipoprotein,LPP)发生变性水解,PG结构也发生了改变,引起PG-LPP之间交联键的减少触发了OMVs的形成[15-16]。第二个假设是周质蓄积的作用。当周质蛋白发生错误折叠或者PG片段在周质空间发生蓄积,便会对外膜产生膨压,从而导致OMVs衍生。在铜绿假单胞菌中,Opr86基因的缺失导致了胞质丝氨酸蛋白酶的表达增加,细胞质中外膜蛋白(outer membrane protein,OMP)的错误折叠诱导了OMVs的生物发生[17-18]。第三个假设称之为“双层耦合模型”。在外膜LPS中,脂质A参与膜不对称以及结构改变中起着非常重要的作用。如果脂质A发生了去酰基化,则会引起膜重塑,增加外膜曲率,引起OMVs的衍生。第四种假设,当vacJ和/或yrb基因沉默或缺失时,磷脂(phospholipid,PL)在外膜的外小叶中积累,导致外小叶不对称扩张,并促进外膜出芽形成OMVs[19]。除了以上几种假设,还提出了一种新的OMVs形成机制,即当细菌鞭毛被外膜鞘包围,而OMVs通常存在于有鞘的鞭毛处,当鞭毛旋转时,这些囊泡则被释放[9]。另外,也有人认为OMVs的衍生主要是一种应激反应,如长链醇和EDTA螯合剂的毒性浓度、抗生素以及渗透压和热休克等物理应激导致细胞释放OMVs[20]。因此,细菌OMVs的衍生是一种完全独立的、普通的细胞膜应激反应。
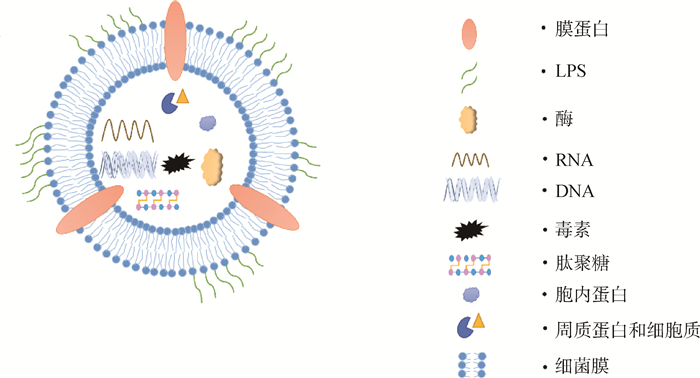
|
图 1 OMVs的结构与组成 Fig. 1 Structure and composition of outer membrane vesicles (OMVs) |
虽说OMVs结构与细菌外膜结构密切相关,然而与亲本菌株外膜组分相比,OMVs中的组分含量会有所增加或减少,这表明OMVs和外膜结构具有一定的差异[21-22]。除了经典的球状结构外,在其他细菌中发现管状和细长型结构[23-24]。通过对OMVs蛋白组进行分析,发现OMVs除固有蛋白成分外,还具有非亲本菌株的蛋白质成分。可以通过进行密度梯度离心纯化的方法对OMVs的组分进行分析[25],以下对蛋白质、脂质、核酸进行简单总结。
1.2.1 蛋白质 革兰阴性菌利用OMVs分泌蛋白质的途径非常成熟,进一步证明了其属于一种独立分泌系统。例如,大肠杆菌和某些肠道细菌所表达的成孔细胞毒素蛋白,如细菌溶素A(ClyA)不通过传统的六种分泌机制释放到细胞外环境,而是由OMVs独立分泌系统介导分泌[26]。通过SDS-PAGE、考马斯亮蓝染色或银染色以及Western blot方法可以检测OMVs中蛋白的存在[27]。目前已经鉴定出几种最丰富OMP(OmpA、OmpC和OmpF),且利用生化分析也可检测到OMVs中的周质蛋白,如碱性磷酸酶等一系列与宿主组织黏附和侵袭有关的毒力因子。
通过蛋白质组学,鉴定出OMVs中含有大约200多种蛋白质。其中最常见的,例如孔蛋白就是一种丰富的OMP,存在于大多数OMVs中,包括Omps、PorA、PorB和OprF等;鼠蛋白水解酶(Mlt和SLT)主要负责某些细胞壁糖肽的水解,尤其是对PG的作用。此外,OMVs中也存在胞质蛋白:EF-Tu、GroEL、DnaK和两种核糖体蛋白(S1和L7/12)等,但细胞质蛋白如何在没有裂解或伴随内膜的情况下进入OMVs是一个难以攻克的问题。此外,嗜肺军团菌(Legionella pneumophila,L. pneumophila)OMVs毒力蛋白含量和培养液中可溶部分的组成在数量和质量有一定差异[28],而关于这些毒力因子作为可溶性介质以及其在OMVs中的包装及分布中的研究却鲜有报道。
最新研究表明,OMVs的衍生与蛋白质组成可能是一个互作的过程[29]。鼠伤寒沙门菌大量释放OMVs,排出亲本菌株内有害的LPS和蛋白质,从而快速适应新环境[30];霍乱弧菌(Vibrio cholerae,V. cholerae)在感染后也有类似的适应性[31]。在大肠杆菌中,周质蛋白酶/伴侣蛋白的degP基因负责去除未折叠和错误折叠蛋白,其缺失后会导致OMVs增加。此外,OMVs中蛋白质还有许多其他生理功能。例如,ABC转运蛋白中的特定营养素(LamB、BtuB和FadL)、无机离子(FepA、FhuA和Fiu)和核苷(Tsx)在细菌群落中发挥转运作用;OMVs中的TonB依赖性受体(BtuB、FhuA和FhuE)可感知营养物质,是细菌在缺乏营养下生存的替代机制[32];OMVs中的水解酶(MltA、SLT)通过细胞壁降解杀死竞争细菌,保证自身生存;OMVs中的OmpT可降解上皮细胞或巨噬细胞产生的阳离子抗菌肽。除了致病特异性毒素外,OMVs的外膜孔蛋白(OmpA和OmpF)具有刺激免疫活性并诱导白细胞迁移,OmpA通过增强巨噬细胞对LPS的摄取,从而加强对脑微血管内皮细胞的侵袭力[32]。
1.2.2 脂质 在大多数革兰阴性菌中,外膜的外小叶主要由LPS组成,内膜的内小叶由PL组成,并且内外表面上脂质的不对称分布(图 1)。因此,OMVs不仅包含这些外膜成分(PL、LPS),且保留了这些成分的不对称性,但不同细菌OMVs的成分会有所差异。肠毒性大肠杆菌(enterotoxigenic Escherichia coli,ETEC)OMVs中主要脂质成分是甘油磷脂(glycerophospholipid,GP)、磷脂酰乙醇胺(phosphatidyl ethanolamine,PE)、磷脂酰甘油和心磷脂(cardiolipin,CL),这与OMVs的曲度有关;脑膜炎奈瑟菌(Neisseria meningitidis,N. meningitidis)OMVs主要包括磷脂酰甘油和PE[33];幽门螺旋杆菌OMVs主要脂质成分为CL,其中饱和脂肪酸的含量较高,使其结构更为坚固[34]。
系统发育树上即使相隔较远的物种中也发现了磷脂ABC转运系统的同源蛋白,如多杀性巴氏杆菌(Pasteurella multocida,P. multocida)、铜绿假单胞菌和鼠伤寒沙门菌等。这表明,OMVs的形成机制可能与PL转运存在密切联系[35-36]。为了触发外膜中的囊泡形成,PL从内膜到外膜的传输应该明显快于从外膜到内膜的传输,转运的紊乱导致其在外膜中积聚,引发OMVs释放。肠毒性大肠杆菌OMVs中含有高浓度的磷脂酰甘油、CL和PE。相比较之下,放线共生放线杆菌(Actinobacillus actinomycetemcomitans,A. actinomycetemcomitans)OMVs含有高浓度的CL和PE,而铜绿假单胞菌仅显示出高浓度的磷脂酰甘油,来自流感嗜血杆菌(Haemophilus influenzae,H. influenzae)的OMVs主要包括PE。因此,OMVs中磷脂酰甘油和PE的聚积对于阐明OMVs生物发生机制至关重要。
1.2.3 核酸 OMVs中的DNA可通过以下两种机制衍生:存在于周质中的DNA,可与其他周质组分一起被包裹,或者源于细胞外环境中的DNA(可能来源于裂解细菌)被运送至OMVs中[37]。获取外源DNA是细菌快速适应新环境的主要途径之一。共享遗传物质可以赋予细菌更强的生存机制,如抗生素抗性酶、定植结构(如菌毛)或毒性特征(如蛋白酶和毒素)[38]。因此,细菌的生存因子如何与T0SS结合,是了解细菌DNA转移的最佳办法[39]。
由于OMVs中的DNA对DNase处理具有抗性,因此采用DNase处理是区分不同类型囊泡DNA最有效方法。利用此方法在副流感嗜血杆菌OMVs中首次发现质粒的存在。随后,发现OMVs含有RNA和DNA。革兰阴性细菌OMVs中的DNA主要以环状质粒、线性质粒和染色体片段形式存在,而革兰阳性细菌的CMVs却并非如此。然而,DNA和RNA具体如何被整合和分类至囊泡中的详细机制尚未阐明。尽管DNA存在于某些OMVs中,但OMVs在不同种属之间的遗传物质交换中所起的作用还有待研究。
OMVs的结构和组成是其功能的基础,也是深入研究的着手点。许多细菌抗原和多种病原相关分子模式(pathogen-associated molecular patterns,PAMP)的共存使OMVs成为对抗其亲本菌株的优势疫苗。OMVs通过以空间传播的方式将PAMP的抗原和佐剂共同递送到相同的抗原呈递细胞,并诱导其成熟和抗原呈递,从而引发抗原特异性免疫反应[40]。
2 分泌特性革兰阴性菌通过衍生含有生物活性蛋白的OMVs,来执行多种生理过程,与其他分泌机制不同,OMVs能够使细菌分泌不溶性分子,并与可溶性物质结合,使酶以募集、隐藏和靶向的形式运输至远处的靶点(图 2)。例如,细菌通过OMVs传递信号,以实现细菌、环境和其它细菌群落之间的通信,维持周围环境的稳态;OMVs参与生物膜的形成和毒力因子的传递,增加了细菌的致病力[41]。此外,OMVs帮助细菌在恶劣的环境中生存等[42]。下面将从四个方面对OMVs的分泌特性进行总结。
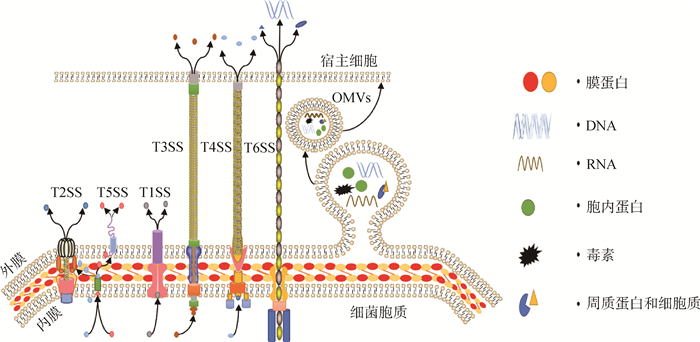
|
六种分泌系统分别嵌入在细菌胞膜中,它们可以向环境或直接在宿主细胞中分泌不同的效应物。然而,革兰阴性菌还可以产生外膜凸起,该凸起的管腔中携带一些效应器,然后被挤出外膜并作为外膜囊泡释放,将内容物直接迁移或运送至宿主细胞。OM.外膜;IM.内膜,OMV.外膜囊泡 The structures of the six secretion systems are inserted in the bacterial envelope; they can secrete different effectors to the environment or directly in the host cell. However, Gram-negative bacteria can produce a bubble of OM; it carries in the lumen some effectors and then the bubble is extruded off the OM and released as OMVs. OMVs can migrate or deliver the cargo directly to the host cell. OM. Outer membrane; IM. Inner membrane; OMV. Outer membrane vesicle 图 2 六种分泌系统和‘0型分泌系统’OMVs的结构比较 Fig. 2 Structural comparisons of the six secretion systems and OMVs production as secretion system type zero |
当细菌处于物理、化学或应激条件下时,会衍生更多的OMVs,这表明OMVs的衍生在细菌生存机制中起着重要作用。当细菌内部产生巨大压力时,OMVs可通过增加产量来释放这些压力,例如在大肠杆菌中,乙醇和高温引起的蛋白质错误折叠,可增加OMVs产量[43]。Sabra等[44]报道,通过增加铜绿假单胞菌的氧饱和度,也可增加OMVs产量。另外,当细菌受到合成抗生素类化合物、宿主上皮细胞以及先天免疫细胞产生的天然抗菌剂的攻击时,细菌释放的OMVs可以充当诱饵,吸收抗菌化合物,将耐药基因瞬转至邻近细胞,促进非可逆性的基因横向转移,增加微生物群体的长期耐药性;也可以介导其它细菌聚集,共同对抗宿主上皮细胞促进定植。例如,牙龈卟啉单胞菌(Porphyromonas gingivalis,P. gingivalis)产生的小泡有可能诱导自身和与其他细菌聚集[45]。此外,在噬菌体感染的情况下,OMVs的产量会增加,提高自身的适应度和生存率[46],其干扰机制主要是在其遗传物质插入或复制到细胞之前捕获噬菌体颗粒,也可通过产生OMVs作为噬菌体的识别位点来进行自身保护。因此,噬菌体很可能与OMVs受体结合,而不是与细菌表面的受体结合。
2.2 毒力因子的分泌大多数致病菌衍生的OMVs所分泌的生物分子,主要与侵袭、黏附、宿主细胞损伤、免疫调节以及增强毒力相关。牙龈卟啉单胞菌和放线杆菌OMVs可以提高细菌黏附宿主细胞的能力;在大肠杆菌、痢疾杆菌等细菌中,OMVs起着输送毒素(ClyA和志贺毒素)作用。另外,OMVs内存在的OMP和LPS可激活宿主的非特异性免疫反应,导致炎症反应过度刺激或感染性休克。通过对感染脑膜炎奈瑟菌患者的血浆进行电子显微镜观察,脑膜炎球菌释放大量OMVs,导致内毒素水平增高,从而引起致命性败血症。此外,沙门菌入侵宿主细胞后衍生含有LPS的OMVs以及其他修饰的表面抗原,从而避免免疫系统的识别。幽门螺旋杆菌OMVs由于缺少起定植作用的黏附因子(血型抗原结合黏附素和唾液酸结合黏附素),无法与宿主细胞相互作用[47]。这对治疗幽门螺旋杆菌病提供了新思路,其它细菌OMVs是否缺乏某些黏附因子,还需待进一步研究。
2.3 DNA、RNA的分泌通过对OMVs中总的DNA分析,被OMVs远距离输送的DNA主要来自亲本菌株的特定基因、质粒以及噬菌体DNA。例如,大肠杆菌O157:H7菌株OMVs,可以将stx1和stx2等基因水平转移到大肠杆菌JM109受体菌株中[48-49]。此外,OMVs内部的DNA转移在抗微生物基因的传播中也发挥着很重要作用。对碳青霉烯耐药的鲍曼不动杆菌(Acinetobacter baumannii,A. baumannii)OMVs携带blaOXA-24基因的质粒,该基因编码负责耐药的β-内酰胺酶。此外,OMVs可以作为细菌群落间水平基因转移的载体,当携带抗性基因菌株衍生的OMVs存在时,孵育敏感菌株会携带该基因的质粒。OMVs的存在使DNA转移不同于其它已知的方法,遗传物质不会受到降解破坏,并会直接远距离传递给受体细胞。
此外,从霍乱弧菌OMVs中检测并分离出RNA分子,它们参与转录调节机制[50]。铜绿假单胞菌OMVs中的sRNA是一种新的病原-宿主互作机制,可调节气管上皮细胞和小鼠肺部的免疫反应。此外,垢密螺旋体(Treponema denticola,T. denticola)和放线共生放线杆菌可通过OMVs运输msRNAs,这些msRNAs可能作为细菌信号分子,与牙周病原体和宿主之间的相互作用有关[51]。
2.4 参与细胞通讯和生物膜形成的分子分泌许多革兰阴性菌在生长过程中或由于环境应激而自然释放OMVs,通过整合到生物膜中并提供必要的营养物质来促进生物膜的形成,以增强细菌适应性[52]。生物膜是附着在由胞外多糖、DNA、蛋白质和其他分子组成的基质表面上的微生物群落,这些分子一起形成了一个胞外聚合物基质[53]。细菌生物膜形成和维持的一个关键因素是群体感应(quorum sensing,QS)现象,该现象主要由细菌群落间的细胞通讯组成,通过释放化学信号或自动诱导物,将信号转导至各细菌内部,从而促进基因表达的变化。笔者认为,OMVs与细菌释放出的自诱导物化学信号分子结合可介导多种功能,包括毒力因子的产生、宿主免疫反应的调节、对竞争微生物的细胞毒性和铁的获取参与,另外QS的大多数自动诱导物是疏水的,同时也存在于OMVs内部,这表明即使在水介质中,OMVs也参与了化学信号的传播[48],但是目前鲜有关于OMVs与细菌释放的化学信号如何结合的研究。此外,在幽门螺杆菌中,观察到生物膜形成的能力与细胞-细胞连接的形成成正比,这也是由OMVs中存在的蛋白质介导的[54]。
3 OMVs在细菌致病中的作用在致病力方面,有文献指出致病菌通常比非致病菌释放更多的OMVs,其原因很可能是致病菌可以调节OMVs分泌以增强其毒力[33]。例如,淋病奈瑟菌(Neisseria gonorrhoeae,N. gonorrhoeae)通过OMVs分泌PorB,被巨噬细胞吸收并将PorB输送到线粒体,从而诱导细胞凋亡,影响先天免疫[55]。当OMVs介导细菌-宿主的相互作用时,会引起宿主产生非免疫原性反应、促炎性反应以及细胞毒性反应,从而对宿主产生致病力。例如,由致病性大肠杆菌携带的大型毒力质粒编码的HIyF所衍生的OMVs可抑制细胞器自噬通量,促进非典型炎症小体途径的激活[56]。从某一方面来看,OMVs本身就是一种重要的细菌毒力因子[45],OMVs由于只可被致病性或非致病性生物体复制,所以不能单独引起发病[57]。另外,OMVs中富含PAMP以及其具有将毒力因子直接引流到淋巴结的特性,被抗原呈递细胞吸收后诱导了免疫刺激和炎症的发生[58]。此外,OMVs还可作为遗传信息载体和传递者来调控致病力[59]。
3.1 细菌-细菌相互作用细菌本身就是“自私”的,为了自身防御,细菌与细菌之间也会进行竞争。OMVs对于那些具有相同肽聚糖结构的细菌来说,毒性作用非常明显;OMVs携带的酶使细菌也能够区分自身细胞和非自身细胞,从而实现对非相似细胞的靶向清除[60]。铜绿假单胞菌衍生了含有多种毒力因子(包括蛋白酶、溶血素、磷脂酶C、碱性磷酸酶、抗菌喹诺酮和噬菌体的专一水解酶)的OMVs,通过囊泡融合或附着,来影响其他细菌囊泡蛋白水解酶的递送,杀死宿主细胞或其他细菌[61]。在黄色黏球菌(Myxococcus xanthus, M. xanthus)中,OMVs可能在裂解目标细胞中发挥作用,其含有蛋白酶、水解酶和具有抗菌活性的次级代谢产物。另外,革兰阳性细菌衍生的CMVs附着在细胞壁表面并释放PG水解酶,这些酶消化PG细胞壁并导致其裂解。铜绿假单胞菌OMVs含有PG水解酶,并与大肠杆菌和金黄色葡萄球菌膜融合,从而清除竞争细菌[62]。此外,OMVs在细菌互作过程中可能有助于清除共生菌群,从而使亲本细菌能够在特定的宿主部位定植。然而,还应考虑到,OMVs介导的病原体可直接从外部环境中,通过其他微生物裂解产物,来获取营养来源和新的遗传物质,这也是感染宿主炎症的间接来源[63]。
3.2 细菌-宿主相互作用致病细菌衍生的OMVs能够将毒力因子传递给宿主细胞,并且所释放的LPS、PG以及核酸,可以介导炎症反应[64]。来自特定细菌的OMVs可以破坏黏膜和上皮屏障的完整性,促进活性物质转移,有利于OMVs通过生物屏障[65]。此外,致病性和共生细菌衍生的OMVs可以通过多种机制进入宿主细胞,使其内容物能够在宿主中得到定向释放。另外,共生细菌释放的OMVs还含有PAMP,其具有能够调节宿主免疫,维持肠道内稳态并促进与宿主的共生[66-67]。以下将从以下三个方面讨论OMVs如何与宿主相互作用。
3.2.1 OMVs与宿主受体的相互作用 细菌感染期间释放的OMVs会影响免疫系统和感染结果,其结构大小、释放的含量以及亲本菌株的异质性都可能对受体细胞产生影响,导致炎症和免疫反应或促进病原体进入受体细胞存活[68]。肠道细菌衍生的细胞外小泡(GBEVs)在细菌-细菌和细菌-宿主起着关键作用[69]。在肠道微环境中,GBEVs通过减少宿主先天免疫反应来促进肠道病原体定植及增殖,GBEVs可直接进入肠黏液层,被宿主细胞内吞后,与细胞膜受体或细胞内受体结合,如TLR4配体、TLR2配体等,从而调节宿主免疫应答[69]。而炎症小体的激活依赖于通过Toll样受体(TLR)信号传导对传感器的转录诱导。例如,卡他莫拉细菌(Moraxella catarrhalis,M. catarrhalis)OMVs通过与TLR2的相互作用内化于人上皮细胞。双歧杆菌(Bifidobacterium)衍生的OMVs可增强树突状细胞内部TLR2/1和TLR4细胞的应答。假单胞菌和结核分支杆菌(Mycobacterium tuberculosis,M. tuberculosis)等细菌OMVs也可与TLR4相互作用,激活炎症反应[70]。最近有研究表明,非致病性大肠杆菌OMVs与TLR4结合以诱导IL-1β的表达,这取决于髓样分化因子(MyD88),因其属于TLR信号通路中的非常重要的接头分子[71]。若将MyD88这个介导炎症的“关键桥梁”作为一个新的研究靶点,将能更进一步解析疾病的发生机制。同时,OMVs与TLR4互作时是否需要其他TLR4辅助因子,还有待进一步研究探讨。
3.2.2 OMVs输送途径 有五种不同的内吞途径(图 3)可以将OMVs输送至非吞噬性宿主细胞:大型胞饮作用、网格蛋白介导的内吞、小窝蛋白介导内吞、脂质筏介导的内吞和直接膜融合。
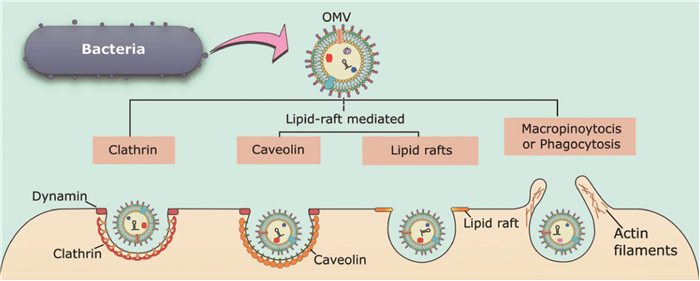
|
OMVs可以通过网格蛋白介导的内吞作用、脂筏介导的内吞、小窝蛋白的内吞,或通过巨噬细胞吞噬作用进入,这是从环境中吸收物质的更常见途径 OMVs can enter by clathrin-mediated endocytosis, lipid-raft-mediated endocytosis that may or may not be dependent on caveolin, or by macropinocytosis or phagocytosis which are more general pathways for uptake of material from the environment 图 3 OMVs进入宿主细胞的机制[72] Fig. 3 Mechanisms of OMV entry into host cells[72] |
第一种,通过大型胞饮作用引起的内吞。主要是由细胞膜下方肌动蛋白驱动,导致一个圆形褶皱突起,最终在顶部闭合,从而包围一部分细胞外空间[73]。它通常在细胞内吞和免疫细胞抗原采样中发挥作用,但也可被细菌[如沙门菌、产单核细胞李氏杆菌(Listeria monocytogenes,L. monocytogenes)]或病毒(埃博拉病毒)利用进入细胞[74-75],该机制可在各种途径中产生最大的内吞囊泡(>1 μm)[76]。
第二种,通过网格蛋白介导的内吞。简单来说,可分为“衔接蛋白和网格蛋白的货物招募;包被小凹的内陷、缢缩和液泡的芽殖;包被液泡的脱壳”几个过程[77]。例如,霍乱毒素以及多种大肠杆菌菌株在内的许多游离的毒力效应物可以进入该途径。
第三种,小窝蛋白(caveolin,CAV)介导的内吞。主要发生在富含胆固醇,鞘脂和小窝蛋白的物质中,尽管内化速度缓慢(比网格蛋白介导的低5倍),但它可以有效地将物质输送到胞质溶胶中,这个种类型的内吞主要发生在流感病毒中。通常使用化学抑制剂对CAV所介导的内吞作用来进行检测,如菲利平或甲基-β环糊精,去除或破坏富含胆固醇的膜结构域,抑制动力蛋白功能以防止囊泡内化,如大肠杆菌、鼠伤寒沙门菌、铜绿假单胞菌以及许多病毒,病原体可能更倾向于这种机制,因为与网格蛋白包被的凹陷不同,通过小窝内化的细菌被认为可以避免输送到溶酶体以及随后的降解[78]。例如,当大肠杆菌、沙眼衣原体(Chlamydia trachomatis,C. trachomatis)通过该途径进入宿主细胞时,它们能够逃避检测并在宿主细胞内持续存在。
第四种,脂质筏介导的内吞。其是富含胆固醇和鞘脂的质膜结构域,高度有序且比周围的双层更坚硬,可积累信号分子[79]。主要以富含胆固醇区域聚集引起膜的弯曲,继而引起的内吞作用。例如,铜绿假单胞菌、牙龈假单胞菌和鲍曼杆菌等均是以此方式实现内吞作用。
第五种,直接膜融合引起内吞作用。OMVs能够通过与宿主质膜的直接融合进入宿主细胞,如共生放线菌衍生的OMVs在孵育两分钟内将脂质追踪染料赋予宿主细胞质膜[80]。同样,在肺泡上皮细胞表面可以观察到用荧光标记示踪嗜肺军团菌OMVs,表明它们是长时间黏附或融合的[81]。
3.2.3 OMVs介导炎症激活和调节免疫反应 OMVs可能是影响病宿主炎症反应的关键因素,细菌在宿主定植后,其衍生的OMVs可能被上皮细胞和巨噬细胞吸收,从而立即触发宿主先天免疫反应。其在宿主细胞中具有免疫调节和触发相关信号级联的能力,这也是OMVs介导细菌-宿主相互作用的一个有力证据[82]。肠炎沙门菌的双组分系统PhoP-PhoQ协调LPS分子的重塑,并同时上调OMVs的衍生。OMVs以剂量依赖的方式保护细菌,并且在没有OMVs的情况下,细菌对补体介导的杀伤非常敏感[83]。利用此思路对其他细菌的双组分系统中某一信号通路进行抑制,降低OMVs的含量,从而介导的炎症反应,也是很好的研究方向。
LPS被认为是OMVs中最丰富且最有效的免疫刺激成分。例如,脂质A分子形成LPS超分子的两亲性碱基结构,它们是激活免疫系统的强效内毒素,其组分也是微生物相关分子模式和真核生物模式识别受体的免疫配体。而真核生物模式识别受体在与革兰阴性菌相互作用时控制炎症、细胞死亡和宿主免疫[84-85]。许多研究表明,TLR4受体复合物是如何感知LPS的,从而触发大多数革兰阴性细菌感染常见的促炎反应。高水平的LPS和TLR4激活可导致LPS毒性,并在脓毒性休克中发挥作用。对于研究OMVs刺激宿主产生的免疫反应,应首先确定LPS的作用。OMVs作为LPS递送载体,具有增强细菌清除或通过激活炎症反应引起宿主组织损伤的能力。LPS纯化后与OMVs结合不仅刺激先天免疫反应的能力不同,而且在宿主组织中分布和清除的能力也可能不同。纯化的LPS可能表现出更多的疏水性,更快地与适合的宿主膜结合。因此,OMVs得以深入滞留于吞噬细胞所在的组织,同样也可能导致OMVs更容易被组织吞噬细胞识别和清除。
另外,OMVs是细菌RNA的理想递送机制,可以保护其免受细胞外RNA酶的降解,在宿主体内充当远距离运输的载体,并将它们递送到宿主细胞中[72]。在这些RNA中,有些可以发挥与miRNA类似的功能,直接沉默靶宿主基因。放线菌OMVs中携带的RNA可通过人巨噬细胞中的TLR-8和NF-κB信号通路激活促炎细胞因子TNF-α[86]。
大多数研究通常只探讨OMVs对细菌感染的弊端,其实OMVs对细菌的感染是一把双刃剑,当细菌激活炎症小体后,这一途径似乎会对细菌的感染产生反作用[17]。大肠杆菌OMVs递送的LPS以鸟苷酸结合蛋白1(GBP1)依赖的方式激活非经典炎性体反应[87]。同样,铜绿假单胞菌OMVs激活依赖于caspase-11途径和caspase-5的非典型炎性反应。
4 小结与展望OMVs作为革兰阴性菌的一种独立分泌系统,发挥了多种生物功能,如QS、耐药基因转移,毒素和毒力因子的递送等。通过细菌-细菌和细菌-宿主之间相互作用,导致细菌性疾病更加难以防控,对养殖业每年造成不可估量的经济损失,对全球的生物公共卫生以及动物性产品留下巨大隐患,从而威胁着人类健康。因此,非常需要开发新的治疗药剂和方法。经过总结,T0SS与传统分泌系统相比,有很多优势:OMVs可以保护易降解的生物分子;转移一种以上能够发挥协同或互补作用的酶,将其递送到靶细胞上,即使其远离定植位点。此外,这种分泌系统可以向其他细菌输出定向毒素[11]。课题组前期研究发现野生型鼠伤寒沙门菌株外膜囊泡感染小鼠,可导致小鼠产生炎症反应及全身败血症并且最终发生死亡;利用基因工程鼠伤寒沙门菌株衍生的外膜囊泡免疫小鼠和雏鸡,可刺激动物机体产生良好的体液免疫应答反应[88]。所以,OMVs是一把双刃剑。除了增强细菌对宿主的致病力外,研究学者可通过利用其免疫原性、主动靶向性等特点研发相应的疫苗、佐剂等进行疾病的防治。目前,首例基于OMVs的脑膜炎奈瑟菌疫苗已被批准用于临床。利用重组DNA技术,以OMVs作为抗原或治疗分子的载体,构建和生产含有异源蛋白或配体的OMVs使用基因工程细菌。相信随着科学技术的发展,对于OMVs的研究层次将越来越深。
此外,虽然对OMVs的结构功能、分泌特性、致病机制以及应用方面的研究取得了很大进展,但尚有许多问题需要努力去探索和阐明。例如,该领域进展的障碍之一是缺乏分离和纯化OMVs的标准化方法,以及缺乏对细菌OMVs上存在的个体标志物的明确鉴定,因为受生长条件的影响,OMVs的组成和大小可能会发生剧烈变化;需要可靠的方法来追溯OMVs的起源母细胞,追溯到其母源细胞是很重要的,因为体内OMVs不是来自同种细胞群,而是由许多不同类型的细胞释放的。还需要去明确很多问题,起于源头,为什么细菌会产生囊泡,产生囊泡的好处是否大于成本?哪些胞膜因子导致外膜裂变和OMVs释放?什么信号和途径调节OMVs的生物发生?如何实现LPS依赖于可溶性内容物的富集和排除?哪些过程在不同的革兰阴性菌中是保守的?OMVs货物的包装选择机制是什么?未来有望对这些基本问题的解决,提高对OMVs更为复杂和多方面实体的独特能力的认识,更好地解决严重的细菌性疾病。
| [1] |
周舒扬, 张丕奇, 戴肖东, 等. 细菌外膜囊泡(OMV)研究进展[J]. 微生物学杂志, 2021, 41(6): 83-89. ZHOU S Y, ZHANG P Q, DAI X D, et al. Advances in bacterial Outer Membrane Vesicles (OMV)[J]. Journal of Microbiology, 2021, 41(6): 83-89. DOI:10.3969/j.issn.1005-7021.2021.06.011 (in Chinese) |
| [2] |
MACNAIR C R, TAN M W. The role of bacterial membrane vesicles in antibiotic resistance[J]. Ann New York Acad Sci, 2023, 1519: 63-73. DOI:10.1111/nyas.14932 |
| [3] |
LEE E Y, CHOI D Y, KIM D K, et al. Gram-positive bacteria produce membrane vesicles: proteomics-based characterization of Staphylococcus aureus-derived membrane vesicles[J]. Proteomics, 2009, 9(24): 5425-5436. DOI:10.1002/pmic.200900338 |
| [4] |
RIVERA J, CORDERO R J, NAKOUZI A S, et al. Bacillus anthracis produces membrane-derived vesicles containing biologically active toxins[J]. Proc Natl Acad Sci U S A, 2010, 107(44): 19002-19007. DOI:10.1073/pnas.1008843107 |
| [5] |
ELLIS T N, KUEHN M J. Virulence and immunomodulatory roles of bacterial outer membrane vesicles[J]. Microbiol Mol Biol Rev, 2010, 74(1): 81-94. DOI:10.1128/MMBR.00031-09 |
| [6] |
TOYOFUKU M, SCHILD S, KAPARAKIS-LIASKOS M, et al. Composition and functions of bacterial membrane vesicles[J]. Nat Rev Microbiol, 2023, 21(7): 415-430. DOI:10.1038/s41579-023-00875-5 |
| [7] |
KULP A, KUEHN M J. Biological functions and biogenesis of secreted bacterial outer membrane vesicles[J]. Ann Rev Microbiol, 2010, 64: 163-184. DOI:10.1146/annurev.micro.091208.073413 |
| [8] |
SCHWECHHEIMER C, KUEHN M J. Outer-membrane vesicles from Gram-negative bacteria: biogenesis and functions[J]. Nat Rev Microbiol, 2015, 13(10): 605-619. DOI:10.1038/nrmicro3525 |
| [9] |
TOYOFUKU M, NOMURA N, EBERL L. Types and origins of bacterial membrane vesicles[J]. Nat Rev Microbiol, 2019, 17(1): 13-24. DOI:10.1038/s41579-018-0112-2 |
| [10] |
COSTA T R D, FELISBERTO-RODRIGUES C, MEIR A, et al. Secretion systems in Gram-negative bacteria: structural and mechanistic insights[J]. Nat Rev Microbiol, 2015, 13(6): 343-359. DOI:10.1038/nrmicro3456 |
| [11] |
GUERRERO-MANDUJANO A, HERNÁNDEZ-CORTEZ C, IBARRA J A, et al. The outer membrane vesicles: Secretion system type zero[J]. Traffic, 2017, 18(7): 425-432. DOI:10.1111/tra.12488 |
| [12] |
THAY B, DAMM A, KUFER T A, et al. Aggregatibacter actinomycetemcomitans outer membrane vesicles are internalized in human host cells and trigger NOD1-and NOD2-dependent NF-κB activation[J]. Infect Immun, 2014, 82(10): 4034-4046. DOI:10.1128/IAI.01980-14 |
| [13] |
BISHOP D G, WORK E. An extracellular glycolipid produced by Escherichia coli grown under lysine-limiting conditions[J]. Biochem J, 1965, 96(2): 567-576. DOI:10.1042/bj0960567 |
| [14] |
QING G, GONG N Q, CHEN X H, et al. Natural and engineered bacterial outer membrane vesicles[J]. Biophys Rep, 2019, 5(4): 184-198. DOI:10.1007/s41048-019-00095-6 |
| [15] |
COMBO S, MENDES S, NIELSEN K M, et al. The discovery of the role of outer membrane vesicles against bacteria[J]. Biomedicines, 2022, 10(10): 2399. DOI:10.3390/biomedicines10102399 |
| [16] |
KIM J Y, SUH J W, KANG J S, et al. Gram-negative bacteria's outer membrane vesicles[J]. Infect Chemother, 2023, 55(1): 1-9. DOI:10.3947/ic.2022.0145 |
| [17] |
MCMILLAN H M, KUEHN M J. The extracellular vesicle generation paradox: a bacterial point of view[J]. EMBO J, 2021, 40(21): e108174. DOI:10.15252/embj.2021108174 |
| [18] |
FURUYAMA N, SIRCILI M P. Outer membrane vesicles (OMVs) produced by gram-negative bacteria: structure, functions, biogenesis, and vaccine application[J]. BioMed Res Int, 2021, 2021: 1490732. |
| [19] |
CHEN H Y, ZHOU M Y, ZENG Y T, et al. Recent advances in biomedical applications of bacterial outer membrane vesicles[J]. J Mater Chem B, 2022, 10(37): 7384-7396. DOI:10.1039/D2TB00683A |
| [20] |
BAUMGARTEN T, SPERLING S, SEIFERT J, et al. Membrane vesicle formation as a multiple-stress response mechanism enhances Pseudomonas putida DOT-T1E cell surface hydrophobicity and biofilm formation[J]. Appl Environ Microbiol, 2012, 78(17): 6217-6224. DOI:10.1128/AEM.01525-12 |
| [21] |
COLLINS S M, BROWN A C. Bacterial outer membrane vesicles as antibiotic delivery vehicles[J]. Front Immunol, 2021, 12: 733064. DOI:10.3389/fimmu.2021.733064 |
| [22] |
程谦, 吴疆, 王岱. 细菌外膜囊泡与抗生素相关的研究进展[J]. 中国抗生素杂志, 2019, 44(10): 1119-1124. CHENG Q, WU J, WANG D, et al. Advances in the relationship of bacterial outer-membrane vesicles and antibiotics[J]. Chinese Journal of Antibiotics, 2019, 44(10): 1119-1124. DOI:10.3969/j.issn.1001-8689.2019.10.001 (in Chinese) |
| [23] |
RUDNICKA M, NOSZCZYŃSKA M, MALICKA M, et al. Outer membrane vesicles as mediators of plant-bacterial interactions[J]. Front Microbiol, 2022, 13: 902181. DOI:10.3389/fmicb.2022.902181 |
| [24] |
TURNER L, BITTO N J, STEER D L, et al. Helicobacter pylori Outer membrane vesicle size determines their mechanisms of host cell entry and protein content[J]. Front Immunol, 2018, 9: 1466. DOI:10.3389/fimmu.2018.01466 |
| [25] |
JAN A T. Outer membrane vesicles (OMVs) of gram-negative bacteria: a perspective update[J]. Front Microbiol, 2017, 8: 1053. DOI:10.3389/fmicb.2017.01053 |
| [26] |
WAI S N, LINDMARK B, SÖDERBLOM T, et al. Vesicle-mediated export and assembly of pore-forming oligomers of the enterobacterial ClyA cytotoxin[J]. Cell, 2003, 115(1): 25-35. DOI:10.1016/S0092-8674(03)00754-2 |
| [27] |
FERRARI G, GARAGUSO I, ADU-BOBIE J, et al. Outer membrane vesicles from group B Neisseria meningitidis Δgna33 mutant: proteomic and immunological comparison with detergent-derived outer membrane vesicles[J]. Proteomics, 2006, 6(6): 1856-1866. DOI:10.1002/pmic.200500164 |
| [28] |
BEHRENS F, FUNK-HILSDORF T C, KUEBLER W M, et al. Bacterial membrane vesicles in pneumonia: from mediators of virulence to innovative vaccine candidates[J]. IntJ Mol Sci, 2021, 22(8): 3858. DOI:10.3390/ijms22083858 |
| [29] |
JUODEIKIS R, CARDING S R. Outer membrane vesicles: biogenesis, functions, and issues[J]. Microbiol Mol Biol Rev, 2022, 86(4): e00032-22. |
| [30] |
ZINGL F G, KOHL P, CAKAR F, et al. Outer membrane vesiculation facilitates surface exchange and in vivo adaptation of vibrio cholerae[J]. Cell Host Microbe, 2020, 27(2): 225-237. DOI:10.1016/j.chom.2019.12.002 |
| [31] |
ZINGL F G, THAPA H B, SCHARF M, et al. Outer membrane vesicles of Vibrio cholerae protect and deliver active cholera toxin to host cells via porin-dependent uptake[J]. mBio, 2021, 12(3): e0053421. DOI:10.1128/mBio.00534-21 |
| [32] |
NEVOT M, DERONCELÉ V, MESSNER P, et al. Characterization of outer membrane vesicles released by the psychrotolerant bacterium Pseudoalteromonas antarctica NF3[J]. Environ Microbiol, 2006, 8(9): 1523-1533. DOI:10.1111/j.1462-2920.2006.01043.x |
| [33] |
DELL'ANNUNZIATA F, FOLLIERO V, GIUGLIANO R, et al. Gene transfer potential of outer membrane vesicles of gram-negative bacteria[J]. Int J Mol Sci, 2021, 22(11): 5985. DOI:10.3390/ijms22115985 |
| [34] |
JARZAB M, POSSELT G, MEISNER-KOBER N, et al. Helicobacter pylori-derived outer membrane vesicles (OMVs): role in bacterial pathogenesis?[J]. Microorganisms, 2020, 8(9): 1328. DOI:10.3390/microorganisms8091328 |
| [35] |
陈桥桥, 涂仕娟, 夏修文, 等. 细菌外膜囊泡发生机制的研究进展[J]. 泰山医学院学报, 2019, 40(12): 980-982. CHEN Q Q, TU S J, XIA X W, et al. Research progress on the mechanism of bacterial outer membrane vesicles[J]. Journal of Mount Taishan Medical College, 2019, 40(12): 980-982. (in Chinese) |
| [36] |
AVILA-CALDERÓN E D, RUIZ-PALMA M D S, AGUILERA-ARREOLA M G, et al. Outer membrane vesicles of gram-negative bacteria: an outlook on biogenesis[J]. Front Microbiol, 2021, 12: 557902. DOI:10.3389/fmicb.2021.557902 |
| [37] |
RENELLI M, MATIAS V, LO R Y, et al. DNA-containing membrane vesicles of Pseudomonas aeruginosa PAO1 and their genetic transformation potential[J]. Microbiology, 2004, 150(Pt 7): 2161-2169. |
| [38] |
BAQUERO F. Environmental stress and evolvability in microbial systems[J]. Clinical Microbiology and Infection, 2009, 15(Suppl 1): 5-10. |
| [39] |
TOUSSAINT A, CHANDLER M. Prokaryote genome fluidity: toward a system approach of the mobilome[M]//HELDEN J, TOUSSAINT A, THIEFFRY D. Bacterial Molecular Networks. New York: Springer, 2012: 57-80.
|
| [40] |
LI M, ZHOU H, YANG C, et al. Bacterial outer membrane vesicles as a platform for biomedical applications: An update[J]. J Control Release, 2020, 323: 253-268. DOI:10.1016/j.jconrel.2020.04.031 |
| [41] |
BEGIĆ M, JOSI Ć D. Biofilm formation and extracellular microvesicles-The way of foodborne pathogens toward resistance[J]. Electrophoresis, 2020, 41(20): 1718-1739. DOI:10.1002/elps.202000106 |
| [42] |
HUANG Y K, NIEH M P, CHEN W, et al. Outer membrane vesicles (OMVs) enabled bio-applications: A critical review[J]. Biotechnol Bioeng, 2022, 119(1): 34-47. DOI:10.1002/bit.27965 |
| [43] |
MCBROOM A J, KUEHN M J. Release of outer membrane vesicles by Gram-negative bacteria is a novel envelope stress response[J]. Mol Microbiol, 2007, 63(2): 545-558. DOI:10.1111/j.1365-2958.2006.05522.x |
| [44] |
SABRA W, LVNSDORF H, ZENG A P. Alterations in the formation of lipopolysaccharide and membrane vesicles on the surface of Pseudomonas aeruginosa PAO1 under oxygen stress conditions[J]. Microbiology (Reading), 2003, 149(Pt 10): 2789-2795. |
| [45] |
KUEHN M J, KESTY N C. Bacterial outer membrane vesicles and the host-pathogen interaction[J]. Genes Dev, 2005, 19(22): 2645-2655. DOI:10.1101/gad.1299905 |
| [46] |
MANNING A J, KUEHN M J. Contribution of bacterial outer membrane vesicles to innate bacterial defense[J]. BMC Microbiol, 2011, 11: 258. DOI:10.1186/1471-2180-11-258 |
| [47] |
HOSSEINI-GIV N, BASAS A, HICKS C, et al. Bacterial extracellular vesicles and their novel therapeutic applications in health and cancer[J]. Front Cell Infect Microbiol, 2022, 12: 962216. DOI:10.3389/fcimb.2022.962216 |
| [48] |
MASHBURN-WARREN L M, WHITELEY M. Special delivery: vesicle trafficking in prokaryotes[J]. Mol Microbiol, 2006, 61(4): 839-846. DOI:10.1111/j.1365-2958.2006.05272.x |
| [49] |
DORWARD D W, GARON C F, JUDD R C. Export and intercellular transfer of DNA via membrane blebs of Neisseria gonorrhoeae[J]. J Bacteriol, 1989, 171(5): 2499-2505. DOI:10.1128/jb.171.5.2499-2505.1989 |
| [50] |
SJöSTRöM A E, SANDBLAD L, UHLIN B E, et al. Membrane vesicle-mediated release of bacterial RNA[J]. Sci Rep, 2015, 5: 15329. DOI:10.1038/srep15329 |
| [51] |
CHEN J W, ZHANG H F, WANG S Q, et al. Inhibitors of bacterial extracellular vesicles[J]. Front Microbiol, 2022, 13: 835058. DOI:10.3389/fmicb.2022.835058 |
| [52] |
MICOLI F, MACLENNAN C A. Outer membrane vesicle vaccines[J]. Seminars Immunol, 2020, 50: 101433. DOI:10.1016/j.smim.2020.101433 |
| [53] |
MIRZAEI R, MOHAMMADZADEH R, ALIKHANI M Y, et al. The biofilm-associated bacterial infections unrelated to indwelling devices[J]. IUBMB life, 2020, 72(7): 1271-1285. DOI:10.1002/iub.2266 |
| [54] |
YONEZAWA H, OSAKI T, WOO T, et al. Analysis of outer membrane vesicle protein involved in biofilm formation of Helicobacter pylori[J]. Anaerobe, 2011, 17(6): 388-390. DOI:10.1016/j.anaerobe.2011.03.020 |
| [55] |
DEO P, CHOW S H, HAY I D, et al. Outer membrane vesicles from Neisseria gonorrhoeae target PorB to mitochondria and induce apoptosis[J]. PLoS Pathog, 2018, 14(3): e1006945. DOI:10.1371/journal.ppat.1006945 |
| [56] |
DAVID L, TAIEB F, PÉNARY M, et al. Outer membrane vesicles produced by pathogenic strains of Escherichia coli block autophagic flux and exacerbate inflammasome activation[J]. Autophagy, 2022, 18(12): 2913-2925. DOI:10.1080/15548627.2022.2054040 |
| [57] |
LIEBERMAN L A. Outer membrane vesicles: A bacterial-derived vaccination system[J]. Front Microbiol, 2022, 13: 1029146. DOI:10.3389/fmicb.2022.1029146 |
| [58] |
WEYANT K B, OLOYEDE A, PAL S, et al. A modular vaccine platform enabled by decoration of bacterial outer membrane vesicles with biotinylated antigens[J]. Nat Commun, 2023, 14(1): 464. DOI:10.1038/s41467-023-36101-2 |
| [59] |
张蒙蒙, 王桂琴, 徐飞. 革兰阴性菌外膜囊泡及其作用机制的研究进展[J]. 中国兽医科学, 2021, 51(9): 1182-1189. ZHANG M M, WANG G Q, XU F. Research progress on outer membrane vesicles of gram-negative and its mechanism[J]. Chinese Veterinary Science, 2021, 51(9): 1182-1189. (in Chinese) |
| [60] |
JALALIFAR S, MOROVATI KHAMSI H, HOSSEINI-FARD S R, et al. Emerging role of microbiota derived outer membrane vesicles to preventive, therapeutic and diagnostic proposes[J]. Infect Agents Cancer, 2023, 18(1): 3. DOI:10.1186/s13027-023-00480-4 |
| [61] |
TASHIRO Y, YAWATA Y, TOYOFUKU M, et al. Interspecies interaction between Pseudomonas aeruginosa and other microorganisms[J]. Microbes Environ, 2013, 28(1): 13-24. DOI:10.1264/jsme2.ME12167 |
| [62] |
BALHUIZEN M D, VELDHUIZEN E J A, HAAGSMAN H P. Outer membrane vesicle induction and isolation for vaccine development[J]. Front Microbiol, 2021, 12: 629090. DOI:10.3389/fmicb.2021.629090 |
| [63] |
RICE K C, BAYLES K W. Molecular control of bacterial death and lysis[J]. Microbiol Mol Biol Rev, 2008, 72(1): 85-109. DOI:10.1128/MMBR.00030-07 |
| [64] |
KAPARAKIS-LIASKOS M, FERRERO R L. Immune modulation by bacterial outer membrane vesicles[J]. Nat Rev Immunol, 2015, 15(6): 375-387. DOI:10.1038/nri3837 |
| [65] |
JAHROMI L P, FUHRMANN G. Bacterial extracellular vesicles: Understanding biology promotes applications as nanopharmaceuticals[J]. Adv Drug Deliv Rev, 2021, 173: 125-140. DOI:10.1016/j.addr.2021.03.012 |
| [66] |
ROSSI O, CITIULO F, MANCINI F. Outer membrane vesicles: moving within the intricate labyrinth of assays that can predict risks of reactogenicity in humans[J]. Human Vacc Immunotherapeut, 2021, 17(2): 601-613. DOI:10.1080/21645515.2020.1780092 |
| [67] |
GILMORE W J, JOHNSTON E L, ZAVAN L, et al. Immunomodulatory roles and novel applications of bacterial membrane vesicles[J]. Mol Immunol, 2021, 134: 72-85. DOI:10.1016/j.molimm.2021.02.027 |
| [68] |
SPENCER N, YERUVA L. Role of bacterial infections in extracellular vesicles release and impact on immune response[J]. Biomed J, 2021, 44(2): 157-164. DOI:10.1016/j.bj.2020.05.006 |
| [69] |
LIANG X, DAI N N, SHENG K L, et al. Gut bacterial extracellular vesicles: important players in regulating intestinal microenvironment[J]. Gut Microbes, 2022, 14(1): 2134689. DOI:10.1080/19490976.2022.2134689 |
| [70] |
WANG S M, GUO J Y, BAI Y, et al. Bacterial outer membrane vesicles as a candidate tumor vaccine platform[J]. Front Immunol, 2022, 13: 987419. DOI:10.3389/fimmu.2022.987419 |
| [71] |
DHITAL S, DEO P, STUART I, et al. Bacterial outer membrane vesicles and host cell death signaling[J]. Trends Microbiol, 2021, 29(12): 1106-1116. DOI:10.1016/j.tim.2021.04.003 |
| [72] |
CARUANA J C, WALPER S A. Bacterial membrane vesicles as mediators of microbe-microbe and microbe-host community interactions[J]. Front Microbiol, 2020, 11: 432. DOI:10.3389/fmicb.2020.00432 |
| [73] |
SARTORIO M G, PARDUE E J, FELDMAN M F, et al. Bacterial outer membrane vesicles: from discovery to applications[J]. Ann Rev Microbiol, 2021, 75: 609-630. DOI:10.1146/annurev-micro-052821-031444 |
| [74] |
ROSALES-REYES R, PÉREZ-LÓPEZ A, SÁNCHEZ-GÓMEZ C, et al. Salmonella infects B cells by macropinocytosis and formation of spacious phagosomes but does not induce pyroptosis in favor of its survival[J]. Microb Pathogen, 2012, 52(6): 367-374. DOI:10.1016/j.micpath.2012.03.007 |
| [75] |
CZUCZMAN M A, FATTOUH R, VAN RIJN J M, et al. Listeria monocytogenes exploits efferocytosis to promote cell-to-cell spread[J]. Nature, 2014, 509(7499): 230-234. DOI:10.1038/nature13168 |
| [76] |
AMANO A, TAKEUCHI H, FURUTA N. Outer membrane vesicles function as offensive weapons in host-parasite interactions[J]. Microbes Infect, 2010, 12(11): 791-798. DOI:10.1016/j.micinf.2010.05.008 |
| [77] |
姚鹏程, 叶恭银. 网格蛋白介导的内吞作用机制[J]. 生命科学研究, 2003, 7(S1): 22-25, 69. YAO P C, YE G Y. The mechanism of clathrin-mediated endocytosis[J]. Life Science Research, 2003, 7(S1): 22-25, 69. (in Chinese) |
| [78] |
O'DONOGHUE E J, KRACHLER A M. Mechanisms of outer membrane vesicle entry into host cells[J]. Cell Microbiol, 2016, 18(11): 1508-1517. DOI:10.1111/cmi.12655 |
| [79] |
MULCAHY L A, PINK R C, CARTER D R. Routes and mechanisms of extracellular vesicle uptake[J]. J Extracell Vesicles, 2014, 3(1): 24641. DOI:10.3402/jev.v3.24641 |
| [80] |
DEMUTH D R, JAMES D, KOWASHI Y, et al. Interaction of Actinobacillus actinomycetemcomitans outer membrane vesicles with HL60 cells does not require leukotoxin[J]. Cell Microbiol, 2003, 5(2): 111-121. DOI:10.1046/j.1462-5822.2003.00259.x |
| [81] |
GALKA F, WAI S N, KUSCH H, et al. Proteomic characterization of the whole secretome of Legionella pneumophila and functional analysis of outer membrane vesicles[J]. Infect Immun, 2008, 76(5): 1825-1836. DOI:10.1128/IAI.01396-07 |
| [82] |
PALOMINO R A Ñ, VANPOUILLE C, COSTANTINI P E, et al. Microbiota-host communications: bacterial extracellular vesicles as a common language[J]. PLoS Pathog, 2021, 17(5): e1009508. DOI:10.1371/journal.ppat.1009508 |
| [83] |
DEHINWAL R, COOLEY D, RAKOV A V, et al. Increased production of outer membrane vesicles by Salmonella interferes with complement-mediated innate immune attack[J]. mBio, 2021, 12(3): e0086921. DOI:10.1128/mBio.00869-21 |
| [84] |
GIORDANO N P, CIAN M B, DALEBROUX Z D. Outer membrane lipid secretion and the innate immune response to gram-negative bacteria[J]. Infect Immun, 2020, 88(7): e00920-19. |
| [85] |
SIMPSON B W, TRENT M S. Pushing the envelope: LPS modifications and their consequences[J]. Nat Rev Microbiol, 2019, 17(7): 403-416. DOI:10.1038/s41579-019-0201-x |
| [86] |
CHOI J, KIM Y K, HAN P L. Extracellular vesicles derived from Lactobacillus plantarum Increase BDNF expression in cultured hippocampal neurons and produce antidepressant-like effects in mice[J]. Exp Neurobiol, 2019, 28(2): 158-171. DOI:10.5607/en.2019.28.2.158 |
| [87] |
FINETHY R, DOCKTERMAN J, KUTSCH M, et al. Dynamin-related irgm proteins modulate LPS-induced caspase-11 activation and septic shock[J]. EMBO Rep, 2020, 21(11): e50830. DOI:10.15252/embr.202050830 |
| [88] |
尚珂. 家禽中多重耐药性沙门菌的传播和外膜囊泡疫苗的评价[D]. 全州: 全北国立大学, 2021. (in English) SHANG K. Transmission of multidrug-resistant (MDR) Salmonella Enterica and evaluation of outer membrane vesicle (OMV) vaccines in poultry[D]. Jeonju: Jeonbuk National University, 2021. |
(编辑 白永平)



