伪结核棒状杆菌(Corynebacterium pseudotuberculosis,Cp)为一种革兰阳性的兼性细胞内寄生菌,可感染多种动物和人并引起慢性炎症性疾病,如马溃疡性淋巴管炎、羊干酪样淋巴结炎(caseous lymphadenitis,CLA)、牛乳腺炎和人坏死性淋巴结炎等[1],其中以Cp感染羊引起的CLA最为常见。Cp感染山羊可造成多个方面的危害,包括降低生产性能、引起繁殖障碍、在羊体表及内脏器官形成脓肿而影响销售,以及Cp通过乳汁排出对食用羊奶的人群具有潜在危害等[2]。此外,因为Cp对外界环境的抵抗力强,且感染病程长,发病过程缓慢,一旦在羊场感染,则很难清除,是世界公认的难以防治的传染病之一[1-2]。羊CLA呈全世界分布,广泛流行,据世界动物卫生组织(OIE)统计,全球至少有64个国家确认有该病存在[3]。本病在意大利羊群中的血清阳性率为21.85%[4],巴西东北地区为30.3%[5],韩国为57.3%[6]。近年来,我国关于Cp感染山羊的报道日益增多,陕西[7]、四川[8]、重庆[9]、云南[10]、福建[11]等多个省市均有该病原感染的报道,其从脓肿样本中的分离率为39.22%~100.00%。本文通过对所采集的山羊体表淋巴结脓肿病料进行Cp分离及病原特性研究,以明确重庆和贵州发病羊场Cp感染情况,为该病原防治提供参考。
1 材料与方法 1.1 主要试剂及小鼠营养琼脂购自AOBOX公司;细菌微量生化鉴定管购自青岛海博生物技术有限公司;Premix Taq购自TaKaRa公司;核酸染料购自SBS赛百盛公司;药敏纸片购自杭州微生物试剂有限公司;脑心浸出液(BHI)肉汤、萘啶酸、磷霉素钠购自Solarbio公司。昆明系小鼠购自重庆莱彼特生物科技有限公司。
1.2 引物设计参考伪结核棒状杆菌的cp40基因序列(OL347 712.1)设计检测引物:上游引物SF: 5′-ATGCATAATTCTCCTCHATCAGTC-3′,下游引物SR: 5′-TTATCTAGAACCAGTTGGCTTTCC-3′, 扩增片段为1 140 bp。其余基因,包括编码延伸因子(fusA)、磷脂酶D(pld)、铁摄取和调节相关毒力(因子FagA和FagB)、细菌σ因子(SigE)、小菌毛蛋白(SpaC)、锌依赖的超氧化物歧化酶(SodC)、蛋白激酶G(PknG)、神经氨酸酶(NanH)和寡肽透过酶(OppB、OppD、OppF)的检测引物均按文献设计[9],由上海百力格生物技术服务有限公司合成。
1.3 病料采集方法对重庆市3个羊场(江津区、涪陵区和秀山县各1个),以及贵州省独山县1个羊场患脓肿的山羊采样,首先对脓肿部位皮肤用碘伏消毒,进而以无菌手术刀片切开皮肤,挤出脓汁或干酪样物质,收集于灭菌离心管中,低温送至实验室,进行病原分离培养。
1.4 细菌分离鉴定将脓肿样本接种在含5%兔血琼脂平板上,37 ℃培养48 h。将疑似Cp的菌落接种在BHI液体培养基(磷霉素浓度为200 μg·mL-1,萘啶酸浓度为4 μg·mL-1)中震荡培养24 h,再次进行三区划线纯化。将分离菌接种生化试验管进行葡萄糖、木糖、甘露醇、麦芽糖、甲基红、氧化酶和硝酸盐还原的生化试验。勾取单菌落至肉汤中培养,以该菌液作为模板,以Cp的fusA基因特异性引物进行PCR扩增鉴定是否为Cp[9]。
1.5 细菌致病性试验将15只昆明系小鼠随机分成5组,每组3只,体重为24~28 g。每个区县随机选择1株Cp(XS2、JJS-4、GZ-5和FL-2-5)在血平板划线培养,挑取单菌落至1 mL BHI肉汤中培养24 h,按每只小鼠腹腔注射0.2 mL菌液(含1.25×107CFU),对照组注射等量生理盐水,观察小鼠发病及死亡情况。
1.6 毒力基因PCR检测以ATCC19410为对照,采用菌液PCR方法检测Cp毒力基因,针对每个毒力基因的PCR反应体系:Premix Taq 12.5 μL,毒力基因上、下游引物各1.0 μL,培养Cp菌液2.0 μL,ddH2O 8.5 μL,总体积25.0 μL。反应条件:94 ℃ 5 min;94 ℃ 40 s,60 ℃ 40 s,72 ℃ 40 s,共30个循环;72 ℃ 2 min。最后对PCR产物用1%的琼脂糖电泳检测。
1.7 药物敏感性试验及耐药基因检测分别吸取培养至1.5×108 CFU·mL-1的Cp菌液200 μL,均匀涂布于血琼脂平板上,将药敏纸片置于培养基的适当位置,37 ℃培养48 h,测量并记录抑菌圈大小,参考美国临床标准CLSI判定药敏结果。采用NCBI′s AMRFinderPlus进行Cp全基因组的耐药基因分析,发现在Cp菌中主要有2种耐药基因:氨基糖苷O-磷酸转移酶APH(3′)-IIa(aph(3′)-IIa)和广谱A类β内酰胺酶TEM-116(blaTEM-116)。设计aph(3′)-IIa和blaTEM-116特异性引物(aph3-F: 5′-GGAAGGGACTGGCTGCTA-3′和aph3-R: 5′-GCGCGCCTTGAGCCTGGC-3′, 预计扩增片段270 bp;blaTEM116-F:5′-ATCGGAGGACCGAAGGAG-3′和blaTEM116-R:5′-TTTATCAGC-AATAAACCA-3′; 预计扩增片段279 bp),检测所分离菌株中耐药基因携带水平。
1.8 细菌fusA测序及序列分析将fusA的PCR扩增产物送至擎科生物公司进行双向测序,拼接序列后提交至GenBank。分析所获得Cp fusA序列的相似度,每个羊场选择一株菌fusA序列,同时在NCBI上选取国内外源自山羊、绵羊、马、水牛等宿主且已经有明确生物型信息的Cp fusA序列,羊生物型(biotype ovis)包括CP001809、NC_017301、CP01079、NC_017301、NZ_CP012695、NZ_CP015100和NZ_MDWN01000001,马生物型(biotype equi)包括CP003082、CP012022、NC_017307、NC_017730和NC_017945,以及溃疡棒状杆菌(C. ulcerans)、白喉棒状杆菌(C. diphtheriae)的fusA序列,用DNAstar Lasergene 7.1.0进行相似度分析,以结核分支杆菌(Mycobacterium tuberculosis)的fusA序列为外群,用Clustal X 1.83程序进行序列对位排序,利用MEGA 4.0构建系统进化树。
2 结果 2.1 Cp分离鉴定从重庆市江津区、涪陵区和秀山县,以及贵州省独山县发病山羊中共采集40份脓肿样本,获得23分离菌(重庆江津、涪陵、秀山和贵州独山县所各分离获得11、1、10和1株菌),分离率为57.5%。分离菌在血琼脂培养基上培养后出现1 mm大小,白色、不透明、干燥的菌落,接种环易将其在平板上推动,大部分菌株在血琼脂培养基出现β型溶血环。革兰染色镜检可见呈蓝紫色、球杆状细菌。选择部分菌株进行生化试验,结果显示葡萄糖、麦芽糖和甲基红试验结果为阳性,而木糖、甘露醇、氧化酶和硝酸盐还原试验结果为阴性,其结果符合《伯杰氏细菌鉴定手册》中Cp的生化特征。经Cp的fusA特异性引物PCR检测,所有分离菌均检测到fusA基因(图 1)。综上,23株分离菌经鉴定为Cp。

|
M. 2000bp DNA相对分子质量标准;1. ATCC19410;2. FL-2-5; 3. GZ-5; 4~13. XS1、2、3、5、6、8、9、10、11、14;14~24. JJS-2、3、4、5、6、7、8、9、14、15、16;黑色箭头指fusA基因 M. 2000 bp DNA marker; 1. ATCC19410;2. FL-2-5; 3. GZ-5; 4-13. XS1, 2, 3, 5, 6, 8, 9, 10, 11, 14;14-24. JJS-2, 3, 4, 5, 6, 7, 8, 9, 14, 15, 16; The black arrow refers to the fusA gene 图 1 山羊Cp分离菌fusA检测结果 Fig. 1 Identification results of Cp isolates |
对23株Cp菌株毒力基因PCR检测显示,所分离的Cp中均携带pld、FagA、FagB、SigE、SpaC、SodC、PknG、NanH、OppB、OppD、OppF和cp40基因。
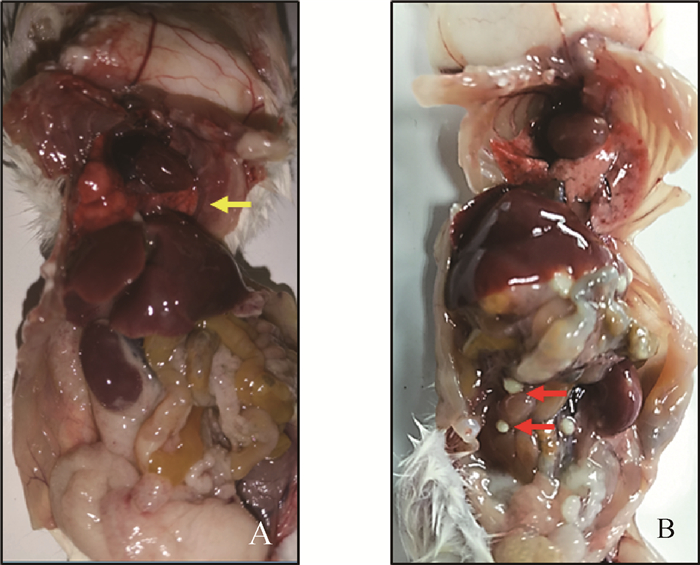
2.3 对小鼠的致病性分析致病性分析显示,不同地区的伪结核棒状杆菌分离株对小白鼠致病情况不一致,其攻毒后死亡时间为40~138 h,其中秀山分离株(XS-2)致病力最强,在48 h内全部死亡,其次为江津分离株(JJS-4)和贵州分离株(GZ-5),所有小鼠均在64 h内死亡,最后为涪陵分离株(FL-2-5),攻毒小鼠在138 h内死亡。攻毒后小鼠表现为精神不振、被毛粗乱、扎堆、饮欲食欲减退和活动减少等。剖检发现,死亡时间在48 h内通常表现为脏器的出血肿胀,而死亡时间超过48 h的小鼠通常可见脏器多有脓肿(图 2)。
|
A. Cp感染40 h死亡小鼠的肺有出血(黄色箭头);B. Cp感染138 h死亡小鼠肠壁上有脓肿(红色箭头) A. Lung bleeding of mice died 40 h after Cp infection (yellow arrow); B. Abscesses on the intestinal wall of mice died 138 h after Cp infection (red arrow) 图 2 Cp分离株感染小鼠病变结果 Fig. 2 Results of pathological changes in mice infected with Cp isolates |
药敏试验显示,不同地区分离的Cp其敏感性药物不完全一致。整体上,所分离Cp对头孢拉定、丁胺卡那和多西环素敏感率最高,达95.65%(22/23),其次为青霉素、氨苄西林、四环素、万古霉素和环丙沙星,敏感率为91.30%(21/23),但对呋喃唑酮100%耐药,对新霉素和卡那霉素耐药率为82.61%(19/23),对庆大霉素的耐药率为69.57%(表 1)。耐药基因检测发现,所分离Cp菌株中aph(3′)-IIa和blaTEM-116携带率分别为0和4.35%(1/23)。对应药敏试验结果,发现检出blaTEM-116的Cp对β内酰胺类抗生素青霉素和氨苄西林具有耐药性。
|
|
表 1 Cp的药敏试验结果 Table 1 Results of the antimicrobial susceptibility tests for C. pseudotuberculosis |
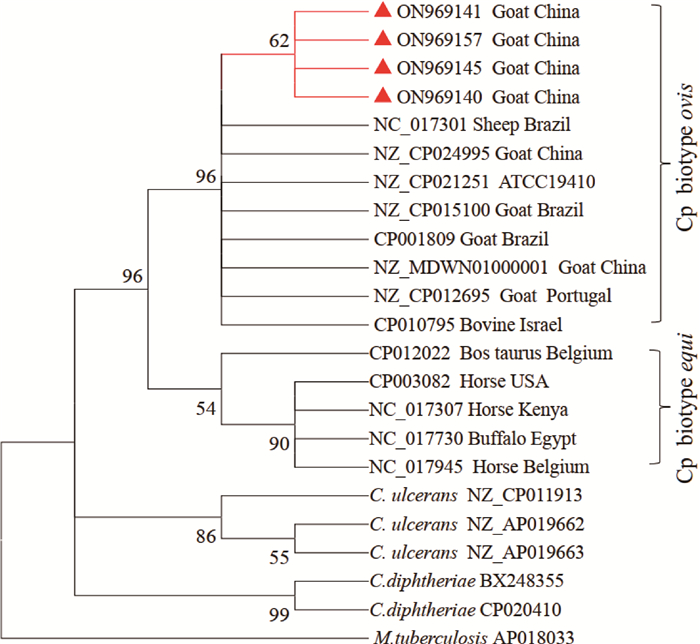
将23株Cp的fusA基因PCR扩增产物进行测序并提交GenBank,获得登录号:ON969140~ON969162。相似度分析显示,除JJS-8 (ON969141)与其他Cp的相似度为99.9%,所获得Cp的fusA序列间相似度为100%。因此每个场选择1株Cp的fusA序列进一步分析,发现本次获得Cp与羊生物型Cp(biotype ovis)的fusA序列相似度为99.8%~99.9%,与马生物型Cp(biotype equi)相似度为98.9%~99.2%,与溃疡棒状杆菌(C. ulcerans)相似度为94.0~94.3%,与白喉棒状杆菌(C. diphtheriae)相似度为91.5%~91.7%。多序列比对显示,羊生物型和马生物型Cp的fusA差异位点主要在924 bp(羊A/马C)、927 bp(羊C/马T)、972 bp(羊G/马A)、1 113 bp(羊C/马G)、1 149 bp(羊C/马T)、1230 bp(羊T/马G),而与其他羊生物型Cp相比,本次分离Cp的fusA基因序列差异点主要位于第1 389 bp处,所获得的序列该位点碱基为T,而其余Cp在该位点为C。氨基酸编码分析显示,仅在第371位氨基酸有差异,羊生物型为天冬氨酸(D),而马生物型为谷氨酸(E)。基于fusA的系统进化分析显示,除去外群,棒状杆菌共分为四个分支,分别为Cp羊生物型(biotype ovis)、Cp马生物型(biotype equi)、溃疡棒状杆菌(C. ulcerans)和白喉棒状杆菌(C. diphtheriae),本研究所分离Cp聚类到Cp羊生物型(biotype ovis),提示所分离获得的Cp生物型为羊型(图 3)。
|
枝上数字为Bootstrap 1 000次重复抽样百分比,三角形表示本研究获得的Cp fusA基因序列 The numbers on the branches representing the bootstrap values of 1 000 samples, and the triangle representing the fusA gene sequences of Cp obtained in this study 图 3 基于Cp fusA的系统进化树构建结果 Fig. 3 Result of system evolution tree constructed based on fusA of Cp |
Cp是引起绵羊、山羊等反刍动物脓肿病的主要病原之一,在众多诊断该病原感染的方法中,从脓肿样本中分离出伪结核棒状杆菌是最直接和最可靠的方法。本研究采用分离菌的菌落特征、染色特点并结合其延伸因子编码基因fusA的特异性引物进行PCR鉴定。发现所采集的山羊体表脓肿样本中Cp的分离率为57.5%(23/40),高于我国西南地区(39.22%,40/102)[9],以及墨西哥(35.63%,57/160)[12]、印度拉吉斯坦(51.9%,14/27)[13]报道的该病原分离率,而低于四川(65%,13/20)[8]、陕西(100%,9/9)[7]、埃及(90.07%,254/282)[14]报道的Cp分离率。致病力检测表明,所分离的Cp具有较强的致病力。以上结果表明,Cp仍然是重庆和贵州部分羊场引发山羊体表脓肿的重要病原,急需引起当地养殖户和相关部门的重视。
本研究发现91.30%以上的Cp对头孢拉定、青霉素和环丙沙星等多种抗生素敏感,但有82.61%的Cp对卡那霉素和新霉素耐药,69.57%的菌株对庆大霉素有耐药性。关于Cp药物敏结果的报道差异较大,如魏宇辰等[7]报道Cp对庆大霉素、环丙沙星敏感率达100%,但对青霉素耐药或中度敏感。徐志豪等[8]报道,Cp对庆大霉素和青霉素的耐药率分别达90.00%和95.00%,说明不同地区分离的Cp药物敏感性差异较大。本次分离的Cp对卡那霉素和庆大霉素的耐药率,远高于本实验室前期研究结果(10.53%的Cp对卡那霉素耐药,7.89%的Cp对庆大霉素耐药),提示即使在相近地区,不同养殖场中分离的Cp对抗生素的敏感性也有较大差异,这可能与不同羊场用药习惯有关。此外,本研究发现所有的Cp分离株对呋喃唑酮完全耐药,这与Li等[9]报道类似,深入发掘研究该病原对呋喃唑酮耐药的基因将有利于该病原的防治。关于Cp耐药基因相关研究极少,TEM是超广谱β内酰胺酶(ESBLs)主要的耐药基因型[15],其中TEM-116由Jeong等[16]首次在大肠杆菌和肺炎克雷伯菌临床分离株中检测到,本文在国内首次从Cp临床分离株中检测出blaTEM-116,且该菌对β内酰胺类抗生素青霉素和氨苄西林具有耐药性,提示该基因的存在可能与Cp菌株对β内酰胺类抗生素耐药有关。IIa型氨基糖苷类3′-O-磷酸转移酶(APH(3′)-IIa)是一种常见的细菌抗氨基糖苷类抗生素的酶[17],主要存在于革兰阳性菌中,虽然本研究发现Cp对氨基糖苷类的卡那霉素和庆大霉素耐药率较高,但并未检测出aph(3′)-IIa耐药基因,其原因是否与Cp中可能存在其他类别的氨基糖苷类耐药基因有待进一步研究。
毒力基因的PCR检测结果表明,所有分离菌株中均携带有pld、FagA、FagB、OppB、OppD、OppF、SodC、SpaC、pknG、NanH、sigE、cp40这些毒力或假定毒力基因,与Li等[9]的研究结果相似。而Guerrero等[12]报道在98.2%的菌株中检测到FagB基因,Aquino等[18]研究显示FagC的检出率为99.40%,FagD的检出率为95.23%,表明不同地区的Cp分离菌株毒力基因携带情况不完全一致。此外,本研究表明,即使是具有相似的毒力基因谱,其致病力也不完全相同,其原因是否与这些菌株携带了其他不同的毒力基因,或同种毒力基因的表达水平不同有关尚待进一步研究。
根据硝酸盐还原酶试验结果将Cp分为两个生物型,其中分离自马和牛的Cp通常为马生物型(biotype equi,硝酸盐还原阳性),而分离自绵羊和山羊的Cp为羊生物型(biotype ovis,硝酸盐还原阴性)[19],本研究生化试验显示所检测菌株硝酸盐还原试验为阴性,说明分离菌为羊生物型。研究发现延长因子P(elongation factor P)编码基因(fusA)表达稳定,可作为定量分析Cp基因表达的内参[20]。此外,基于Cp管家基因fusA单独或联合其他管家基因dnaK、infB、groeL1和leuA的进化分析,有助于了解Cp的分子特征[9, 21]。Li等[9]构建了基于fusA和16S rRNA的Cp系统进化树,发现利用fusA而不是16S rRNA,可以有效将Cp羊生物型和马生物型区分开,本文与Li等的研究结果一致,结合所分离的Cp硝酸盐还原试验阴性的结果,说明所分离的Cp均为羊生物型(biotype ovis)菌株。此外,本文进一步比对了羊生物型和马生物型fusA基因序列及编码氨基酸的差异,发现其碱基差异位点主要在第924、927、972、1 113、1 149和1 230 bp处,而氨基酸序列仅在第371位点有差异,提示虽然羊生物型和马生物型Cp的核苷酸差异位点较多,但对其编码蛋白功能可能影响不大,这些不同位点碱基改变与Cp出现羊生物型和马生物型分化的关系及具体机制还有待进一步研究。综上,本研究明确了引起重庆和贵州部分羊场发生体表淋巴结脓肿的Cp病原特点,为防控该病提供了参考资料。
4 结论伪结核棒状杆菌是引起重庆和贵州部分羊场发生体表淋巴结脓肿的主要病原,本研究明确其部分生物学特性,为防控该病原提供了参考资料。
| [1] |
TAN J M, YI W Y, WANG Z Y, et al. TRIM21 negatively regulates Corynebacterium pseudotuberculosis-induced inflammation and is critical for the survival of C. pseudotuberculosis infected C57BL6 mice[J]. Vet Microbiol, 2021, 261: 109209. DOI:10.1016/j.vetmic.2021.109209 |
| [2] |
李子娟, 马欣, 李超, 等. 羊伪结核病流行现状及防控技术研究进展[J]. 中国兽医学报, 2018, 38(11): 2219-2226. LI Z J, MA X, LI C, et al. Research progress on epidemiology and control technology of caseous lymphadenitis[J]. Chinese Journal of Veterinary Science, 2018, 38(11): 2219-2226. (in Chinese) |
| [3] |
ABEBE D, SISAY TESSEMA T. Determination of Corynebacterium pseudotuberculosis prevalence and antimicrobial susceptibility pattern of isolates from lymph nodes of sheep and goats at an organic export abattoir, Modjo, Ethiopia[J]. Lett Appl Microbiol, 2015, 61(5): 469-476. DOI:10.1111/lam.12482 |
| [4] |
BETTINI A, MANCIN M, MAZZUCATO M, et al. A seroepidemiological survey of Corynebacterium pseudotuberculosis infection in South Tyrol, Italy[J]. Pathogens, 2022, 11(11): 1314. DOI:10.3390/pathogens11111314 |
| [5] |
DE FARIAS A E M, ALVES J R A, ALVES F S F, et al. Seroepidemiological characterization and risk factors associated with seroconversion to Corynebacterium pseudotuberculosis in goats from Northeastern Brazil[J]. Trop Anim Health Prod, 2019, 51(4): 745-752. DOI:10.1007/s11250-018-1748-7 |
| [6] |
JUNG B Y, LEE S H, KIM H Y, et al. Serology and clinical relevance of Corynebacterium pseudotuberculosis in native Korean goats (Capra hircus coreanae)[J]. Trop Anim Health Prod, 2015, 47(4): 657-661. DOI:10.1007/s11250-015-0773-z |
| [7] |
魏宇辰, 王斌, 白新栋, 等. 奶山羊不同组织来源干酪性脓肿中伪结核棒状杆菌的分离及毒力基因和耐药性检测[J]. 中国兽医学报, 2023, 43(5): 945-950. WEI Y C, WANG B, BAI X D, et al. Isolation of Corynebacterium pseudotuberulosis from different caseous abscesses tissues of dairy goats and detection of virulence genes and antimicrobial resistance of isolates[J]. Chinese Journal of Veterinary Science, 2023, 43(5): 945-950. (in Chinese) |
| [8] |
徐志豪, 黄诗琴, 李乡城, 等. 四川省山羊皮下脓肿的流行病学调查及病原体分析[J]. 中国兽医科学, 2016, 46(8): 991-996. XU Z H, HUANG S Q, LI X C, et al. Epidemiological survey and etiological analysis in goat with subcutaneous abscess in Sichuan Province[J]. Chinese Veterinary Science, 2016, 46(8): 991-996. (in Chinese) |
| [9] |
LI H X, YANG H Y, ZHOU Z Y, et al. Isolation, antibiotic resistance, virulence traits and phylogenetic analysis of Corynebacterium pseudotuberculosis from goats in southwestern China[J]. Small Ruminant Res, 2018, 168: 69-75. DOI:10.1016/j.smallrumres.2018.09.015 |
| [10] |
郑国英, 马玉馨, 李太仙, 等. 昆明市西山区山羊伪结核棒状杆菌的分离鉴定[J]. 动物医学进展, 2017, 38(9): 32-37. ZHENG G Y, MA Y X, LI T X, et al. Isolation and identification of goat Corynebacterium pseudotuberculosis in Xishan distract Kunming[J]. Progress in Veterinary Medicine, 2017, 38(9): 32-37. DOI:10.3969/j.issn.1007-5038.2017.09.008 (in Chinese) |
| [11] |
王锐鸿, 林昶, 池雪林, 等. 山羊伪结核棒状杆菌LY20株分离鉴定及病理组织学观察[J]. 中国兽医学报, 2021, 41(12): 2411-2420. WANG R H, LIN C, CHI X L, et al. Isolation and identification of Corynebacterium pseudotuberculosis from goats and histopathological observation of infected mice[J]. Chinese Journal of Veterinary Science, 2021, 41(12): 2411-2420. (in Chinese) |
| [12] |
GUERRERO J A V, DE OCA JIMÉNEZ R M, ACOSTA DIBARRAT J, et al. Isolation and molecular characterization of Corynebacterium pseudotuberculosis from sheep and goats in Mexico[J]. Microb Pathog, 2018, 117: 304-309. DOI:10.1016/j.micpath.2018.02.031 |
| [13] |
KUMAR J, SINGH F, TRIPATHI B N, et al. Epidemiological, bacteriological and molecular studies on caseous lymphadenitis in Sirohi goats of Rajasthan, India[J]. Trop Anim Health Prod, 2012, 44(7): 1319-1322. DOI:10.1007/s11250-012-0102-8 |
| [14] |
AL-GAABARY M H, OSMAN S A, OREIBY A F. Caseous lymphadenitis in sheep and goats: clinical, epidemiological and preventive studies[J]. Small Ruminant Res, 2009, 87(1-3): 116-121. DOI:10.1016/j.smallrumres.2009.10.008 |
| [15] |
周炜, 周芷锦, 沈红霞, 等. 我国猪源和鸡源大肠杆菌抗生素耐药性相关基因研究进展[J]. 中国兽药杂志, 2021, 55(7): 59-68. ZHOU W, ZHOU Z J, SHEN H X, et al. Progress on the antibiotics resistance related genes of Escherichia coli from swine and chicken in China[J]. Chinese Journal of Veterinary Drug, 2021, 55(7): 59-68. (in Chinese) |
| [16] |
JEONG S H, BAE I K, LEE J H, et al. Molecular characterization of extended-spectrum beta-lactamases produced by clinical isolates of Klebsiella pneumoniae and Escherichia coli from a Korean nationwide survey[J]. J Clin Microbiol, 2004, 42(7): 2902-2906. DOI:10.1128/JCM.42.7.2902-2906.2004 |
| [17] |
HOLBROOK S Y L, GENTRY M S, TSODIKOV O V, et al. Nucleoside triphosphate cosubstrates control the substrate profile and efficiency of aminoglycoside 3'-O-phosphotransferase type Ⅱa[J]. Med Chem Commun, 2018, 9(8): 1332-1339. DOI:10.1039/C8MD00234G |
| [18] |
AQUINO DE SÁ MDA C, GOUVEIA G V, KREWER CDA C, et al. Distribution of PLD and FagA, B, C and D genes in Corynebacterium pseudotuberculosis isolates from sheep and goats with caseus lymphadenitis[J]. Genet Mol Biol, 2013, 36(2): 265-268. DOI:10.1590/S1415-47572013005000013 |
| [19] |
DORELLA F A, CARVALHO P L, OLIVEIRA S C, et al. Corynebacterium pseudotuberculosis: microbiology, biochemical properties, pathogenesis and molecular studies of virulence[J]. Vet Res, 2006, 37(2): 201-218. DOI:10.1051/vetres:2005056 |
| [20] |
CARVALHO D M, DE SÁ P H, CASTRO T L P, et al. Reference genes for RT-qPCR studies in Corynebacterium pseudotuberculosis identified through analysis of RNA-seq data[J]. Antonie van Leeuwenhoek, 2014, 106(4): 605-614. DOI:10.1007/s10482-014-0231-3 |
| [21] |
PATHIRANA H N K S, CHO H S, CHO Y I, et al. Molecular characterization and antimicrobial susceptibility of Corynebacterium pseudotuberculosis isolated from skin abscesses of native Korean goats (Capra hircus coreanae)[J]. J Appl Microbiol, 2022, 133(3): 2074-2082. DOI:10.1111/jam.15683 |
(编辑 白永平)



