可变剪接(alternative splicing,AS)又称为选择性剪接。可变剪接是真核生物独有的一种在生命演化漫长过程中产生的调控方式[1]。前体mRNA通过选择不同的剪接方式产生不同结构的成熟mRNA这一过程称为可变剪接(选择性剪接)[2]。这种调控方式使原本有限的基因序列可以根据环境的不同而编码出多样、复杂的蛋白质,从而更好地适应复杂的生活环境[3]。可变剪接几乎发生在所有动物体的组织中,雄性动物最重要的生殖器官—睾丸也不例外,睾丸组织是可变剪接mRNA异构体数量最丰富的组织之一[4]。精子生成又称为精子发生,是以曲精细管为起始部位,精原细胞经过有丝分裂和两次减数分裂等一系列生理过程变为精细胞,精细胞再变为精子的过程[5-8]。在精子发生的时期往往伴随着十分复杂的机体调控机制。例如,蛋白质的新旧交替,激素类辅助与调节,细胞因子的靶向和调控等[9-10]。Chen等[11]的研究结果表明,小鼠在发生可变剪接的基因数量变化模式与精子发生过程中的基因表达模式非常相似,说明可变剪接与雄性动物的精子生成密切相关。
前体mRNA的剪接主要通过形成剪接复合体的形式行使功能[12]。剪接复合体包含了核小RNA蛋白质复合体和其他多种蛋白质因子。这包括富含精氨酸和丝氨酸蛋白参与组成的核不均一核糖核蛋白(heterogeneous nuclear ribonucleoprotein,hnRNP) 家族,是各种前体mRNA被加工成为核糖或蛋白复合体过程中最主要的一类蛋白质[13]。hnRNP家族C端富含甘氨酸,含有一个RNA识别域和一个核定位序列,C末端作用多样,包括RNA结合、细胞定位及与蛋白之间的相互作用[14]。剪接过程主要包括剪接位点与前体mRNA剪接复合体的形成、内含子的切除和外显子的连接、剪接产物的释放与复合体的解聚[12]。hnRNP家族通过与剪接沉默子结合,防止SR蛋白或者剪接体组件与可调控外显子的联系,从而引起外显子跳跃[15]。其中hnRNPF通过与剪接位点的G束结合来控制可变剪接[16]。叉状头转录因子FOXP3的外显子2编码区域与hnRNPF的第二个准RNA识别基序结合会抑制hnRNPF与靶前体mRNA结合,从而抑制可变剪接[17]。hnRNPF包含3种亚型:hnRNPH1、hnRNPH2与hnRNPH3,其中hnRNPH1在减数分裂细胞中表达并定位于染色体,会破坏减数分裂过程,损害生殖-支持细胞通信最终导致不育[18]。不止如此,当hnRNPF在细胞中异常表达时往往会伴随着多种疾病的发生。
可变剪接事件的发生受剪接调节因子等的调控,剪接因子可通过对可变剪接调控,从而影响精子的生成。例如,牛睾丸中的某种结构蛋白与其精子的生成息息相关,可变剪接参与调控该基因的表达就会影响其精子的质量,进而影响种群的繁殖效率[19]。剪接调节因子,如多聚嘧啶区结合蛋白1(PTBP1)、多聚嘧啶区结合蛋白2(PTBP2)、RNA结合蛋白(RBMXL2和Sam68)等,可通过调控精子发生中的可变剪接事件保证精子的生成[20]。PTBP1和PTBP2是分别调节雄性哺乳动物睾丸中精原细胞有丝分裂和精母细胞减数分裂可变剪接的调节因子,能保证精子的正常生成;支架蛋白SYMPK是一种减数分裂所必需的相关蛋白,同时也与精原细胞的存活密切相关,在睾丸内表达量很高,该蛋白可以调控生殖细胞的可变剪接进而影响小鼠的精子生成过程[21-22]。孙武[23]发现, 大部分睾丸表达基因都发生了可变剪接,而且发生在成熟期的比例明显高于其他时期,表明可变剪接事件在睾丸发育及精子生成中发挥着关键性作用。既然正常的基因可变剪接能促进精子的生成,那么异常的可变剪接也会对精子生成产生抑制作用,而这种情况便会导致雄性的生殖性能受到影响,严重时甚至会导致不育,例如:无头精子综合征[24-25]。Li等[26]对未性成熟与性成熟蒙古马睾丸进行了转录组测序可变剪接分析,发现精子发生过程中存在许多不同的可变剪接事件,发生可变剪接产生的不同蛋白质大多发生外显子跳跃。国外尚未有文章报道有关马属动物可变剪接对精子生成的影响。
本课题组在前期的研究中发现剪接因子hnRNPF在蒙古马性成熟后的睾丸组织中表达量较高,可能对蒙古马精子生成具有一定的影响。为研究可变剪接因子对蒙古马精子生成的作用,本试验以蒙古马为研究对象,构建hnRNPF过表达慢病毒载体,转染至体外培养的蒙古马睾丸支持细胞(sertoli cell,SC),检测细胞的增殖情况及精子生成相关基因在不同细胞中的差异表达情况,揭示hnRNPF调控精子生成的作用机制,为提高蒙古马精子数量与精液品质提供新的思路。
1 材料与方法 1.1 试验材料1.1.1 试验对象 本研究采用蒙古马睾丸支持细胞作为试验材料。在试验后续过程中所进行的细胞分离与体外培养的操作均严格按照本试验室的流程进行[27]。
1.1.2 主要仪器、试剂 倒置相差显微镜(OLYMPUS)、数显电热恒温水浴锅(YiTong)、细胞计数板(Watson)、纯水仪(OLABO)、-80 ℃冰箱(Haier)、台式离心机(Sigma)、高速冷冻离心机(Sigma)、二氧化碳培养箱、超净工作台(ESCO)、CFX实时荧光定量PCR仪(Bio-Rad)、普通PCR反应扩增仪(Bio-Rad)。
细胞培养液(50 mL):DMEM/F-12培养基+1%丙酮酸钠+10%胎牛血清(FBS)+2%双抗+0.001 5 g碳酸氢钠(NaHCO3)+2% 谷氨酰胺;清洗液(50 mL):杜氏硝酸缓冲盐溶液(DPBS)+1%双抗;细胞冻存液:FBS+二甲基亚砜(DMSO);胰蛋白酶溶液(Gibco);细胞活力检测试剂盒(biosharp);反转录试剂盒(TaKaRa);定量反转录聚合酶链式反应(qRT-PCR)试剂盒(TaKaRa)。
1.2 试验方法1.2.1 hnRNPF过表达慢病毒载体的构建 通过NCBI官网 https://www.ncbi.nlm.nih.gov/下载hnRNPF马属动物基因序列,由苏州安升达生物科技有限公司进行过表达慢病毒载体的合成。
1.2.2 hnRNPF过表达慢病毒载体转染蒙古马睾丸支持细胞 选择使用1×107浓度的过表达慢病毒载体进行转染,将保存在-80 ℃冰箱中的过表达慢病毒载体取出,冰上溶解。实验室前期研究显示,蒙古马睾丸支持细胞在第3代时细胞活性最高。取出培养好的第3代蒙古马睾丸支持细胞,弃废液,DPBS清洗两次。根据病毒∶培养基为1 ∶9的比例抽取适量慢病毒载体和培养基注入培养皿中,混匀后放入37 ℃、5%二氧化碳培养箱中培养。24 h后吸去皿中液体,加入培养基。以24 h为间隔,不同时间段拍照观察,确定最佳转染时间。
1.2.3 CCK-8检测细胞增殖活性 在96孔板中培养蒙古马睾丸支持细胞,待细胞生长至约70%后,一组加入hnRNPF过表达慢病毒载体,一组不加,形成对照,每组设置4个重复。24 h后换液,并在分别转染0、24、48、72 h时更换90 μL培养液和10 μL CCK-8试剂,细胞培养箱继续孵育2 h,酶标仪检测450 nm处吸光值,对比两组细胞的增殖情况。
1.2.4 总RNA抽提试剂(TRIzol)法提取转染细胞与未转染细胞RNA并反转录为cDNA (1) 将1 mL TRIzol试剂加入细胞培养基中,样本充分涡旋混匀15 s。15~30 ℃静置10 min。(2)TRlzol:氯仿为5 ∶1。按照比例添加氯仿。小心盖好样品管。用手大力摇管15 s。15~30 ℃孵育15 min。2~8 ℃,离心机12 000 g离心15 min。(3)离心结束后管中分3层。红色为酚-氯仿相层。然后依次为中间相和水相层。水相层无色。水相层转移至新管保存。(4)在室温下孵育样品10 min。离心机温度控制在4 ℃,12 000 g离心10 min。(5)弃上清。用75%的乙醇洗涤RNA沉淀一次。涡旋振荡将沉淀弹起来。4 ℃,7 500 g离心5 min。在该过程结束时,冰上干燥RNA沉淀30 min。无RNA酶水70 μL吹打几次溶解RNA。(6)溶解后,用酶标仪测定RNA浓度及纯度,利用反转录试剂盒迅速将RNA反转录成cDNA,-20 ℃保存样本。
1.2.5 qRT-PCR检测精子生成相关基因在两种细胞中的差异表达 选取精子生成相关基因(PKMYT1、CDC25C、YWHAZ、BUB1、BTRC、CCNE1、CALM1、PLK1、REC8、MAPK3、ADCY7) 设计引物(表 1),由上海生工生物工程有限公司合成。
|
|
表 1 引物序列信息 Table 1 Primers sequence information |
将转染后的细胞设为试验组,未转染的细胞为对照组,每组设置3个重复,选取GAPDH作为内参基因。反应体系:TB Green 12.5 μL,上、下游引物各1 μL,cDNA模板2 μL,RNase-free ddH2O 8.5 μL。反应条件:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火30 s,95 ℃延伸15 s, 共40个循环;60 ℃退火30 s; 4 ℃保存。
1.2.6 数据处理 qRT-PCR结果以F=2-ΔΔCt为运算公式计算,检验方法为独立样本t检验,P < 0.05为差异显著,使用Graphpad prism软件作图。
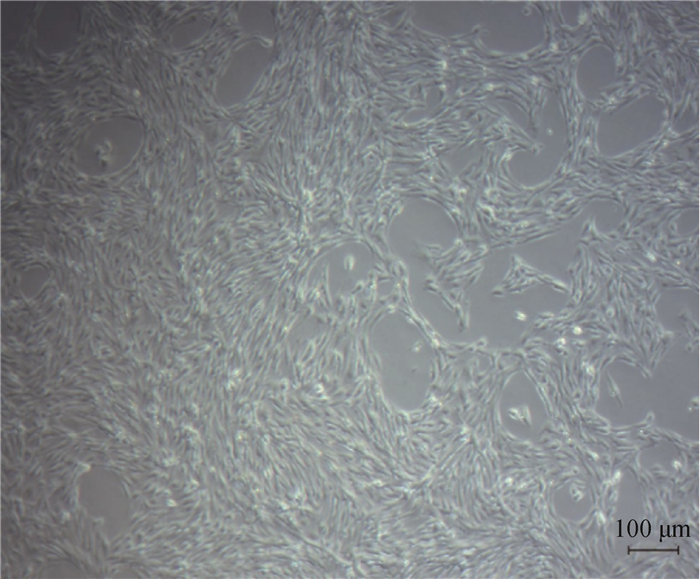
2 结果 2.1 蒙古马睾丸支持细胞培养图 1为培养48 h蒙古马睾丸支持细胞4倍镜下图片。由图可见细胞已贴壁,视野内细胞数量多。蒙古马睾丸支持细胞呈现细长梭状,在显微镜下略显透明,但轮廓清晰,细胞核明亮清楚。
|
图 1 蒙古马睾丸支持细胞培养 Fig. 1 Culture of Mongolian horse testicular sertoli cells |
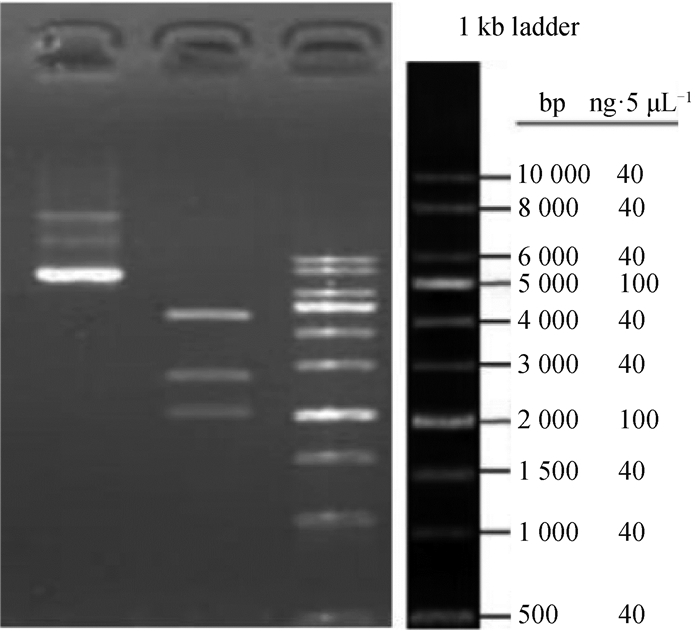
合成基因hnRNPF,连接至载体pGWLV10(GFP),构建hnRNPF in pGWLV10(GFP),大抽并去内毒素,包装过表达慢病毒,滴度检测。琼脂糖凝胶电泳检测构建结果如图 2所示,目的条带与目的基因片段的长度相一致,证明hnRNPF in pGWLV10(GFP)慢病毒构建成功,可以用于后续试验。
|
图中电泳图谱泳道从左到右依次为空载体、hnRNPF过表达慢病毒载体(目的条带)、参照条带 The electrophoresis lanes in the figure from left to right are empty vector, hnRNPF overexpression lentiviral vector (target bands), and reference bands 图 2 hnRNPF过表达慢病毒构建结果 Fig. 2 Results of hnRNPF overexpression lentivirus construction |
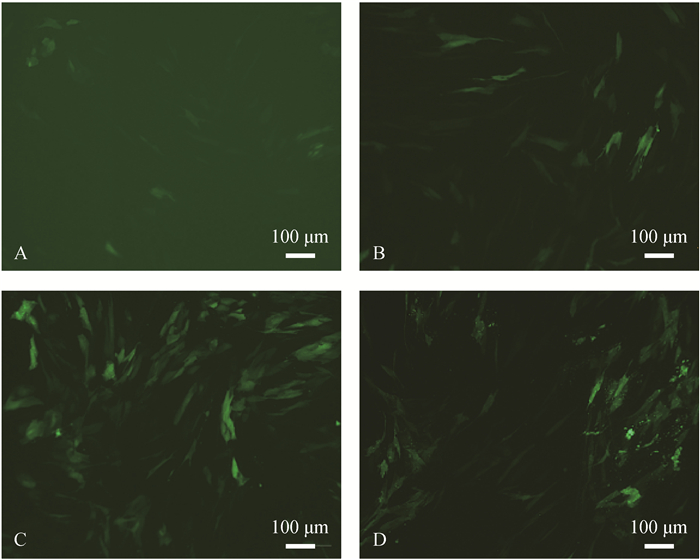
将构建的hnRNPF过表达慢病毒载体转染至支持细胞中,分别在24、48、72、96 h在荧光显微镜下观察转染效率。通过图 3比较发现,在72和96 h载体转染效率相同,说明载体在72 h后转染效率不再升高,考虑细胞活性,转染效率最适时间为72 h,故选择载体转染细胞72 h时用于后续试验。
|
A-D图依次为转染时间24、48、72、96 h时荧光显微镜下转染状态 The A-D plots show the transfection status under fluorescence microscope at 24, 48, 72 and 96 h of transfection 图 3 hnRNPF过表达慢病毒载体转染细胞 Fig. 3 Cells were transfected with hnRNPF overexpression lentiviral vector |
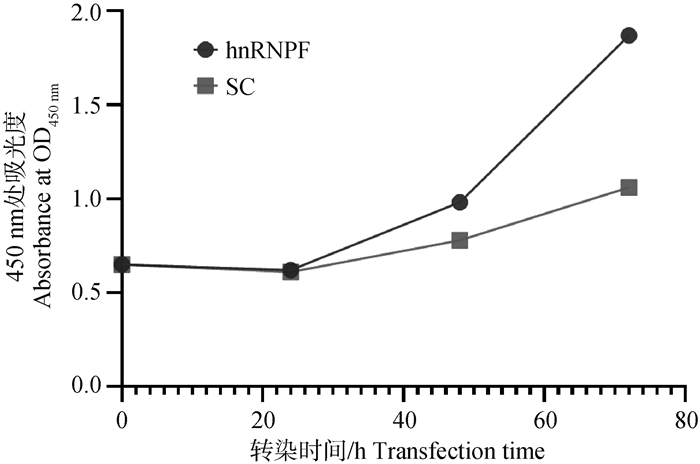
根据酶标仪数据结果,利用Graphpad prism软件作图显示(图 4)。可以发现数据曲线呈先下降再上升的趋势。两组细胞的增殖情况从被转染的24 h内出现下降趋势,但在转染24 h后呈现上升趋势,并且转染后的细胞增长趋势始终高于未转染的细胞。由此可得出,hnRNPF剪接因子会促进蒙古马睾丸支持细胞的增殖。
|
图 4 hnRNPF过表达慢病毒感染细胞CCK-8活力增殖曲线 Fig. 4 Activity proliferation curve of cells transfected with hnRNPF overexpression lentivirus by CCK-8 |
选择与精子生成相关基因进行实时荧光定量PCR试验,以转染hnRNPF过表达慢病毒细胞为试验组,未转染病毒细胞为对照组。以GAPDH作为内参基因,Graphpad prism软件作图(图 5)。结果显示, 上述11种基因在转染病毒细胞中的表达量均远高于对照组细胞,且差异显著,说明hnRNPF可能对于蒙古马精子生成具有促进作用。

|
*. P < 0.05;**. P < 0.01;***. P < 0.001;****.P < 0.000 1 图 5 精子生成相关基因qRT-PCR检测 Fig. 5 Detection of spermatogenesis-related genes by qRT-PCR |
精子生成是一个复杂的生理过程,包括有丝分裂、减数分裂和精子形成。大多可变剪接所需的反式作用剪接因子都在睾丸中表达。精子生成过程中一些重要的基因在特定的发育阶段有着不同的剪接变异。参与基因可变剪接过程的剪接因子对精子生成具有重要意义。Ptbp2是神经系统中的重要可变剪接因子,可调节睾丸细胞中生殖细胞的mRNA可变剪接,对男性睾丸细胞的存活以及生殖能力至关重要。当生殖细胞中的Ptbp2缺失时会导致精母细胞和精细胞的增殖下降,并且伴随睾丸中mRNA剪接异常,影响生殖细胞存活[20]。RNA结合蛋白Rbm5同样也是男性生殖细胞中重要的剪接因子,对于精子生成选择性剪接具有重要作用[28]。当Rbm5缺失时,大规模功能性基因的选择性剪接发生异常,影响基因表达。Ranbp9是一种RNA结合蛋白, 可以与多种剪接因子(SR蛋白和HNRNPs家族)结合共同调节与精子生成相关的可变剪接,确保精子生成可变剪接的正确性[29]。将生殖细胞中的Ranbp9特异性敲除会导致精母细胞和精细胞大量缺失,进而导致生殖能力明显下降。乳腺癌扩增序列2(BCAS2)作为一种剪接因子通过复制蛋白A复合物参与DNA损伤修复,经过小鼠试验发现BCAS2剪接因子对于小鼠受精卵的内源性及外源性DNA损伤具有修复作用,可以通过复制蛋白A复合物维持小鼠胎盘基因组的完整性[30]。BCAS2在小鼠睾丸中高度富集,Vasa-Cre对生精细胞BCAS2有破坏作用,当BCAS2缺失时就会导致男性不育,对精母细胞具有影响但对精原细胞影响不大,经过进一步研究发现,BCAS2参与睾丸精原细胞的可变剪接并对精子发生过程中有丝分裂向减数分裂的转变和男性生育能力具有重要作用[30]。有研究发现,改变转录因子环磷酸腺苷反应元件调节因子(CREM)的表达会导致男性不育,在对比了CREM发生可变剪接产生的不同异构体对人和种公马精子生成的影响,发现缺乏CREM激活子同样会导致种公马不育[31]。
异质核糖核蛋白(hnRNP)是在哺乳动物细胞中大量表达的典型RNA结合蛋白的大家族。在hnRNP蛋白中发现了4种不同类型的RNA结合结构域,包括RNA识别基序(RRM)、非经典准RRM(q-RRM)、富含甘氨酸的结构域和K同源性(KH)结构域[32]。核不均一核糖核蛋白hnRNPF包含3个非经典q-RRM,该蛋白最经典的功能是调节可变剪接,主要通过调节与外显子相关的可变剪接事件来调节基因的可变剪接[33]。有体外研究表明,hnRNPF通过其q-RRM直接结合富含G的前mRNA序列参与可变剪接调控[34]。雄性生殖细胞最独特的特征是复杂的可变剪接模式,因此剪接因子在雄性生殖过程中就显得尤为重要。通过检测hnRNP家族在小鼠睾丸中的表达含量,发现hnRNPF在睾丸中高度表达[35]。因此,有理由相信hnRNPF在雄性生殖过程中具有重要的作用。目前,hnRNPF对雄性生殖系统及精子生成方面的具体影响还未可知。本研究发现,经过表达hnRNPF转染后的SC细胞增殖情况要优于未转染的SC细胞;说明剪接因子hnRNPF会促进蒙古马睾丸支持细胞的增殖。为从基因水平上研究hnRNPF对精子生成的影响,本研究选取了11个与精子生成相关的基因,研究其在两类细胞中的差异表达,例如:酪氨酸3-单加氧酶/色氨酸5单加氧酶激活蛋白(YWHAZ)通过与细胞周期调控因子(CDC25)蛋白结合并调节其功能,参与细胞G1/S期和G2/M期转变,在有丝分裂间期发挥作用[36]。YWHAZ蛋白在小鼠早期胚胎的各个时期均有表达,同时定位于早期胚胎的细胞质与细胞核中,提示该蛋白可能在小鼠早期胚胎发育过程中发挥一定的作用。CDC25C是一种磷酸酶编码基因,对细胞周期的调控有着重要作用[37]。蛋白激酶膜相关酪氨酸/苏氨酸1(PKMYT1)是一种周期性的调节蛋白激酶,能够有效地去除磷酸化,生物学功能是防止在细胞增殖时发生DNA改变[38]。苯并咪唑出芽抑制解除同源物蛋白1(BUB1)也影响细胞分裂,有研究表明,BUB1作为有丝分裂检查点的平台蛋白,可通过形成复合物的形式直接或间接对其他重要周期蛋白进行调控,从而影响整个细胞周期的进程[39-40]。Polo样激酶1(PLK1)对于早期胚胎发育至关重要,有研究显示PLK1会调节小鼠精子发生减数分裂过程中的DNA双链断裂(DSBs)修护[41]。敲除精子细胞中的PLK1会导致不育[42]。在本研究中,qRT-PCR试验显示精子生成相关基因的表达量在转染过表达hnRNPF慢病毒载体的蒙古马睾丸支持细胞中高于未转染的细胞,且差异显著,表明剪接因子hnRNPF可能通过调控上述基因的表达量从而调节精子生成,具体作用机理还需进一步的探寻。
4 结论本研究结果显示,转染了hnRNPF后的蒙古马睾丸支持细胞增殖情况优于未转染的细胞,精子生成相关基因在转染后细胞中的表达量较高,且差异显著。结果表明,剪接因子hnRNPF发生可变剪接可能对蒙古马精子的生成起促进作用,研究成果为提高蒙古马精子数量和精液品质提供了新的思路。
| [1] |
王浩然. 杨树NAC转录因子可变剪接初步研究[D]. 南京: 南京林业大学, 2018. WANG H R. A preliminary study on the alternative cleavage and polyadenylation of NAC transcription factor genes in Populus[D]. Nanjing: Nanjing Forestry University, 2018. (in Chinese) |
| [2] |
ZHANG Y J, QIAN J J, GU C Y, et al. Alternative splicing and cancer: a systematic review[J]. Signal Transduct Target Ther, 2021, 6(1): 78. DOI:10.1038/s41392-021-00486-7 |
| [3] |
宋代玲, 翁雅娟, 特日格乐, 等. 基因的可变剪接对哺乳动物精子生成作用的研究进展[J]. 黑龙江畜牧兽医, 2023(1): 27-31, 126. SONG D L, WENG Y J, TE R G L, et al. Research progress on the effects of gene alternative splicing on mammalian spermatogenesis[J]. Heilongjiang Animal Science and Veterinary Medicine, 2023(1): 27-31, 126. (in Chinese) |
| [4] |
SENOO M, TAKIJIRI T, YOSHIDA N, et al. PTBP1 contributes to spermatogenesis through regulation of proliferation in spermatogonia[J]. J Reprod Dev, 2019, 65(1): 37-46. DOI:10.1262/jrd.2018-109 |
| [5] |
张姹, 魏易焓, 卢静怡, 等. 不同运动方式和运动时间对小鼠睾酮分泌和精子生成的影响[J]. 中国畜牧杂志, 2021, 57(2): 96-100. ZHANG C, WEI Y H, LU J Y, et al. Effects of different exercise modes and exercise time on testosterone secretion and spermatogenesis in mice[J]. Chinese Journal of Animal Science, 2021, 57(2): 96-100. (in Chinese) |
| [6] |
崔迎迎. MEI1基因可变剪切事件对蒙古马精子生成的调控作用[D]. 呼和浩特: 内蒙古农业大学, 2021. CUI Y Y. Regulatory role of MEI1 with alternative splicing event on spermatogenesis in Mongolian horse[D]. Hohhot: Inner Mongolia Agricultural University, 2021. (in Chinese) |
| [7] |
王丽佳. Trib3基因敲除对雄性大鼠精子生成影响的相关研究[D]. 呼和浩特: 内蒙古医科大学, 2020. WANG L J. Effects of Trib3 gene knockout on spermatogenesis in male rats[D]. Hohhot: Inner Mongolia Medical University, 2020. (in Chinese) |
| [8] |
王颖洁. gga-miR-31-5p调控鸡减数分裂和精子生成的机制解析[D]. 扬州: 扬州大学, 2020. WANG Y J. Mechanism of gga-miR-31-5p regulating meiosis and spermatogenesis in chicken[D]. Yangzhou: Yangzhou University, 2020. (in Chinese) |
| [9] |
MUSTAFA S. 白藜芦醇对束缚应激以及母体束缚应激小鼠睾丸发育和精子生成的影响[D]. 南京: 南京农业大学, 2020. MUSTAFA S. Roles of resveratrol on testicular development and spermatogenesis under the condition of restraint and maternal restraint stress in mice[D]. Nanjing: Nanjing Agricultural University, 2020. (in Chinese) |
| [10] |
刘勇. DNA甲基化与可变剪接影响荷斯坦公牛睾丸FBXW11基因表达和精子活力[D]. 邯郸: 河北工程大学, 2019. LIU Y. DNA methylation and alternative splicing affect FBXW11 gene expression and sperm motility in Holstein bulls testis[D]. Handan: Hebei University of Engineering, 2019. (in Chinese) |
| [11] |
CHEN Y, ZHENG Y X, GAO Y, et al. Single-cell RNA-seq uncovers dynamic processes and critical regulators in mouse spermatogenesis[J]. Cell Res, 2018, 28(9): 879-896. DOI:10.1038/s41422-018-0074-y |
| [12] |
PENG Q, ZHOU Y J, OYANG L, et al. Impacts and mechanisms of alternative mRNA splicing in cancer metabolism, immune response, and therapeutics[J]. Mol Ther, 2022, 30(3): 1018-1035. DOI:10.1016/j.ymthe.2021.11.010 |
| [13] |
苏明强. HnRNP F通过调控TPX2表达促进膀胱癌细胞增殖[D]. 广州: 南方医科大学, 2019. SU M Q. HnRNP F promotes the proliferation of bladder cancer cells via regulating the TPX2 expression[D]. Guangzhou: Southern Medical University, 2019. (in Chinese) |
| [14] |
WAITHAKA A, MAIAKOVSKA O, GRIMM D, et al. Sequences and proteins that influence mRNA processing in Trypanosoma brucei: Evolutionary conservation of SR-domain and PTB protein functions[J]. PLoS Negl Trop Dis, 2022, 16(10): e0010876. DOI:10.1371/journal.pntd.0010876 |
| [15] |
CHEN M, ZHANG J, MANLEY J L. Turning on a fuel switch of cancer: HnRNP proteins regulate alternative splicing of pyruvate kinase mRNA[J]. Cancer Res, 2010, 70(22): 8977-8980. DOI:10.1158/0008-5472.CAN-10-2513 |
| [16] |
HUANG H L, ZHANG J, HARVEY S E, et al. RNA G-quadruplex secondary structure promotes alternative splicing via the RNA-binding protein hnRNPF[J]. Genes Dev, 2017, 31(22): 2296-2309. DOI:10.1101/gad.305862.117 |
| [17] |
DU J G, WANG Q, ZIEGLER S F, et al. FOXP3 interacts with hnRNPF to modulate pre-mRNA alternative splicing[J]. J Biol Chem, 2018, 293(26): 10235-10244. DOI:10.1074/jbc.RA117.001349 |
| [18] |
FENG S L, LI J M, WEN H, et al. hnRNPH1 recruits PTBP2 and SRSF3 to modulate alternative splicing in germ cells[J]. Nat Commun, 2022, 13(1): 3588. DOI:10.1038/s41467-022-31364-7 |
| [19] |
高源. 安格斯牛睾丸组织非编码RNA鉴定及单细胞转录图谱绘制[D]. 杨凌: 西北农林科技大学, 2021. GAO Y. Non-coding RNA identification and single-cell transcriptome atlas of angus bull testis[D]. Yangling: Northwest A&F University, 2021. (in Chinese) |
| [20] |
ZAGORE L L, GRABINSKI S E, SWEET T J, et al. RNA binding protein Ptbp2 is essential for male germ cell development[J]. Mol Cell Biol, 2015, 35(23): 4030-4042. DOI:10.1128/MCB.00676-15 |
| [21] |
SENOO M, HOZOJI H, ISHIKAWA-YAMAUCHI Y, et al. RNA-binding protein Ptbp1 regulates alternative splicing and transcriptome in spermatogonia and maintains spermatogenesis in concert with Nanos3[J]. J Reprod Dev, 2020, 66(5): 459-467. DOI:10.1262/jrd.2020-060 |
| [22] |
LIU W B, WANG F C, XU Q H, et al. BCAS2 is involved in alternative mRNA splicing in spermatogonia and the transition to meiosis[J]. Nat Commun, 2017, 8: 14182. DOI:10.1038/ncomms14182 |
| [23] |
孙武. 整合RNA-seq和全基因组测序数据解析控制湖羊睾丸发育的基因和调控网络[D]. 兰州: 兰州大学, 2019. SUN W. Identification of the candidate genes and regulatory network related to testicular development in Hu sheep based on RNA-seq and re-sequencing data[D]. Lanzhou: Lanzhou University, 2019. (in Chinese) |
| [24] |
杨旭辉, 汪惠琴, 朱照平, 等. 畸形精子症发生的分子机制研究进展[J]. 新乡医学院学报, 2023, 40(8): 796-800. YANG X H, WANG H Q, ZHU Z P, et al. Research progress on the molecular mechanism of teratozoospermia[J]. Journal of Xinxiang Medical University, 2023, 40(8): 796-800. (in Chinese) |
| [25] |
李琳, 王景尚, 阴赪宏, 等. 人类无头精子症的遗传学研究进展[J]. 中华男科学杂志, 2019, 25(9): 838-842. LI L, WANG J S, YIN C H, et al. Advances in the molecular genetic studies of acephalic spermatozoa syndrome[J]. National Journal of Andrology, 2019, 25(9): 838-842. (in Chinese) |
| [26] |
LI B, HE X L, ZHAO Y P, et al. Transcriptome profiling of developing testes and spermatogenesis in the Mongolian horse[J]. BMC Genet, 2020, 21(1): 46. DOI:10.1186/s12863-020-00843-5 |
| [27] |
宋连杰, 崔迎迎, 赵一萍, 等. 蒙古马睾丸支持细胞的体外分离培养与鉴定[J]. 中国畜牧兽医, 2020, 47(9): 2751-2758. SONG L J, CUI Y Y, ZHAO Y P, et al. Isolation, culture and identification of testis Sertoli cells in Mongolian horses in vitro[J]. China Animal Husbandry & Veterinary Medicine, 2020, 47(9): 2751-2758. (in Chinese) |
| [28] |
OUD M S, SMITS R M, SMITH H E, et al. A de novo paradigm for male infertility[J]. Nat Commun, 2022, 13(1): 154. DOI:10.1038/s41467-021-27132-8 |
| [29] |
YANG J B, ZHANG Z W, ZHANG Y Y, et al. CLOCK interacts with RANBP9 and is involved in alternative splicing in spermatogenesis[J]. Gene, 2018, 642: 199-204. DOI:10.1016/j.gene.2017.11.007 |
| [30] |
XU Q H, WANG F C, XIANG Y L, et al. Maternal BCAS2 protects genomic integrity in mouse early embryonic development[J]. Development, 2015, 142(22): 3943-3953. |
| [31] |
BLÖCHER S, BEHR R, WEINBAUER G F, et al. Different CREM-isoform gene expression between equine and human normal and impaired spermatogenesis[J]. Theriogenology, 2003, 60(7): 1357-1369. DOI:10.1016/S0093-691X(03)00142-0 |
| [32] |
GEUENS T, BOUHY D, TIMMERMAN V. The hnRNP family: insights into their role in health and disease[J]. Hum Genet, 2016, 135(8): 851-867. DOI:10.1007/s00439-016-1683-5 |
| [33] |
TYSON-CAPPER A, GAUTREY H. Regulation of Mcl-1 alternative splicing by hnRNP F, H1 and K in breast cancer cells[J]. RNA Biol, 2018, 15(12): 1448-1457. DOI:10.1080/15476286.2018.1551692 |
| [34] |
WANG L Y, YAN F. Molecular insights into the specific recognition between the RNA binding domain qRRM2 of hnRNP F and G-tract RNA: A molecular dynamics study[J]. Biochem Biophys Res Commun, 2017, 494(1-2): 95-100. |
| [35] |
WANG X L, LI J M, YUAN S Q. Characterization of the protein expression and localization of hnRNP family members during murine spermatogenesis[J]. Asian J Androl, 2023, 25(3): 314-321. DOI:10.4103/aja202273 |
| [36] |
MOLZAN M, OTTMANN C. Synergistic binding of the phosphorylated S233-and S259-binding sites of C-RAF to one 14-3-3ζ dimer[J]. J Mol Biol, 2012, 423(4): 486-495. |
| [37] |
LIU K, ZHENG M Y, LU R, et al. The role of CDC25C in cell cycle regulation and clinical cancer therapy: a systematic review[J]. Cancer Cell Int, 2020, 20(1): 213. |
| [38] |
HU Y Y, GONG C L, LI Z B, et al. Demethylase ALKBH5 suppresses invasion of gastric cancer via PKMYT1 m6A modification[J]. Mol Cancer, 2022, 21(1): 34. |
| [39] |
ZHANG G, KRUSE T, GUASCH BOLDÚ C, et al. Efficient mitotic checkpoint signaling depends on integrated activities of Bub1 and the RZZ complex[J]. EMBO J, 2019, 38(7): e100977. |
| [40] |
MOYLE M W, KIM T, HATTERSLEY N, et al. A Bub1-Mad1 interaction targets the Mad1-Mad2 complex to unattached kinetochores to initiate the spindle checkpoint[J]. J Cell Biol, 2014, 204(5): 647-657. |
| [41] |
WELLARD S R, SKINNER M W, ZHAO X Q, et al. PLK1 depletion alters homologous recombination and synaptonemal complex disassembly events during mammalian spermatogenesis[J]. Mol Biol Cell, 2022, 33(5): ar37. |
| [42] |
WELLARD S R, ZHANG Y J, SHULTS C, et al. Overlapping roles for PLK1 and Aurora A during meiotic centrosome biogenesis in mouse spermatocytes[J]. EMBO Rep, 2021, 22(4): e51023. |
(编辑 郭云雁)



