2. 动物保健与畜产品质量安全研究实验室, 乌鲁木齐 830052;
3. 乌鲁木齐市动物园, 乌鲁木齐 830001;
4. 深圳市真瑞生物有限公司, 深圳 518000;
5. 新疆畜牧科学院兽医研究所, 乌鲁木齐 830000
2. The Research Team of Animal Healthcare and Quality & Safety of Livestock Products, Urumqi 830052, China;
3. Urumqi Zoo, Urumqi 830001, China;
4. Shenzhen Zhenrui Biological Co., LTD, Shenzhen 518000, China;
5. Institute of Veterinary Medicine, Xinjiang Academy of Animal Science, Urumqi 830000, China
犊牛腹泻是全球养牛业中一种常见的消化道疾病,以消化不良、腹泻、痢疾等为主要症状,极易造成犊牛生长发育不良、生长周期延长、继发感染甚至死亡,给牧场主造成巨大的经济损失[1-2]。病毒所致犊牛腹泻是最常见的因素之一[3]。牛诺瓦病毒(bovine norovirus, BNoV)是嵌杯病毒科、诺瓦病毒属的无囊膜单股正链RNA病毒[4]。1978年,首次在英国腹泻犊牛的粪便中被发现[5],2018年,首次在我国犊牛腹泻粪便中检测到[6],BNoV作为一种新发病原,尚未见关于重组酶介导等温扩增检测方法的报道。牛轮状病毒(bovine rotavirus, BRV)属于呼肠孤病毒科,轮状病毒属,是引起犊牛腹泻的主要病原之一,感染犊牛后引起的疾病具有发病率高、流行性广、危害性大等特点,严重影响我国养牛业的发展[7-8]。两者在临床中单凭症状很难区别,给临床诊断带来了极大的困难,且常有混合感染而加重腹泻严重度,造成死亡率增加[7, 9]。
重组酶介导等温扩增(recombinase aided amplification, RAA)技术,利用重组酶、单链结合蛋白、聚合酶进行反应,是一种具有反应速度快、特异性强、灵敏度高的恒温扩增技术[10-11]。本研究基于RAA技术,结合侧流层析试纸条(lateral flow dipstick, LFD)对扩增产物进行可视化观察,同时检测BNoV和BRV,为有效防控BNoV和BRV提供技术支持。
1 材料与方法 1.1 材料1.1.1 主要试剂和仪器 病毒基因组DNA/RNA提取试剂盒(天根生化科技有限公司),感受态细胞pEASY-T1(北京全式金生物技术有限公司),恒温快速扩增试剂盒(安普未来生物科技有限公司),天隆Gentier 48E实时荧光定量PCR仪(西安天隆科技有限公司),电热恒温水浴锅(上海尚普仪器设备有限公司)。
1.1.2 样品来源 BNoV、BRV、牛病毒性腹泻病毒(bovine viral diarrhea virus, BVDV)、牛冠状病毒(bovine coronavirus, BCoV)、牛传染性鼻气管炎病毒(infectious bovine rhinotracheitis virus, IBRV)阳性样品采集自喀什、塔城等地区经本实验室收集、鉴定和保存。2022年从新疆博乐、喀什等地采集犊牛腹泻临床样本共计168份,样品放于-80 ℃保存。
1.2 方法1.2.1 标准质粒的构建 选用NCBI中BNoV(登录号:OM991740)的RdRp和BRV(登录号:MN928486)的VP7基因序列,利用DNAMAN软件进行分析比对,选择高同源性的保守区域,利用NCBI Primer-BLAST数据库各设计1条引物,BNoV-F:5′-CCCAGATGGCCCTCTCAGTTCCA-AAGATCTCA-3′,BNoV-R:5′-TGTTCTCAATCCGGTCGCAA-3′;目的片段长度为1 254 bp,BRV- F:5′-GGCTTTAAAAGCGAGAATTTCC-3′,BRV-R:5′-GGTCACATCATACAACTCTAAT-3′,目的片段长度1 062 bp,由生工生物工程(上海)股份有限公司合成。PCR反应体系:上下游引物各0.5 μL,2×Easytaq PCR SuperMix 12.5 μL,Nuclease-free Water 9.5 μL,cDNA 2 μL。反应程序为94 ℃ 3 min;94 ℃ 30 s,64 ℃ 30 s,72 ℃ 30 s,30个循环;72 ℃ 5 min;琼脂糖凝胶电泳鉴定目的片段,纯化后连接到pEASY-T1载体,并计算出pEASY-BNoV和pEASY-BRV的拷贝数分别为5.27×1010和1.12×1010 copies·μL-1。
1.2.2 引物探针的设计及筛选 利用NCBI Primer-BLAST数据库针对RdRp和BRV的VP7基因设计多条特异性引物,反应完成后,用2%琼脂糖凝胶电泳检测RAA产物,经多次试验筛选,最后选择了2组引物和探针用于后续试验。引物序列BNoV-F1:5′-CCCAGATGGCCCTCTCAGTTCCAAAGATCTCAG-3′,BNoV-R1:[5′-TAM]GTGAAATTCTGGGACTGCCCTATTCCAGGGTTG-3′,BNoV-P:[5′FAM]GGGCGA-GAGGTGGCCGTACGCCTCAATGACT[THF]GTAACTGCTACACTTTC[3′C3spacer],片段长度为272 bp;BRV-F1:5′-GTTCCTCTTGCACAGTCAAAGTGTGTCCATTAAA-3′,BRV-R1:[5′-biotin]CAGCTGTGATGTCTAAAACGTTCGCACCAC-CTAC-3′,BRV-P:[5′FAM]CGTTTGAAACAGTTGCAACGACGGAGAAACT[THF] GTGATTACAGATGTTGT[3′C3spacer],片段长度为258 bp。
1.2.3 核酸提取 使用天根生化科技(北京)有限公司的病毒基因组RNA试剂盒提取BNoV阳性样本和BRV阳性样本。将20 μL Proteinase K加入1.5 mL离心管中,并加入200 μL平衡至室温的肛拭子样品。加入200 μL Carrier RNA工作液,涡旋混匀15 s。56 ℃孵育15 min。加入250 μL的无水乙醇,涡旋振荡15 s,室温静置5 min。将离心管中的溶液全部转移至过滤柱,8 000 r·min-1离心1 min,弃废液。加500 μL缓冲液GD,8 000 r·min-1离心1 min,弃废液。加600 μL漂洗液PW,静置2 min,8 000 r·min-1离心1 min,弃废液。重复上一步骤进行二次漂洗。加500 μL无水乙醇,8 000 r·min-1离心1 min,弃废液。12 000 r·min-1将空的过滤柱离心3 min。将过滤柱放入1.5 mL的离心管中,室温放置3 min后,加入50 μL的RNase-Free ddH2O,室温静置5 min后,12 000 r·min-1离心1 min。保存于-80 ℃备用。
1.2.4 双重RAA-LFD反应体系的建立及优化 预试验反应体系为50 μL,其中C buffer 20 μL,L buffer 5 μL,P-core 12 μL,dNTPs(25 mmol·L-1)0.6 μL,上、下游引物和探针稀释至10 μmol·L-1,按照不同的配比进行引物探针浓度的筛选,N-core 0.6 μL,DNA模板3.8 μL,ddH2O 0.9 μL最后加B buffer 2.5 μL。混合后离心,放入恒温设备中39 ℃孵育30 min。将10 μL RAA混合物加90 μL ddH2O混匀,吸取50 μL溶液直接滴加在样品垫上,10 min后观察质控线与检测线判读结果。当T1检测线出现时表示样品中含有BRV,当T2检测线出现时表示样品中含有BNoV。确定引物探针浓度后,以标准品为模板,选择不同的温度条件(37~42 ℃)和不同时间条件(5、10、15、20、25、30 min)进行反应,以确定最佳反应条件。
1.2.5 特异性试验 以质粒pEASY-BNoV(5.27× 107 copies·μL-1)、pEASY-BRV(1.12×107 copies·μL-1),以及BCoV(4.13×107 copies·μL-1)、BVDV(2.21×107 copies·μL-1)、IBRV(3.20×107 copies·μL-1)为模板进行RAA扩增,上样量均3.8 μL,LFD检测扩增结果,并用ddH2O为模板作为阴性对照,以确定本方法的特异性。
1.2.6 灵敏度和重复性分析 以构建的pEASY-BNoV和pEASY-BRV进行10倍比稀释,稀释度选择107、105、103、102、101 copies·μL-1为模板进行双重RAA-LFD试验,使用pEASY-BNoV和pEASY-BRV(稀释度为107和105 copies·μL-1)作为模板进行3次双重RAA-LFD试验,以ddH2O为模板作为阴性对照。
1.2.7 临床样品检测 采用建立的双重RAA-LFD方法与PCR、qPCR方法检测168份腹泻样本,并用ddH2O为模板作为阴性对照,以质粒标准品作阳性对照,比较3种检测方法的符合性。
2 结果 2.1 反应体系和条件的优化通过引物和探针的优化,确定BNoV上、下游引物(10 μmol·L-1)各1 μL,BRV上、下游引物(10 μmol·L-1)各2 μL,BNoV探针(10 μmol·L-1)0.3 μL,BRV探针(10 μmol·L-1)0.6 μL。结果显示,试验的最佳反应温度为39 ℃(图 1A)。在最佳反应温度39 ℃的条件下,分别在5、10、15、20、25、30 min的不同反应时间进行扩增,结果显示,试验的最佳反应时间为15 min(图 1B)。
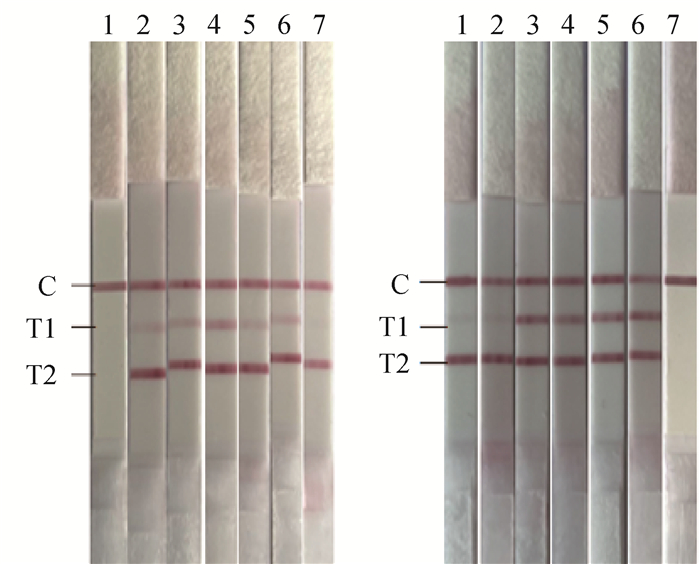
|
A. 反应温度的优化(1. 阴性对照;2. 37 ℃;3. 38 ℃;4. 39 ℃;5. 40 ℃;6. 41 ℃;7. 42 ℃);B. 反应时间的优化(1. 5 min;2. 10 min;3. 15 min;4. 20 min;5. 25 min;6. 30 min;7. 阴性对照) A. Optimization of reaction temperature (1. Negative control; 2. 37 ℃; 3. 38 ℃; 4. 39 ℃; 5. 40 ℃; 6. 41 ℃; 7. 42 ℃); B. Optimization of reaction time (1. 5 min; 2. 10 min; 3. 15 min; 4. 20 min; 5. 25 min; 6. 30 min; 7. Negative control) 图 1 RAA-LFD反应条件的优化 Fig. 1 Optimization of reaction conditions of RAA-LFD |
双重RAA-LFD特异性试验结果使用侧流层析试纸条进行分析。结果显示(图 2),只有加入了相应的病毒模板,试纸条检测线才会出现红色条带,未出现非特异性扩增,不存在交叉反应。
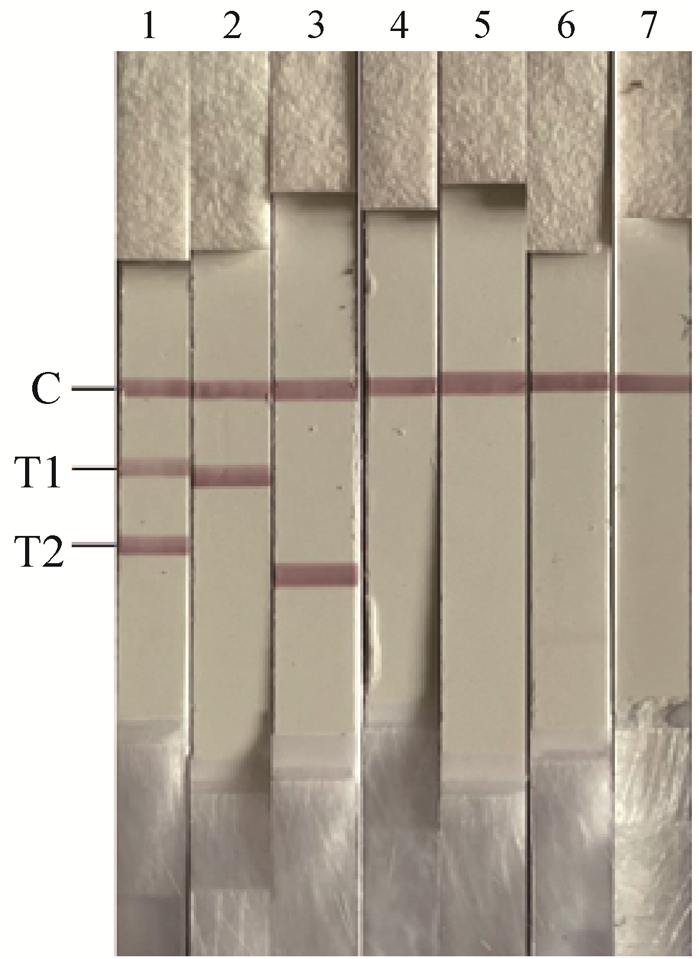
|
1. BNoV和BRV;2. BRV;3. BNoV;4. BCoV;5. BVDV;6. IBRV;7. 阴性对照 1. BNoV and BRV; 2. BRV; 3. BNoV; 4. BCoV; 5. BVDV; 6. IBRV; 7. Negative control 图 2 RAA-LFD的特异性试验 Fig. 2 Specificity test of RAA-LFD |
双重RAA-LFD敏感性及重复性试验结果使用侧流层析试纸条进行分析。结果表明(图 3),BNoV和BRV的双重RAA-LFD的敏感性均为103 copies·μL-1。BNoV和BRV标准品分别使用107、105 copies·μL-1两个稀释度的阳性标准品为模板,结果表明(图 4),该方法重复性良好。
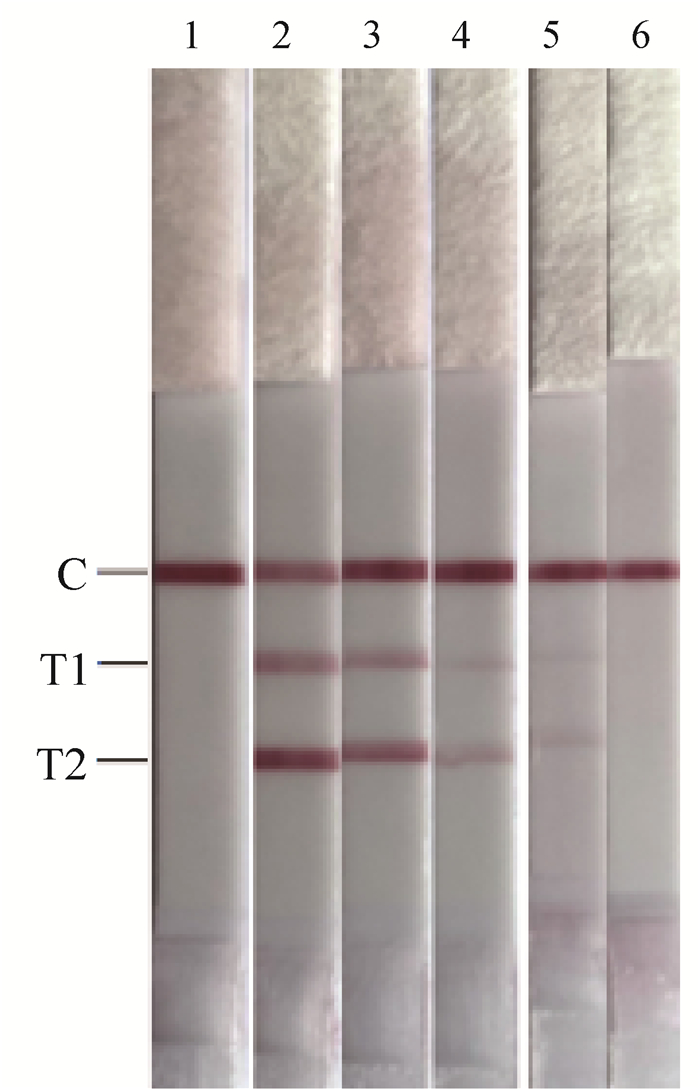
|
1. 阴性对照;2. 107 copies·μL-1;3. 105 copies·μL-1;4. 103 copies·μL-1;5. 102 copies·μL-1;6. 101 copies·μL-1 1. Negative control; 2. 107 copies·μL-1; 3. 105 copies·μL-1; 4. 103 copies·μL-1; 5. 102 copies·μL-1; 6. 101 copies·μL-1 图 3 RAA-LFD的敏感性试验 Fig. 3 Sensitivity test of RAA-LFD |
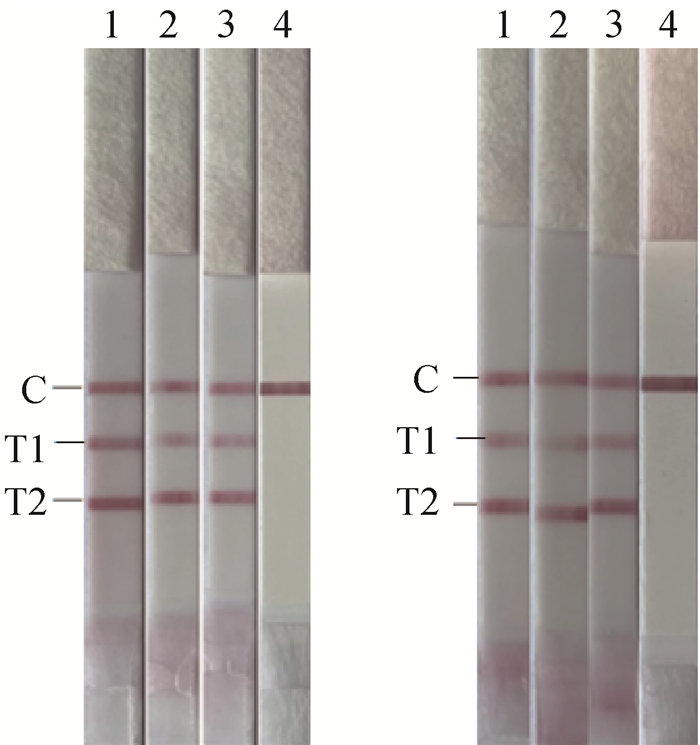
|
A. 质粒拷贝数为107 copies·μL-1 (1~3. 质粒样品;4. 阴性对照);B. 质粒拷贝数为105 copies·μL-1 (1~3. 质粒样品;4. 阴性对照) A. The copy number of plasmids was 107 copies·μL-1 (1-3. Plasmids samples; 4. Negative control); B. The copy number of plasmids was 105 copies·μL-1 (1-3. Plasmids samples; 4. Negative control) 图 4 RAA-LFD的重复性试验 Fig. 4 Repeatability test of RAA-LFD |
用建立的双重RAA-LFD方法检测从牛场采集的腹泻样品168份,使用PCR和qPCR法分别检出BNoV阳性样本70、85份,检出BRV阳性样本40、71份,使用双重RAA-LFD法检出BNoV阳性样本82份,检出BRV阳性样本41份,利用PCR方法和双重RAA-LFD法检测BNoV的阳性符合率为98.57%,阴性符合率为87.86%,总符合率为92.26%;检测BRV阳性符合率为85.00%,阴性符合率为94.53%,总符合率为92.26%;利用qPCR方法和双重RAA-LFD法检测BNoV的阳性符合率为91.76%,阴性符合率为96.39%,总符合率为94.05%;检测BRV阳性符合率为52.11%,阴性符合率为95.88%,总符合率为77.38%;表明本研究建立的双重RAA-LFD方法可用于临床样品检测。
3 讨论BNoV和BRV在一些国家和地区的牛群中广泛存在,感染会引起犊牛腹泻导致严重脱水,并可能继发感染加重疾病的严重程度[12],病毒性病原感染导致腹泻较为严重。孙吉等[13]对川西北草原的220份犊牛腹泻样进行检测,BNoV的检出率为5.9%,BRV的检出率高达40.5%,吴静等[14]调查新疆喀什地区犊牛腹泻情况,BNoV检出率为25.07%,BRV检出率9.37%,其混合感染率为24%。在新疆地区,牛群养殖规模不断扩大,病毒混合感染情况较为严重,单一病原诊断多耗时耗力,故需寻找针对多病原诊断且快速简便的方法。常用的病毒鉴定方法如PCR、qPCR和ELISA等在病毒检测中准确、可靠,但由于过程耗时,操作繁琐,无法实现基层腹泻样本的快速检测,因此本试验建立了一种可视化双重RAA-LFD快速检测方法。
RAA是具有我国自主知识产权的等温核酸扩增技术,可在恒温下快速高效地扩增DNA序列,结合LFD可肉眼观察扩增结果,不需要热循环器,只需要一个水浴锅就可以进行RAA反应[15-16],与PCR、qPCR、ELISA、常规病毒分离和LAMP等方法相比,RAA技术最大的优势在于检测时间短[17],后来旺等[18]根据金黄色葡萄球菌的保守基因(nuc)建立RAA-LFD法,20 min即可检测。王姝等[19]建立了现场快速检测鲤疱疹病毒Ⅱ型的RAA-LFD法,比RT-PCR法灵敏度高出10倍,该方法可在10 min看到目的片段的有效扩增,由此可见,RAA-LFD方法在细菌和病毒方面的快速检测已经全面发展。且RAA技术因其扩增效率高、对设备要求低以及操作简便等特点,在病原检测方面极具优势。近年来,越来越多的研究者开始关注双重荧光RAA检测方法的建立,吴江等[20]根据猪圆环病毒2型和3型的Cap基因建立了双重荧光RAA检测方法,周冬根等[21]建立了检测汉坦病毒的双重荧光RT-RAA技术。但关于同时检测两种病毒的RAA-LFD方法报道较少,且针对BNoV和BRV同时检测尚未见报道。
本试验在重组质粒标准品的基础上建立了同时检测BNoV和BRV的双重RAA-LFD方法。最佳检测时间为20 min,后来旺等[18]检测金黄色葡萄球菌最短时间为20 min,说明了其快速检测的特点;最佳的检测温度为39 ℃,与邓春冉等[22]建立的鸭星状病毒RT-RAA方法优化温度结果一致;且与BCoV、BVDV和IBRV无交叉反应,最低检测限均为103 copies·μL-1,可以看出此方法特异性较好;在临床样本检测中,阳性样本符合率较高,且检出阳性样本数与PCR的检测结果基本一致。临床样品检测结果也提示,BNoV在新疆犊牛腹泻中感染率较高,需要持续关注BNoV的流行及其带来的危害。
4 结论本研究应用RAA-LFD技术构建了对BNoV和BRV两种病毒的快速诊断方法,经过灵敏性、特异性及重复性试验,验证其在39 ℃恒温条件下20 min内可以检出,为基层地区快速检测提供了可能性,为犊牛腹泻流行的地区快速筛查、诊断和监测提供了便利工具,有利于病毒感染早期诊断,及时治疗,具有良好的应用前景。
| [1] |
陈虹豆, 张伟锋, 徐智亮, 等. 2株致犊牛腹泻大肠杆菌的分离鉴定和药敏试验[J]. 畜牧与饲料科学, 2019, 40(2): 108-112. CHEN H D, ZHANG W F, XU Z L, et al. Isolation, identification and antimicrobial susceptibility test of two strains of escherichia coli causing calf diarrhea[J]. Animal Husbandry and Feed Science, 2019, 40(2): 108-112. (in Chinese) |
| [2] |
师志海, 徐照学, 兰亚莉, 等. 牛环曲病毒河南分离株的遗传进化分析[J]. 动物医学进展, 2019, 40(10): 28-31. SHI Z H, XU Z X, LAN Y L, et al. Phylogenetic analysis of bovine torovirus Henan strains[J]. Progress in Veterinary Medicine, 2019, 40(10): 28-31. DOI:10.3969/j.issn.1007-5038.2019.10.006 (in Chinese) |
| [3] |
孙衍立. 微生态制剂在奶牛养殖中的研究进展[J]. 吉林畜牧兽医, 2021, 42(12): 87-88. SUN Y L. Research progress of microecological preparations in dairy farming[J]. Jilin Animal Husbandry and Veterinary Medicine, 2021, 42(12): 87-88. DOI:10.3969/j.issn.1672-2078.2021.12.063 (in Chinese) |
| [4] |
王文佳, 邓廷贤, 徐照学, 等. 牛星状病毒和牛诺如病毒双重PCR检测方法的建立及应用[J]. 中国预防兽医学报, 2020, 42(8): 786-790. WANG W J, DENG T X, XU Z X, et al. Establishment and application of a duplex PCR assay for detection of bovine astrovirus and bovine norovirus[J]. Chinese Journal of Preventive Veterinary Medicine, 2020, 42(8): 786-790. (in Chinese) |
| [5] |
ALMEIDA J D, CRAIG C R, HALL T E. Multiple viruses present in the faeces of a scouring calf[J]. Vet Rec, 1978, 102(8): 170-171. DOI:10.1136/vr.102.8.170 |
| [6] |
师志海, 徐照学, 兰亚莉, 等. 牛诺如病毒及牛嵴病毒双重PCR检测方法的建立及初步应用[J]. 中国动物传染病学报, 2020, 28(1): 28-32. SHI Z H, XU Z X, LAN Y L, et al. Development and preliminary application of a duplex PCR method for simult detection of bovine norovirus and bovine kobuvirus[J]. Chinese Journal of Animal Infectious Diseases, 2020, 28(1): 28-32. (in Chinese) |
| [7] |
彭志豪, 韩荞忆, 崔明江, 等. 牛轮状病毒和牛冠状病毒双重TaqMan荧光定量PCR检测方法的建立及应用[J]. 中国预防兽医学报, 2020, 42(10): 1009-1013. PENG Z H, HAN Q Y, CUI M J, et al. Establishment and application of a duplex TaqMan real-time PCR assay for simultaneous detection of bovine rotavirus and bovine coronavirus[J]. Chinese Journal of Preventive Veterinary Medicine, 2020, 42(10): 1009-1013. (in Chinese) |
| [8] |
沈思思. 犊牛常见腹泻病因的研究进展[J]. 湖南畜牧兽医, 2022(3): 51-54. SHEN S S. Research progress on the etiology of common diarrhea in calves[J]. Hunan Journal of Animal Science & Veterinary Medicine, 2022(3): 51-54. (in Chinese) |
| [9] |
姜玲玲, 牛小霞, 刘强, 等. 宁夏地区肉牛腹泻相关病毒感染状况的分析[J]. 畜牧兽医学报, 2023, 54(9): 3863-3871. JIANG L L, NIU X X, LIU Q, et al. Analysis of infection status of beef cattle diarrhea-related virus in Ningxia[J]. Acta Veterinaria et Zootechnica Sinica, 2023, 54(9): 3863-3871. (in Chinese) |
| [10] |
朱裕敏, 吴江, 王津津, 等. 病毒性神经坏死病毒实时荧光RT-RAA快速检测方法的建立[J]. 中国兽医科学, 2022, 52(7): 824-829. ZHU Y M, WU J, WANG J J, et al. Development of a real-time RT-RAA assay for rapid detection of viral nervous necrosis virus[J]. Chinese Veterinary Science, 2022, 52(7): 824-829. (in Chinese) |
| [11] |
杨洋. 五种重要动物病毒快速恒温扩增检测技术的建立与应用[D]. 北京: 中国农业科学院, 2017. YANG Y. Development and evaluation of isothermal amplification assays for rapid detection of five important animal viruses[D]. Beijing: Chinese Academy of Agricultural Sciences, 2017. (in Chinese) |
| [12] |
刘梦瑶, 王展慧, 吴浩, 等. 牛星状病毒、牛病毒性腹泻病毒1型、牛冠状病毒和牛轮状病毒四重实时荧光定量RT-PCR检测方法的建立[J]. 畜牧兽医学报, 2021, 52(7): 1942-1952. LIU M Y, WANG Z H, WU H, et al. The development of the quadruple real-time RT-PCR for bovine astroviruses, bovine viral diarrhea virus 1, bovine coronavirus and bovine rotavirus[J]. Acta Veterinaria et Zootechnica Sinica, 2021, 52(7): 1942-1952. (in Chinese) |
| [13] |
孙吉, 岳华, 汤承. 检测牛5种腹泻病毒的多重RT-PCR方法的建立及应用[J]. 畜牧兽医学报, 2022, 53(1): 209-218. SUN J, YUE H, TANG C. Establishment and application of multiplex RT-PCR for detection of five bovine diarrhea viruses[J]. Acta Veterinaria et Zootechnica Sinica, 2022, 53(1): 209-218. (in Chinese) |
| [14] |
吴静, 史晋成, 萨妮耶·库尔班, 等. 新疆喀什地区安格斯犊牛腹泻主要病毒性病原调查及牛诺如病毒全基因序列分析[J]. 中国畜牧兽医, 2022, 49(11): 4420-4428. WU J, SHI J C, SANIYE K, et al. Investigation of the main viral pathogens of angus calf diarrhea in kashgar region of Xinjiang and whole gene sequence analysis of bovine norovirus[J]. China Animal Husbandry & Veterinary Medicine, 2022, 49(11): 4420-4428. (in Chinese) |
| [15] |
孙晓红, 后来旺, 李达容, 等. 重组酶等温扩增技术在分析检测中的应用研究进展[J]. 食品与发酵工业, 2020, 46(24): 265-270. SUN X H, HOU L W, LI D R, et al. Research progress on the application of isothermal recombinase amplification in analytical detection[J]. Food and Fermentation Industries, 2020, 46(24): 265-270. (in Chinese) |
| [16] |
杨俊杰, 邬添, 柳成龙, 等. 新型等温扩增技术应用于疟原虫等寄生虫快速诊断的研究进展[J]. 中国热带医学, 2022, 22(9): 884-889. YANG J J, WU T, LIU C L, et al. Research progress of new isothermal amplification technology in rapid diagnosis of Plasmodium and other parasites[J]. China Tropical Medicine, 2022, 22(9): 884-889. (in Chinese) |
| [17] |
杨惠源, 陈国权, 温依铭, 等. 重组酶介导等温扩增技术检测鰤鱼诺卡氏菌方法的建立[J]. 大连海洋大学学报, 2023, 38(1): 104-111. YANG H Y, CHEN G Q, WEN Y M, et al. Establishment of a recombinase-aided amplification (RAA) assay for detection of Nocardia seriolae[J]. Journal of Dalian Ocean University, 2023, 38(1): 104-111. (in Chinese) |
| [18] |
后来旺, 李达容, 邓波, 等. 金黄色葡萄球菌RAA-LFD快速检测方法的建立与应用[J]. 食品科学, 2022, 43(4): 331-339. HOU L W, LI D R, DENG B, et al. Development and application of recombinase-aided amplification combined with lateral flow dipstick assay for rapid detection of Staphylococcus aureus[J]. Food Science, 2022, 43(4): 331-339. (in Chinese) |
| [19] |
王姝, 吕晓楠, 徐立蒲, 等. 鲤疱疹病毒Ⅱ型RAA-LFD检测方法的建立[J]. 检验检疫学刊, 2020, 30(3): 1-4. WANG S, LV X N, XU L P, et al. Development of recombinase-aid amplification assay combined with lateral flow dipstick for detection of the cyprinid herpesvirus-2[J]. Journal of Inspection and Quarantine, 2020, 30(3): 1-4. (in Chinese) |
| [20] |
吴江, 林彦星, 徐鹏, 等. PCV2型和PCV3型双重荧光定量PCR检测方法的建立[J]. 中国兽医科学, 2021, 51(9): 1121-1127. WU J, LIN Y X, XU P, et al. Establishment of dual fluorescence quantitative PCR for PCV2 and PCV3[J]. Chinese Veterinary Science, 2021, 51(9): 1121-1127. (in Chinese) |
| [21] |
周冬根, 罗洁, 许恒毅, 等. 双重荧光RT-RAA检测引起肾综合征出血热汉坦病毒方法的建立[J]. 中国国境卫生检疫杂志, 2022, 45(4): 253-256, 263. ZHOU D G, LUO J, XU H Y, et al. Development of a detection method of duplex fluorescent RT-RAA for hemorrhagic fever with renal syndrome hantan virus[J]. Chinese Journal of Frontier Health and Quarantine, 2022, 45(4): 253-256, 263. (in Chinese) |
| [22] |
邓春冉, 张富友, 尚佳静, 等. 鸭星状病毒3型RT-RAA快速检测方法的建立[J]. 中国动物检疫, 2022, 39(11): 105-110. DENG C R, ZHANG F Y, SHANG J J, et al. Establishment of a rapid RT-RAA assay for DAstV-3[J]. China Animal Health Inspection, 2022, 39(11): 105-110. (in Chinese) |
(编辑 白永平)



