2. 江苏农业科学院 兽医研究所, 南京 210000;
3. 兽用生物制品(泰州)国泰技术创新中心, 泰州 225300
2. Institute of Veterinary Medicine, Jiangsu Academy of Agricultural Sciences, Nanjing 210000, China;
3. GuoTai (Taizhou) Center of Technology Innovation for Veterinary Biologicals, Taizhou 225300, China
轮状病毒(rotavirus,RV)近年来严重危害全球健康,是一种人畜共患病原体。轮状病毒为呼肠孤病毒科、轮状病毒属,是一种分节段的双链核糖核苷酸(dsRNA)病毒,其结构呈二十面对称体,无囊膜,三层衣壳结构包裹11段dsRNA,分为结构蛋白(VP1~VP4、VP6~VP7)和非结构蛋白(NSP1~NSP5)。轮状病毒分为10个群(A~J),其中A、B、C及H群在世界各地流行并感染人和多种动物。其中I群来源于犬,J群来源于蝙蝠[1]。目前,人类轮状病毒A群(rotavirus-A,RVA)有较完整数据,但对猪轮状病毒(porcine rotavirus,PoRV)的了解有限。PoRV A群造成的危害最为严重,也是我国主要高发病原体[2]。G9型RVAs是G型中最常见的,被认为是猪和人类的新兴病原体,猪源G9型的所有基因组片段与人类RVAs的基因组片段相似度高,所以猪被认为是人类G9型RVAs的潜在宿主库[3]。猪轮状病毒A群是引起幼龄仔猪发生急性胃肠炎的主要病原之一,主要侵害小肠上皮细胞[4],多以粪口途径传播,其中小于10~20日龄的仔猪感染后死亡率极高,且该病原经常与其他病原混合感染。虽然有多种检测轮状病毒的方式,比如ELISA、PCR等[5-6],但目前尚无治疗轮状病毒的有效药物,接种疫苗仍是预防轮状病毒性胃肠炎暴发的重要措施。
鸟苷酸结合蛋白1(guanylate-binding protein-1,GBP1)、鸟苷酸结合蛋白2(guanylate binding protein-2,GBP2)属于鸟苷酸结合蛋白家族(GBPs),是干扰素(interferon,IFN)诱导的GTPases超家族(65~72 ku)成员,GBP1、GBP2能够被干扰素诱导表达。GBPs家族具有GTPase酶活性结构域,有多篇文献报道其活性与抗病毒作用相关[7-8],主要作用为抵抗原生动物感染[9-11]、抑制细菌增殖、抗病毒复制、抗肿瘤作用以及促进炎症反应形成,在抗病原微生物反应中发挥着重要作用。已有多项研究表明,GBP1对猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus, PRRSV)[12]、猪伪狂犬病病毒(pseudorabies virus, PRV)[13-14]、口蹄疫病毒(foot-and-mouth disease virus, FMDV)[15]、脑淋巴结心肌炎病毒(encephalomyocarditis virus, EMCV)和水疱型口炎病毒(vesicular stomatitis virus, VSV)[16]等多种病毒均有抗病毒作用。然而,GBP1、GBP2在PoRV感染过程中的作用目前还未见研究报道,基于此,探索GBP1、GBP2蛋白的未知功能及对PoRV复制的影响,深层次理解PoRV复制的分子机制,为候选抗病基因提供重要的证据。
1 材料与方法 1.1 病毒、细胞和质粒PoRV A群G9P[7]型毒株NJ2012,包含11段dsRNA(NCBI序列号MT874983~MT874993)[17]、恒河猴细胞MA104细胞和pCDNA3.1(+)真核表达质粒,均由江苏省农业科学院兽医研究所保存。
1.2 试剂GAPDH小鼠单克隆抗体、GBP1鼠多克隆抗体、GBP2兔多克隆抗体购自Proteintech公司;胎牛血清(四季青FBS)、DMEM培养基购自Gibco公司;2Phanta Master Mix高保真酶/2Phanta Max Master Mix(Dye Plus)、HiScriptⓇⅡ Q RT SuperMix for qPCR/5 HiScriptⓇⅡ Q RT SuperMix for qPCR逆转录酶、ChamQ Universal SYBR qPCR Master Mix、2×AceQ qPCR Probe Master Mixa、50×ROX Reference Dye 2b购自Vazyme公司;NSP5荧光定量PCR引物及探针购自生工公司;转染试剂Lipo3000、T4 DNA Ligase(40000 EU)连接酶、KpnⅠ、BamHⅠ、ApaⅠ和XhoⅠ限制性内切酶购自Thermo Fisher公司;RIPA蛋白裂解液和胰酶购自碧云天公司;大肠杆菌感受态Trans5α购自Transgen公司;泛GTPase酶抑制剂(CID-1067700)购自Selleck公司。
1.3 引物设计与合成分别根据猪源的GBP1基因(Gene ID: 100151938)、GBP2基因(Gene ID: 100153137),使用Snapgene软件设计引物,由擎科生物科技有限公司合成。在引物的5'端和3'端添加限制性内切酶位点KpnⅠ、BamHⅠ、ApaⅠ和XhoⅠ。引物序列见表 1、siRNA序列见表 2。
|
|
表 1 引物片段序列 Table 1 Primer fragment sequences |
|
|
表 2 siRNA片段 Table 2 siRNA fragments |
按Vazyme试剂盒说明书提取细胞内的RNA,并反转录为cDNA,反转录体系:16 μg RNA,4 μL 5 HiScriptⓇⅡ Q RT SuperMix for qPCR,反应条件为50 ℃ 15 min,85 ℃ 5 s。PCR扩增反应体系为:cDNA模板2 μL,2 Phanta Max Master Mix(Dye Plus)12.5 μL,上游引物(10 μmol ·L-1)1 μL,下游引物(10 μmol ·L-1)1 μL,加ddH2O补足25 μL。反应程序:95 ℃预变性2 min; 95 ℃变性15 s,58 ℃退火15 s,72 ℃延伸2 min;共30个循环;72 ℃再延伸5 min。最后用浓度为1%琼脂糖凝胶分析扩增产物大小。
将条带大小正确的GBP1全长、GBP2(47-592 aa)、(131-592 aa)基因片段、GBP1、GBP2的G、M、E、ME截断体和pCDNA3.1(+)空载体同时使用KpnⅠ、BamHⅠ、ApaⅠ和XhoⅠ双酶切回收,T4 DNA连接酶过夜连接后,转化大肠杆菌感受态Trans 5α。次日,挑取单菌落培养提取重组质粒,再酶切鉴定确定条带大小,并送测序分析序列的正确性。
1.5 PoRV感染对GBP1和GBP2表达影响试验将MA104细胞消化后铺于24孔板,置于37 ℃、5% CO2培养箱中,待细胞长满单层,将107 TCID50 ·mL-1毒价的PoRV(NJ 2012)病毒液按0.1 MOI接毒量感染细胞,接毒后分别在0、1、6、12和24 h收取细胞,Western blot检测PoRV病毒和GBP1、GBP2表达情况。同时设置(+)PoRV接毒组和(-)PoRV未接毒组。
1.6 GBP1、GBP2基因的过表达将MA104细胞消化后铺于24孔板,置于37 ℃、5% CO2培养箱中,待细胞长满单层,Lipo3000转染重组质粒,参照说明书进行正向转染操作。pCDNA3.1(+)、GBP1全长、GBP2(47-592 aa)、(131-592 aa)、GBP1、GBP2的G、M、E、ME截断体转染至MA104细胞后继续培养。转染后24 h,按0.1 MOI感染PoRV病毒液,接毒后12 h左右,收取细胞。通过定量PCR和Western blot方法分别检测PoRV和GBP1、GBP2基因在mRNA和蛋白水平的变化。
1.7 GBP1、GBP2基因的siRNA干扰试验前期细胞铺板、培养和转染方法同“1.6”所描述,按照转染试剂说明书进行操作。将转染重组质粒更换为GBP1、GBP2的siRNA基因片段,对照组由pCDNA3.1(+)空载体更换为公司合成的Negative control(NC)空白对照,序列见表 1。转染后24 h,按0.1 MOI接毒量感染PoRV,接毒后12 h,收取细胞,检测在mRNA水平上GBP1、GBP2和病毒基因PoRV-NSP5变化和蛋白水平上PoRV-VP6的变化,分析干扰GBP1、GBP2表达对PoRV复制的影响。
1.8 GBPs泛GTPase酶活性区域抑制试验前期细胞铺板、培养、转染及接毒方法同“1.6”所描述,分成两组,过表达组操作同“1.6”,抑制组分别在接毒前1 h和接毒后1 h加入泛GTPase酶活性抑制剂,浓度每孔10 μmol。继续培养,接毒后12后收取细胞,定量PCR和Western blot分别检测PoRV和GBP1、GBP2基因在mRNA和蛋白水平的变化。
1.9 Western blot检测蛋白样品的制备:弃掉细胞板中培养基,收取细胞,加PBS重悬,加RIPA裂解液,冰上裂解10 min,加蛋白上样缓冲液,混匀后金属浴煮沸10 min,SDS-PAGE分析并进行Western blot鉴定。用半干转膜法将蛋白转至硝酸纤维素膜上,5%脱脂奶粉封闭2 h,含0.5%吐温-20的磷酸盐缓冲液(PBST)洗膜3次,根据检测靶标选择对应抗体,4 ℃过夜孵育,次日PBST洗膜3次,再孵育对应一抗和二抗,继续室温孵育60 min,PBST洗涤后,ECL曝光检测。
1.10 荧光定量PCR检测分别使用SYBR Green法和探针法检测GBP和PoRV基因表达情况,引物序列见表 1。GBP1和GBP2基因用SYBR Green法检测体系和扩增程序。荧光定量体系:ChamQ Universal SYBR qPCR Master Mix 5 μL,qGBP1、qGBP2-F 0.2 μL,qGBP1、qGBP2-R 0.2 μL,模板cDNA 3 μL,ddH2O补足10 μL。荧光定量程序:95 ℃预变性30 s;95 ℃变性10 s,60 ℃延伸30 s,熔解曲线为默认程序。PoRV-NSP5基因用探针法检测,荧光定量体系为:2×AceQ qPCR Probe Master Mixa10 μL,50×ROX Reference Dye 2b 0.4 μL,qNSP5-F 0.4 μL,qNSP5-R 0.4 μL,TaqMan Probe 0.2 μL,Template cDNA 2 μL,ddH2O补足20 μL。荧光定量程序:95 ℃预变性5 min;95 ℃变性10 s,60 ℃延伸30 s,熔解曲线为默认程序。GBP1、GBP2的qPCR引物序列见表 3。
|
|
表 3 qPCR引物片段序列 Table 3 qPCR primer fragment sequences |
将MA104细胞消化后铺于24孔板,置于37 ℃、5% CO2培养箱中,待细胞长满单层,用5 μg ·mL-1含胰酶的DMEM培养基稀释病毒,按照10倍比稀释,从10-1稀释到10-10。每孔加入100 μL稀释好的病毒液,每个稀释度重复8孔,对照孔加入100 μL 5 μg ·mL-1含胰酶的DMEM培养基维持。每日观察病变并记录,一般观察5 d左右。按照Reed-Muench两氏法计算结果。
1.12 数据统计分析所有试验数据均采用统计学分析/试验数据均利用GraphPad Prism9软件作图,通过one-way ANOVA进行统计分析,并通过Tukey’s multiple comparisons test进行组内多重比较,其中,*表示差异较显著为(P<0.05),**表示差异显著(P<0.01),***表示差异极显著(P<0.001),****表示差异极显著(P<0.000 1)。
2 结果 2.1 重组质粒的构建以猪肾细胞反转录后的cDNA为模板,成功扩增出全长pCDNA3.1-GBP1-HIS(1 773 bp)、pCDNA3.1(+)-GBP2(47-592 aa)-HIS(1 635 bp)和pCDNA3.1(+)-GBP2(131-592 aa)-HIS(1 383 bp)片段。
以GBP1和GBP2的全长质粒为模板,成功扩增出GBP1的pCDNA3.1-GBP1-G-HIS(840 bp)、pCDNA3.1-GBP1-M-HIS(243 bp)、pCDNA3.1-GBP1-E-HIS(600 bp)、pCDNA3.1-GBP1-ME-HIS(930 bp)和GBP2的pCDNA3.1-GBP2-G-HIS(840 bp)、pCDNA3.1-GBP2-M-HIS(531 bp)、pCDNA3.1-GBP2-E-HIS(279 bp)、pCDNA3.1-GBP2-ME-HIS(933 bp)四段结构域截断体,琼脂糖凝胶分析显示与预期结果一致(图 1A、C、D)。以上重组质粒经KpnⅠ、BamHⅠ、ApaⅠ和XhoⅠ双酶切鉴定,可见与预期结果大小一致(图 1B、E、F),并且测序结果与GenBank序列一致,没有突变。
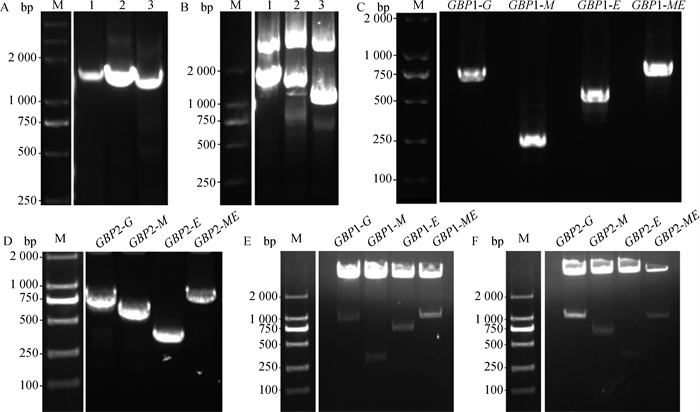
|
A. GBP1、GBP2基因的PCR扩增[1. GBP1(1 773 bp)全长基因扩增产物;2. GBP2(47aa-592aa)(1 635 bp)基因扩增产物;3. GBP2(131aa-592aa)(1383bp)基因扩增产物];B. pCDNA3.1(+)-GBP1-全长-HIS、pCDNA3.1(+)-GBP2-(47、131-592aa)-HIS重组质粒的酶切验证;C. GBP1截断体G、M、E、ME基因的PCR扩增;D. GBP2截断体G、M、E、ME基因的PCR扩增;E. pCDNA3.1(+)-GBP1-HIS截断体G、M、E、ME重组质粒的酶切验证;F. pCDNA3.1(+)-GBP2-HIS截断体G、M、E、ME重组质粒的酶切验证;M. DL2000 DNA相对分子质量标准 A. PCR amplification of GBP1 and GBP2 genes, 1. Full-length gene amplification product of GBP1 (1 773 bp), 2. Gene amplification product of GBP2 (47aa-592aa) (1 635 bp), 3. Gene amplification product of GBP2 (131aa-592aa) (1 383 bp); B. Enzymatic verification of pCDNA3.1(+)-GBP1-full-length-HIS, pCDNA3.1(+)-GBP2-(47, 131-592aa)-HIS recombinant plasmids; C. PCR amplification of GBP1 truncated G, M, E, ME genes; D. PCR amplification of GBP2 truncated G, M, E, ME genes; E. Enzymatic validation of pCDNA3.1(+)-GBP1-HIS truncator G, M, E, ME recombinant plasmid; F. Enzymatic validation of pCDNA3.1(+)-GBP2-HIS truncator G, M, E, ME recombinant plasmid; M. DL2000 DNA molecular weight standard 图 1 重组质粒构建与验证 Fig. 1 Recombinant plasmid construction and validation |
按0.1 MOI接毒量PoRV感染细胞,接毒后6、12、24 h分别收取(+)PoRV接毒组和(-)PoRV未接毒组样品,通过Western blot和相对荧光定量PCR,结果显示,接毒后6、12、24 h PoRV-VP6(40 ku)蛋白表达逐渐升高,GBP2(65 ku)蛋白表达逐渐升高,接毒组GBP1(65 ku)蛋白与未接毒组组相比,在6和12 h表达明显升高(图 2A)。与不同时间对应未接毒组相比较,接毒组的GBP1、GBP2基因mRNA拷贝数均逐渐升高,接毒后6 h,接毒组GBP1、GBP2表达量无明显变化。接毒后12 h,GBP1基因mRNA拷贝数升高7倍左右,GBP2基因mRNA拷贝数升高5倍左右。接毒后24 h,GBP1、GBP2基因表达量达到最高,GBP1基因mRNA拷贝数升高15倍左右,GBP2基因mRNA拷贝数升高12倍左右(图 2B、2C)。结果表明,在MA104细胞中,PoRV感染能上调GBP1、GBP2的表达。
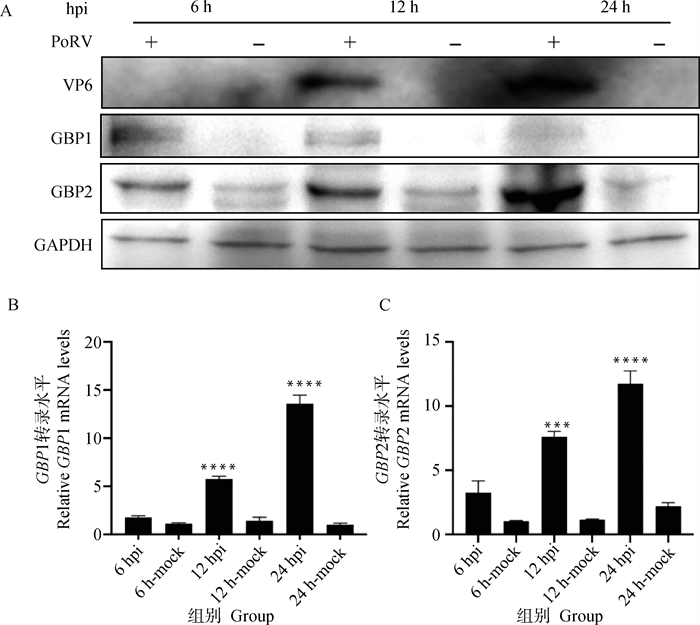
|
A. 蛋白水平上GBP1、GBP2的表达+表示PoRV接毒组;-表示PoRV未接毒组;hpi表示病毒接毒时间;B. mRNA水平上GBP1的表达;C.mRNA水平上GBP2的表达;6、12、24 hpi表示PoRV不同时间接毒组;6 h-mock、12 h-mock、24 h-mock表示不同时间未接毒组(差异性分析指同时间接毒组与未接毒组相比较)。***.P < 0.001; ****.P < 0.000 1 A. Expression of GBP1 and GBP2 at the protein level + indicates PoRV attached group; -indicates PoRV unattached group; hpi indicates the time of virus attachment; B. Expression of GBP1 at the mRNA level; C. Expression of GBP2 at the mRNA level; 6 hpi, 12 hpi, 24 hpi indicate PoRV unattached group; 6 h-mock, 12 h-mock, 24 h-mock indicate PoRV unattached group, 12 h-mock, 24 h-mock denote the uninfected group at different times (differential analysis refers to the comparison of the simultaneous indirect poisoning group with the uninfected group). ***.P < 0.001; ****.P < 0.000 1 图 2 接种病毒后不同时间点GBP1、GBP2蛋白在细胞内的复制水平 Fig. 2 Replication levels of GBP1 and GBP2 proteins in cells at different time points after virus inoculation |
针对GBP1、GBP2基因的特异性siRNA转染进MA104细胞24 h后,按0.1 MOI感染PoRV,接毒后12 h收取样品。通过Western blot、定量PCR、毒价测定等方法检测,结果显示,与无关干扰NC接毒组相比较,干扰GBP1、GBP2后的接毒组,PoRV-VP6蛋白表达量升高(图 3A),干扰GBP1、GBP2组的PoRV-NSP5基因mRNA拷贝数均升高至2倍以上(图 3B)。干扰GBP1组的毒价升高至108 TCID50 ·mL-1,干扰GBP2组的毒价升至接近108 TCID50 ·mL-1(图 3C)。结果表明,GBP1、GBP2蛋白表达下调后,PoRV复制明显升高。
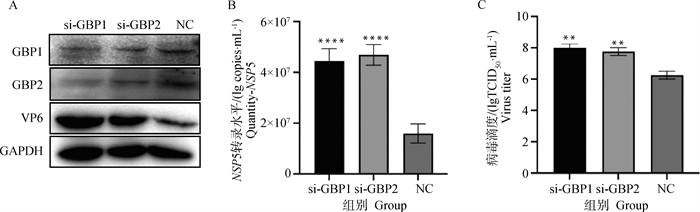
|
A. PoRV-VP6蛋白水平变化;B. PoRV-NSP5 mRNA表达的变化;C. PoRV毒价的变化。**.P < 0.01; ****.P < 0.000 1 A. Change in PoRV-VP6 protein level; B. Change in PoRV-NSP5 mRNA expression; C. Change of PoRV virulence value. **.P < 0.01; ****.P < 0.000 1 图 3 干扰GBP1、GBP2蛋白后PoRV复制水平变化 Fig. 3 Changes in PoRV replication levels after interference with GBP1 and GBP2 proteins |
将重组质粒pCDNA3.1(+)-GBP1-HIS(1-590 aa、65 ku)和pCDNA3.1(+)-GBP2-HIS(47-592 aa、60 ku)(131-592 aa、55 ku)转染进MA104细胞24 h后,按0.1 MOI感染PoRV,接毒后12 h,进行Western blot、定量PCR、毒价测定。结果显示,与转染对照质粒的接毒组(Mock组)相比,过表达GBP1、GBP2后PoRV-VP6蛋白表达下降(图 4A),过表达GBP1接毒组,PoRV-NSP5基因mRNA拷贝数降低60%,过表达GBP2(47-592 aa)PoRV-NSP5基因mRNA拷贝数降低44%、GBP2(131-592 aa)PoRV-NSP5基因mRNA拷贝数降低46%(图 4B),过表达GBP1接毒组的PoRV毒价降低至104 TCID50 ·mL-1左右,过表达GBP2接毒组PoRV毒价降至105 TCID50 ·mL-1左右(图 4C)。结果表明,过表达GBP1、GBP2蛋白抑制PoRV的复制。
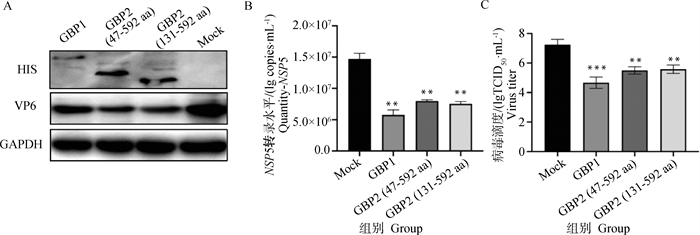
|
A. PoRV-VP6蛋白水平变化;B. PoRV-NSP5 mRNA表达的变化;C. PoRV毒价的变化。**.P < 0.01; ***.P < 0.001 A. Change in PoRV-VP6 protein level; B. Change in PoRV-NSP5 mRNA expression; C. Change of PoRV virulence value. **.P < 0.01; ***.P < 0.001 图 4 过表达GBP1、GBP2蛋白后PoRV复制水平变化 Fig. 4 Changes in PoRV replication levels after overexpression of GBP1 and GBP2 proteins |
初步验证GBP1、GBP2蛋白对PoRV的抑制作用后,将重组质粒pCDNA3.1(+)-GBP1-HIS和pCDNA3.1(+)-GBP2-HIS(47-592 aa、131-592 aa)转染进MA104细胞24 h后,以0.1 MOI感染PoRV,并在接毒后0、6、12、24 h 4个时间点分批收样,进行Western blot、定量PCR检测。结果显示,与转染对照质粒的接毒组(Mock组)相比,接毒0 h,过表达GBP1、GBP2后接毒组的PoRV-VP6蛋白未见明显条带,PoRV-NSP5基因表达无明显差异。接毒后6 h,Mock组的PoRV-VP6蛋白表达未见明显条带,过表达GBP1的PoRV-NSP5基因mRNA拷贝数表达下降38%,过表达GBP2(47-592 aa)的PoRV-NSP5基因mRNA拷贝数降低27%、GBP2(131-592 aa)的PoRV-NSP5基因mRNA拷贝数降低24%。接毒后12 h细胞生长状态最好,过表达GBP1、GBP2后接毒组的PoRV-VP6蛋白的表达均下降、过表达GBP1的PoRV-NSP5基因mRNA拷贝数表达下降51%,过表达GBP2(47-592 aa)的PoRV-NSP5基因mRNA拷贝数降低42%、GBP2(131aa-592aa)的PoRV-NSP5基因mRNA拷贝数降低40%。接毒后24 h,过表达GBP1、GBP2后,PoRV-VP6蛋白的表达下降、过表达GBP1的PoRV-NSP5基因mRNA拷贝数表达下降35%,过表达GBP2(47-592 aa)的PoRV-NSP5基因mRNA拷贝数降低20%、GBP2(131-592 aa)的PoRV-NSP5基因mRNA拷贝数降低29%(图 5A、5B)。结果表明,过表达GBP1、GBP2在接毒后12 h抑制PoRV的复制效果最明显,24 h其次,说明GBP1、GBP2在PoRV吸附、入侵等前期阶段没有明显效果,GBP对病毒基因转录水平在6 h开始有明显抑制作用,而对病毒蛋白在接毒后12、24 h发挥抑制效果。
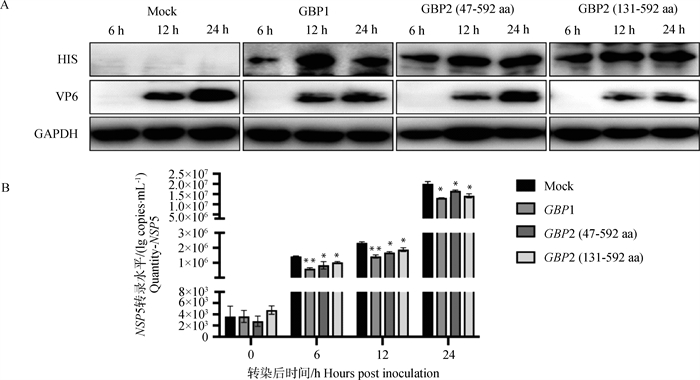
|
A.PoRV-VP6蛋白水平变化;B.PoRV-NSP5 mRNA表达的变化(每不同时间组与对应时间Mock组间比较)。*.P < 0.05;**.P < 0.01 A. Changes in PoRV-VP6 protein levels; B. Changes in PoRV-NSP5 mRNA expression (comparison between each different time group and the corresponding time Mock group).*.P < 0.05; **.P < 0.01 图 5 过表达GBP蛋白不同时间的PoRV复制水平变化 Fig. 5 Changes in PoRV replication levels at different times of overexpression of GBP protein |
利用广谱GTPase酶抑制剂泛GTPase酶抑制剂(CID-1067700),验证抑制剂对过表达GBP1、GBP2蛋白后PoRV感染的影响。将重组质粒pCDNA3.1(+)-GBP1-HIS和pCDNA3.1(+)-GBP2-HIS(47-592 aa、131-592 aa)转染进MA104细胞24 h后,分成酶活性非抑制组(Overexpression)和酶活性抑制组(Inhibition)。根据酶抑制剂推荐接种剂量10 nmol,设置6种剂量梯度。PoRV感染MA104细胞,接毒后12、24 h后两个时间点收样。通过CCK8方法、Western blot、定量PCR检测。结果显示,抑制剂加入MA104细胞后,6.25 nmol、12 h细胞状态最好,细胞活力最高,酶抑制剂毒性最小(图 6A)。Inhibition组加入抑制剂并过表达GBP1、GBP2后接毒,与Mock-Inhibition组比较,GBP1-Inhibitor、GBP2-Inhibitor组PoRV-NSP5基因mRNA拷贝数表达量均上升至1.5倍左右(图 6B)、PoRV-VP6蛋白表达上升(图 6C),说明对GBP1、GBP2抑制PoRV复制的效果被解除。Overexpression组过表达GBP1、GBP2后接毒,与Mock组相比较,过表达GBP1、GBP2组PoRV-NSP5基因mRNA拷贝数表达均下降,其中GBP1组下降33%,GBP2组下降46%(图 6B),PoRV-VP6蛋白表达也下降(图 6D),GBP1、GBP2抑制PoRV的复制。结果表明,GBP1、GBP2蛋白对PoRV的复制发挥作用需要GTPase活性区域。
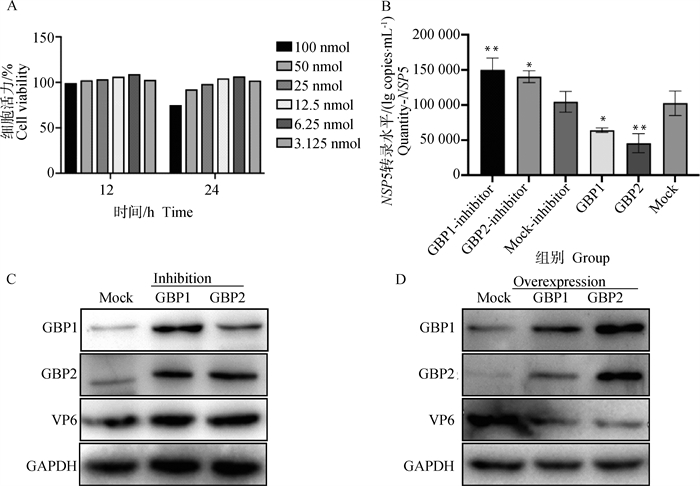
|
A.细胞活力水平(%);B.PoRV-NSP5 mRNA水平的变化(与Mock组间比较,未标记为无显著差异);C.Inhibition组PoRV-VP6、GBP1、GBP2蛋白水平变化;D.Overexpression组PoRV-VP6、GBP1、GBP2蛋白水平变化。*.P < 0.05; **.P < 0.01 A. Cell viability levels (%); B. Changes in PoRV-NSP5 mRNA levels (compared with no significant difference between Mock groups, unlabeled); C. Changes in PoRV-VP6, GBP1, and GBP2 protein levels in the Inhibition group; D. Changes in PoRV-VP6, GBP1, and GBP2 protein in the Overexpression group level changes. *.P < 0.05; **.P < 0.01 图 6 抑制GBP1、GBP2蛋白结构域后PoRV的变化 Fig. 6 Changes in PoRV after inhibition of the structural domains of GBP1 and GBP2 proteins |
根据GBP家族蛋白具有的不同结构区域,N端具有球状GTPase结构域,具有水解和结合GTP的功能,标为G区域。中间的螺旋部分起连接作用,标为M区域。C端具有GTPase效应器结构域,标为E区域[18]。将全长的GBP1(1-590 aa)、GBP2(1-592 aa)蛋白分别截断为4段,GBP1-G(1-280 aa)、GBP1-M(280-361 aa)、GBP1-E(361-560 aa)、GBP1-ME(280-560 aa)、GBP2-G(1-280 aa)、GBP2-M(281-464 aa)、GBP2-E(464-557 aa)、GBP2-ME(281-592 aa),验证对PoRV产生影响作用的区域(图 7A、7B)。将重组质粒pCDNA3.1(+)-GBP1-G/M/E/ME-HIS和pCDNA3.1(+)-GBP2-G/M/E/ME-HIS转染进MA104细胞24 h后,以0.1 MOI感染PoRV,接毒12 h后收样。通过Western blot、定量PCR检测。结果显示,与转染对照质粒的接毒组相比,过表达GBP1、GBP2的G区、M区、E区、ME区4段截断体后,过表达后G区域PoRV-VP6蛋白表达下降最明显。过表达GBP1截断体中,M区PoRV-VP6蛋白部分表达下降。过表达GBP2截断体中,M、E区PoRV-VP6蛋白部分表达下降(图 7C),过表达G区域的PoRV-NSP5基因mRNA拷贝数表达下降,GBP1-G下降54%,GBP2-G下降50%,其他区域PoRV-NSP5基因表达无明显差异(图 7D)。结果表明,GBP1和GBP2的G区域抑制PoRV的复制,说明主要发挥抑制PoRV复制作用的功能区域是G区域。
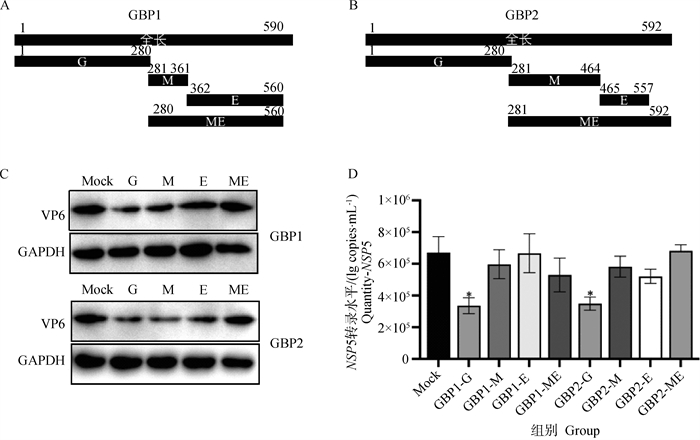
|
A、B. GBP1、GBP2截断体G、M、E、ME区结构域示意图;C. PoRV-VP6蛋白水平变化;D. PoRV-NSP5 mRNA水平的变化(与Mock组间比较,未标记为无显著差异, *.P < 0.05) A, B. Schematic diagram of the structural domains of the G, M, E, and ME regions of GBP1 and GBP2 truncates; C. Changes in PoRV-VP6 protein levels; D. Changes in PoRV-NSP5 mRNA levels (compared with the Mock group, unlabeled as not significantly different, *.P < 0.05) 图 7 GBP1、GBP2蛋白的G、M、E、ME区截断体对PoRV复制的变化 Fig. 7 Changes in the truncated G, M, E, and ME regions of GBP1 and GBP2 proteins on PoRV replication |
PoRV是养殖场最主要的病毒性腹泻病原之一[19],尽管多种安全有效的PoRV疫苗已在全国范围广泛使用,但PoRV仍严重危害生猪养殖业的发展。由于对PoRV发病机制和病毒与宿主相互作用的基础方面了解不足,阻碍了疫苗改进和有效抗病毒治疗产品的研发。本试验室在前期转录组学中发现(数据未公开),PoRV感染猪小肠上皮细胞后可显著上调GBP1、GBP2基因表达,但与哪个病毒蛋白互作,或者通过哪种信号通路来发挥作用,都尚不明确。
PoRV可以通过DAP参与许多生物过程和信号通路,如代谢过程、免疫系统过程、氨基酸代谢、MHC Ⅰ类肽组装复合物、Hippo信号通路等,以此对抗细胞的免疫机制[20]。但细胞受到病毒感染时,首先细胞会通过启动自身的一系列免疫应答反应来阻止病毒的入侵或者抑制病毒的复制,从而维持细胞自身的稳态。GBPs家族被IFN诱导后可以大量表达[21],具有抑制细胞增殖减少病理损伤的作用。GBP1抗猪瘟病毒(classical swine fever virus, CSFV)[7]、甲型流感病毒(influenza A virus, IAV)[22]、伪狂犬病病毒(PRV)都需要GTPase发挥作用。GBP2抗PRRSV、PRV、EMCV、VSV也依赖于GTPase的活性,且GBP2对弓形虫和沙门菌呈现显著抑制[9]。本研究发现PoRV感染MA104细胞后,GBP1、GBP2的转录水平显著上调。作者首先通过构建真核重组质粒转染MA104细胞实现GBP1、GBP2过表达,发现PoRV-VP6蛋白和PoRV-NSP5 mRNA基因均显著降低,病毒复制一定程度受到抑制。为进一步明确GBP1、GBP2与PoRV关系,设计特异性siRNA感染片段转染MA104细胞,沉默GBP1、GBP2基因在细胞中的表达,PoRV复制增加。由此可见,GBP1、GBP2基因能够抑制PoRV复制。通过GTPase酶活性抑制试验和GBP1、GBP2截断体过表达试验发现G区域对PoRV具有抑制复制的效果。说明GBP1、GBP2共有的N端的G区域GTPase酶功能区为其发挥抗病毒效果所必需,但具体机制尚有待深入研究。
4 结论本研究成功构建了GBP1全长、GBP2两段真核表达质粒、GBP1、GBP2的G、M、E、ME结构域截断体,并验证了其能够成功表达。随着PoRV在MA104细胞中的复制,GBP1、GBP2的转录水平显著上调。过表达GBP1、GBP2蛋白显著抑制PoRV在MA104细胞中的复制。沉默表达GBP1、GBP2蛋白显著促进PoRV在MA104细胞中的复制。通过抑制GBP1、GBP2的酶活性区域和过表达GBP1、GBP2的G、M、E、ME区截断体,发现GBP1、GBP2依赖GTPase酶的G区域来抑制PoRV的复制。该研究首次揭示了GBP1、GBP2蛋白能够发挥抗猪轮状病毒的作用,为深入研究GBP1、GBP2蛋白开辟了新道路。
| [1] |
HULL J J A, QI M P, MONTMAYEUR A M, et al. Metagenomic sequencing generates the whole genomes of porcine rotavirus A, C, and H from the United States[J]. PLoS One, 2020, 15(12): e0244498. DOI:10.1371/journal.pone.0244498 |
| [2] |
LI Y, WANG F X, KAN R C, et al. Genetic and immunological characterization of G9 group A porcine rotaviruses in China[J]. Zoonoses Public Health, 2022, 69(6): 694-703. DOI:10.1111/zph.12958 |
| [3] |
XUE R, TIAN Y, ZHANG Y, et al. Diversity of group A?rotavirus of porcine rotavirus in Shandong province China[J]. Acta Virol, 2018, 62(3): 229-234. DOI:10.4149/av_2018_216 |
| [4] |
CUI T T, THEUNS S, XIE J X, et al. Porcine rotavirus mainly infects primary porcine enterocytes at the basolateral surface[J]. Vet Res, 2019, 50(1): 110. DOI:10.1186/s13567-019-0728-x |
| [5] |
SONG D S, KANG B K, OH J S, et al. Multiplex reverse transcription-PCR for rapid differential detection of porcine epidemic diarrhea virus, transmissible gastroenteritis virus, and porcine group A rotavirus[J]. J Vet Diagn Invest, 2006, 18(3): 278-281. DOI:10.1177/104063870601800309 |
| [6] |
MEMON A M, CHEN F Z, KHAN S B, et al. Development and evaluation of polyclonal antibodies based antigen capture ELISA for detection of porcine rotavirus[J]. Anim Biotechnol, 2023, 34(5): 1807-1814. DOI:10.1080/10495398.2022.2052304 |
| [7] |
LI L F, YU J H, LI Y F, et al. Guanylate-binding protein 1, an interferon-induced GTPase, exerts an antiviral activity against classical swine fever virus depending on its GTPase activity[J]. J Virol, 2016, 90(9): 4412-4426. DOI:10.1128/JVI.02718-15 |
| [8] |
CUI W, BRAUN E, WANG W, et al. Structural basis for GTP-induced dimerization and antiviral function of guanylate-binding proteins[J]. Proc Natl Acad Sci U S A, 2021, 118(15): e2022269118. DOI:10.1073/pnas.2022269118 |
| [9] |
DEGRANDI D, KONERMANN C, BEUTER-GUNIA C, et al. Extensive characterization of IFN-induced GTPases mGBP1 to mGBP10 involved in host defense[J]. J Immunol, 2007, 179(11): 7729-7740. DOI:10.4049/jimmunol.179.11.7729 |
| [10] |
DEGRANDI D, KRAVETS E, KONERMANN C, et al. Murine guanylate binding protein 2 (mGBP2) controls Toxoplasma gondii replication[J]. Proc Natl Acad Sci U S A, 2013, 110(1): 294-299. DOI:10.1073/pnas.1205635110 |
| [11] |
陈梦阁. 小鼠巨噬细胞GBP2和GBP5在抗新孢子虫感染中的作用[D]. 长春: 吉林大学, 2021, doi: 10.27162/d.cnki.gjlin.2021.006159. CHEN M G. The roles of GBP2 and GBP5 in resistance to Neospora caninum infection in mouse macrophages[D]. Changchun: Jilin University, 2021, doi: 10.27162/d.cnki.gjlin.2021.006159.(in Chinese) |
| [12] |
DUAN H, DONG H X, WU S Y, et al. Porcine reproductive and respiratory syndrome virus non-structural protein 4 cleaves guanylate-binding protein 1 via its cysteine proteinase activity to antagonize GBP1 antiviral effect[J]. Vet Res, 2022, 53(1): 55. DOI:10.1186/s13567-022-01071-8 |
| [13] |
晏星. 猪GBP1、GBP2基因的克隆及其对PRRSV和PRV增殖的影响[D]. 武汉: 华中农业大学, 2014. YAN X. Cloning of porcine GBP1 and GBP2 genes and investigation of its anti-viral effect on PRRSV and PRV proliferation[D]. Wuhan: Huazhong Agricultural University, 2014. (in Chinese) |
| [14] |
牛颖颖. 宿主蛋白GBP1在猪伪狂犬病病毒感染过程中的作用[D]. 杨凌: 西北农林科技大学, 2020, doi: 10.27409/d.cnki.gxbnu.2020.001681. NIU Y Y. The role of host protein GBP1 in pseudorabies virus infection[D]. Yangling: Northwest A&F University, 2020, doi: 10.27409/d.cnki.gxbnu.2020.001681.(in Chinese) |
| [15] |
杨黎. 口蹄疫病毒VP1蛋白经GBP1和TP53调控病毒复制与细胞凋亡研究[D]. 南昌: 江西农业大学, 2022, doi: 10.27177/d.cnki.gjxnu.2022.000443. YANG L. Study on the regulation of VP1 protein of foot-and-mouth disease virus on virus replication and apoptosis by GBP1 and TP53[D]. Nanchang: Jiangxi Agricultural University, 2022, doi: 10.27177/d.cnki.gjxnu.2022.000443.(in Chinese) |
| [16] |
ANDERSON S L, CARTON J M, LOU J, et al. Interferon-induced guanylate binding protein-1 (GBP-1) mediates an antiviral effect against vesicular stomatitis virus and encephalomyocarditis virus[J]. Virology, 1999, 256(1): 8-14. DOI:10.1006/viro.1999.9614 |
| [17] |
常新见, 周金柱, 范宝超, 等. 猪轮状病毒NJ2012株VP8基因序列分析及原核表达[J]. 畜牧与兽医, 2020, 52(10): 68-72. CHANG X J, ZHOU J Z, FAN B C, et al. Sequence analysis and prokaryotic expression of the VP8 gene of porcine rotavirus strain NJ2012[J]. Animal Husbandry & Veterinary Medicine, 2020, 52(10): 68-72. (in Chinese) |
| [18] |
朱紫祥, 曹阳春, 曹伟军, 等. 干扰素诱导蛋白鸟苷酸结合蛋白1研究进展[J]. 病毒学报, 2014, 30(4): 456-462. ZHU Z X, CAO Y C, CAO W J, et al. Recent progress in interferon induced protein GBP1 research[J]. Chinese Journal of Virology, 2014, 30(4): 456-462. DOI:10.13242/j.cnki.bingduxuebao.002532 (in Chinese) |
| [19] |
张家祺, 甲呷格西, 周群, 等. 宏基因组学技术分析四川省集约化猪场中仔猪腹泻粪便的病毒种群[J]. 畜牧兽医学报, 2023, 54(6): 2478-2486. ZHANG J Q, JIA G G X, ZHOU Q, et al. Metagenomics analysis of virus populations in piglet diarrheal feces from intensive pig farms in Sichuan province[J]. Acta Veterinaria et Zootechnica Sinica, 2023, 54(6): 2478-2486. (in Chinese) |
| [20] |
ZHOU J Z, HUANG S M, FAN B C, et al. iTRAQ-based proteome analysis of porcine group A rotavirus-infected porcine IPEC-J2 intestinal epithelial cells[J]. J Proteomics, 2021, 248: 104354. DOI:10.1016/j.jprot.2021.104354 |
| [21] |
PLACE D E, BRIARD B, SAMIR P, et al. Interferon inducible GBPs restrict Burkholderia thailandensis motility induced cell-cell fusion[J]. PLoS Pathog, 2020, 16(3): e1008364. DOI:10.1371/journal.ppat.1008364 |
| [22] |
NORDMANN A, WIXLER L, BOERGELING Y, et al. A new splice variant of the human guanylate-binding protein 3 mediates anti-influenza activity through inhibition of viral transcription and replication[J]. FASEB J, 2012, 26(3): 1290-1300. DOI:10.1096/fj.11-189886 |
(编辑 白永平)



