雌性动物卵巢卵泡的发育及排卵与生殖性能密切相关[1]。颗粒细胞(GCs)在卵泡的募集、选择、排卵和闭锁中起着至关重要的作用[2]。GCs分泌的雌激素(E2)促进卵母细胞和卵泡的发育[3-4]。研究表明,反刍动物卵巢卵泡发育是一个高度协调和营养敏感的过程[5],其中氨基酸摄入是影响卵泡发育和决定排卵率的一个关键因素[6]。Han等[7-8]发现,L-半胱氨酸可以促进MG-63和MCF-7细胞增殖以及各自的雌激素反应元件(ERE)活性。
L-Cys作为一种非必需氨基酸,除了合成蛋白质外,L-Cys可作为谷胱甘肽的前体,是一种重要的抗氧化剂[9]。许多研究证实,通过饮食、营养补充剂或药物使用L-Cys,可以提高雌性动物的生殖性能[10-11]。前人研究表明,添加100 μmol·L-1的L-Cys衍生物N-乙酰-半胱氨酸可促进绵羊卵巢GCs增殖[12]。但关于L-Cys通过调控卵巢GCs的增殖和凋亡从而影响动物繁殖性能的研究尚未见报道。因此,本试验通过研究不同浓度L-Cys对绵羊GCs增殖、凋亡的影响,为L-Cys对绵羊卵泡发育及排卵的调控机制提供理论依据,同时也为营养调控繁殖提供理论参考依据。
1 材料与方法 1.1 采集卵巢于河北省唐县瑞丽屠宰场采集新鲜的母羊卵巢(年龄为1岁龄的小尾寒羊),用生理盐水冲洗干净后立即放入含1%双抗的37 ℃缓冲盐水溶液中,在4 h内运回实验室
1.2 试验方法1.2.1 细胞培养 用预热的37 ℃,75%酒精和生理盐水各冲洗卵巢3次。用无菌刀片划破表面直径为2~8 mm的卵泡,获取卵泡液,将卵泡悬浮液在1 500×g离心10 min后立即收集颗粒细胞。用血细胞计数器计数,将GCs以2×105个·孔-1的密度接种于T25细胞培养瓶中,添加5 mL的10%完全培养基在37 ℃和5% CO2的恒温培养箱中培养48 h,每24 h更换1次培养基。
将GCs以3×106个·孔-1接种于6孔板中,检测不同L-Cys浓度对类固醇合成的影响,以及GCs增殖凋亡和类固醇生成相关基因/蛋白的表达。在每次处理中,将细胞分为5个不同浓度的L-Cys处理组,每组3个重复。GCs培养基中加入10%胎牛血清和1%链霉素/青霉素混合物,直到细胞融合率达到80%,取出培养基。用1×PBS洗涤细胞,然后在细胞中分别加入0、100、300、500和700 μmol·L-1的L-Cys再培养48 h。处理48 h后,收集细胞上清液和GCs进行后续测量。
1.2.2 绵羊卵巢GCs鉴定 采用免疫荧光染色法鉴定特异表达于GCs的FSHR。将GCs按3×105个·孔-1的密度接种到细胞6孔板中,在恒温培养箱中培养48 h。当70%的细胞贴壁时,用4%多聚甲醛固定15 min。用0.2% Triton浸透10 min,后在室温下用2%牛血清白蛋白(BSA)阻断30 min。然后,用兔抗FSHR在4 ℃下孵育过夜。一抗孵育,再与小鼠抗兔IgG/Bio抗体37 ℃孵育90 min。然后使用DAPI染液避光孵育10 min。使用荧光显微镜观察细胞染色情况。
1.2.3 GCs增殖活力检测 采用96孔板,以1× 105个·孔-1的密度接种GCs,分为5组,每组6个重复,观察不同浓度L-Cys对GCs增殖的影响。药物添加48 h后,并根据说明书每孔加入CCK-8溶液,温育2.5 h后,测定450 nm时各孔液体的吸光度值,并用公式计算细胞活力。
1.2.4 GCs凋亡检测 将各组细胞1 500 r·min-1离心10 min,加70%乙醇4 ℃固定过夜,加500 μL的Binding Buffer悬浮细胞,加入5 μL Annexin V-FITC混匀后,加入5 μL Propidium Iodide固定细胞进行染色,37 ℃避光反应10 min,采用BD Accuri C6流式细胞仪进行分析,并使用FlowJo 7.6软件处理数据。
1.2.5 E2及P4检测 收集各组细胞上清液各1 mL于干净EP管中,使用ELISA(江苏晶美生物科技有限公司)试剂盒检测细胞培养基上清液中的E2 (JLC02368)和P4(JLC10263)浓度。P4试剂盒灵敏度为1.0 ng·mL-1板内和板间变异系数均小于15%,E2试剂盒灵敏度为1.0 pg·mL-1组内和组间变异系数分别小于10%。
1.2.6 总RNA提取和cDNA合成 使用高纯RNA组织试剂盒(北京全式金生物技术股份有限公司,ER501-01-V2)提取各组细胞RNA并选取OD260 nm/OD280 nm值在1.8~2.0之间的样品进一步分析。使用反转录试剂盒(北京全式金生物技术有限公司,AE311-03)去除基因组DNA,反转录RNA样品。
1.2.7 实时荧光定量(RT-qPCR) 根据NCBI数据库序列信息设计引物(表 1),以GAPDH为内参,采用RT-qPCR检测L-Cys对绵羊GCs中增殖基因PCNA、CCNB1、CCND2,凋亡基因BAX、Caspase-3、Bcl-2及和类固醇激素基因STAR、CYP11A1、CYP19A1、3β-HSD mRNA表达的影响,采用2-△△ct方法分析数据。
|
|
表 1 基因引物序列 Table 1 Primer sequences amplifying genes |
1.2.8 Western blot检测 收集各组培养48 h后的GCs,提取总蛋白。测定蛋白浓度,SDS变性,将蛋白质用10%聚丙烯酰胺凝胶进行SDS-PAGE。电泳结束后,转移分离胶到NC膜,300 mA恒流,转膜时间以目的蛋白分子大小而定。将膜完全浸没T-TBS中室温轻摇60 min。用T-BST稀释一抗,放4 ℃摇床过夜,然后T-TBS漂洗4次,每次5 min;二抗室温孵育60 min,然后T-TBS漂洗5次,每次4 min。放入化学发光仪器,充分滴加发光液曝光后拍照分析灰度值。抗体信息如表 2所示。
|
|
表 2 一抗信息 Table 2 Primary antibody information |
每个试验重复3次,数据采用SPSS 22.0版进行分析。所有数据均为正态分布的连续变量,以“平均值±标准误差(SEM)”表示。采用单因素方差分析(one way-ANOVA)对各组间的数据进行分析。P < 0.05表示差异显著。采用GraphPad prism 8.0软件制作图表。
2 结果 2.1 绵羊卵巢GCs的鉴定为了阐明L-Cys在GCs分化中的潜在作用,对绵羊GCs的分布和表达进行了鉴定。免疫荧光检测卵巢中GCs特异性标志物FSHR的表达(图 1)。红色荧光标记的细胞为FSHR阳性细胞,蓝色荧光区域为DAPI染色的细胞核。Merge提供了绿色荧光标记的FSHR和蓝色荧光标记的DAPI的覆盖层,表示GCs的高纯度。

|
A.蓝色荧光为被DAPI染色的细胞核;B.红色荧光为FSHR蛋白表达情况;C.FSHR和DAPI重叠图 A.Blue fluorescence is the nucleus stained by DAPI; B.Red fluorescence is the expression of FSHR protein; C.FSHR and DAPI overlap 图 1 绵羊GCs鉴定结果 Fig. 1 The results of identification of sheep granulosa cells |
采用CCK-8检测L-Cys对绵羊GCs增殖的影响,结果见图 2。由图 2可知,添加L-Cys后各组GCs的增殖活力均显著高于对照组(P < 0.05)。其中,300 μmol·L-1和500 μmol·L-1组间GCs增殖活力差异不显著(P>0.05),但均显著高于0 μmol·L-1和700 μmol·L-1组(P < 0.05)。

|
不同字母表示差异显著(P < 0.05),相同字母表示差异不显著(P>0.05),下同 The different letters indicate the significant difference (P < 0.05), the same letter indicate no significant difference (P>0.05), the same as below 图 2 不同浓度L-Cys处理48 h后对绵羊颗粒细胞增殖的影响 Fig. 2 Effects of different concentrations L-Cys on the proliferation of ovine granulosa cells treated for 48 h |
利用Annexin V-FITC检测L-Cys对绵羊GCs凋亡的影响,结果见图 3和图 4。图 3A、3B、3C、3D和3E分别为0、100、300、500和700 μmol·L-1组颗粒细胞凋亡结果。由图 4可知,100、300和500 μmol·L-1处理组的GCs 48 h后凋亡率显著低于对照组(P < 0.05),其中100 μmol·L-1组细胞凋亡率最低;700 μmol·L-1组细胞凋亡率与对照组之间差异不显著(P>0.05)。

|
A, B, C, D, E分别为0、100、300、500、700 μmol·L-1 L-Cys对绵羊GCs凋亡的影响。Q3-1为机械损伤致死细胞,Q3-2为晚期凋亡细胞,Q3-3为活细胞,Q3-4为早期凋亡细胞。不同颜色代表荧光染色强度,Q3-1和Q3-4表示染色结果为单阳,Q3-2表示双阳,Q3-3表示未染色 A, B, C, D, E are the effect of 0, 100, 300, 500, 700 μmol· L-1 L-Cys on apoptosis of sheep GCs. Q3-1 is the mechanical injury lethal cells, Q3-2 is the late apoptotic cells, Q3-3 is the living cells, and Q3-4 is the early apoptotic cells. Different colors represent fluorescence staining intensity, Q3-1 and Q3-4 indicate that the staining result is single Yang, Q3-2 indicates double Yang, and Q3-3 indicates no staining 图 3 L-Cys处理绵羊GCs凋亡结果图 Fig. 3 Results of apoptosis in L-Cys treated ovine granulosa cells |

|
图 4 不同浓度L-Cys处理48 h后对绵羊GCs凋亡的影响 Fig. 4 Effect of different concentrations of L-Cys on apoptosis of ovine granulosa cells treated for 48 h |
利用ELISA试剂盒检测L-Cys对绵羊GCs类固醇激素分泌的影响。由图 5A可知,P4含量在5个不同L-Cys剂量组呈先降低后升高的趋势。与对照组相比,添加100、300和500 μmol·L-1的L-Cys显著抑制了GCs中P4的分泌(P < 0.05),由图 5B可知,E2含量在5个不同L-Cys剂量组呈先升高后下降的趋势。其中100 μmol·L-1处理组与对照组相比有显著增高趋势(0.05<P<0.1)。

|
A. L-Cys对P4分泌的影响;B. L-Cys对E2分泌的影响 A. Effect of L-Cys on P4 secretion; B. Effect of L-Cys on E2 secretion 图 5 L-Cys对绵羊GCs分泌类固醇激素的影响 Fig. 5 The effect of L-Cys on the secretion of steroid hormones of ovine granulosa cells |
利用RT-qPCR检测L-Cys处理48 h后对GCs增殖基因及蛋白表达的影响。由图 6和图 7可知,GCs增殖相关基因PCNA、CCNB1、CCND2 mRNA及其蛋白表达在5个不同L-Cys剂量组均呈先升高后降低的趋势。与对照组相比,300 μmol·L-1处理组显著上调了增殖基因PCNA的表达(P < 0.05),100 μmol·L-1和300 μmol·L-1组显著上调增殖基因CCNB1的表达(P < 0.05),300 μmol·L-1和500 μmol·L-1处理组显著上调了增殖基因CCND2的表达(P < 0.05),并且300 μmol·L-1处理组显著上调了增殖蛋白PCNA、CCNB1和CCND2的表达(P < 0.05),与CCK-8细胞活力结果相一致。

|
A. L-Cys对绵羊GCs的PCNA mRNA表达的影响;B. L-Cys对绵羊GCs的CCNB1 mRNA表达的影响;C. L-Cys对绵羊GCs的CCND2 mRNA表达的影响 A. Effect of L-Cys on PCNA mRNA expression in sheep GCs; B. Effects of L-Cys on CCNB1 mRNA expression in sheep GCs; C. Effects of L-Cys on CCND2 mRNA expression in sheep GCs 图 6 L-Cys对绵羊GCs增殖相关基因表达的影响 Fig. 6 Effects of L-Cys on the expression of proliferation-related genes in sheep GCs |

|
A. L-Cys对绵羊GCs的PCNA表达的影响;B. L-Cys对绵羊GCs的CCNB1表达的影响;C. L-Cys对绵羊GCs的CCND2表达的影响; D. PCNA、CCNB1、CCND2蛋白表达的Western blot结果 A. The effect of L-Cys on PCNA expression in sheep GCs; B. Effects of L-Cys on CCNB1 expression in sheep GCs; C. Effects of L-Cys on CCND2 expression in sheep GCs; D.Western blot results of PCNA, CCNB1, CCND2 proteins expression 图 7 L-Cys对绵羊GCs增殖相关蛋白表达的影响 Fig. 7 Effects of L-Cys on the expression of proliferation-related proteins in sheep GCs |
利用RT-qPCR检测L-Cys处理48 h后对颗粒细胞凋亡基因及蛋白表达的影响。由图 8和图 9可知,与对照组比,100 μmol·L-1和300 μmol·L-1组的凋亡相关基因BAX、Caspase-3 mRNA及其蛋白的表达均显著下调(P < 0.05);100 μmol·L-1组显著上升抗凋亡基因Bcl-2 mRNA及其蛋白表达(P < 0.05);而300 μmol·L-1组仅显著上升抗凋亡蛋白Bcl-2的表达(P < 0.05),这与流式凋亡结果相一致。

|
A. L-Cys对绵羊GCs的BAX mRNA表达的影响;B. L-Cys对绵羊GCs的Bcl-2 mRNA表达的影响;C. L-Cys对绵羊GCs的Caspase-3 mRNA表达的影响 A. Effects of L-Cys on BAX mRNA expression in sheep GCs; B. Effects of L-Cys on Bcl-2 mRNA expression in sheep GCs; C. Effects of L-Cys on Caspase-3 mRNA expression in sheep GCs 图 8 L-Cys对绵羊GCs凋亡相关基因表达的影响 Fig. 8 Effects of L-Cys on expression of apoptosis-related genes in sheep GCs |

|
A. L-Cys对绵羊GCs的BAX表达的影响;B. L-Cys对绵羊GCs的Bcl-2表达的影响;C. L-Cys对绵羊GCs的Caspase-3表达的影响;D. BAX、Bcl-2、Caspase-3蛋白表达的Western blot结果 A. The effect of L-Cys on BAX expression in sheep GCs; B. The effect of L-Cys on Bcl-2 expression in sheep GCs; C. Effects of L-Cys on Caspase-3 expression in sheep GCs; D. Western blot results of BAX, Bcl-2, Caspase-3 proteins expression 图 9 L-Cys对绵羊GCs凋亡相关蛋白表达的影响 Fig. 9 Effects of L-Cys on expresssion of apoptosis-related proteins in sheep GCs |
利用RT-qPCR检测L-Cys处理48 h后对GCs类固醇合成基因表达的影响。由图 10和图 11可知,类固醇生成相关基因STAR、3β-HSD mRNA及其蛋白表达在5个不同L-Cys剂量组均呈先降低后升高的趋势,而P4合成基因CYP11A1和E2合成基因CYP19A1 mRNA及其蛋白表达在5个不同L-Cys剂量组均呈先升高后降低的趋势。与对照组相比,100、300和500 μmol·L-1组P4合成基因STAR、3β-HSD的mRNA及其蛋白表达水平显著下降(P < 0.05);而100 μmol·L-1组的CYP11A1的mRNA量及其蛋白显著上升(P < 0.05);100 μmol·L-1和300 μmol·L-1组的CYP19A1的mRNA及其蛋白表达水平显著高于对照组(P < 0.05)。
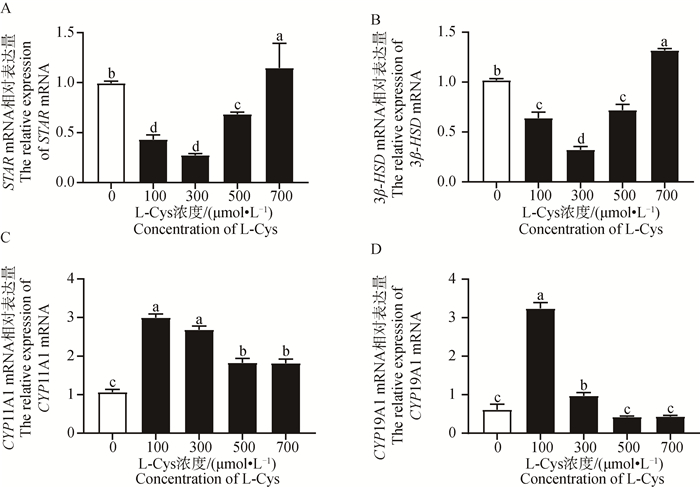
|
A. L-Cys对绵羊GCs的STAR mRNA表达的影响;B. L-Cys对绵羊GCs的3β-HSD mRNA表达的影响;C. L-Cys对绵羊GCs的CYP11A1 mRNA表达的影响;D. L-Cys对绵羊GCs的CYP19A1 mRNA表达的影响 A. Effects of L-Cys on STAR mRNA expression in sheep GCs; B. Effects of L-Cys on 3β-HSD mRNA expression in sheep GCs; C. Effects of L-Cys on CYP11A1 mRNA expression in sheep GCs; D. Effects of L-Cys on CYP19A1 mRNA expression in sheep GCs 图 10 L-Cys对绵羊GCs类固醇激素相关基因表达的影响 Fig. 10 Effects of L-Cys on the expression of steroid hormone-related genes in sheep GCs |

|
A. L-Cys对绵羊GCs的STAR表达的影响;B. L-Cys对绵羊GCs的3β-HSD表达的影响;C. L-Cys对绵羊GCs的CYP11A1表达的影响;D. L-Cys对绵羊GCs的CYP19A1表达的影响; E. STAR、3β-HSD、CYP11A1、CYP19A1蛋白表达的Western blot结果 A. The effect of L-Cys on STAR expression in sheep GCs; B. Effects of L-Cys on 3β-HSD expression in sheep GCs; C. The effect of L-Cys on CYP11A1 expression in sheep GCs; D. Effects of L-Cys on CYP19A1 expression in sheep GCs; E. Western blot results of STAR, 3β-HSD, CYP11A1, CYP19A1 proteins expression 图 11 L-Cys对绵羊GCs类固醇激素相关蛋白表达的影响 Fig. 11 Effects of L-Cys on the expression of steroid hormone-related proteins in sheep GCs |
卵巢GCs在卵泡的发育、排卵以及闭锁过程中发挥着重要作用[13],GCs分化、增殖、凋亡以及其与卵母细胞之间的联系还决定着卵母细胞的正常发育[14]。研究发现,L-Cys通过调控多种细胞信号通路来提高猪、牛、羊卵母细胞的增殖能力[15-16]。另外,曾有研究表明,L-Cys通过内质网(ER) 应激和丝裂原活化蛋白激酶(MAPK)信号传导诱导猪肠上皮细胞死亡[17]。本研究发现,100、300和500 μmol·L-1组的L-Cys显著升高绵羊GCs的增殖活力,且凋亡率显著降低,说明适量L-Cys可促进绵羊卵巢GCs增殖,抑制其凋亡,这与Han等[7-8]发现L-Cys促进MG-63和MCF-7细胞增殖的研究结果相似。
PCNA是一种DNA聚合酶重要的辅助蛋白,也是颗粒细胞DNA合成过程中促进其分裂的一种细胞内抗原。它一般在细胞增殖周期的S期中表达量最高,是评价细胞增殖快慢的一个重要指标[18]。CCNB1表达的蛋白cyclin B1主要在G2/M期中表达,并在有丝分裂中起到了重要作用[19]。CCND2是细胞周期蛋白D型家族(Cyclin Ds,CCNDs)中的成员,可正向调控细胞周期从而促进增殖[20]。本试验中,300 μmol·L-1组增殖基因PCNA、CCNB1 mRNA及其蛋白表达量显著上升,500 μmol·L-1处理组增殖基因CCND2表达量显著上升,说明L-Cys可以通过调控PCNA、CCNB1、CCND2 mRNA及其蛋白表达影响卵巢GCs增殖,这与Wang等[21]发现L-Cys可以促进神经干细胞的增殖结果相一致。
细胞凋亡的调控途径之一是线粒体介导的“内源性凋亡通路”,卵巢颗粒细胞是其发生的主要位置[22]。这个过程主要由Bcl-2蛋白家族调控,其中BAX则具有对抗Bcl-2的作用,可促进细胞的凋亡[23]。而卵泡闭锁与颗粒细胞凋亡有密切关系。前人研究发现,N-乙酰-L-半胱氨酸通过调节Bcl-2和BAX蛋白水平抑制人类癌症细胞的凋亡[24],这与本研究结果一致,本试验中100 μmol·L-1和300 μmol·L-1组BAX和Caspase-3的mRNA表达量显著下降,100、300和500 μmol·L-1组BAX、Caspase-3蛋白表达量显著下降;100 μmol·L-1组Bcl-2的mRNA表达量显著上升,100、300和500 μmol·L-1组Bcl-2的蛋白表达量显著上升。BAX和Bcl-2及其蛋白的表达量呈现相反特征,与之前的研究结果相符,说明100 μmol·L-1和300 μmol·L-1的L-Cys可以抑制GCs的凋亡。
3.2 L-Cys对绵羊卵巢GCs中P4和E2分泌及相关基因表达的影响卵巢GCs是雌性动物体内重要的类固醇激素分泌细胞,可合成P4、E2和其他一些细胞因子等,这些类固醇激素对于雌性动物的卵泡发育不可或缺[25]。但是L-Cys与绵羊卵巢GCs的功能关系尚不清晰。本研究中,在GCs培养液中分别添加不同浓度的L-Cys处理48 h,发现P4含量呈先降低后升高的趋势,并且添加100、300和500 μmol·L-1的L-Cys显著抑制了GCs中P4的分泌,这与Ogunlade等[26]发现D-核糖-L-半胱氨酸(DRLC) 在大鼠卵巢颗粒细胞中可以降低P4含量的结果一致。而E2含量则是呈先升高后下降的趋势。其中100 μmol·L-1的L-Cys促进其分泌,但无显著性差异。这与Han等[8]发现L-Cys可以促进MG-63和MCF-7细胞的ERβ信使RNA(mRNA)表达和E2反应元件(ERE)活性的结果相似。
类固醇激素合成第一步是胆固醇的转运,其中将胆固醇原料从线粒体外转运到线粒体内膜是由类固醇生成快速调节蛋白STAR(由STAR基因编码)负责,这一步是重要的限速反应[27]。有研究表明,在兔、牛和绵羊的黄体内STAR mRNA与其蛋白的合成是不可分割的,同时STAR在该组织内表达量与P4的合成呈正相关[28-29]。而CYP11A1基因编码的细胞色素P450酶可以使胆固醇变为孕烯醇酮[30],孕烯醇酮在3β-HSD的催化下转化为有活性的P4和雄烯二酮[31],雄烯二酮在CYP19A1基因编码的细胞色素芳香化酶的催化下变成E2[32]。前人研究表明,抗氧化物通过改变牛卵巢中STAR、3β-HSD和CYP19A1基因的表达量来调控P4和E2变化[33-34]。这与本研究结果一致,本研究中,添加100 μmol·L-1和300 μmol·L-1的L-Cys显著抑制了基因STAR、3β-HSD mRNA及其蛋白表达,添加100 μmol·L-1的L-Cys显著促进了基因CYP11A1和CYP19A1的mRNA表达,添加300 μmol·L-1的L-Cys显著促进了CYP11A1和CYP19A1蛋白的表达。说明L-Cys通过抑制P4合成酶编码基因STAR、3β-HSD mRNA及其蛋白表达和促进P4合成的限速酶基因CYP11A1 mRNA及其蛋白表达来抑制绵羊卵巢GCs中P4的分泌;但本试验中,L-Cys显著促进E2合成酶编码基因CYP19A1 mRNA及其蛋白表达使E2的分泌呈上升趋势但未达显著水平,这可能与物种差异有关。
4 结论 4.1 L-Cys通过上调基因PCNA、CCNB1、CCND2、Bcl-2 mRNA及其蛋白表达、下调基因BAX、Caspase-3 mRNA及其蛋白表达,促进绵羊GCs增殖,抑制其凋亡。
4.2 L-Cys通过下调基因STAR、3β-HSD mRNA及其蛋白表达以及上调基因CYP11A1 mRNA及其蛋白表达抑制P4的分泌。
| [1] |
SUN S, LIU S M, LUO J, et al. Repeated pregnant mare serum gonadotropin-mediated oestrous synchronization alters gene expression in the ovaries and reduces reproductive performance in dairy goats[J]. Reprod Domest Anim, 2019, 54(6): 873-881. DOI:10.1111/rda.13439 |
| [2] |
WANG Y, DUAN C H, GUO Y X, et al. Effects of glucose on glycolysis and steroidogenesis as well as related gene expression in ovine granulosa cells in vitro[J]. Small Ruminant Res, 2022, 215: 106766. DOI:10.1016/j.smallrumres.2022.106766 |
| [3] |
AN R, WANG X F, YANG L, et al. Polystyrene microplastics cause granulosa cells apoptosis and fibrosis in ovary through oxidative stress in rats[J]. Toxicology, 2021, 449: 152665. DOI:10.1016/j.tox.2020.152665 |
| [4] |
AN X P, MA H D, LIU Y H, et al. Effects of miR-101-3p on goat granulosa cells in vitro and ovarian development in vivo via STC1[J]. J Anim Sci Biotechnol, 2020, 11: 102. DOI:10.1186/s40104-020-00506-6 |
| [5] |
WALSH S W, MATTHEWS D, BROWNE J A, et al. Acute dietary restriction in heifers alters expression of genes regulating exposure and response to gonadotrophins and IGF in dominant follicles[J]. Anim Reprod Sci, 2012, 133(1-2): 43-51. DOI:10.1016/j.anireprosci.2012.06.012 |
| [6] |
COMIN A, PERIC T, MONTILLO M, et al. Luteal activity and effect of dietary energy restriction on follicular development in lactating cows[J]. Reprod Domest Anim, 2017, 52(4): 632-639. DOI:10.1111/rda.12959 |
| [7] |
HAN N R, KIM H Y, YANG W M, et al. Glutamic acid ameliorates estrogen deficiency-induced menopausal-like symptoms in ovariectomized mice[J]. Nutr Res, 2015, 35(9): 774-783. DOI:10.1016/j.nutres.2015.06.006 |
| [8] |
HAN N R, KIM N R, KIM H M, et al. Cysteine prevents menopausal syndromes in ovariectomized mouse[J]. Reprod Sci, 2016, 23(5): 670-679. DOI:10.1177/1933719115612133 |
| [9] |
YIN J, REN W K, YANG G, et al. L-Cysteine metabolism and its nutritional implications[J]. Mol Nutr Food Res, 2016, 60(1): 134-146. DOI:10.1002/mnfr.201500031 |
| [10] |
CLEMENTE PLAZA N, REIG GARCÍA-GALBIS M, MARTÍNEZ-ESPINOSA R M. Effects of the usage of L-cysteine (L-Cys) on human health[J]. Molecules, 2018, 23(3): 575. DOI:10.3390/molecules23030575 |
| [11] |
MOHAMMADI H, FARZINPOUR A, VAZIRY A. Reproductive performance of breeder quails fed diets supplemented with L-cysteine-coated iron oxide nanoparticles[J]. Reprod Domest Anim, 2017, 52(2): 298-304. DOI:10.1111/rda.12902 |
| [12] |
李书元. 褪黑素和N-乙酰半胱氨酸对绵羊卵泡细胞增殖的影响[D]. 兰州: 西北民族大学, 2022. LI S Y. Effects of Melatonin and N-acetyl cysteine on the proliferation of sheep follicle cells[D]. Lanzhou: Northwest Minzu University, 2022. (in Chinese) |
| [13] |
HAO E Y, WANG D H, CHANG L Y, et al. Melatonin regulates chicken granulosa cell proliferation and apoptosis by activating the mTOR signaling pathway via its receptors[J]. Poult Sci, 2020, 99(11): 6147-6162. DOI:10.1016/j.psj.2020.08.001 |
| [14] |
MONTE A P O, BEZERRA MÉ S, MENEZES V G, et al. Involvement of phosphorylated Akt and FOXO3a in the effects of growth and differentiation Factor-9(GDF-9) on inhibition of follicular apoptosis and induction of granulosa cell proliferation after in vitro culture of sheep ovarian tissue[J]. Reprod Sci, 2021, 28(8): 2174-2185. DOI:10.1007/s43032-020-00409-x |
| [15] |
ELGEBALY M M, HAZAA A B M, AMER H A, et al. L-Cysteine improves bovine oocyte developmental competence in vitro via activation of oocyte-derived growth factors BMP-15 and GDF-9[J]. Reprod Domest Anim, 2022, 57(7): 734-742. DOI:10.1111/rda.14113 |
| [16] |
CHOI J Y, KANG J T, PARK S J, et al. Effect of 7, 8-dihydroxyflavone as an antioxidant on in vitro maturation of oocytes and development of parthenogenetic embryos in pigs[J]. J Reprod Dev, 2013, 59(5): 450-456. DOI:10.1262/jrd.2012-134 |
| [17] |
JI Y, WU Z L, DAI Z L, et al. Excessive L-cysteine induces vacuole-like cell death by activating endoplasmic reticulum stress and mitogen-activated protein kinase signaling in intestinal porcine epithelial cells[J]. Amino Acids, 2016, 48(1): 149-156. DOI:10.1007/s00726-015-2071-5 |
| [18] |
李伊健, 尉斌艳, 何雨彤, 等. PCNA、AR和INHA基因在藏羊和小尾寒羊睾丸中的表达差异[J]. 中国草食动物科学, 2022, 42(4): 27-30, 77. LI Y J, WEI B Y, HE Y T, et al. Differential expression of PCNA, AR and INHA genes in the testis of Tibetan Sheep and Small-tailed Han Sheep[J]. China Herbivore Science, 2022, 42(4): 27-30, 77. (in Chinese) |
| [19] |
朱文文, 肖葛琼. CDK1和CCNB1表达水平在肝细胞癌中的临床意义[J]. 健康研究, 2023, 43(1): 70-73, 79. ZHU W W, XIAO G Q. The clinical sighificance of CDK1 and CCNB1 expression levels in hepatocellular carcinoma[J]. Health Research, 2023, 43(1): 70-73, 79. (in Chinese) |
| [20] |
MJELLE R, HEGRE S A, AAS P A, et al. Cell cycle regulation of human DNA repair and chromatin remodeling genes[J]. DNA Repair (Amst), 2015, 30: 53-67. DOI:10.1016/j.dnarep.2015.03.007 |
| [21] |
WANG Z, LIU D X, WANG F W, et al. L-Cysteine promotes the proliferation and differentiation of neural stem cells via the CBS/H2S pathway[J]. Neuroscience, 2013, 237: 106-117. DOI:10.1016/j.neuroscience.2012.12.057 |
| [22] |
KASHYAP D, GARG V K, GOEL N. Intrinsic and extrinsic pathways of apoptosis: role in cancer development and prognosis[J]. Adv Protein Chem Struct Biol, 2021, 125: 73-120. |
| [23] |
REED J C. Double identity for proteins of the Bcl-2 family[J]. Nature, 1997, 387(6635): 773-776. DOI:10.1038/42867 |
| [24] |
HO Y S, LEE H M, MOU T C, et al. Suppression of nitric oxide-induced apoptosis by N-acetyl-l-cysteine through modulation of glutathione, bcl-2, and bax protein levels[J]. Mol Carcinog, 1997, 19(2): 101-113. DOI:10.1002/(SICI)1098-2744(199707)19:2<101::AID-MC5>3.0.CO;2-I |
| [25] |
SHI J X, LIU C Y, CHEN M Y, et al. The interference effects of bisphenol A on the synthesis of steroid hormones in human ovarian granulosa cells[J]. Environ Toxicol, 2021, 36(4): 665-674. DOI:10.1002/tox.23070 |
| [26] |
OGUNLADE B, GBOTOLORUN S C, OGUNLADE A A. D-ribose-L-cysteine modulates lead acetate-induced hematobiochemical alterations, hormonal imbalance, and ovarian toxicity in adult female Wistar rats[J]. Drug Chem Toxicol, 2022, 45(4): 1606-1613. DOI:10.1080/01480545.2020.1850756 |
| [27] |
SREERANGARAJA URS D B, WU W H, KOMRSKOVA K, et al. Mitochondrial function in modulating human granulosa cell steroidogenesis and female fertility[J]. Int J Mol Sci, 2020, 21(10): 3592. DOI:10.3390/ijms21103592 |
| [28] |
PESCADOR N, SOUMANO K, STOCCO D M, et al. Steroidogenic acute regulatory protein in bovine corpora lutea[J]. Biol Reprod, 1996, 55(2): 485-491. DOI:10.1095/biolreprod55.2.485 |
| [29] |
CHENG J C, HAN X Y, MENG Q X, et al. HB-EGF upregulates StAR expression and stimulates progesterone production through ERK1/2 signaling in human granulosa-lutein cells[J]. Cell Commun Signal, 2022, 20(1): 166. DOI:10.1186/s12964-022-00983-4 |
| [30] |
ZHANG C W, ZHANG X L, XIA Y J, et al. Association between polymorphisms of the CYP11A1 gene and polycystic ovary syndrome in Chinese women[J]. Mol Biol Rep, 2012, 39(8): 8379-8385. DOI:10.1007/s11033-012-1688-7 |
| [31] |
EIMERL S, ORLY J. Regulation of steroidogenic genes by insulin-like growth factor-1 and follicle-stimulating hormone: differential responses of cytochrome P450 side-chain cleavage, steroidogenic acute regulatory protein, and 3β-hydroxysteroid dehydrogenase/isomerase in rat granulosa cells[J]. Biol Reprod, 2002, 67(3): 900-910. DOI:10.1095/biolreprod.101.002170 |
| [32] |
RYTELEWSKA E, KISIELEWSKA K, GUDELSKA M, et al. The effect of orexin a on the StAR, CYP11A1 and HSD3B1 gene expression, as well as progesterone and androstenedione secretion in the porcine uterus during early pregnancy and the oestrous cycle[J]. Theriogenology, 2020, 143: 179-190. DOI:10.1016/j.theriogenology.2019.10.012 |
| [33] |
PARWEEN S, DINARDO G, BAJ F, et al. Differential effects of variations in human P450 oxidoreductase on the aromatase activity of CYP19A1 polymorphisms R264C and R264H[J]. J Steroid Biochem Mol Biol, 2020, 196: 105507. DOI:10.1016/j.jsbmb.2019.105507 |
| [34] |
WANG M M, LI Y, MOLENAAR A, et al. Vitamin E and selenium supplementation synergistically alleviate the injury induced by hydrogen peroxide in bovine granulosa cells[J]. Theriogenology, 2021, 170: 91-106. DOI:10.1016/j.theriogenology.2021.04.015 |
(编辑 郭云雁)



