2. 黑龙江省牛病防控工程技术研究中心, 大庆 163319
2. Heilongjiang Provincial Technology Innovation Center for Bovine Disease Control and Prevention, Heilongjiang Bayi Agricultural University, Daqing 163319, China
牛病毒性腹泻-黏膜病(BVD-MD)是由牛病毒性腹泻病毒(bovine viral diarrhea virus, BVDV)感染引起的牛的一种重要传染病。BVDV感染可导致牛的急性感染,表现为发热、腹泻、黏膜溃疡、繁殖障碍等,严重威胁养牛业健康发展。持续性感染和免疫抑制也是BVDV感染的两个重要特点,为该病的净化增加了难度,同时增加了继发感染的风险,造成的间接经济损失也不容忽视[1-3]。目前,尚没有治疗该病的特效药物,疫苗接种仍然是主要的防控手段,但由于毒株具有种类多、易变异、感染率高等特点,导致该病防控效果较差。在注重疫苗研发的同时,深入探究与BVDV感染可能相关的因素,对该病的防控也许有重要价值。
肠道菌群是机体内数量庞大的微生物群体,在宿主的消化、免疫调节中发挥关键作用[4-5]。然而,当动物受到饲料转换、生产、抗生素长期使用、环境变化等应激因素影响时,容易导致正常菌群组成发生变化,造成菌群紊乱[6-9]。大量研究表明,肠道菌群与多种疾病的发生密切相关,如炎症性肠病和肠易激综合征等肠道内疾病[10-11],以及心血管疾病和神经退行性疾病等肠道外疾病[12-13]。近年,越来越多的研究也报道,肠道菌群与多种感染性疾病的发生发展密切相关,且肠道菌群紊乱可降低机体免疫应答能力,进而增加病原的易感性[14]。依据临床上多种因素容易导致肠道菌群发生紊乱,结合肠道菌群紊乱可降低机体对病原的清除能力,推测肠道内定居的微生物也许是导致BVDV高感染率的一个关键因素。因此,本研究拟通过建立抗生素诱导的肠道菌群紊乱小鼠模型,探究肠道菌群紊乱对BVDV易感性的影响,为揭示临床BVDV高感染率以及为该病的防控提供理论依据。
1 材料与方法 1.1 病毒株和实验动物CP型BVDV(NADL株)由黑龙江省牛病防控工程技术研究中心保存,SPF级BALB/c雌性小鼠36只(6~8周龄),购自北京维通利华实验动物技术有限公司。
1.2 主要试剂硫酸新霉素、氨苄青霉素、甲硝唑均购自上海慧颖科技有限公司;盐酸万古霉素购自浙江医药股份有限公司;两性霉素B购自浙江海正药业股份有限公司;山羊抗兔IgG/辣根酶标记的二抗购自北京中杉金桥生物技术有限公司;BCA蛋白浓度测定试剂盒、RIPA蛋白裂解液、超敏ECL化学发光试剂盒购自碧云天生物科技有限公司;逆转录试剂盒、SYBR荧光定量qRT-PCR试剂盒购自TaKaRa公司。TRIzol购自Invitrogen公司。
1.3 动物分组与处理菌群紊乱小鼠模型构建:依据前期研究报道[15],具体方法如下:将6只BALB/c小鼠随机分为2组,分别为抗生素处理组(Abx group)和健康对照组(Control group),每组3只。Abx组小鼠依据体重,按照100 mg·kg-1氨苄西林、50 mg·kg-1盐酸万古霉素、100 mg·kg-1甲硝唑、100 mg·kg-1硫酸新霉素、1mg·kg-1两性霉素B的剂量,每日2次,连续灌胃13 d后,收集小鼠粪便样本,进行菌群结构分析。对照组小鼠灌胃等体积生理盐水。
BVDV感染小鼠模型构建:将菌群紊乱小鼠和健康小鼠平均各分为2组,分别为Control组、BVDV组、Abx-BVDV组和Abx组,每组5只。依据课题组前期建立的方法[16],BVDV感染组小鼠腹腔注射105 TCID50的CP型BVDV,Control组和Abx组小鼠接种等体积的DMEM,于感染第7天,采集小鼠血液和十二指肠用于各项指标检测。
粪菌移植(FMT)试验:试验分为Abx-BVDV组和Abx-BVDV-FMT组,每组5只。抗生素处理13 d后,依据前期研究报道的方法对Abx-BVDV-FMT组小鼠进行FMT试验[17-18],Abx-BVDV组小鼠给予等体积的生理盐水,FMT共处理9 d。即:于移植第3天,腹腔注射BVDV,在BVDV感染期间每天移植1次。BVDV感染7 d后,采集小鼠血液和十二指肠用于各项指标检测。所有试验均获得黑龙江八一农垦大学动物伦理委员会批准。
1.4 16S rRNA测序取菌群紊乱小鼠模型构建试验中Control组和Abx组小鼠的粪便样本,采用SDS法提取菌群DNA,并检测其浓度和纯度。对V3-V4区进行扩增,通过Hi Seq2500 PE250进行测序分析。利用Uparse软件将同源性高于97%的序列聚类为同一OTUs,并依据OTU对样本进行物种分类注释。组间差异选用R软件分析,α多样性和β多样性指数反应。两组间比较采用T-test和wilcox检验。
1.5 荧光定量PCR检测小鼠血液和十二指肠中BVDV载量无菌取BVDV感染小鼠模型构建试验和FMT试验中各组小鼠血液和十二指肠(n=5),采用TRIzol法提取总RNA,并反转录为cDNA,以cDNA为模板进行荧光定量PCR反应。BVDV引物序列为,上游:5′-GAGTACAGGGTAGTCGTCAG-3′,下游:5′-CTCTGCAGCACCCTATCAGG-3′,引物由生工生物(上海)工程股份有限公司合成。反应体系:SYBRⓇ Premix Ex TaqTM Ⅱ 10 μL,水7 μL,上、下游引物各1 μL,目的模板1 μL,共20 μL体系。反应条件:95 ℃预变性30 s;95 ℃ 15 s,60 ℃ 30 s,72 ℃ 30 s,共45个循环,根据标准曲线计算出病毒载量。
1.6 Western blot检测小鼠十二指肠中BVDV E0蛋白表达无菌取BVDV感染小鼠模型构建试验和FMT试验中各组小鼠十二指肠(n=5),加入组织裂解液,提取蛋白。每孔上样40 μg,50V恒压电泳25 min、80V恒压电泳20 min,然后120V恒压电泳45 min。切下目的凝胶转至PVDF膜,5%脱脂奶粉封闭1.5 h后,分别加入鼠源BVDV E0(1∶100)一抗和兔源a-tubulin(1∶3 000)一抗,4℃孵育过夜。鼠源和兔源二抗(1∶8000),室温孵育2 h,使用ECL显色剂进行显色,于凝胶成像仪中进行曝光成像,得到灰度值,计算相对表达量。
1.7 十二指肠病理组织学检查无菌取BVDV感染小鼠模型构建试验和FMT试验中各组小鼠十二指肠(n=5),部分组织于10%甲醛中固定,7 d后取出组织,并经冲洗、脱水、透明、浸蜡、包埋、切片、展片、苏木素-伊红染色、封片等步骤,完成组织切片的制备。
1.8 统计分析数据采用SPSS 25.0统计学软件处理。计量资料用“均数±标准差(mean±SD)表示”,两组间比较采用独立样本t检验,P>0.05差异不显著,P<0.05和P<0.01认为具有统计学意义。
2 结果 2.1 抗生素处理对小鼠肠道菌群结构和丰度的影响所有样品测序共获得480 083对Reads,双端Reads质控、拼接后共产生478 700条Clean Reads,平均产生79 783条Clean Reads。对α多样性指数分析发现,与对照组相比,抗生素处理显著减少了ACE、Chao1、Simpson和Shannon指数水平(图 1A~D)。在Control组和Abx组间共存在218个共有的OTUs。与α多样性指数变化相同的是,Control组中存在205个特异的OTUs,而Abx组中仅有7个(图 1E)。β多样性(PCoA和UPGMA法聚类)分析结果表明,Control组和Abx组样本中微生物组成存在差异(图 2A、B)。进一步对物种门水平分析发现,厚壁菌门、拟杆菌门和变形菌门是相对丰度最高的三个门水平物种(图 2C)。与Control组相比,抗生素处理显著降低了厚壁菌门和拟杆菌门的相对丰度,然而显著增加了变形菌门相对丰度(图 2C~E)。
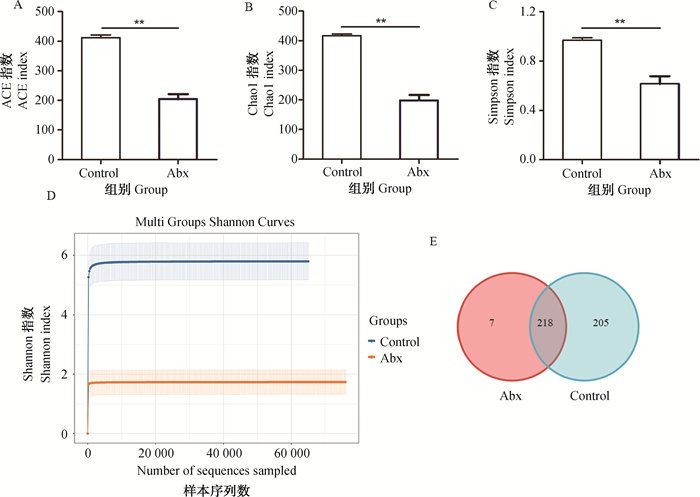
|
A. ACE指数;B. Chao 1指数;C. Simpsion指数;D. Shannon指数;E. Venn图。**. P<0.01,下同 A. ACE index; B. Chao 1 index; C. Simpsion index; D. Shannon index; E. Venn diagram.**. P < 0.01, the same as below 图 1 抗生素处理对肠道菌群多样性的影响 Fig. 1 Effects of antibiotic treatment on the diversity of gut microbiota |
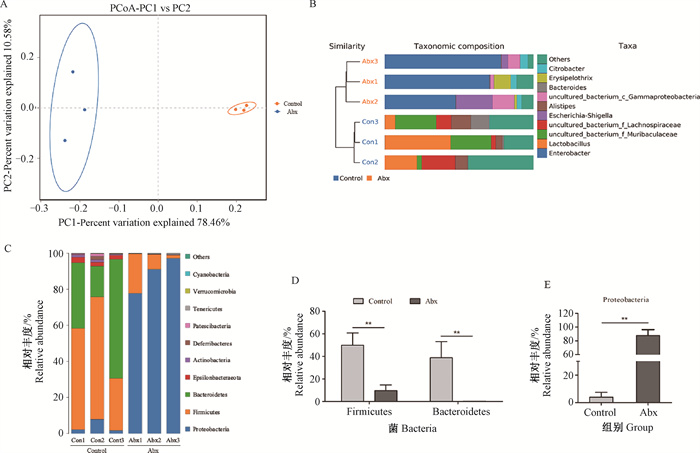
|
A. PCoA分析;B. UPGMA聚类树与柱状图结合;C. 门水平上微生物相对丰度;D. 厚壁菌门和拟杆菌门相对丰度;E. 变形菌门相对丰度 A. PCoA analysis; B. UPGMA cluster tree combined with bar graph; C. Relative abundance of dominant gut microbiota at the phylum level; D. The relative abundance of Firmicutes and Bacteroidetes; E. The relative abundance of Proteobacteria 图 2 抗生素处理对肠道菌群组成的影响 Fig. 2 Effects of antibiotic treatment on the composition of gut microbiota |
如图 3A、3B所示,与BVDV组相比,肠道菌群紊乱明显增加了小鼠血液和十二指肠中BVDV RNA水平。Western blot检测也发现,肠道菌群紊乱小鼠十二指肠中BVDV E0蛋白表达显著高于BVDV感染的健康小鼠(图 3C、3D)。
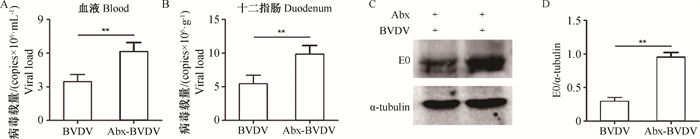
|
A. 血液中BVDV RNA水平;B. 十二指肠中BVDV RNA水平;C. 十二指肠中BVDV E0蛋白水平;D. BVDV E0蛋白灰度分析 A. BVDV RNA level in the blood; B. BVDV RNA level in the duodenum; C. BVDV E0 protein level in duodenum; D. Gray level analysis of BVDV E0 protein 图 3 肠道菌群紊乱对BVDV复制的影响 Fig. 3 Effects of gut microbiota disturbance on BVDV replication |
对BVDV感染7 d的小鼠十二指肠进行病理组织学检测发现,与Control组相比,BVDV感染导致十二指肠整体结构轻度异常,上皮细胞脱落坏死、少量炎症细胞浸润。然而,与BVDV感染的健康小鼠相比,BVDV感染的肠道菌群紊乱组小鼠的十二指肠病理学变化更为显著(图 4)。
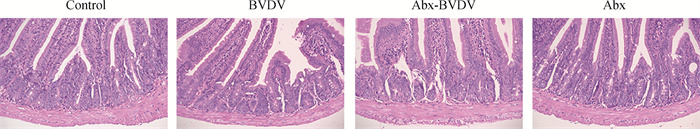
|
图 4 肠道菌群紊乱对小鼠十二指肠病理组织学变化的影响(HE染色,200×) Fig. 4 Effect of gut microbiota disturbance on histopathological changes of duodenum in mice (HE staining, 200×) |
如图 5所示,与Abx-BVDV组相比,在FMT移植给菌群紊乱小鼠后,血液和十二指肠中BVDV RNA水平均被显著抑制(图 5A、5B)。与Abx-BVDV组相比,FMT处理也显著降低了BVDV E0蛋白的表达(图 5C、5D)。病理组织学分析发现,BVDV感染菌群紊乱小鼠诱导的十二指肠整体结构异常、上皮细胞脱落坏死以及炎性细胞浸润,在FMT处理后明显改善(图 5E)。
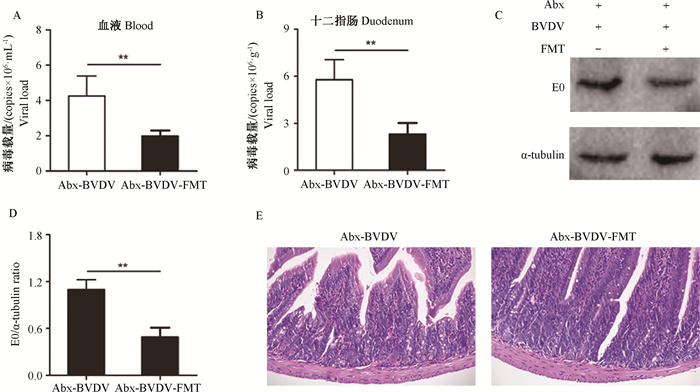
|
A. 血液中BVDV RNA水平;B. 十二指肠中BVDV RNA水平;C. 十二指肠中BVDV E0蛋白水平;D. BVDV E0蛋白灰度分析;E. 十二指肠病理变化(HE染色200×) A. BVDV RNA levels in the blood; B. BVDV RNA levels in the duodenum; C. BVDV E0 protein levels in duodenum; D. Gray level analysis of BVDV E0 protein; E. Histopathological changes of duodenum (HE staining 200×) 图 5 FMT对BVDV感染小鼠的保护作用 Fig. 5 Protective effect of FMT on the mice infected by BVDV |
肠道菌群是动物体内数量庞大、种类繁多的微生物群体,与机体的健康息息相关。本研究以抗生素诱导的肠道菌群紊乱小鼠模型为研究对象,探究了肠道菌群紊乱对BVDV感染的影响。对肠道菌群紊乱的重要指标进行检测发现,在抗生素处理13 d后,小鼠肠道内微生物的ACE、Chao1、Simpson和Shannon等α多样性指数均明显下降,表明抗生素处理减少了肠道微生物的多样性。OTU是为了便于分析,人为划分的分类单元,1个OTU通常代表 1个微生物物种。本研究中,抗生素处理也减少了OTU的数量,进一步表明抗生素具有降低微生物多样性的能力。微生物组成是评估肠道菌群紊乱的另一个重要指标。前期研究表明,抗生素诱导的肠道菌群紊乱小鼠中厚壁菌门和拟杆菌门相对丰度明显降低,然而变形菌门相对丰度却显著增加[19-20]。本研究首先通过微生物β-多样性分析发现,抗生素处理组和对照组小鼠肠道微生物可明显区分开,表明两组间存在显著的微生物群落差异。随后,在门水平上进一步分析了微生物组成的不同,发现厚壁菌门、拟杆菌门和变形菌门是相对丰度最高的3种。与前期研究结果相一致的是,抗生素处理组中厚壁菌门和拟杆菌门的相对丰度明显降低,变形菌门相对丰度显著增加。以上结果表明,抗生素诱导的肠道菌群紊乱小鼠模型被成功建立。
生产实践中,由于疾病治疗中抗生素的长期使用、饲料的转换、生产以及各类应激因素均易导致动物正常肠道微生物组成发生改变,造成菌群紊乱。近年,越来越多的研究也表明肠道菌群与感染性疾病的发生发展密切相关。如,Abt等[21]研究发现,紊乱的肠道菌群可通过抑制机体先天性免疫反应和获得性免疫反应,降低机体对流感病毒的清除能力。另外,有研究也证实肠道菌群紊乱可加重肺炎球菌和钩端螺旋体的感染[18, 22]。重要的是,Thackrag等[23]发现,紊乱的肠道菌群可诱导CD8+ T数量减少,同时增加与BVDV同科的西尼罗河病毒、登革热病毒和寨卡病毒对小鼠的易感性。本团队前期研究已经证实,BVDV感染小鼠的外周血淋巴细胞中CD8+ T数量显著减少,通过干预CD8+ T增殖和活化具有抗BVDV效果[24-25]。另外,参与BVDV致病过程中的多种分子机制,也受肠道菌群的调节,如先天性免疫、自噬等[26-27]。基于上述理论,笔者推测紊乱的肠道菌群也许将影响BVDV的感染。与该理论假设相一致的是,本研究发现在BVDV感染的肠道菌群紊乱小鼠的血液和十二指肠中BVDV载量要明显高于BVDV感染的健康小鼠,十二指肠病理学变化也进一步证实了肠道菌群紊乱能够增加BVDV的易感性。已有研究证实,采用干预肠道菌群的方微生态制剂等干预肠道菌群的策略是否具有抗BVDV效果,本研究进行了粪菌移植(FMT)试验。FMT试验是研究肠道微生物与疾病相关性的常用方法,同时也在疾病治疗中呈现较好效果[28-30]。本研究通过给菌群紊乱小鼠回补健康供体小鼠肠道微生物后,发现通过微生物恢复的方法可以对BVDV感染的小鼠起到较好的保护效果。这些结果进一步表明,肠道菌群也许是影响BVDV感染的重要因素之一。
4 结论本研究成功构建了肠道菌群紊乱小鼠模型,证实了小鼠肠道菌群紊乱具有增加BVDV易感性的作用,初步揭示了以肠道菌群为靶点的微生态制剂和抗BVDV药物的研发也许具有一定的可行性。然而,小鼠和本体动物间肠道菌群结构存在一定的差异,肠道菌群对BVDV感染本体动物的影响及其分子机制仍有待进一步研究。
| [1] |
KHODAKARAM-TAFTI A, FARJANIKISH GH. Persistent bovine viral diarrhea virus (BVDV) infection in cattle herds[J]. Iran J Vet Res, 2017, 18(3): 154-163. |
| [2] |
WATHES D C, OGUEJIOFOR C F, THOMAS C, et al. Importance of viral disease in dairy cow fertility[J]. Engineering (Beijing), 2020, 6(1): 26-33. |
| [3] |
RAN X H, CHEN X H, MA L L, et al. A systematic review and meta-analysis of the epidemiology of bovine viral diarrhea virus (BVDV) infection in dairy cattle in China[J]. Acta Trop, 2019, 190: 296-303. DOI:10.1016/j.actatropica.2018.08.031 |
| [4] |
VALDES A M, WALTER J, SEGAL E, et al. Role of the gut microbiota in nutrition and health[J]. BMJ, 2018, 361: k2179. |
| [5] |
SHI N, LI N, DUAN X W, et al. Interaction between the gut microbiome and mucosal immune system[J]. Military Med Res, 2017, 4: 14. DOI:10.1186/s40779-017-0122-9 |
| [6] |
ROCHEGUE T, HAENNI M, MONDOT S, et al. Impact of antibiotic therapies on resistance genes dynamic and composition of the animal gut microbiota[J]. Animals (Basel), 2021, 11(11): 3280. |
| [7] |
胡晓宇. 奶牛瘤胃菌群紊乱与乳腺炎的关联性及机制研究[D]. 长春: 吉林大学, 2020. HU X Y. The correlation and mechanism between rumen microbiota disturbance and mastitis in dairy cows[D]. Changchun: Jilin University, 2020. (in Chinese) |
| [8] |
张晨. 犊牛补饲对肠道微生物多样性及生长性能、血液指标的影响[D]. 呼和浩特: 内蒙古农业大学, 2020. ZHANG C. Effects of calf supplementation on intestinal microbial diversity, growth performance and blood indexes[D]. Hohhot: Inner Mongolia Agricultural University, 2020. (in Chinese) |
| [9] |
郭新羽, 沙玉柱, 蒲小宁, 等. 环境温度对动物肠道微生物菌群影响的研究进展[J]. 畜牧兽医学报, 2022, 53(9): 2858-2866. GUO X Y, SHA Y Z, PU X N, et al. Research progress on the effect of ambient temperature on intestinal Microflora of Animals[J]. Acta Veterinaria et Zootechnica Sinica, 2022, 53(9): 2858-2866. (in Chinese) |
| [10] |
VILA A V, IMHANN F, COLLIJ V, et al. Gut microbiota composition and functional changes in inflammatory bowel disease and irritable bowel syndrome[J]. Sci Transl Med, 2018, 10(472): eaap8914. DOI:10.1126/scitranslmed.aap8914 |
| [11] |
ZUO T, NG S C. The gut microbiota in the pathogenesis and therapeutics of inflammatory bowel disease[J]. Front Microbiol, 2018, 9: 2247. DOI:10.3389/fmicb.2018.02247 |
| [12] |
SINGH R K, CHANG H W, YAN D, et al. Influence of diet on the gut microbiome and implications for human health[J]. J Transl Med, 2017, 15(1): 73. DOI:10.1186/s12967-017-1175-y |
| [13] |
QUIGLEY E M M. Microbiota-brain-gut axis and neurodegenerative diseases[J]. Curr Neurol Neurosci Rep, 2017, 17(12): 94. DOI:10.1007/s11910-017-0802-6 |
| [14] |
CAI Y J, CHEN L M, ZHANG S E, et al. The role of gut microbiota in infectious diseases[J]. WIREs Mech Dis, 2022, 14(4): e1551. DOI:10.1002/wsbm.1551 |
| [15] |
ZARRINPAR A, CHAIX A, XU Z Z, et al. Antibiotic-induced microbiome depletion alters metabolic homeostasis by affecting gut signaling and colonic metabolism[J]. Nat Commun, 2018, 9(1): 2872. DOI:10.1038/s41467-018-05336-9 |
| [16] |
刘思雨, 张月莹, 黄江, 等. 小鼠感染BVDV诱导NLRP3炎症小体的表达及其对病毒复制的影响[J]. 中国农业大学学报, 2022, 27(10): 134-141. LIU S Y, ZHANG Y Y, HUANG J, et al. Differential expression of NLRP3 inflammasome induced by BVDV infection in mice and its effect on virus replication[J]. Journal of China Agricultural University, 2022, 27(10): 134-141. (in Chinese) |
| [17] |
TIAN Z H, LIU J, LIAO M Y, et al. Beneficial effects of fecal microbiota transplantation on ulcerative colitis in mice[J]. Dig Dis Sci, 2016, 61(8): 2262-2271. DOI:10.1007/s10620-016-4060-2 |
| [18] |
SCHUIJT T J, LANKELMA J M, SCICLUNA B P, et al. The gut microbiota plays a protective role in the host defence against pneumococcal pneumonia[J]. Gut, 2016, 65(4): 575-583. DOI:10.1136/gutjnl-2015-309728 |
| [19] |
HU X Y, GUO J, ZHAO C J, et al. The gut microbiota contributes to the development of Staphylococcus aureus-induced mastitis in mice[J]. ISME J, 2020, 14(7): 1897-1910. DOI:10.1038/s41396-020-0651-1 |
| [20] |
SHAO H Q, ZHANG C Y, XIAO N Q, et al. Gut microbiota characteristics in mice with antibiotic-associated diarrhea[J]. BMC Microbiol, 2020, 20(1): 313. DOI:10.1186/s12866-020-01999-x |
| [21] |
ABT M C, OSBORNE L C, MONTICELLI L A, et al. Commensal bacteria calibrate the activation threshold of innate antiviral immunity[J]. Immunity, 2012, 37(1): 158-170. DOI:10.1016/j.immuni.2012.04.011 |
| [22] |
XIE X F, LIU J X, CHEN X, et al. Gut microbiota involved in leptospiral infections[J]. ISME J, 2022, 16(3): 764-773. DOI:10.1038/s41396-021-01122-6 |
| [23] |
THACKRAY L B, HANDLEY S A, GORMAN M J, et al. Oral antibiotic treatment of mice exacerbates the disease severity of multiple flavivirus infections[J]. Cell Rep, 2018, 22(13): 3440-3453. DOI:10.1016/j.celrep.2018.03.001 |
| [24] |
LIU Y, WU C H, CHEN N N, et al. PD-1 blockade restores the proliferation of peripheral blood lymphocyte and inhibits lymphocyte apoptosis in a BALB/c mouse model of CP BVDV acute infection[J]. Front Immunol, 2021, 12: 727254. DOI:10.3389/fimmu.2021.727254 |
| [25] |
LIU Y, LIU S S, WU C H, et al. PD-1-mediated PI3K/Akt/mTOR, Caspase 9/Caspase 3 and ERK pathways are involved in regulating the apoptosis and proliferation of CD4+ and CD8+ T cells during BVDV infection in vitro[J]. Front Immunol, 2020, 11: 467. DOI:10.3389/fimmu.2020.00467 |
| [26] |
THAISS C A, ZMORA N, LEVY M, et al. The microbiome and innate immunity[J]. Nature, 2016, 535(7610): 65-74. DOI:10.1038/nature18847 |
| [27] |
LAPAQUETTE P, BIZEAU J B, ACAR N, et al. Reciprocal interactions between gut microbiota and autophagy[J]. World J Gastroenterol, 2021, 27(48): 8283-8301. DOI:10.3748/wjg.v27.i48.8283 |
| [28] |
王燕, 滕晓晓, 杨柠芝, 等. 粪菌移植法治疗非特异病原性羔羊腹泻的效果初报[J]. 畜牧兽医学报, 2020, 51(8): 1878-1885. WANG Y, TENG X X, YANG N Z, et al. Preliminary report of the therapeutic effect of fecal microbiota transplantation on non-specific pathogenic diarrhea in suckling lambs[J]. Acta Veterinaria et Zootechnica Sinica, 2020, 51(8): 1878-1885. (in Chinese) |
| [29] |
OOIJEVAAR R E, TERVEER E M, VERSPAGET H W, et al. Clinical application and potential of fecal microbiota transplantation[J]. Annu Rev Med, 2019, 70: 335-351. |
| [30] |
陈佳琦, 张晓迪, 顾招兵, 等. 粪便微生物移植对仔猪肠道屏障功能的影响及作用机制进展[J]. 畜牧兽医学报, 2021, 52(5): 1195-1207. CHEN J Q, ZHANG X D, GU Z B, et al. Effects and mechanism of faecal microbiota transplantation on intestinal barrier function in piglets[J]. Acta Veterinaria et Zootechnica Sinica, 2021, 52(5): 1195-1207. (in Chinese) |
(编辑 范子娟)



