2. 默沙东(宁波)动物保健科技有限公司, 宁波 315336;
3. 江苏省农业科学院兽医研究所, 南京 210014
2. MSD (Ningbo) Animal Health Technology Co., Ltd., Ningbo 315336, China;
3. Institute of Veterinary Medicine, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China
传染性喉气管炎病毒(infectious laryngotracheitis virus, ILTV)属于疱疹病毒科、α疱疹病毒亚科传染性喉气管炎病毒属。ILTV感染鸡后引起鸡喉气管炎(infectious laryngotracheitis, ILT),主要危害成年鸡和产蛋鸡,造成死亡和/或产蛋下降,种鸡的ILT发病呈世界性分布,世界上许多国家都有该病的发病报道,该病在我国近几年也呈散发流行趋势,不断有养殖场发生ILTV感染的报道[1-4]。临床上严重的ILTV感染往往表现为呼吸困难、喘气、咳血等,具有很高的致死性,而温和型感染主要表现为黏液性气管炎、鼻炎、结膜炎、不愿活动和低死亡率等多种形式,不论是严重感染还是温和型感染均给生产带来了严重的损失和威胁。在集约化养禽的发达国家,已使用弱毒疫苗控制了蛋鸡的ILT,但有报道称在2019年4月以来我国山东省多个地区发生了多起商品肉鸡、地方品种肉鸡等感染ILTV的病例,临床主要表现为严重的咳血、呼吸困难以及呼吸道粘膜出血和充血[3],表明ILTV感染肉鸡目前在我国呈现出散发和多发现象。
ILTV的基因组大小约为155 kb,是一种双链DNA病毒,与其他疱疹病毒一样,基因组包括长独特区、短独特区以及两端的反向重复序列等结构,编码大量的糖蛋白以及与毒力和病毒复制有关的蛋白。gB和UL32基因编码病毒粒子的表面糖蛋白,其中gB不仅是病毒感染所必需的糖蛋白,而且是一种主要的保护性抗原,可诱导体液免疫[5],并且在病毒感染过程中诱导膜融合和病毒穿入[6-7]。糖蛋白gD作为疱疹病毒的受体对于病毒结合到敏感细胞的表面是必需的[8-9]。糖蛋白gB和gD也是ILTV等疱疹病毒的保护性抗原,可诱导中和抗体和细胞免疫反应,是重要的免疫原蛋白[10-11]。而糖蛋白gE/gI对于ILTV在细胞与细胞之间扩散具有显著的促进作用,缺失gE/gI的ILTV病毒噬斑形成能力显著下降,仅能够在单细胞内增殖[12]。TK基因是ILTV的主要毒力基因[13],缺失TK可以使ILTV的致病力减弱但仍然保持良好的免疫原性[14]。ICP4基因参与激活病毒早/晚期基因的表达,与病毒毒力存在关联[15]。糖蛋白gC是ILTV主要的表面抗原蛋白,对病毒的复制是非必需的,但缺失gC可以使ILTV对鸡的致病力减弱,并且增强先天性和特异性免疫反应[16]。糖蛋白gG是ILTV的毒力因子,缺失gG可以使病毒毒力显著减弱[17]。此外还有报道糖蛋白gD、gB、gH、gL、gK、gM、gN等参与了疱疹病毒致病性的形成[18-21]。
ILTV野毒株的毒力差异很大,部分毒株感染鸡后具有很高的发病率和致死率,属于强致病力毒株,而感染后症状轻微或不明显、无致死率的毒株属于温和型毒株,因此及时了解我国当前散发的ILTV毒株的致病性和主要抗原基因和毒力基因的系统发育和进化关系,以及筛选一株攻毒后发病稳定的强毒株用于ILTV活疫苗的效力检验,对于做好ILT的防控具有重要的临床意义。本研究对1株临床ILTV分离株的主要免疫原性基因和毒力基因进行遗传进化分析,了解其与疫苗株之间的进化亲缘关系,并在28日龄和56日龄SPF鸡测定了该毒株的致病力,其研究结果为我国有效预防和控制ILTV的感染提供了临床参考。
1 材料与方法 1.1 主要试剂与材料含1%庆大霉素的胰蛋白磷酸盐肉汤(TPB),购自Sigma公司;1-5TM 2×High Fidelity master Mix购自MCLAB公司;DNA胶回收试剂盒购自ThermoFisher公司,平末端载体pClone007试剂盒购自擎科生物科技有限公司;DNA提取试剂盒购自Qiagen公司;舒泰购自法国维克有限公司;SPF鸡胚购自济南斯帕法斯家禽有限公司;56和28日龄SPF鸡购自济南赛斯家禽科技有限公司。
PCR引物由生工生物工程(上海)股份有限公司合成(表 1)。
|
|
表 1 PCR扩增使用的引物名称和序列 Table 1 Primers name and sequence of this study used |
ILTV临床分离株WF03株由福建省农业科学院畜牧兽医研究所保存。该病毒株分离自免疫了ILTV细胞源弱毒活疫苗的黄羽肉鸡群,鸡群在40~50日龄出现了以咳血和死亡为特征的疑似ILT,发病率较高,部分鸡出现死亡。采用有限稀释法纯化病毒,将保存的ILTV病毒液以TPB连续10倍稀释,取10-1、10-2、10-3、10-4、10-5、10-6稀释度采用鸡胚尿囊膜(CAM)方式接种10日龄SPF鸡胚,每个稀释度接种6枚,接种量为0.2 mL·胚-1,弃去24 h内死亡鸡胚,继续孵化7 d,每日检查鸡胚存活情况,7 d后对存活鸡胚检查尿囊膜,死亡鸡胚和尿囊膜出现灰白色斑的鸡胚判定为阳性。取最高稀释度的阳性尿囊膜以1∶5的比例加入预冷的PBS进行研磨,反复冻融3次,12 000 r·min-1,4 ℃离心10 min,取上清病毒液采用同样方式继续纯化2次。将纯化第3次收获的阳性病毒液命名为WF03株P0代。采用CAM方式接种10日龄SPF鸡胚7 d后收获尿囊膜并按照上述方法制备病毒液,记为P1代;依次传代制备不同代次的病毒液,分别记为P2代、P3代等。
将待测EID50的病毒液以TPB连续稀释成10-3.6、10-4.2、10-4.8、10-5.4和10-6.0 5个稀释度,从高稀释度到低稀释度经CAM接种病毒液,每个稀释度接种6枚胚,每胚接种0.2 mL,置37℃继续孵化7 d,每天检查鸡胚存活情况并作记录。同时取6个SPF鸡胚以同样方式接种TPB作为阴性对照。弃去接种后24 h内的死亡鸡胚,每个稀释度应至少有4个鸡胚存活,阴性对照鸡胚在接种后第2~7天不应该有死亡出现,试验才有效。接种24 h后死亡的鸡胚判定感染阳性,接种第7天后对所有存活鸡胚进行检查,当鸡胚尿囊膜有明显增厚出现白色病斑,判为感染阳性。采用Reed-Muench法计算鸡胚半数感染量EID50,重复测定3次,至少2次测定试验成立,结果才有效。
1.3 ILTV主要基因的扩增与测序将300 mL ILTV P5代病毒液以45 000 r·min-1,4 ℃离心4.5 h,弃去上清后将沉淀物使用DNA提取试剂盒按照说明书提取基因组DNA后,采用表 1中的引物分别对免疫原性基因gB、UL32、gD、gC和参与毒力形成的基因TK、ICP4、gG、gE、gI、gH、gL、gK、gM、gN进行PCR扩增。反应体系:1-5TM 2×High Fidelity master Mix 25 μL,上、下游引物各1 μL,DNA模板2 μL,ddH2O 21 μL;反应条件:98 ℃ 2 min;98 ℃ 10 s,56 ℃ 15 s,72 ℃ 30 s,共30个循环;72 ℃ 5 min。扩增结束后,将PCR产物进行1%琼脂糖凝胶电泳,将目的条带切胶并利用DNA胶回收试剂盒回收PCR产物。
将回收到的PCR产物连接到平末端载体pClone007中转化感受态细胞DH5α后涂布含氨苄抗生素的平板,每个基因均筛选5个克隆子(菌液)送生工生物工程(上海)股份有限公司进行测序。
1.4 关键抗原基因和毒力基因遗传进化分析从NCBI下载ILTV国内外主要分离株和疫苗株的基因组序列(表 2),使用DNAStar软件和Geneious软件对参考毒株和分离毒株的免疫原性基因gB、UL32、gD、gC和毒力相关基因TK、ICP4、gG、gE、gI、gH、gL、gK、gM、gN进行分析和串联拼接,对拼接后的序列采用MEGA7软件中的ClastalW算法对所有序列进行多重序列比对后,以邻接(neighbor-Joining, NJ)法中重复数1 000计算bootstrap值构建免疫原性基因gB-gC-gD-UL32和毒力相关基因gE-gI-TK-ICP4-gG-gH-gK-gL-gM-gN的进化树。
|
|
表 2 ILTV参考毒株信息 Table 2 ILTV reference strain information |
将测定过EID50的WF03株P5代病毒液用TBP稀释后以气管攻毒途径对SPF鸡进行感染。选取90羽28日龄SPF鸡随机分为5组,其中第1~4组(每组20羽)以气管内注射途径分别以104.5、104.0、103.5和103.0 EID50·羽-1的剂量接种WF03株0.2 mL;第5组(10羽)经气管内注射途径接种0.2 mL的TPB稀释液,作为阴性对照。另取8周龄SPF鸡,共分为2组,每组11只鸡,其中1组用WF03株以104.0 EID50·只-1的剂量进行气管内注射0.2 mL,另一组以TBP稀释液为空白对照组。
攻毒后,每日对所有鸡进行观察两次,共观察14 d,每天记录每羽鸡的发病情况,包括死亡、咳血、呼吸症状、眼部症状和精神状态等。死亡鸡随时解剖,未死亡鸡在试验结束后采用舒泰过量麻醉致死后统一剖检,重点观察喉头、气管等病理变化,包括气管内有无血块、黄色酪状物栓塞。
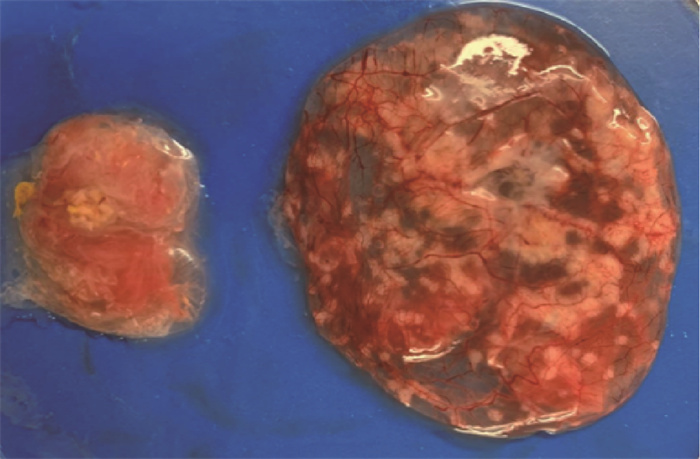
2 结果 2.1 ILTV繁殖特性ILTV WF03株通过CAM途径采用有限稀释法接种10日龄SPF鸡胚,在接种鸡胚7 d后,幸存胚的尿囊膜出现大量灰白色病灶或尿囊膜出现大量的灰白色痘斑(图 1)。测定纯化后病毒的EID50,其P1、P2、P3和P5代的病毒含量分别为105.4、105.8、105.5和105.89 EID50·mL-1。
|
ILTV接种鸡胚7 d后尿囊膜显示灰白色痘斑(右),左侧为正常尿囊膜对照 Gray white acne-spot (right) of allantoic membrane 7 days after inoculation, the left is normal allantoic membrane control 图 1 ILTV WF03株接种鸡胚7 d后尿囊膜病理变化 Fig. 1 The pathological changes of allantoic membrane 7 days after inoculation of chicken embryo with ILTV WF03 strain |
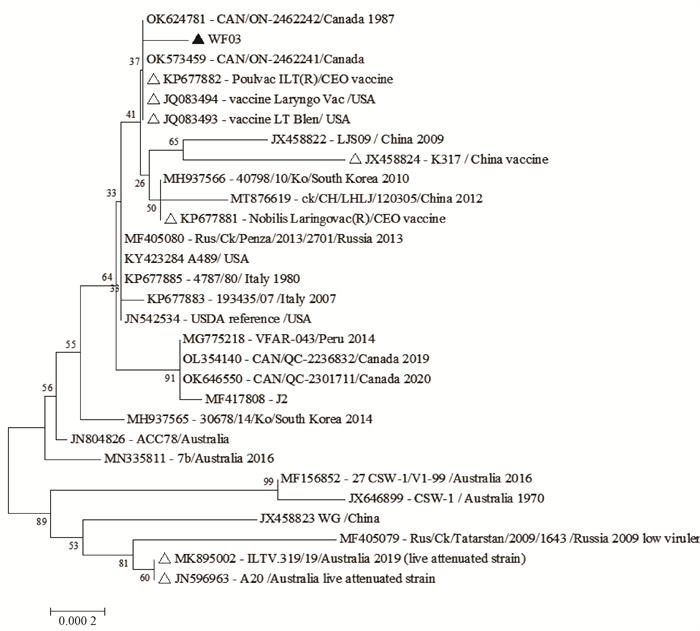
对串联的免疫原性基因gB-gC-gD-UL32的遗传进化分析显示:WF03株与中国2009年的分离株LJS09株、2012年的分离株ck/CH/LHLJ/120305株、疫苗株K317和Nobilis Laringovac(R)处在一个大的进化分支上,并且与疫苗株Poulvac ILT(R)、Laryngo Vac和LT Blen处在同一个分支上且亲缘关系最近(图 2)。通过对WF03株与参考毒株的基因序列比对显示:gB基因与参考毒株的相似性为99.67%~99.93%,gC基因与参考毒株的相似性为99.75%~100.00%,gD基因与参考毒株的相似性为99.14%~100.00%,UL32基因与参考毒株的相似性为99.90%~100.00%。
|
△.疫苗株;▲.本研究分离株 △.Vaccine strains; ▲.Isolate in our study 图 2 免疫原性基因的遗传进化分析 Fig. 2 Phylogenetic tree analysis of genes related to immunogenicity |
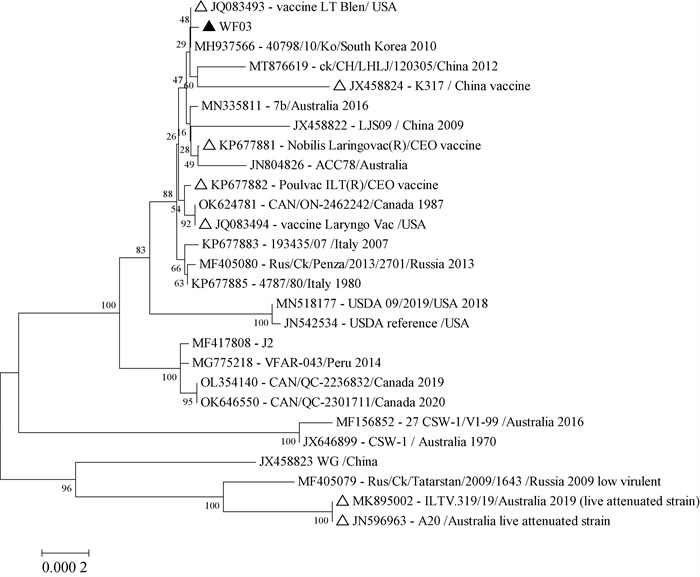
对串联的毒力相关基因gE-gI-TK-ICP4-gG-gH-gK-gL-gM-gN的遗传进化分析显示:WF03株与野毒株进化关系表现为与韩国2010年分离的40798/10/Ko毒株亲缘关系最近,其次与我国2012年分离株ck/CH/LHLJ/120305、2009年分离株LJS09或澳大利亚2016年分离株7b株的亲缘关系较近;WF03株与疫苗株的进化关系表现为与LT Blen株的亲缘关系最近,与K317和Nobilis Laringovac(R)的亲缘关系次之(图 3)。通过WF03株与参考毒株的基因序列比对显示:gE基因与参考毒株的相似性为99.47%~100.00%,gI基因与参考毒株的相似性为99.05%~100.00%,TK基因与参考毒株的相似性为99.68%~100.00%,ICP4基因与参考毒株的相似性为98.71%~99.96%,gG基因与参考毒株的相似性为98.73%~100.00%,gH基因与参考毒株的相似性为99.58%~100.00%,gK基因与参考毒株的相似性为99.59%~100.00%,gL基因与参考毒株的相似性为99.84%~100.00%,gM基因与参考毒株的相似性为99.77%~100.00%,gN基因与参考毒株的相似性为99.28%~100.00%。
|
△.疫苗株;▲.本研究分离株 △.Vaccine strains; ▲.Isolate in our study 图 3 毒力相关基因的遗传进化分析 Fig. 3 Phylogenetic tree analysis of genes related to virulence (B) |
WF03株以104.5、104.0、103.5和103.0 EID50·羽-1的剂量感染28日龄SPF鸡后发病率分别为100%(20/20)、100%(20/20)、95%(19/20)和85%(17/20),死亡率分别为45%(9/20)、30%(6/20)、35%(7/20)和10%(2/20),阴性对照组未发生特异性临床症状。在WF03株攻毒后2 d开始陆续出现临床症状,持续期均超过2 d并且食欲废绝,相继出现精神沉郁、咳血、呼吸困难、张口呼吸等典型的ILT发病症状。对死亡鸡解剖后发现气管中有大量血液或血凝块。其余存活鸡从攻毒后第7天开始临床症状逐步消失。结果表明WF03株可以导致28日龄SPF鸡出现较高的发病率和死亡率。
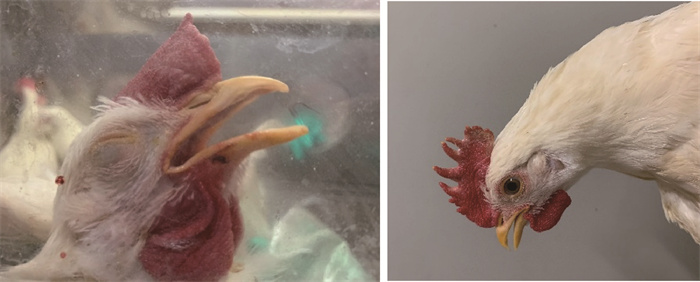
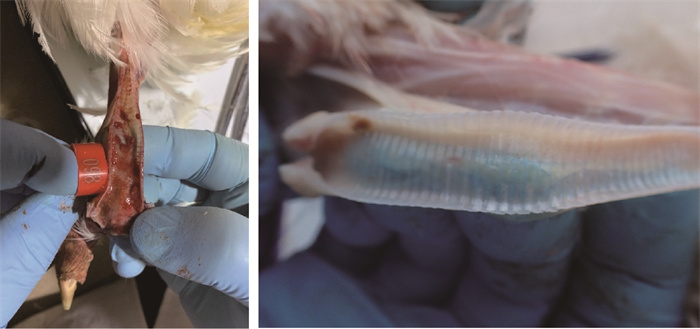
WF03株感染56日龄SPF鸡后2 d开始陆续出现临床症状,持续期均超过3 d并且食欲废绝,第5天时死亡3只,以中度至重度气喘(11/11)(图 4)、咳血(7/11)(图 4)、中度至重度呼吸困难(7/11)为主要临床症状。对第5天死亡鸡解剖发现气管中有大量血液或血凝块(图 5),其余存活鸡到攻毒后9日临床症状消失。结果表明WF03株可以导致56日龄SPF鸡100%(11/11)的发病率和27.3%(3/11)的死亡率。因此结果表明WF03株对于SPF鸡的具有较强的致病力,其以不同剂量感染均可以使80%的鸡发病。
|
图 4 攻毒后出现张口呼吸和咳血(左)和未感染对照鸡(右) Fig. 4 Open mouth breathing and hemoptysis after challenge (left) and control without challenge (right) |
|
图 5 攻毒后死亡鸡剖检气管可见大量新鲜血液或血凝块(左)和未感染对照鸡气管(右) Fig. 5 A large amount of fresh blood or blood clots was found in tracheal necropsy of dead chickens after challenge and trachea without challenge (right) |
在我国,鸡胚源(chicken embryo origin,CEO) 和组织细胞源(tissue culture origin,TCO) 2种弱毒活疫苗已批准用于ILT预防和控制,但在近几年仍有养殖场发生ILTV感染的报道,尤其在肉鸡中也发现了ILTV感染的病例[1-4]。糖蛋白gB、gD和gC以及UL32蛋白是ILTV重要的保护性抗原,可以诱导中和抗体和细胞免疫反应,并且还可以增强先天性和特异性免疫反应[5, 10-11, 16],此外糖蛋白gB和gD还参与病毒黏附、膜融合和穿入的过程[6-9],而糖蛋白gC虽不是病毒复制必需基因,但缺失gC可以使ILTV对鸡的致病力减弱[16],因此gB、gC和gD在ILTV致病力的形成中同样发挥着重要作用。本研究通过对ILTV WF03分离株的免疫原性基因gB-gC-gD-UL32的遗传进化分析发现WF03分离株与我国早期ILTV分离株的亲缘关系较近,其主要抗原基因与现有主要疫苗毒株K317、Poulvac ILT(R)、Laryngo Vac和LT Blen的亲缘关系均较近,提示现有疫苗能够对目前的ILTV分离株提供有效保护,然而在免疫鸡群中仍然具有ILT的散发病例。目前预防ILTV感染的疫苗不仅有CEO和TCO两种弱毒活疫苗,基因工程载体疫苗也已经商品化,由于不同疫苗制备工艺不同,且ILTV临床分离株的毒力强弱差异较大,因此选用何种疫苗免疫,应该在使用前进行有效性评估。
在疱疹病毒(包括ILTV)中,糖蛋白gE、gI和gG以及TK基因缺失可以使病毒毒力显著减弱,并且使病毒保持良好的免疫原性[12-14, 17]。ICP4基因参与激活病毒早/晚期基因的表达,与病毒毒力存在关联[15]。此外还有报道糖蛋白gH、gL、gK、gM、gN等也参与了疱疹病毒致病性的形成[18-21]。而在本研究中通过28和56日龄SPF鸡的感染试验结果表明以104.0 EID50的剂量攻毒后表现出严重的咳血和死亡,WF03株属于强致病力毒株,但通过对毒力相关基因gE-gI-TK-ICP4-gG-gH-gK-gL-gM-gN的进化树分析,其亲缘关系与韩国2010年分离的40798/10/Ko毒株亲缘关系最近,其次分别与我国2012年分离株ck/CH/LHLJ/120305、2009年分离株LJS09和澳大利亚2016年分离株7b株的亲缘关系较近,并且与疫苗株中的LT Blen和K317株的亲缘关系同样较近。有报道根据TK、ICP4、gB和UL32基因核苷酸序列分析结果,近年新分离的ILTV BT株与我国早期LJS09毒株等属于同一进化分支,未出现较大变异,但以104.0EID50的剂量气管内攻毒2周龄SPF鸡未出现死亡,仅有少部分鸡出现结膜分泌物,剖检显示喉头气管正常[22],但早期毒株LJS09株对4周龄鸡以102 EID50攻毒,急性症状出现在感染后4~6 d,表现为呼吸困难,并且发病率和死亡率分别为80%和10%[23],因此本试验ILTV WF03株感染28日龄和56日龄SPF鸡后的发病时间、比例、症状与其他ILTV强致病力毒株感染情况基本一致。因此本研究通过对ILTV主要基因的遗传特征分析表明目前ILTV临床分离株与我国早期的分离株在毒力基因的遗传关系上无显著的差异,ILTV未发生较大的遗传变异现象,但分离株的致病力具有较大差异,在临床上可能呈现出温和型和急性型ILTV共存的局面,目前现有疫苗可能仍对当前ILTV强致病力毒株的流行具有保护作用。
此外,目前由于ILTV疫苗免疫效力评估尚没有标准株使用,不同生物制品厂使用不同ILTV强毒株对疫苗进行效力检验。然而,ILTV野毒株的毒力差异很大,有的毒株具有很高的发病率和致死率属于强致病力毒株,而有的毒株感染后仅表现出结膜炎等轻微症状或症状不明显,对于筛选一株遗传稳定、发病可靠、临床症状易于观察的强毒株进行ILTV疫苗的效力检验是非常有必要的,也是非常重要的。WF03株以104.5、104.0、103.5和103.0 EID50·羽-1的剂量感染28日龄SPF鸡后至少有80%的鸡发病,且以咳血、死亡为主要临床症状,对56日龄SPF鸡以104.0 EID50·羽-1的剂量攻毒后,100%的鸡发病,主要以气喘、呼吸困难和咳血为主要临床症状。因此WF03株可作为疫苗效力检验用强毒株,其发病稳定,临床症状易于观察。
4 结论本研究通过28和56日龄SPF鸡的人工感染试验结果表明ILTV WF03分离株具有很强的致病力,对28和56日龄鸡的致死性也较强,但通过免疫原性基因gB-gC-gD-UL32和毒力相关基因gE-gI-TK-ICP4-gG-gH-gK-gL-gM-gN的遗传进化分析以及与参考毒株的基因序列相似性比较表明WF03株未发生明显的遗传变异,与我国早期的ILTV分离株和目前市场上的疫苗株具有很近的亲缘关系,因此WF03株可用于当前使用以及尚在开发的ILTV商品疫苗的效力检验用强毒株。
| [1] |
李玉燕, 巩新民, 祝永华, 等. 某种鸡场传染性喉气管炎病毒的分离与鉴定[J]. 中国兽医杂志, 2020, 56(7): 50-51. LI Y Y, GONG X M, ZHU Y H, et al. Isolation and identification of infectious laryngotracheitis virus from one breeder flock[J]. Chinese Journal of Veterinary Medicine, 2020, 56(7): 50-51. (in Chinese) |
| [2] |
孔聪聪, 赵妍, 张晓敏, 等. 一株鸡传染性喉气管炎病毒的分离鉴定及TK基因分析[J]. 中国预防兽医学报, 2012, 34(12): 955-958. KONG C C, ZHAO Y, ZHANG X M, et al. Isolation and identification of infectious laryngotracheitis virus from Heilongjiang province and sequence analysis of the TK gene[J]. Chinese Journal of Preventive Veterinary Medicine, 2012, 34(12): 955-958. DOI:10.3969/j.issn.1008-0589.2012.12.06 (in Chinese) |
| [3] |
秦春芝, 徐怀英, 周萌, 等. 肉鸡传染性喉气管炎的发生和诊断及其PCR诊断方法的建立[J]. 家禽科学, 2020(8): 6-10, 34. QIN C Z, XU H Y, ZHOU M, et al. Diagnosis of infectious laryngotracheitis in broilers and establishment of PCR diagnostic methods[J]. China Poultry Science, 2020(8): 6-10, 34. DOI:10.3969/j.issn.1673-1085.2020.08.002 (in Chinese) |
| [4] |
高晓磊, 朱秀同, 刘思桐, 等. 一株鸡传染性喉气管炎病毒的分离鉴定[J]. 今日畜牧兽医, 2019, 35(4): 17-18. GAO X L, ZHU X T, LIU S T, et al. Isolation and identification of an avian infectious laryngotracheitis virus[J]. Today Animal Husbandry and Veterinary Medicine, 2019, 35(4): 17-18. DOI:10.3969/j.issn.1673-4092.2019.04.013 (in Chinese) |
| [5] |
徐美玉, 赵烨, 朱发江, 等. 表达ILTV gB和UL32基因的重组鸡痘病毒疫苗安全性及稳定性分析[J]. 中国兽医杂志, 2015, 51(2): 6-8, 12. XU M Y, ZHAO Y, ZHU F J, et al. Safety and stability evaluation of recombinant Fowlpox virus expressing UL32 gene and gB gene of infectious laryngotracheitis virus[J]. Chinese Journal of Veterinary Medicine, 2015, 51(2): 6-8, 12. DOI:10.3969/j.issn.0529-6005.2015.02.002 (in Chinese) |
| [6] |
CONNOLLY S A, JACKSON J O, JARDETZKY T S, et al. Fusing structure and function: a structural view of the herpesvirus entry machinery[J]. Nat Rev Microbiol, 2011, 9(5): 369-381. DOI:10.1038/nrmicro2548 |
| [7] |
SPEAR P G, LONGNECKER R. Herpesvirus entry: an update[J]. J Virol, 2003, 77(19): 10179-10185. DOI:10.1128/JVI.77.19.10179-10185.2003 |
| [8] |
LU G W, ZHANG N, QI J X, et al. Crystal structure of herpes simplex virus 2 gD bound to nectin-1 reveals a conserved mode of receptor recognition[J]. J Virol, 2014, 88(23): 13678-13688. DOI:10.1128/JVI.01906-14 |
| [9] |
DI GIOVINE P, SETTEMBRE E C, BHARGAVA A K, et al. Structure of herpes simplex virus glycoprotein D bound to the human receptor nectin-1[J]. PLoS Pathog, 2011, 7(9): e1002277. DOI:10.1371/journal.ppat.1002277 |
| [10] |
LAZEAR E, WHITBECK J C, PONCE-DE-LEON M, et al. Antibody-induced conformational changes in herpes simplex virus glycoprotein gD reveal new targets for virus neutralization[J]. J Virol, 2012, 86(3): 1563-1576. DOI:10.1128/JVI.06480-11 |
| [11] |
ZHAO W, SPATZ S, ZHANG Z Y, et al. Newcastle disease virus (NDV) recombinants expressing infectious laryngotracheitis virus (ILTV) glycoproteins gB and gD protect chickens against ILTV and NDV challenges[J]. J Virol, 2014, 88(15): 8397-8406. DOI:10.1128/JVI.01321-14 |
| [12] |
DEVLIN J M, BROWNING G F, GILKERSON J R. A glycoprotein I-and glycoprotein E-deficient mutant of infectious laryngotracheitis virus exhibits impaired cell-to-cell spread in cultured cells[J]. Arch Virol, 2006, 151(7): 1281-1289. DOI:10.1007/s00705-005-0721-8 |
| [13] |
HAN M G, KWEON C H, MO I P, et al. Pathogenicity and vaccine efficacy of a thymidine kinase gene deleted infectious laryngotracheitis virus expressing the green fluorescent protein gene[J]. Arch Virol, 2002, 147(5): 1017-1031. DOI:10.1007/s00705-001-0794-y |
| [14] |
SCHNITZLEIN W M, WINANS R, ELLSWORTH S, et al. Generation of thymidine kinase-deficient mutants of infectious laryngotracheitis virus[J]. Virology, 1995, 209(2): 304-314. DOI:10.1006/viro.1995.1262 |
| [15] |
JOHNSON M A, TYACK S G, PRIDEAUX C, et al. Nucleotide sequence of infectious laryngotracheitis virus (gallid herpesvirus 1) ICP4 gene[J]. Virus Res, 1995, 35(2): 193-204. DOI:10.1016/0168-1702(94)00096-U |
| [16] |
PAVLOVA S P, VEITS J, BLOHM U, et al. In vitro and in vivo characterization of glycoprotein C-deleted infectious laryngotracheitis virus[J]. J Gen Virol, 2010, 91(4): 847-857. DOI:10.1099/vir.0.016634-0 |
| [17] |
DEVLIN J M, BROWNING G F, HARTLEY C A, et al. Glycoprotein G is a virulence factor in infectious laryngotracheitis virus[J]. J Gen Virol, 2006, 87(10): 2839-2847. DOI:10.1099/vir.0.82194-0 |
| [18] |
VALLBRACHT M, REHWALDT S, KLUPP B G, et al. Functional relevance of the N-terminal domain of pseudorabies virus envelope glycoprotein H and its interaction with glycoprotein L[J]. J Virol, 2017, 91(9): e00061. |
| [19] |
MÖHL B S, CHEN J, PARK S J, et al. Epstein-barr virus fusion with epithelial cells triggered by gB is restricted by a gL glycosylation site[J]. J Virol, 2017, 91(23): e01255-17. |
| [20] |
CHOULJENKO D V, JAMBUNATHAN N, CHOULJENKO V N, et al. Herpes simplex virus 1 UL37 protein tyrosine residues conserved among all alphaherpesviruses are required for interactions with glycoprotein K, Cytoplasmic virion envelopment, and infectious virus production[J]. J Virol, 2016, 90(22): 10351-10361. DOI:10.1128/JVI.01202-16 |
| [21] |
EL KASMI I, LIPPÉ R. Herpes simplex virus 1 gN partners with gM to modulate the viral fusion machinery[J]. J Virol, 2015, 89(4): 2313-2323. DOI:10.1128/JVI.03041-14 |
| [22] |
高昕, 罗园园, 杨慧明, 等. 1株鸡传染性喉气管炎病毒的基因组特征与致病性[J]. 畜牧兽医学报, 2022, 53(4): 1298-1302. GAO X, LUO Y Y, YANG H M, et al. Genomic characteristics and pathogenicity of an avian infectious Laryngotracheitis virus[J]. Acta Veterinaria et Zootechnica Sinica, 2022, 53(4): 1298-1302. (in Chinese) |
| [23] |
蒋露, 李慧昕, 韩宗玺, 等. 鸡传染性喉气管炎病毒LJS09株致病性的研究[J]. 中国预防兽医学报, 2015, 37(3): 181-184. JIANG L, LI H X, HAN Z X, et al. Pathogenicity study of infectious laryngotracheitis virus LJS09[J]. Chinese Journal of Preventive Veterinary Medicine, 2015, 37(3): 181-184. DOI:10.3969/j.issn.1008-0589.2015.03.05 (in Chinese) |
(编辑 白永平)



