2. 阿拉善盟畜牧研究所, 阿拉善 750300
2. Alxa League Animal Husbandry Research Institute, Alxa, League 750300, China
FAF1是1995年由Chu等[1]以酵母双杂交方法筛选得到,FAF1蛋白是死亡诱导信号复合物(death inducing signaling complex,DISC)的组成部分。FAF1蛋白为胞内蛋白[2],主要表达于不同细胞类型的细胞核及核周胞质,其在进化上较为保守,由650个氨基酸构成,大小约为74 ku,含有多个功能性结构域,主要包括N末端泛素相关域(ubiquitin-associating,UBA)、C端泛素调节X域(ubiquitin regulatory X,UBX)、死亡效应结构域(death effector domain interacting domain, DEDID)、Fas相互作用域(FAS-interacting domain, FID)[3]。FAF1 mRNA及蛋白质在人和小鼠的睾丸及卵巢中均有表达[4]。但是FAF1在牦牛睾丸和卵巢中的生物学作用还尚不清楚。
牦牛(Bos grunniens)为青藏高原一带独有的原始牛种之一,一般分布于海拔3 000~5 000米的高原上,它不但能够适应高原寒冷、空气稀薄、强辐射的地理环境,也可用于农牧业和交通运输。除此之外,还能为当地牧民提供肉、奶、毛、皮革、燃料等生产和生活资料,被誉为藏区“牧民之宝”。素有“高原之舟”和“冰河之车”的美称[5]。FAF1广泛存在于多种组织和细胞中,含有多种功能结构域,参与不同信号通路的调节,具有多种重要的生殖生理功能。由于敲除FAF1基因的纯合子会在胚胎早期发育死亡[6],限制了通过基因敲除技术探索FAF1基因的生物学功能,因此通过制备牦牛FAF1多克隆抗体来探索FAF1基因生物学功能具有重要的意义。高品质的精液是保证受精和早期胚胎发育的重要条件,较好的卵巢机能对于受精具有重要意义[7]。细胞凋亡是生殖调节的机制之一,生殖细胞(精子和卵母细胞)的周期性变化与其凋亡过程密切相关[8],Fas-FasL系统被认为是生殖细胞(精子和卵子)凋亡的关键生理调节因子[9]。FAF1是Fas-FasL凋亡通路重要调控元件[10],FAF1通过多种方式作用于细胞凋亡[10],并且其在生殖系统中表达量较高。本研究以牦牛睾丸组织cDNA为模板,扩增FAF1基因全序列,构建全长pET-28a-FAF1原核表达载体,优化诱导表达条件,经镍柱纯化并鉴定后免疫试验动物,获得兔源FAF1多克隆抗体,以牦牛不同年龄睾丸组织及处于不同繁殖周期的卵巢为研究对象,采用实时荧光定量检测不同年龄睾丸组织及处于不同繁殖周期的卵巢FAF1 mRNA相对表达水平,采用Western blot检测不同年龄睾丸组织及处于不同繁殖周期的卵巢FAF1蛋白相对表达水平,采用免疫组织化学技术定位FAF1蛋白表达部位,以期为进一步研究FAF1在牦牛生殖方面的功能提供依据。
1 材料与方法 1.1 试验材料本研究所使用的试剂主要有:TransZol(北京,全式金);GoScript Reverse Transcription System (美国,Promega);Goat anti-rabbit IgG-HRP(北京,博奥森);DNA纯化回收试剂盒、质粒小提试剂盒、DH5a感受态细胞、BL21(DE3)/Rosetta感受态细胞(北京,天根);IPTG、卡那(北京,索莱宝);PVDF膜(美国,Millipore);酵母、氯化粉钠、琼脂、胰蛋白胨(英国,Oxoid);pET-28a为实验室保存;限制性核酸内切酶XhoⅠ、限制性核酸内切酶EcoR I、T4连接酶(大连,TaKaRa);Ni-NTA-Sefinose Column(上海,生工);预混型qPCR试剂盒(湖南,艾科瑞生物);FAF1兔抗牦牛多克隆抗体为甘肃省牛羊胚胎工程中心制备保存。
本研究所使用的仪器主要有:PCR仪(美国,Bio-Rad);SDS-PAGE电泳槽(美国,Rio-Rad公司);超声波破碎仪(宁波,新芝);恒温培养箱(日本,松下);恒温振荡摇床(上海,恒字);超灵敏多功能成像仪(美国,GE Healthcare)。
1.2 样品的采集试验样品于2021年10月采集于青海省西宁市屠宰场。挑选不同年龄的健康雄性牦牛各3头,挑选年龄相仿且处于不同繁殖周期(卵泡期卵巢上具有成熟卵泡、黄体期卵巢有明显黄体和妊娠期卵巢在子宫内有发育的胎儿的卵巢)的健康雌性牦牛各3头,经颈动脉放血致死后,迅速采集睾丸组织和卵巢组织,用0.9%的生理盐水冲洗3次,将组织修剪为约1 cm3的组织块并浸泡于4%的中性多聚甲醛溶液中固定,以便于开展后期的免疫组织化学试验。剩余组织用锡箔纸包裹后放入冻存袋内,然后放入液氮罐中,过程中尽可能的快速,以防止组织降解变质,运回实验室后转存于-80 ℃超低温冰箱中,以便于开展后期的分子试验。
1.3 目的基因的获取利用GoScriptTM Reverse Transcription System试剂盒将总RNA反转录为cDNA。以β-actin(肌动蛋白)为内参基因,β-actin及FAF1基因引物序列如表 1。Taq PCR Master Mix 10 μL,ddH2O 8 μL,模板cDNA 1 μL,β-actin-F、β-actin-R各0.5 μL,共20 μL体系置于PCR仪中,95 ℃预变性5 min,95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸8 s,72 ℃条件下10 min,循环40次。反应结束后琼脂糖凝胶电泳进行验证。模板cDNA验证成功后,扩增FAF1基因,体系共20 μL:Taq PCR Master Mix 10 μL,ddH2O 8 μL,模板cDNA 1 μL,FAF1-F、FAF1-R各0.5 μL,退火时间变为2 min,其它条件不变。琼脂糖凝胶电泳后,利用DNA纯化回收试剂盒纯化目的基因。
|
|
表 1 引物序列及长度 Table 1 Primer sequences and length |
纯化的DNA及空载体pET-28a使用限制性内切酶Xho Ⅰ和EcoR Ⅰ进行双酶切。将酶切好的目的基因与酶切好的载体使用T4 DNA连接酶16 ℃条件过夜连接。将重组质粒转化至DH5a感受态细胞中,涂布至含卡那的LB培养基上,37 ℃过夜培养。挑取阳性克隆菌,提取质粒,分别进行PCR及双酶切验证,验证成功后送至上海生工测序。将连接成功的重组质粒转化至BL21(DE3)/Rosetta感受态细胞。
1.5 重组蛋白优化诱导挑取含有于pET-28a重组子的BL21(DE3)/Rosetta菌落接种于5 mL含卡那的LB培养基中,37 ℃振荡培养过夜。取150 μL培养液于5 mL含卡那的LB培养基中,37 ℃条件下200 r ·min-1振荡培养3 h。取1 mL作为IPTG诱导前的样品,12 000 r ·min-1离心1 min,弃上清液,菌体沉淀用40 μL PBS悬浮,-20 ℃保存。其余样品加入IPTG,使IPTG终浓度为0.5 mmol ·L-1,分别在20 ℃、25 ℃、28 ℃、32 ℃、37 ℃条件下180 r ·min-1振荡培养。分别在各温度诱导后2、3、4、5 h取1 mL样品的菌液,12 000 r ·min-1离心1 min,收集菌体,用30 μL PBS悬浮,-20 ℃保存。在诱导前以及诱导后各时间的样品中各加入10 μL 4×SDS上样缓冲液,涡旋振荡1 min,使菌体完全溶菌,沸水浴10 min。在4 ℃条件下12 000 r ·min-1离心1 min后取上清到新的离心管中。分别取20 μL诱导前以及10 μL诱导后的样品进行SDS-PAGE分析。为提高FAF1重组蛋白的表达量,对诱导剂IPTG浓度(0.1、0.3、0.5、0.7、1.0 mmol ·L-1)进行优化,同时以未诱导样品作为对照,取不同浓度的样品经SDS-PAGE分离并用考马斯亮蓝染色后进行分析。
1.6 重组蛋白大量诱导表达及纯化根据最佳诱导条件进行阳性克隆菌的大量培养,收集菌体,加入PBS缓冲液重悬,冰浴条件下,超声波破碎,功率40 W,工作3 s,间隔3 s,总时间约30 min,以菌体由浑浊变透明且不黏稠为准。将破碎的菌液于4 ℃条件下5 000 r ·min-1离心10 min,收集上清和沉淀,将所得上清和沉淀变性,SDS-PAGE电泳考马斯亮蓝染色。按照Ni-NTA-Sefinose Column说明书对重组蛋白纯化。
1.7 试验动物免疫选取2只健康雄性新西兰大白兔,饲养1周观察是否有应激等不良反应,若无不良反应,则分别取耳缘静脉血1 mL,留作阴性对照。以1.2 mg纯化的FAF1重组蛋白与弗氏完全佐剂等量混匀并充分乳化,分多点背部皮下注射免疫2只新西兰大白兔;第一次免疫两周后进行第二次免疫,以1.2 mg纯化的FAF1重组蛋白与弗氏不完全佐剂等量混匀并充分乳化,分多点肩胛部及腘淋巴结注射免疫2只新西兰大白兔;第二次免疫3周后进行第三次免疫,以0.4 mg纯化的FAF1重组蛋白与弗氏不完全佐剂等量混匀并充分乳化,分多点肩胛部及腘淋巴结注射免疫2只新西兰大白兔;第三次免疫两周后进行耳缘采血检测效价,效价良好则可进行心脏采血收集血液,37 ℃恒温箱静置1 h,再于4 ℃冰箱静置过夜,分离血清,至于-80 ℃超低温冰箱保存备用。
1.8 牦牛FAF1多克隆抗体效价检测将FAF1重组蛋白用包被液稀释至1 μg ·mL-1,96孔酶标板每孔加入100 μL,设置阴性对照和空白对照,前者加入含重组蛋白的包被液,后者只加入包被液,4 ℃过夜;使用1×PBST洗涤3次,拍干;加入5%脱脂奶粉封闭液37 ℃,3 h进行封闭;使用1×PBST洗涤3次,拍干;加入等比稀释的兔多抗血清100 μL,阴性对照孔加入阴性血清,37 ℃孵育2 h;洗涤3次,拍干;每孔加入100 μL以1 ∶10 000稀释的HRP标记山羊抗兔二抗,37 ℃孵育2 h;洗涤3次,拍干;每孔加入100 μL TMB,37 ℃显色15 min;每孔加入50 μL浓度为2 mol ·L-1的H2SO4终止显色反应,放入酶标仪检测450 nm处OD值。
1.9 多克隆抗体特异性检测将纯化后的重组蛋白上样进行SDS-PAGE电泳,65 V条件35 min,调至110 V 1 h。110V条件下转膜70 min,5%脱脂奶粉封闭过夜,加制备的兔源多克隆抗体室温孵育3 h,PBST洗涤5次,每次10 min,加二抗(Goat anti-rabbit IgG-HRP)室温孵育40 min,PBST洗涤6次,每次10 min。在PVDF膜上滴加ELC超敏发光液,置于超灵敏多功能成像仪曝光成像。
1.10 实时荧光定量PCR制备不同组织cDNA工作液,使终浓度为100 ng ·μL-1。加入2X SYBR® Green Pro Taq HS Premix 10 μL,不同组织cDNA工作液1 μL,FAF1-F1、FAF1-R1各0.4 μL,RNase free water 8.2 μL,反应体系共20 μL。反应条件:95 ℃预变性300 s,95 ℃变性10 s,58 ℃退火30 s,72 ℃延伸16 s,共进行40个循环。每个模板,设4个重复组,使用2-ΔΔCt法计算不同年龄睾丸组织及不同繁殖周期卵巢组织FAF1 mRNA的相对表达量。
1.11 Western blot根据SDS-PAGE分离胶和浓缩胶配制体系分别配制浓度为8%的分离胶和5%的浓缩胶。将变性好的蛋白样品进行上样电泳,待电泳结束后,使用湿转的方式将蛋白转印至0.45 μm的PVDF膜上,转膜完成后用PBST洗去膜上的残留转膜液,使用5%脱脂奶粉摇床上孵育过夜,PBST洗涤2次,每次30 min,一抗(兔抗牦牛FAF1多克隆抗体)按1 ∶1 000稀释,室温孵育2.5 h,PBST洗涤5 min,共洗涤6次,二抗(Goat Anti-Rabbit IgG-HRP)1 ∶8 000稀释摇床上孵育40 min,PBST洗涤3次,每次20 min。将超敏化学发光A液与超敏化学发光B液按1 ∶1混匀配置成工作液,将工作液滴加至PVDF膜上并避光作用5 s,使用Amersham Imager 600 System进行化学发光检测。根据成像结果,利用目的灰度值/内参灰度值分析FAF1蛋白相对表达量。
1.12 免疫组织化学将固定于4%中性多聚甲醛的组织在自来水中冲洗24 h,再经梯度酒精脱水后使用酒苯透明,然后浸蜡,最后进行石蜡包埋。利用切片机将组织切为4 μm的连续性切片。在烘片机上60 ℃烘烤6 h,下行脱蜡水化,采用柠檬酸盐进行抗原修复,将载玻片放入0.01 mol ·L-1的柠檬酸盐中,高火加热直至煮沸,再使用中火维持10 min,待冷却至室温后,PBS洗涤3次,每次3 min;使用3% H2O2溶液于37 ℃条件下孵育10 min进行阻断,PBS洗涤3次,每次3 min;山羊血清工作液室温封闭(SPA试剂盒A液)15 min,试验组一抗(兔抗牦牛FAF1多克隆抗体)按1 ∶400稀释后置于湿盒4 ℃孵育过夜,阴性对照组使用PBS作为一抗孵育过夜,PBS洗涤3次,每次3 min;生物素标记山羊抗兔IgG(SPA试剂盒B液)37 ℃条件下孵育15 min,PBS洗涤3次,每次3 min;辣根酶标记链霉卵白素工作液(SPA试剂盒C液)室温孵育15 min,PBS洗涤3次,每次3 min;使用DAB显色液进行显色,经苏木精复染后盐酸酒精分化,在自来水中返蓝10 min。脱水透明后封片。待晾干后置于显微镜下拍照。
1.13 数据分析使用SPSS 25.0对FAF1 mRNA相对表达量和蛋白相对表达量进行单因素方差分析,每组3次重复,计算结果均以“平均值±标准误”来表示,P < 0.05表示二者差异显著,使用Graphpad prism 8进行绘图。
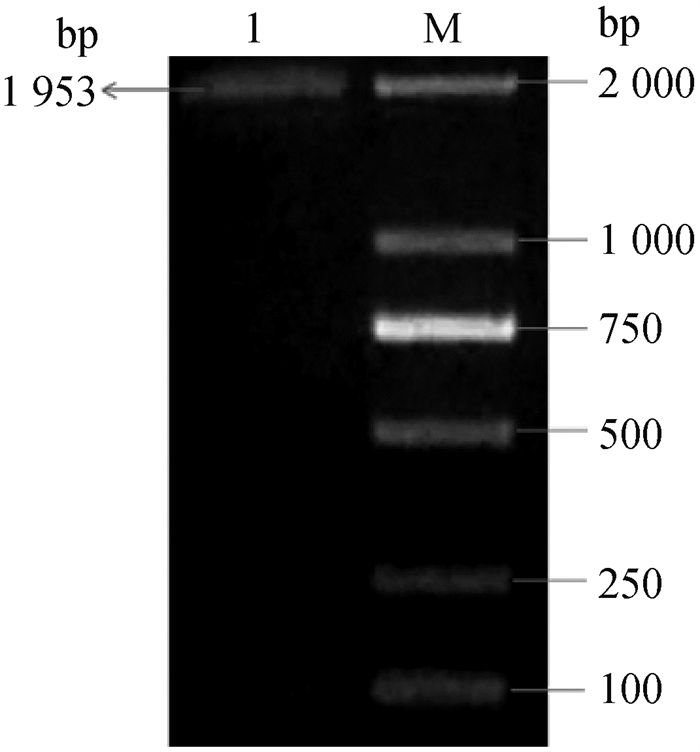
2 结果 2.1 目的基因的获取以牦牛cDNA为模板,以FAF1-F、FAF1-R进行PCR扩增,其结果如图 1所示,在1 953 bp处有清晰单一的条带,与预期大小一致。
|
M. 2000bp ladder; 1. 牦牛睾丸组织cDNA为模板 M. 2000bp ladder; 1. Yaks testis cDNA as template 图 1 牦牛FAF1基因核酸电泳结果 Fig. 1 Electrophoretic results of FAF1 gene in yaks |
以重组质粒pET-28a-FAF1为模板,FAF1-F、FAF1-R为引物进行PCR,结果如图 2A所示,在1 953 bp处有清晰明亮的条带,产物大小与预期相符。将重组质粒pET-28a-FAF1双酶切后,结果如图 2B所示,在5 335bp和1 953bp处有较清晰的条带,且与预期大小一致。重组质粒pET-28a-FAF1经上海生工测序确认pET-28a-FAF1原核表达载体构建成功。

|
A. 重组质粒pET-28a-FAF1 PCR:M. 2000 bp ladder;1. 构建重组质粒。B. 重组质粒pET-28a-FAF1双酶切:M. 5000 bp ladder;1~2. 不同菌落重组质粒 A. Recombinant plasmid pET-28a-FAF1 PCR: M. 2000 bp ladder; 1. Construct recombinant plasmid. B. Recombinant plasmid pET-28a-FAF1 double digestion: M. 5000 bp ladder; 1-2. Recombinant plasmids from different colonies 图 2 重组质粒pET-28a-FAF1的鉴定 Fig. 2 Identification of the recombinant plasmid pET-28a-FAF1 |
重组蛋白pET-28a-FAF1在20 ℃(图 3A)、25 ℃(图 3B)、28 ℃(图 3C)、32 ℃(图 3D)条件下,随诱导时间增加,表达量呈现增加的趋势,37 ℃(图 3E)条件下温度过高,导致该重组蛋白表达量降低。该重组蛋白大小与预期一致,为74 ku,其在25 ℃表达量最大,该温度为该重组蛋白的最优诱导温度;25 ℃下诱导5 h表达量最高,认为5 h为最佳诱导时间。不同浓度IPTG对FAF1重组蛋白诱导表达(图 4)并无太大影响,因此选择0.5 mmol ·L-1作为IPTG最佳诱导浓度。

|
A. 20 ℃不同诱导时间;B. 25 ℃不同诱导时间;C. 28 ℃不同诱导时间;D. 32 ℃不同诱导时间;E. 37 ℃不同诱导时间。M.蛋白预染Marker;1. 未诱导;2. 诱导2 h;3. 诱导3 h;4. 诱导4 h;5. 诱导5 h A. Different induction time at 20 ℃; B. Different induction time at 25 ℃; C. Different induction time at 28 ℃; D. Different induction time at 32 ℃; E. Different induction time at 37 ℃. M. Protein pre-stained marker; 1. Not induced; 2. Induced 2 h; 3. Induced 3 h; 4. Induced 4 h; 5. Induced 5 h 图 3 FAF1重组蛋白温度及诱导时间的优化 Fig. 3 Optimization of temperature and induction time of FAF1 recombinant protein |

|
M. 蛋白预染Marker;1~6. IPTG浓度分别为0.1、0.3、0.5、0.7、1.0和0 mmol ·L-1 M. Protein predye Marker; 1-6. IPTG concentrations were 0.1, 0.3, 0.5, 0.7, 1.0 and 0 mmol ·L-1 图 4 FAF1重组蛋白IPTG浓度的优化 Fig. 4 Optimization of IPTG concentration of FAF1 recombinant protein |
将破碎后的上清和沉淀变性,经SDS-PAGE电泳,考马斯亮蓝染色后,如图 5A所示,经破碎后重组蛋白pET-28a-FAF1基本全部存在于沉淀中,该重组蛋白为不可溶性蛋白。重组蛋白pET-28a-FAF1经镍柱纯化后结果如图 5B所示,其大小为74 ku,与预期一致,成功获得较高纯度的重组蛋白pET-28a-FAF1。

|
A. 可溶性鉴定结果:M. 蛋白预染marker;1. 诱导5h样品;2. 破碎后沉淀样品;3. 破碎后上清样品。B. 重组蛋白纯化结果:M. 蛋白预染marker;1. 纯化后样品 A. Soluble identification results: M. protein predye marker; 1. induced 5h sample; 2. precipitated samples after crushing; 3. crushed supernatant sample. B. Purification results of recombinant protein: M. protein pre-dyed marker; 1. purified sample 图 5 重组蛋白可溶性鉴定及其纯化结果 Fig. 5 Determination of the solubility of recombinant protein and its purification results |
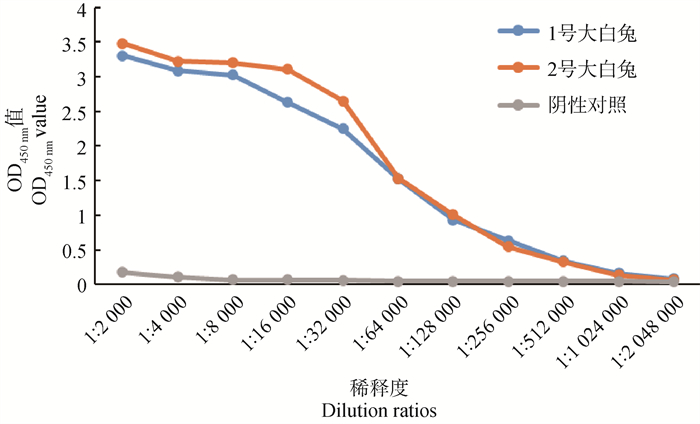
ELISA法检测多抗血清抗体效价结果(图 6)分析显示,稀释度为1 ∶1 024 000时的阳性血清OD450 nm>2.1倍阴性血清OD450 nm阴性血清,因此,兔源FAF1多克隆抗体效价为1 ∶1 024 000。
|
图 6 FAF1抗血清抗体效价 Fig. 6 Antibody titer of FAF1 antiserum |
以重组FAF1蛋白为抗原,1 ∶2 000稀释兔抗血清作为一抗,Goat anti-rabbit IgG-HRP以1 ∶8 000稀释,进行Western blot检测,结果(图 7)显示在74 ku处出现特异性条带。结果表明,本研究制备的兔抗FAF1多克隆抗体可与牦牛重组FAF1蛋白能够发生特异性反应。

|
M. 蛋白预染Marker;1. 重组FAF1蛋白 M. Protein predye Marker; 1. Recombinant FAF1 protein 图 7 FAF1多克隆特异性检测结果 Fig. 7 Results of FAF1 polyclonal specificity detection |
qRT-PCR结果统计分析(图 8)表明FAF1 mRNA的表达普遍存在于不同年龄睾丸组织中。其中3、4、7周岁雄性牦牛睾丸组织中FAF1 mRNA相对表达量显著高于其他年龄段。FAF1 mRNA的相对表达水平在牦牛不同年龄睾丸组织中存在差异性表达。

|
柱上所标字母相异表示差异显著(P < 0.05),所标字母相同表示差异不显著(P>0.05)。下同 Bars with different letters means significant difference among the treatments(P < 0.05), while same letter means not significant different among treatments(P>0.05). The same as below 图 8 FAF1 mRNA在不同年龄睾丸组织相对表达水平 Fig. 8 Relative expression levels of FAF1 mRNA in testicular tissues at different ages |
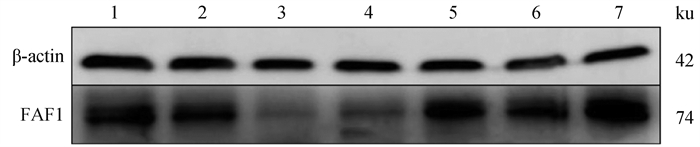
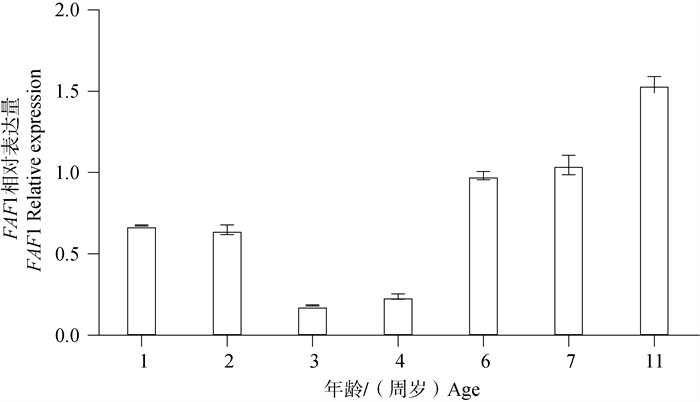
Western blot结果(图 9)显示,FAF1蛋白普遍存在于雄性牦牛不同年龄睾丸组织。统计分析后结果显示(图 10),11周岁时FAF1相对蛋白表达量显著高于其他年龄,6、7周岁次之,3、4周岁FAF1相对蛋白表达量最低,FAF1蛋白在牦牛不同年龄的相对表达量存在差异性。
|
1~7. 1、2、3、4、6、7、11周岁牦牛睾丸样品 1-7. Testis samples from 1, 2, 3, 4, 6, 7 and 11 years old yaks 图 9 β-actin和FAF1蛋白在不同年龄雄性牦牛睾丸中的检测结果 Fig. 9 Test results of β-actin and FAF1 protein in testis of male yak at different ages |
|
图 10 FAF1蛋白在不同年龄雄性牦牛睾丸组织中的相对表达水平 Fig. 10 Relative expression levels of FAF1 protein in testis of male yak at different ages |
免疫组织化学染色结果(图 11)显示,FAF1蛋白在不同年龄段牦牛睾丸中均有棕褐色阳性表达,不同年龄睾丸FAF1蛋白分布表达部位基本一致,主要表达于精子、精子细胞、精原细胞、初级精母细胞、支持细胞、睾丸间质细胞和管周肌样细胞。

|
A~H. FAF1阳性表达,I~L. FAF1阴性对照。A、E、I为1周岁牦牛睾丸;B、F、J为4周岁牦牛睾丸;C、G、K为7周岁牦牛睾丸;D、H、L为11周岁牦牛睾丸。IC. 间质;ST. 生精小管;S. 精原细胞;PS. 初级精母细胞;Sp. 精子细胞;SC. 支持细胞;MC. 管周肌样细胞:Sz. 精子 A-H. Positive expression of FAF1; I-L. Negative control of FAF1. A, E and I are 1 year old yak testis. B, F, J are 4 years old yak testis; C, G, K are 7 years old yak testis; D, H and L are 11 years old yak testis. IC. Interstitial; ST. Seminiferous tubules; S. Spermatogonia; PS. Primary spermatocytes; Sp. Sperm cell; SC: Sertoli cells; MC. Peritubular myoid cells; Sz. Spermatozoa 图 11 FAF1蛋白在不同年龄睾丸的表达定位 Fig. 11 Localization of FAF1 protein expression in testis of different ages |
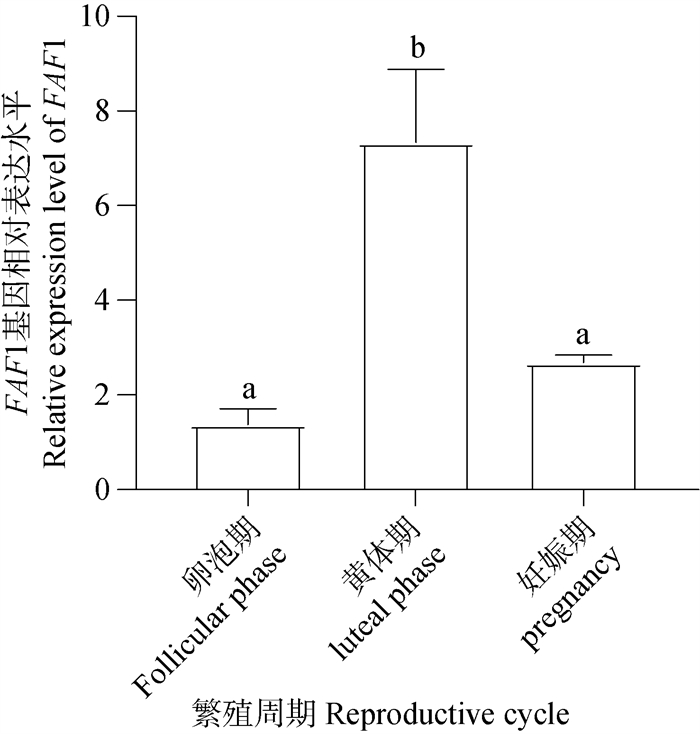
qRT-PCR结果(图 12)统计分析表明FAF1 mRNA普遍表达存于不同时期的卵巢。黄体期卵巢FAF1 mRNA相对表达量显著高于卵泡期和妊娠期,妊娠期卵巢次之,卵泡期卵巢FAF1 mRNA相对表达量最低。FAF1 mRNA的相对表达量在牦牛不同繁殖周期卵巢组织存在差异化表达。
|
图 12 FAF1 mRNA在不同繁殖周期卵巢的表达定位 Fig. 12 Localization of FAF1 mRNA expression in ovary during different reproductive cycles |
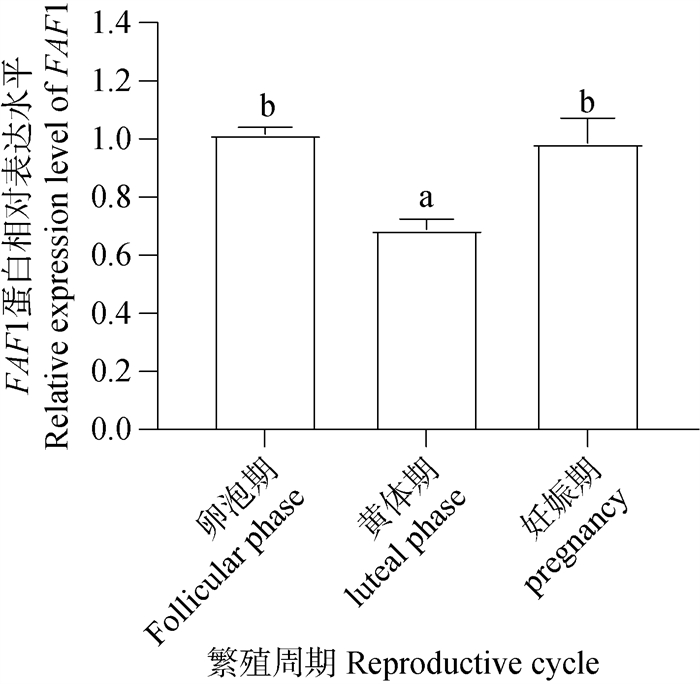
Western blot检测结果(图 13)显示,FAF1蛋白普遍存在于牦牛不同繁殖周期的卵巢组织中。经统计分析结果(图 14)显示,卵泡期和妊娠期卵巢FAF1蛋白相对表达量显著高于黄体期,卵泡期卵巢表达量最高,妊娠期卵巢次之,黄体期卵巢中的FAF1相对表达量最低,FAF1蛋白在牦牛不同繁殖周期卵巢组织中相对表达存在差异性。

|
1. 卵泡期卵巢;2. 黄体期卵巢;3. 妊娠期卵巢 1. Follicular ovary; 2. Luteal phase ovary; 3. Ovaries during pregnancy 图 13 β-actin和FAF1蛋白在不同繁殖周期卵巢检测结果 Fig. 13 Results of β-actin and FAF1 protein in ovary during different reproductive cycles |
|
图 14 FAF1蛋白在不同繁殖周期卵巢相对表达水平 Fig. 14 Relative expression levels of FAF1 protein in ovary during different reproductive cycles |
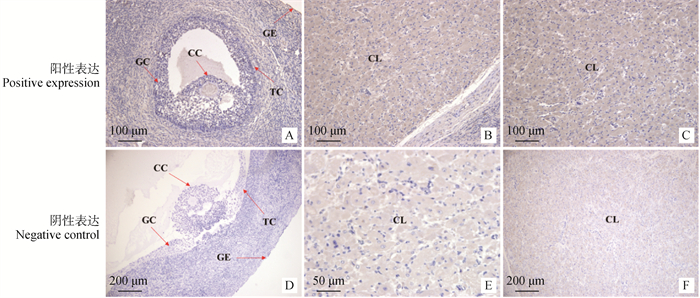
免疫组织化学染色结果(图 15)显示,FAF1蛋白在不同繁殖周期卵巢均存在棕褐色阳性表达。在不同繁殖周期卵巢中表达部位并无明显的差异,主要表达于卵巢生殖上皮细胞、颗粒细胞、卵丘细胞(图 15A)卵泡膜细胞和黄体细胞(图 15B、15C)。
|
A、D为卵泡期卵巢;B、E为黄体期卵巢;C、F为妊娠期卵巢;GC. 颗粒细胞;GE. 生殖上皮细胞;TC. 卵泡膜细胞;CL. 黄体细胞;CC. 卵丘细胞 A and D are follicular stage ovaries; B and E are luteal phase ovaries; C and F are ovaries during pregnancy; GC. Granulosa cell; GE. Germ epithelial cells; TC. Theca cell; CL. Luteal cells; CC. Cumulus cell 图 15 FAF1蛋白在不同繁殖周期卵巢的表达定位 Fig. 15 Expression localization of FAF1 protein in ovary during different reproductive cycles |
FAF1含有多个功能结构域,主要包括N末端UBA、C端UBX、DEDID、FID[11]。UBA能够募集对FAF1介导的细胞凋亡和应激反应至关重要的多泛素化蛋白[12],从而介导细胞凋亡和应激反应[13-14]。UBX与泛素-蛋白酶体系统中的分子伴侣含valosin的蛋白(valosin-containing protein,VCP)相结合[15],VCP是酵母中多功能Cdc48p和爪蟾中多功能p97的哺乳动物同源物[16],它是与多种细胞活动相关的ATP酶家族的成员,在细胞周期调节、凋亡、转录激活、细胞器生物发生、囊泡转运、内质网降解等多种生理过程中起分子伴侣的作用[17]。
DEDID可与Fas相关死亡域(Fas-associated protein with death domain, FADD)蛋白及caspase-8相互作用增强或者启动Fas介导的凋亡[18])。FID与IKKβ直接相互作用来阻止IKKα、IKKβ和IKKγ/NEMO复合物形成,从而抑制NF-κB信号传导,FAF1也被称为IκB激酶(IκB kinase,IKK)激活的抑制剂[14]。除此之外FAF1还可以通过干扰NF-κB的RelA亚基(p65)的核易位而抑制NF -κB的活性[19]。近年来,相关的研究报道还表明FAF1是一种抑癌基因,在多种肿瘤组织和细胞中的表达都是降低的,例如胃癌[20]、肺癌[21]、乳腺癌[22]等,FAF1表达下调可能导致肿瘤的发生。FAF1还通过抑制MAVS来调节抗病毒免疫过程[21]。
睾丸是雄性动物的生殖腺,是精子形成和睾酮分泌的主要器官[23]。哺乳动物睾丸内精子发生是一个复杂而又十分精细的生理过程,其中包括凋亡的调节机制,正常的精子在发生的过程中就存在自发性的生殖细胞凋亡现象[24-25],睾丸生殖细胞凋亡这一过程排除了受到损伤或具有畸形染色体的生殖细胞,既保证了遗传信息传递的准确性,又使得生殖细胞从支持细胞获得充足的营养和支持[26],而过度的凋亡又会使得生殖细胞数量过少,形成的精子数量减少,从而导致雄性个体生育能力下降。Fas信号通路与生精细胞的敏感性密切相关,可能主导生精细胞凋亡[27],FAF1为Fas通路的重要调控元件,对于Fas通路活化具有重要的调控作用[28]。本研究表明随着牦牛年龄的增长,从幼年到青年,再至老年,FAF1 mRNA及FAF1蛋白普遍表达于各个年龄阶段,但在不同年龄又有存在差异性,这与Adham等[6]在小鼠睾丸上的研究结果一致。FAF1 mRNA相对表达量在3、4周岁时升高,6周岁下降,7周岁再次升高,后又下降,差异化表达表明FAF1在睾丸发育及精子发生等生理过程发挥重要生物学作用。FAF1 mRNA相对表达量随着雄性牦牛达到性成熟而增加,可能是由于性成熟睾酮分泌量的改变,生殖细胞数量增加,造成睾丸生殖细胞凋亡增加[29],从而FAF1 mRNA相对表达量增加,老年时表达量下降则可能是由于睾酮分泌量减少,性功能降低,精子发生减少,相应凋亡也减少;FAF1蛋白相对表达量在青年初期(3、4周岁)时下降,后逐步升高,与FAF1 mRNA相对表达量不尽相同,可能因为FAF1蛋白不能单独启动细胞凋亡程序,除了在人类BOSC23细胞中可直接启动细胞凋亡[30],FAF1蛋白需与其他蛋白结合形成死亡效应丝(death effector filament,DEF)或DISC发挥凋亡作用[31],因此,FAF1蛋白相对表达量降低可能是形成了蛋白复合体来发挥凋亡作用而导致。FAF1蛋白主要表达于不同年龄的精子、精子细胞、精原细胞、初级精母细胞、支持细胞、睾丸间质细胞和管周肌样细胞中。支持细胞是为生殖细胞增殖分化提供营养和支持;睾丸间质细胞是分泌睾酮及影响支持细胞分化;管周肌样细胞主要是协同支持细胞,为精原细胞提供基质,产生不同阶段的生精细胞[32];提示FAF1可能参与睾丸发育、精子发生及睾酮分泌等重要生理过程。
卵巢在动物生殖中占有极其重要的地位,因为它不仅能产生卵细胞,还能分泌数种性激素。FAF1 mRNA相对表达量在黄体期卵巢显著高于卵泡期和妊娠期,妊娠期卵巢次之,卵泡期卵巢表达量最低。在卵巢组织中,闭锁卵泡、排卵时的卵巢上皮和黄体发生时都会发生细胞凋亡[33]。黄体期卵巢时由于形成黄体,孕激素分泌增加,FAF1 mRNA表达量显著上升,Taniguchi等[34]发现牛的黄体期卵巢Fas mRNA表达水平显著高于其他阶段,FAF1是Fas家族成员,为Fas通路重要调控原件,本研究结果与Taniguchi等[34]研究结果相似,推测FAF1 mRNA表达量受孕激素调控,可能参与黄体溶解的生理过程。FAF1蛋白相对表达量在卵泡期卵巢显著高于黄体期和妊娠期,妊娠期卵巢次之,黄体期相对表达量最低。FAF1蛋白表达情况与FAF1 mRNA表达情况相反,这可能是因为一般情况下FAF1蛋白需要与其他蛋白形成复合蛋白才能发挥其生物学作用,与上述FAF1蛋白在睾丸中表达情况相似,因此导致黄体期卵巢中FAF1蛋白表达量较低,用以形成复合物溶解黄体。FAF1表达于不同繁殖周期卵巢生殖上皮细胞、颗粒细胞、卵丘细胞和黄体细胞。生殖上皮在卵细胞形成中是不可或缺的因素[35];颗粒细胞的增殖分化与卵泡的发育密切相关[36],卵泡闭锁其实质就是颗粒细胞凋亡而产生的结果[37];卵丘细胞通过缝隙连接调节卵母细胞中激素蛋白质和相关调节因子的表达,从而影响卵母细胞成熟[38];卵泡膜细胞可以和颗粒细胞,卵母细胞发生相互作用,在卵泡发育过程中提供结构支持,还可以合成雄激素[39];黄体细胞在妊娠建立及黄体维持、发育和退化中具有重要作用[40]。而FAF1在雌性牦牛不同繁殖周期差异性表达,因此推测FAF1蛋白可能参与卵泡闭锁、发育、成熟和黄体溶解等生理过程。
4 结论本研究成功构建pET-28a-FAF1原核表达载体,并优化其诱导温度,诱导表达后的融合蛋白为不可溶性蛋白,经镍柱纯化后,利用Western blot鉴定,成功获得纯度较高的FAF1重组蛋白,免疫试验动物后获得兔源FAF1多克隆抗体,效价为1 ∶1 024 000,具有良好特异性。FAF1在不同年龄睾丸及不同繁殖周期卵巢组织中均有表达,且不同年龄睾丸及不同繁殖周期卵巢表达水平存在显著差异,揭示FAF1在牦牛不同阶段中具有重要生物学作用,推测FAF1可能与雄性牦牛的睾丸发育、精子发生及睾酮分泌密切相关,与雌性牦牛的卵泡闭锁、发育、成熟和黄体溶解生理过程相关,但相关机制有待进一步深入研究。
| [1] |
CHU K, NIU X, WILLIAMS L T. A Fas-associated protein factor, FAF1, potentiates Fas-mediated apoptosis[J]. Proc Natl Acad Sci U S A, 1995, 92(25): 11894-11898. DOI:10.1073/pnas.92.25.11894 |
| [2] |
PARK G, KIM B S, KIM E. A novel function of FAF1, which induces dopaminergic neuronal death through cell-to-cell transmission[J]. Cell Commun Signal, 2020, 18(1): 113. DOI:10.1186/s12964-020-00596-9 |
| [3] |
SONG S, PARK J K, SHIN S C, et al. The complex of Fas-associated factor 1 with Hsp70 stabilizes the adherens junction integrity by suppressing RhoA activation[J]. J Mol Cell Biol, 2022, 14(6): mjac037. DOI:10.1093/jmcb/mjac037 |
| [4] |
PENG H, LIU H J, LIU F, et al. NLRP2 and FAF1 deficiency blocks early embryogenesis in the mouse[J]. Reproduction, 2017, 154(3): 245-251. DOI:10.1530/REP-16-0629 |
| [5] |
WU ML, ZHAO HD, TANG XQ, et al. Organization and Complexity of the Yak (Bos Grunniens) Immunoglobulin Loci[J]. FRONT IMMUNOL, 2022, 9(13): 87-95. |
| [6] |
ADHAM I M, KHULAN J, HELD T, et al. Fas-associated factor (FAF1) is required for the early cleavage-stages of mouse embryo[J]. Mol Hum Reprod, 2008, 14(4): 207-213. DOI:10.1093/molehr/gan009 |
| [7] |
周彪. 浅析提高高原牦牛繁殖性能的技术要点[J]. 畜禽业, 2019, 30(4): 27. ZHOU B. A brief analysis on the technical points of improving reproductive performance of plateau yak[J]. Livestock and Poultry Industry, 2019, 30(4): 27. (in Chinese) |
| [8] |
张军强, 丁家桐. 细胞凋亡与生殖[J]. 畜牧与兽医, 2002, 34(7): 41-43. ZHANG J Q, DING J T. Gonadal cell apoptosis[J]. Animal Husbandry & Veterinary Medicine, 2002, 34(7): 41-43. DOI:10.3969/j.issn.0529-5130.2002.07.025 (in Chinese) |
| [9] |
KAKU H, LUDLOW A V, GUTKNECHT M F, et al. Fas apoptosis inhibitory molecule blocks and dissolves pathological amyloid-β species[J]. Front Mol Neurosci, 2021, 14: 750578. DOI:10.3389/fnmol.2021.750578 |
| [10] |
YU C S, KIM B S, PARK M, et al. FAF1 mediates necrosis through JNK1-mediated mitochondrial dysfunction leading to retinal degeneration in the ganglion cell layer upon ischemic insult[J]. Cell Commun Signal, 2018, 16(1): 56. DOI:10.1186/s12964-018-0265-7 |
| [11] |
CUI S J, SIMMONS JR G, VALE G, et al. FAF1 blocks ferroptosis by inhibiting peroxidation of polyunsaturated fatty acids[J]. Proc Natl Acad Sci U S A, 2022, 119(17): e2107189119. DOI:10.1073/pnas.2107189119 |
| [12] |
SONG E J, KANG M J, KIM Y S, et al. Flagellin promotes the proliferation of gastric cancer cells via the Toll-like receptor 5[J]. Int J Mol Med, 2011, 28(1): 115-119. |
| [13] |
GAO F F, QUAN J H, CHOI I W, et al. FAF1 downregulation by Toxoplasma gondii enables host IRF3 mobilization and promotes parasite growth[J]. J Cell Mol Med, 2021, 25(19): 9460-9472. DOI:10.1111/jcmm.16889 |
| [14] |
LI X M, CHENG Y L, LI J Y, et al. Torularhodin alleviates hepatic dyslipidemia and inflammations in high-fat diet-induced obese mice via PPARα signaling pathway[J]. Molecules, 2022, 27(19): 6398. DOI:10.3390/molecules27196398 |
| [15] |
RAPE M, HOPPE T, GORR I, et al. Mobilization of processed, membrane-tethered SPT23 transcription factor by CDC48UFD1/NPL4, a ubiquitin-selective chaperone[J]. Cell, 2001, 107(5): 667-677. DOI:10.1016/S0092-8674(01)00595-5 |
| [16] |
FUJISAWA R, POLO RIVERA C, LABIB K P M. Multiple UBX proteins reduce the ubiquitin threshold of the mammalian p97-UFD1-NPL4 unfoldase[J]. eLife, 2022, 11: e76763. DOI:10.7554/eLife.76763 |
| [17] |
CHAPMAN J H, CRAIG J M, WANG C D, et al. UPF1 mutants with intact ATPase but deficient helicase activities promote efficient nonsense-mediated mRNA decay[J]. Nucleic Acids Res, 2022, 50(20): 11876-11894. DOI:10.1093/nar/gkac1026 |
| [18] |
董少男, 谢琪璇, 秋山泰身, 等. Fas相关因子1的研究进展[J]. 中国病理生理杂志, 2012, 37(2): 565-569, 576. DONG S N, XIE Q X, AKIYAMA T, et al. Progresses and insights of Fas-associated factor 1[J]. Chinese Journal of Pathophysiology, 2012, 37(2): 565-569, 576. (in Chinese) |
| [19] |
PARK M Y, JANG H D, LEE S Y, et al. Fas-associated Factor-1 Inhibits Nuclear Factor-κB (NF-κB) Activity by Interfering with Nuclear Translocation of the RelA (p65) Subunit of NF-κB[J]. J Biol Chem, 2004, 279(4): 2544-2549. DOI:10.1074/jbc.M304565200 |
| [20] |
HYLAND P L, LIN S W, HU N, et al. Genetic variants in fas signaling pathway genes and risk of gastric cancer[J]. Int J Cancer, 2014, 134(4): 822-831. DOI:10.1002/ijc.28415 |
| [21] |
DAI T, WU L M, WANG S, et al. FAF1 regulates antiviral immunity by inhibiting MAVS but is antagonized by phosphorylation upon viral infection[J]. Cell Host Microbe, 2018, 24(6): 776-790. DOI:10.1016/j.chom.2018.10.006 |
| [22] |
OMID-SHAFAAT R, MOAYERI H, RAHIMI K, et al. Serum Circ-FAF1/Circ-ELP3:a novel potential biomarker for breast cancer diagnosis[J]. J Clin Lab Anal, 2021, 35(11): e24008. |
| [23] |
刘敏清. 牦牛AQP1和AQP11基因的克隆及其在不同发育阶段睾丸中的表达[D]. 兰州: 甘肃农业大学, 2021. LIU M Q. Yak (Bos Grunniens) AQP1 and AQP11 gene cloning and their expression in the testes at different developmental stages[D]. Lanzhou: Gansu Agricultural University, 2021. (in Chinese) |
| [24] |
NIEDERBERGER C. Re: the effect of age on the expression of apoptosis biomarkers in human spermatozoa[J]. J Urol, 2011, 186(3): 1015-1016. |
| [25] |
AITKEN R J, FINDLAY J K, HUTT K J, et al. Apoptosis in the germ line[J]. Reproduction, 2011, 141(2): 139-150. |
| [26] |
SHUKLA K K, MAHDI A A, RAJENDER S. Apoptosis, spermatogenesis and male infertility[J]. Front Biosci Elite Ed, 2012, 4(2): 746-754. |
| [27] |
TRAORE K, MARTINEZ-ARGUELLES D B, PAPADOPOULOS V, et al. Repeated exposures of the male Sprague Dawley rat reproductive tract to environmental toxicants: do earlier exposures to di-(2-ethylhexyl)phthalate (DEHP) alter the effects of later exposures?[J]. Reprod Toxicol, 2016, 61: 136-141. |
| [28] |
杲修杰. HSP70阻抑应激心肌细胞凋亡Fas通路的FAF1调控机制[D]. 北京: 中国人民解放军军事医学科学院, 2015. GAO X J. HSP70 inhibits FAF1 regulation of Fas Pathway in stressed cardiomyocytes[D]. Beijing: Academy of Military Medical Sciences, 2015. (in Chinese) |
| [29] |
ORAZIZADEH M, KHORSANDI L S, HASHEMITABAR M. Toxic effects of dexamethasone on mouse testicular germ cells[J]. Andrologia, 2010, 42(4): 247-253. |
| [30] |
KAMATH R S, FRASER A G, DONG Y, et al. Systematic functional analysis of the Caenorhabditis elegans genome using RNAi[J]. Nature, 2003, 421(6920): 231-237. |
| [31] |
PARK M Y, RYU S W, KIM K D, et al. Fas-associated factor-1 mediates chemotherapeutic-induced apoptosis via death effector filament formation[J]. Int J Cancer, 2005, 115(3): 412-418. |
| [32] |
王霞. 藏绵羊睾酮合成相关基因在睾丸和附睾中的表达特征及生物学功能[D]. 兰州: 甘肃农业大学, 2021. WANG X. The expression characteristics and biological function of tibetan sheep testosterone synthesis-related genes in testes and epididymides[D]. Lanzhou: Gansu Agricultural University, 2021. (in Chinese) |
| [33] |
TILLY J L, HSUEH A J W. Apoptosis as the basis of ovarian follicular atresia[M]//HILLIER S G. Gonadal Development and Function. New York: Raven Press, 1992: 157-165.
|
| [34] |
TANIGUCHI H, YOKOMIZO Y, OKUDA K. Fas-fas ligand system mediates luteal cell death in bovine corpus luteum[J]. Biol Reprod, 2002, 66(3): 754-759. |
| [35] |
李谷月. FSH诱导体外培养的天祝白牦牛卵泡颗粒细胞凋亡及其对调控基因Fas/FasL mRNA表达的影响[D]. 兰州: 甘肃农业大学, 2013. LI G Y. The effects of FSH on apoptosis of ovarian granulose cells of Tian Zhu white yak and on expression of Fav/FasL mRNA in vitro[D]. Lanzhou: Gansu Agricultural University, 2013. (in Chinese) |
| [36] |
许慧韬. 抑制素在牛体外有腔卵泡中的表达规律及其对牛卵泡颗粒细胞增殖的影响[D]. 北京: 中国农业科学院, 2020. XU H T. Expression of inhibin in bovine antral follicles and its effect on the proliferation of bovine follicular granulosa cells in vitro[D]. Beijing: Chinese Academy of Agricultural Sciences, 2020. (in Chinese) |
| [37] |
谢敏, 姜法贵, 郭燕君. 卵泡发育和闭锁过程中颗粒细胞自噬和凋亡关系的研究[J]. 四川生理科学杂志, 2015, 37(2): 85-88. XIE M, JIANG F G, GUO Y J. Relationship between granulosa cells autophagy and apoptosis in the process of follicular development and atresia[J]. Sichuan Journal of Physiological Sciences, 2015, 37(2): 85-88. (in Chinese) |
| [38] |
刘斌, 王靖雷, 高丽青, 等. LPA对牦牛卵丘细胞主要卵源因子表达的影响[J]. 农业生物技术学报, 2023, 31(5): 989-1000. LIU B, WANG J L, GAO L Q, et al. Effect of LPA on the expression of main oocytesreted factors in cumulus cells of yak (Bos grunniens)[J]. Journal of Agricultural Biotechnology, 2023, 31(5): 989-1000. (in Chinese) |
| [39] |
YOUNG J M, MCNEILLY A S. Theca: the forgotten cell of the ovarian follicle[J]. Reproduction, 2010, 140(4): 489-504. |
| [40] |
张文华. 催产素对牛黄体细胞中突触素表达的影响[D]. 杨凌: 西北农林科技大学, 2012. ZHANG W H. Effect of oxytocin on the expression of syp in Bovine luteal cells[D]. Yangling: Northwest A&F University, 2012. (in Chinese) |
(编辑 范子娟)



