2. 沧州职业技术学院农牧工程系, 沧州 061000
2. Department of Agricultural and Animal Husbandry Engineering, Cangzhou Technical College, Cangzhou 061000, China
绵羊的排卵数/胎产羔数与卵泡的生长发育和闭锁密切相关[1],颗粒细胞作为卵泡内数量最多、比例最大以及功能最全的细胞群,其增殖、凋亡、分化和激素生成等对卵泡生长发育及卵泡闭锁至关重要[2-3]。本课题组最新研究发现,TGF-β信号通路在具有高繁殖力的绵羊卵泡内发挥正调控作用[4]。TGFβR1作为TGF-β信号通路的核心信号分子,是否通过介导TGF-β/Smad分支信号通路调控绵羊卵泡内颗粒细胞的功能,目前尚不清楚。
TGF-β/Smad是TGF-β信号通路的一个重要分支,其中磷酸化的TGFβ受体活性因子(TGFβR1)作为核心信号分子,会依次与SMAD2/3结合并将其活化,共同与SMAD4结合后调控下游基因的表达。在小鼠和猪等哺乳动物的卵巢颗粒细胞中,TGF-β信号通路的激活可促进颗粒细胞增殖[5-7],而失活则会导致颗粒细胞凋亡和卵泡闭锁[8-10]。Zhang等[11]研究表明,TGFβR1和SMAD3的表达受到阻碍时,导致猪颗粒细胞的生长和分化减少,并致使细胞凋亡。现有研究发现,SMAD3基因敲除会导致大鼠雌激素产生减少和颗粒细胞凋亡增加[12]。Yu和Liu[13]的研究发现,SMAD2是miR-30d-5p的靶基因,SMAD2过表达增强了大鼠卵巢颗粒细胞增殖并抑制了细胞凋亡。SMAD4是细胞核中TGF-β信号通路的介体和效应器,调节众多细胞过程,包括细胞增殖、分化、自身免疫、多能性和可塑性以及细胞生长、凋亡、自噬、侵袭和转移[14-17]。SMAD4失调与胚胎、骨骼肌分化缺陷、干细胞丢失、神经系统发育障碍和延迟、女性不育和其他疾病有关[18-22]。
为此,本试验拟构建pcDNA3.1(+)-TGFβR1和pcDNA3.1(+)-SMAD4过表达质粒载体及shRNA-TGFβR1和shRNA-SMAD4干扰表达质粒载体,对绵羊颗粒细胞中TGFβR1和SMAD4基因分别进行过表达和干扰,利用CCK-8细胞增殖检测、流式细胞术、Annexin-V FITC/PI双染技术检测绵羊颗粒细胞增殖、周期及凋亡功能,并结合Real-Time PCR及Western blot检测TGFβR1、SMAD4的mRNA水平和TGF-β/Smad信号通路中TGFβR1、SMAD2/3等的磷酸化水平,探究TGFβR1、SMAD4对颗粒细胞增殖、凋亡、周期及TGF-β信号通路的影响,进而揭示TGFβR1介导TGF-β/Smad信号通路调控绵羊卵泡内颗粒细胞功能的机制。
1 材料与方法 1.1 试验材料1.1.1 绵羊卵巢 从河北省保定市唐县屠宰场采集绵羊卵巢,将其放入加有1%双抗的37 ℃生理盐水中,于3 h内运回实验室。
1.1.2 主要试剂 胎牛血清、胰酶、双抗、0.25% Tripsin-EDTA均购自Gibco公司;DME/F-12、PBS购自Hyclone公司;TRIzol® Plus RNA Purification Kit购自Invitrogen公司;RNase-Free DNase Set购自Qiagen公司;SuperScriptTM Ⅲ First-Strand Synthesis SuperMix for qRT-PCR、Power SYBR® Green PCR Master Mix购自Roche公司;30%丙烯酰胺溶液购自Bio-Rad公司;PVDF转印膜购自Millipore公司;ECL DualVue WB Marker购自GE公司;SuperSignal West Dura Extended Duration Substrate购自Thermo Pierce公司;X-ray film购自华东医药;细胞周期检测试剂盒购自碧云天生物技术公司;Annexin V-FITC/PI细胞凋亡检测试剂盒购自江苏凯基生物。
1.1.3 主要仪器设备 二氧化碳培养箱购自Thermo Fisher公司;Quantstudio多重实时荧光定量PCR仪购自美国life technologies公司;Mini-PROTEAN电泳系统、Mini Trans-Blot转印系统购自美国Bio-Rad公司;流式细胞仪购自美国Becton-Dickinson FACS Calibur公司。
1.2 试验方法1.2.1 颗粒细胞采集及培养 剪下屠宰绵羊的卵巢,用75%酒精喷洗,放于37 ℃灭菌生理盐水(含双抗)的保温瓶中,于4 h内回到实验室,进行颗粒细胞采集。采用预热37 ℃的生理盐水冲洗卵巢,使用灭菌剪刀剪掉卵巢周围系膜,生理盐水反复冲洗至干净,在DME/F-12培养基(含10%胎牛血清)中用无菌刀片划破3~7 mm的卵泡,将卵泡液和培养基混合液转移至离心管(10 mL)中,1 500 r ·min-1离心8 min,弃上清,PBS清洗两次,加入DME/F-12培养基(含10%胎牛血清)吹打混匀后接种于培养皿中,置于37 ℃,50 mL ·L-1 CO2培养箱中培养。参照韩红叶[23]的方法对颗粒细胞进行免疫荧光鉴定。
1.2.2 pcDNA3.1(+)-TGFβR1和pcDNA3.1(+)-SMAD4真核表达载体的构建 使用Nhe I和Hind Ⅲ两个限制性内切酶对pcDNA3.1质粒载体进行双酶切线性化处理,并通过琼脂糖凝胶电泳检测酶切产物,切胶回收线性化的pcDNA3.1载体。通过PCR扩增获取TGFβR1和SMAD4基因的目的片段,引物由上海桑尼生物合成,TGFβR1与SMAD4引物序列见表 1。PCR扩增程序:95 ℃ 3 min;95 ℃ 30 s,58 ℃ 30 s,72 ℃ 1 min,29个循环;72 ℃ 10 min。胶回收目的片段后进行重组反应,重组反应体系:目的片段1 μL,线性化载体1 μL,2×Super Fusion Mix 5 μL,H2O 3 μL,50 ℃水浴1 h完成重组反应。将重组产物转化至感受态细胞DH5α中,将菌液涂板37 ℃恒温箱培养12 h,挑取单克隆菌落37 ℃摇菌16 h,酶切验证后将阳性菌液送公司测序鉴定。对符合条件的质粒命名为pcDNA3.1(+)-TGFβR1和pcDNA3.1(+)-SMAD4质粒载体(文中简称为pc3.1-TGFβR1和pc3.1-SMAD4),对照组为pcDNA3.1空白载体(文中简称为PC组)。
|
|
表 1 PCR引物序列 Table 1 Primers sequence for PCR |
1.2.3 shRNA-TGFβR1和shRNA-SMAD4质粒的构建 使用Age I和EcoR I两个限制性内切酶对pLKO.1质粒进行双酶切线性化处理,并通过琼脂糖凝胶电泳检测酶切产物,切胶回收线性化的pLKO.1载体。TGFβR1和SMAD4的shRNA oligo序列信息见表 2。shRNA oligo退火后得到双链shRNA,使用T4连接酶将双链shRNA和线性化的pLKO.1载体进行连接反应,连接反应体系:退火得到的双链DNA片段2 μL,线性化载体1 μL,T4连接酶1 μL,T4 buffer 2 μL,H2O 14 μL,16 ℃反应过夜。将重组产物转化至感受态细胞DH5α中,将菌液涂板37 ℃恒温箱培养12 h,挑取单克隆菌落37 ℃摇菌16 h,酶切验证后将阳性菌液送公司测序鉴定。对符合条件的质粒命名为shRNA-TGFβR1和shRNA-SMAD4质粒载体,对照组为shRNA-NC空白载体。
|
|
表 2 shRNA oligo序列信息 Table 2 shRNA oligo sequence information |
1.2.4 过表达与干扰质粒载体转染 颗粒细胞正常培养达到70%~80%融合度后,胰蛋白酶消化、PBS清洗,完全培养基重悬,以5×105个细胞铺于6孔板中,每个组别3个重复。利用Lipofectamine 3000转染试剂分别将pcDNA3.1(+)-TGFβR1、pcDNA3.1(+)-SMAD4、shRNA-TGFβR1和shRNA-SMAD4质粒转染至绵羊颗粒细胞,参照lipo3000转染说明书进行转染,取两个1.5 mL离心管,分别加入125 μL opti-MEM、5 μL lipo3000试剂和125 μL opti-MEM、2.5 μL质粒、5 μL lipo3000试剂,轻轻混匀,按1 ∶1轻轻混合两管溶液于室温下孵育10~15 min,将转染溶液添加至6孔板中,在37 ℃培养48 h后收取细胞进行后续试验。
1.2.5 细胞增殖、凋亡及周期的检测 采用CCK-8细胞增殖检测技术对颗粒细胞进行测定,将细胞接种于96孔板中培养24 h,在每孔中加入10 μL CCK-8溶液,置于培养箱中孵育2 h,用酶标仪测定450 nm处的OD值。采用细胞周期检测试剂盒检测颗粒细胞的细胞周期情况,收集处理好的细胞,加入500 μL PI/RNase A染色工作液,室温混匀避光30 min,使用流式细胞仪检测周期情况。采用Annexin-V FITC/PI试剂盒检测颗粒细胞的凋亡情况,在悬浮细胞中加入10 μL Annexin-V FITC和5 μL PI溶液,混匀避光20 min,用流式细胞仪检测细胞凋亡情况。
1.2.6 TGFβR1和SMAD4基因表达水平的检测 采用TRIzol法提取颗粒细胞的总RNA,并用cDNA链合成试剂盒得到cDNA,通过Real-Time PCR检测转染后颗粒细胞中TGFβR1和SMAD4的mRNA表达水平,采用Primer Premier 6.0进行引物设计(表 3)。配制20 μL反应体系: Master Mix 10.0 μL,上、下游引物各0.5 μL,cDNA 1.0 μL,ddH2O 8.0 μL。反应条件为:95 ℃ 1 min;95 ℃ 15 s,63 ℃ 25 s,40个循环。每个样品重复3次,各个基因的相对表达水平用2-ΔΔct表示。
|
|
表 3 Real-Time PCR的引物序列 Table 3 Primer sequence for Real-Time PCR |
1.2.7 蛋白水平的检测 提取颗粒细胞的总蛋白,通过Western blot方法检测TGFβR1、BAX、BCL2、Caspase3、SMAD4、p-TGFβR1、p-TGFβR2、p-SMAD2/3的蛋白水平。做SDS-PAGE电泳分析,电泳结束后进行蛋白质转膜和转印膜封闭后进行一抗杂交,4 ℃孵育过夜,T-TBS漂洗4次,每次5 min;二抗室温孵育1 h,T-TBS漂洗5次,每次5 min;ECL工作液处理后放于成像仪中显色留图,采用Image J软件对蛋白条带进行分析。
1.2.8 统计分析 本试验均重复3次,使用SPSS 26.0软件进行统计学分析,结果均以“平均值±标准差”表示,采用单因素方差分析检验数据的差异显著性,P<0.05表示具有显著性差异,P<0.01表示具有极显著性差异,采用Origin 2021软件进行绘图。
2 结果 2.1 绵羊卵巢颗粒细胞的鉴定绵羊卵巢颗粒细胞可特异性表达FSHR蛋白,检测FSHR的存在状况可鉴定颗粒细胞,如图 1所示,FSHR在细胞质中表达,经FSHR染色后,细胞的胞浆部分呈绿色荧光,而DAPI染色后细胞核清晰呈现蓝色荧光,通过重叠可直观表现出细胞的细胞核及细胞质的分布区域,显微镜下可见的FSHR表达率>90%,表明分离培养的绵羊颗粒细胞纯度较高,符合后续试验对颗粒细胞的条件要求。

|
图 1 绵羊颗粒细胞FSHR免疫荧光染色情况 Fig. 1 Immunofluorescence staining of FSHR in sheep granulosa cells |
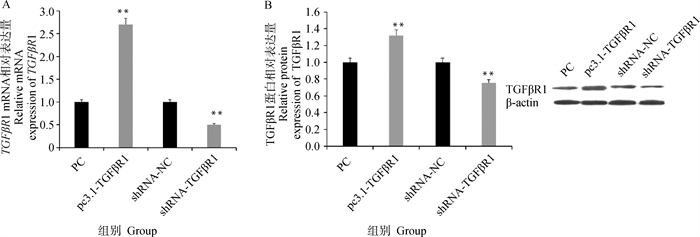
通过Real-Time PCR及Western blot对转染过表达和干扰TGFβR1载体的颗粒细胞中TGFβR1的表达量进行检测,结果显示(图 2A),pc3.1-TGFβR1过表达载体转染颗粒细胞后,TGFβR1的表达量较对照组(PC组)极显著升高(P < 0.01),而shRNA-TGFβR1组转染颗粒细胞后,TGFβR1的表达量较shRNA-NC组极显著降低(P < 0.01)。通过Western blot方法对转染过表达或干扰TGFβR1载体的颗粒细胞中TGFβR1蛋白表达变化进行检测,结果表明(图 2B),过表达TGFβR1会极显著增加其蛋白的表达量(P < 0.01),干扰TGFβR1会极显著降低蛋白的表达量(P < 0.01)。以上结果表明, TGFβR1过表达载体和干扰载体能够显著改变TGFβR1的表达水平,可用于后续试验。
|
A. TGFβR1 mRNA相对表达量;B. TGFβR1蛋白相对表达量。*.P<0.05;**.P<0.01,下同。过表达组基因相对表达量均按PC=1的标准进行均一化处理;干扰组基因相对表达量均按shRNA-NC=1的标准进行均一化处理。下同 A. Relative expression of TGFβR1 mRNA; B. Relative expression level of TGFβR1 protein. *.P < 0.05; **.P < 0.01, the same as below.Relative expression levels of overexpressed genes were homogenized according to the standard of PC=1. The relative expression levels of interfering genes were homogenized according to shRNA-NC=1. The same as below 图 2 TGFβR1过表达和干扰的转染效率 Fig. 2 Transfection efficiency of TGFβR1 overexpression and interference |
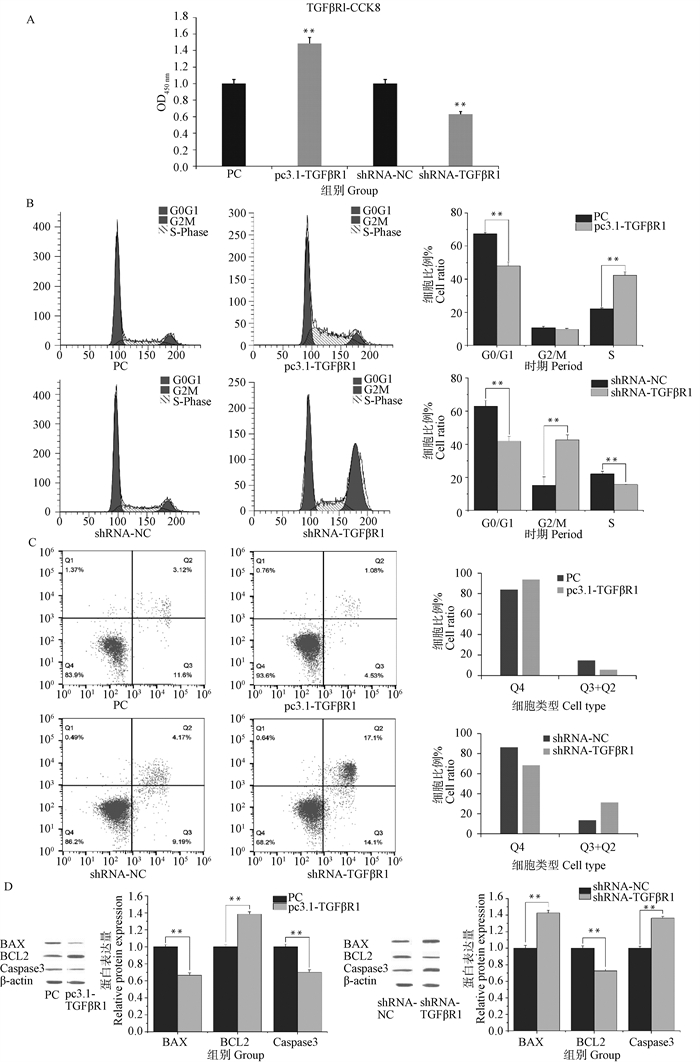
用CCK-8方法检测转染过表达和干扰TGFβR1载体的颗粒细胞增殖的情况,结果表明(图 3A),TGFβR1过表达促进颗粒细胞增殖,TGFβR1干扰较shRNA-NC对照组会抑制颗粒细胞的增殖。细胞周期检测结果显示(图 3B),TGFβR1过表达,G0/G1期细胞数量极显著降低,对应S期细胞数量极显著增加(P<0.01),G2/M期细胞数量无显著变化(P>0.05);TGFβR1干扰可极显著降低G0/G1和S期的细胞数量,而G2/M期细胞数量则极显著增加(P<0.01)。通过Annexin-V FITC/PI检测细胞凋亡结果显示(图 3C),与PC组对比,TGFβR1过表达可以显著降低颗粒细胞的凋亡数量(P<0.05);与shRNA-NC对照组相比,TGFβR1干扰则显著增加颗粒细胞凋亡数量(P<0.05)。TGFβR1过表达和干扰会影响凋亡蛋白的表达(图 3D),TGFβR1过表达会极显著抑制BAX和Caspase3蛋白的表达水平,TGFβR1干扰会极显著抑制BCL2蛋白的表达水平(P < 0.01)。
|
A. TGFβR1过表达/干扰后颗粒细胞CCK-8检测结果;B. TGFβR1过表达/干扰处理后颗粒细胞周期流式检测结果;C. TGFβR1过表达/干扰处理后颗粒细胞凋亡检测结果(Q1.坏死;Q2.凋亡晚期;Q3.凋亡早期;Q4.正常);D. TGFβR1过表达/干扰处理凋亡蛋白BAX、BCL2、Caspase3表达水平检测结果 A. Detection results of granulosa cell CCK-8 after TGFβR1 overexpression/interference; B. Flow cytometry of granulosa cell cycle after TGFβR1 overexpression/interference; C. Apoptosis detection results of granulosa cells after TGFβR1 verexpression/interference (Q1.Necrosis; Q2.Late apoptosis; Q3.Early apoptosis; Q4.Normal); D. Apoptotic protein expression levels of BAX, BCL2 and Caspase3 after TGFβR1 overexpression/interference treatment 图 3 TGFβR1过表达/干扰对颗粒细胞增殖、周期、凋亡的影响 Fig. 3 Effects of overexpression/interference of TGFβR1 on proliferation, cycle, apoptosis of granulosa cells |
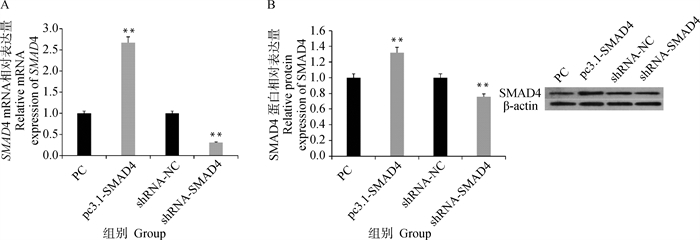
通过Real-Time PCR及Western blot对过表达和干扰SMAD4载体的颗粒细胞中SMAD4的表达量进行检测,结果显示(图 4A),pc3.1-SMAD4载体转染颗粒细胞后,SMAD4的表达量较对照组(PC组)极显著升高(P < 0.01),而shRNA-SMAD4组转染颗粒细胞后,SMAD4的表达量较shRNA-NC组极显著降低(P < 0.01)。通过Western blot方法对转染过表达和干扰SMAD4载体的颗粒细胞中SMAD4的蛋白表达变化进行检测,结果表明(图 4B),SMAD4过表达会极显著增加其蛋白的表达量(P < 0.01),干扰SMAD4极显著降低其蛋白的表达量(P < 0.01)。以上结果表明, SMAD4过表达载体和干扰载体能够显著改变SMAD4的表达水平,均可用于后续试验。
|
A. SMAD4 mRNA相对表达量;B. SMAD4蛋白相对表达量 A. Relative expression level of SMAD4 mRNA; B.Relative expression of SMAD4 protein 图 4 SMAD4过表达和干扰的转染效率 Fig. 4 Transfection efficiency of SMAD4 overexpression and interference |
通过CCK-8方法检测转染过表达和干扰SMAD4载体的颗粒细胞增殖的情况(图 5A),SMAD4过表达可极显著促进颗粒细胞的增殖(P<0.01),干扰SMAD4可极显著抑制颗粒细胞的增殖(P<0.01)。细胞周期检测结果显示(图 5B),SMAD4过表达,G0/G1期的细胞数量极显著下降(P<0.01),G2/M期细胞数量显著降低(P<0.05),而S期细胞数量则极显著增加(P<0.01);干扰SMAD4后的颗粒细胞,G0/G1期的细胞数量极显著下降,G2/M期和S期细胞数量极显著增多(P<0.01)。细胞凋亡检测结果显示(图 5C),pc3.1-SMAD4载体转染颗粒细胞后,降低了凋亡细胞比例,对细胞凋亡的抑制具有积极作用;shRNA-SMAD4组转染颗粒细胞后与对照组(shRNA-NC组)相比,细胞凋亡数量有所增多。进一步探究SMAD4对凋亡蛋白表达水平的影响发现(图 5D),SMAD4过表达会极显著抑制BAX和Caspase3蛋白的表达,干扰SMAD4会极显著抑制BCL2蛋白的表达(P<0.01)。

|
A. SMAD4过表达/干扰后颗粒细胞CCK-8检测结果;B. SMAD4过表达/干扰后颗粒细胞周期流式检测结果;C. SMAD4过表达/干扰处理后颗粒细胞凋亡检测结果(Q1.坏死;Q2.凋亡晚期;Q3.凋亡早期;Q4.正常);D. SMAD4过表达/干扰后凋亡蛋白BAX、BCL2、Caspase3的蛋白表达水平检测结果 A. Detection results of granulosa cell CCK-8 after SMAD4 overexpression/interference; B. Results of cell cycle flow cytometry after SMAD4 overexpression/interference; C. Apoptosis detection results of granulosa cells after SMAD4 overexpression/interference (Q1.Necrosis; Q2.Late apoptosis; Q3.Early apoptosis; Q4.Normal); D. The protein expression levels of BAX, BCL2 and Caspase3 after SMAD4 overexpression/interference treatment 图 5 SMAD4过表达/干扰对颗粒细胞增殖、周期、凋亡的影响 Fig. 5 Effects of SMAD4 overexpression/interference on granulosa cell proliferation, cycle, apoptosis |
TGFβR1过表达与干扰载体转染颗粒细胞后发现(图 6),TGFβR1过表达会极显著促进SMAD4蛋白的表达(P<0.01),干扰TGFβR1后极显著降低SMAD4蛋白的表达(P<0.01),表明TGFβR1对SMAD4蛋白的表达具有促进作用。

|
图 6 TGFβR1过表达和干扰对SMAD4蛋白表达的影响 Fig. 6 Effects of TGFβR1 overexpression and interference on SMAD4 protein expression |
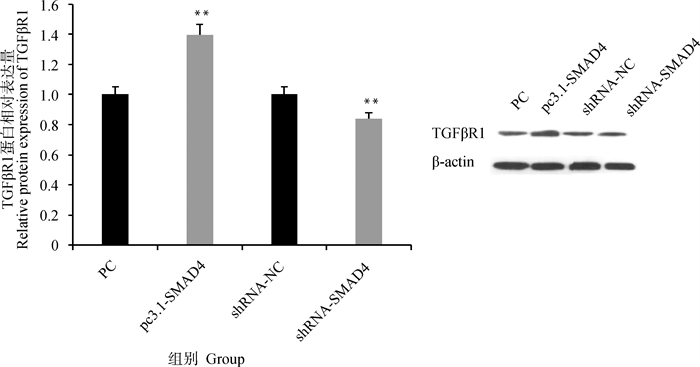
SMAD4过表达和干扰载体转染颗粒细胞后,检测TGFβR1蛋白的表达情况发现(图 7),SMAD4过表达会极显著增加TGFβR1蛋白的表达(P<0.01),干扰SMAD4极显著降低TGFβR1蛋白的表达(P<0.01)。
|
图 7 SMAD4过表达和干扰对TGFβR1蛋白表达的影响 Fig. 7 Effects of SMAD4 overexpression and interference on TGFβR1 protein expression |
TGFβR1过表达和干扰载体转染颗粒细胞后,检测TGF-β信号通路蛋白(p-TGFβR1、p-TGFβR2、p-SMAD2/3)的表达情况发现(图 8),TGFβR1过表达极显著促进了TGFβR1、TGFβR2及SMAD2/3蛋白的磷酸化水平(P<0.01),与此同时,TGFβR1干扰会极显著抑制p-TGFβR1与p-TGFβR2的表达(P<0.01),会降低SMAD2/3的磷酸化水平。

|
A. TGFβR1过表达后p-TGFβR1、p-TGFβR2、p-SMAD2/3蛋白的相对表达量;B. TGFβR1干扰后p-TGFβR1、p-TGFβR2、p-SMAD2/3蛋白的相对表达量 A. Relative expression level of p-TGFβR1, p-TGFβR2 and p-SMAD2/3 proteins after overexpression of TGFβR1; B. Relative expression level of p-TGFβR1, p-TGFβR2 and p-SMAD2/3 proteins after TGFβR1 interference 图 8 TGFβR1过表达和干扰对TGF-β信号通路相关蛋白表达的影响 Fig. 8 Effect of TGFβR1 overexpression/interference on TGF-β signaling pathway-related proteins expression |
绵羊胎产羔数的提升是近年来国内外研究的热点之一。绵羊卵泡发育影响繁殖力的高低,许多研究表明,颗粒细胞的发育状态与卵泡的命运有关。颗粒细胞增殖促进卵泡成熟和排卵,而凋亡导致卵泡闭锁和退化[24],抑制卵巢颗粒细胞凋亡,可促进卵泡发育,提高排卵率和胎产羔数。TGF-β/Smad信号通路在细胞增殖分化、个体发育、软骨发生以及生殖发育、组织创伤修复等过程中都发挥着极其重要的作用[25-26]。本试验探讨了TGFβR1对绵羊颗粒细胞增殖凋亡的作用,并进一步探究TGFβR1如何通过TGF-β/Smad信号通路参与颗粒细胞功能的调控。结果发现,过表达TGFβR1可加快细胞进程进入S期,促进绵羊颗粒细胞增殖,抑制颗粒细胞凋亡,干扰TGFβR1会发生G2/M期阻滞,抑制绵羊颗粒细胞的增殖,促进其凋亡。这些发现与前人的研究结果类似,TGFβR1是TGFβ配体的1型受体[27-28],参与下丘脑-垂体-卵巢轴的调控,促进卵子的发育成熟及黄体形成,参与滋养细胞的增殖、分化[29];TGFβR1还可以介导生长分化因子9(GDF9)的信号,促进颗粒细胞的增殖和人腔前卵泡的生长[30];敲除TGFβR1基因的小鼠能排卵和产生卵母细胞,但会发生胚胎死亡[31],同时还伴随着严重的输卵管畸形[28, 32],这些结果显示,TGFβR1会对颗粒细胞的增殖产生促进作用。进一步研究发现,TGFβR1会抑制促凋亡基因BAX和Caspase3的表达,促进抗凋亡基因BCL2的表达。有研究表明,抗凋亡蛋白BCL2和促凋亡蛋白BAX是细胞凋亡的关键调节因子,其主要作用部位是线粒体膜:前者抑制细胞色素c(Cytc)的释放,后者启动Cytc的释放。BCL2蛋白通过调节生殖细胞和体细胞的凋亡,在卵泡生长发育和卵泡闭锁中发挥重要作用。BCL2基因缺陷的小鼠表现出卵母细胞和原始卵泡数量的减少[33],而BCL2的过表达减少了大的有腔卵泡的颗粒细胞凋亡,从而增加卵泡发生,提高排卵率。而BAX在卵母细胞和颗粒细胞中都有表达,缺失BAX基因的小鼠表现出过多的异常卵泡[34]。与正常卵泡相比,闭锁卵泡颗粒细胞中BAX的表达较强[35]。在猪颗粒细胞中,闭锁卵泡BAX的表达高于健康卵泡[24, 36]。Caspase家族在介导细胞凋亡的过程中发挥重要作用[37],Caspase3是参与多种凋亡信号转导途径的关键执行分子[38-39],活化的Caspase3会裂解相应的胞浆胞核底物,最终导致细胞凋亡[40]。这些结果表明,TGFβR1通过调控BCL2、BAX和Caspase3基因的表达,参与颗粒细胞的增殖凋亡进程。干扰TGFβR1会抑制TGFβR1、TGFβR2以及SMAD2/3的磷酸化,表明TGF-β信号通路被阻断。SMAD2/3是转化生长因子-β信号转导的核心成分,是转化生长因子-β的信号中间产物,激活的TGFβR1通过磷酸化SMAD2/3(R-Smads)蛋白激活Smad信号通路,磷酸化的R-Smads共同与SMAD4蛋白结合,将信号由胞浆转移至细胞核内,调节靶基因的转录,诱导下游目的基因的表达[11, 41]。
由于在TGF-β/Smad信号通路中,TGF-β二聚体结合TGFβR2,并导致TGFβR2自身磷酸化激活,同时将TGFβR1募集到高度保守的近膜区域,之后TGFβR2磷酸化激活TGFβR1并和其之间形成异四聚体复合物,磷酸化的TGFβR1将依次招募SMAD2和SMAD3与其结合将其磷酸化后转为活化状态,将信号传递到胞浆中,SMAD2/3与SMAD4形成异构体复合物,最终将信号由胞浆传递至细胞核中,在细胞核中调节下游基因的表达。SMAD4在该通路中发挥着关键作用,故进一步探究了TGF-β/Smad通路中TGFβR1下游的关键调节因子SMAD4与颗粒细胞功能的关系,研究发现,TGF-β/Smad通路的关键调节因子SMAD4与颗粒细胞的增殖凋亡有密切关系,过表达SMAD4会加快细胞进程进入至S期,促进颗粒细胞的增殖,抑制促凋亡蛋白BAX和Caspase3的表达,促进抗凋亡蛋白BCL2的表达;抑制SMAD4则发生G2/M期阻滞,抑制颗粒细胞增殖,抑制BCL2的表达,促进BAX和Caspase3的表达。SMAD4作为一种常见的TGF-β信号转导介质,被认为在调节卵泡生长和雌性生殖方面发挥了重要作用[9]。敲除卵巢特异性基因SMAD4的小鼠出现生育能力下降,生殖力随着时间的推移而下降,卵泡发生中存在多种缺陷,如严重的卵丘细胞缺陷和颗粒细胞过早黄体化[42]。已有研究发现,腔前颗粒细胞中SMAD4基因的缺失会导致后续卵泡发育和分化的严重缺陷[9]。以上发现证实, TGFβR1介导的TGF-β/Smad通路可以调控绵羊颗粒细胞功能,当SMAD4基因过表达即该信号通路信号传递增强时,可促进绵羊颗粒细胞的增殖,并抑制其凋亡。
4 结论TGFβR1促进绵羊颗粒细胞的增殖及周期进程,抑制颗粒细胞凋亡,通过介导TGF-β/Smad信号通路中SMAD2/3及SMAD4的表达正向调控绵羊颗粒细胞的增殖与周期,并负向调控其凋亡。
| [1] |
付强, 岳巧娴, 锡建中, 等. 绵羊miR-127/FOXO4反馈环路及其对卵泡颗粒细胞凋亡相关基因表达的影响[J]. 畜牧兽医学报, 2022, 53(1): 66-75. FU Q, YUE Q X, XI J Z, et al. Effect of Oar-miR-127/FOXO4 feedback loop on genes associated with apoptosis of sheep granulosa cells[J]. Acta Veterinaria et Zootechnica Sinica, 2022, 53(1): 66-75. (in Chinese) |
| [2] |
FANG X H, XIA W, LI S, et al. SIRT2 is critical for sheep oocyte maturation through regulating function of surrounding granulosa cells[J]. Int J Mol Sci, 2022, 23(9): 5013. DOI:10.3390/ijms23095013 |
| [3] |
LI M N, LIANG W W, ZHU C Y, et al. Smad4 mediates Bmf involvement in sheep granulosa cell apoptosis[J]. Gene, 2022, 817: 146231. DOI:10.1016/j.gene.2022.146231 |
| [4] |
LI Y X, MA X F, GAO T, et al. Differential expression and functional prediction of mRNA in the ovaries of Hanper sheep of high and low fecundity[J]. Reprod Domest Anim, 2022, 57(12): 1623-1635. DOI:10.1111/rda.14239 |
| [5] |
ROSAIRO D, KUYZNIEREWICZ I, FINDLAY J, et al. Transforming growth factor-β: its role in ovarian follicle development[J]. Reproduction, 2008, 136(6): 799-809. DOI:10.1530/REP-08-0310 |
| [6] |
LIU J Y, DU X, ZHOU J L, et al. MicroRNA-26b functions as a proapoptotic factor in porcine follicular granulosa cells by targeting Sma-and Mad-related protein 4[J]. Biol Reprod, 2014, 91(6): 146. |
| [7] |
DU X, ZHANG L F, LI X Y, et al. TGF-β signaling controls FSHR signaling-reduced ovarian granulosa cell apoptosis through the SMAD4/miR-143 axis[J]. Cell Death Dis, 2016, 7(11): e2476. DOI:10.1038/cddis.2016.379 |
| [8] |
ZHOU J L, LIU J Y, PAN Z X, et al. The let-7g microRNA promotes follicular granulosa cell apoptosis by targeting transforming growth factor-β type 1 receptor[J]. Mol Cell Endocrinol, 2015, 409: 103-112. DOI:10.1016/j.mce.2015.03.012 |
| [9] |
YAO G D, YIN M M, LIAN J, et al. MicroRNA-224 is involved in transforming growth factor-β-mediated mouse granulosa cell proliferation and granulosa cell function by targeting Smad4[J]. Mol Endocrinol, 2010, 24(3): 540-551. DOI:10.1210/me.2009-0432 |
| [10] |
YAO W, PAN Z X, DU X, et al. miR-181b-induced SMAD7 downregulation controls granulosa cell apoptosis through TGF-β signaling by interacting with the TGFBR1 promoter[J]. J Cell Physiol, 2018, 233(9): 6807-6821. DOI:10.1002/jcp.26431 |
| [11] |
ZHANG J Q, GAO B W, GUO H X, et al. miR-181a promotes porcine granulosa cell apoptosis by targeting TGFBR1 via the activin signaling pathway[J]. Mol Cell Endocrinol, 2020, 499: 110603. DOI:10.1016/j.mce.2019.110603 |
| [12] |
LI Y X, JIN Y J, LIU Y X, et al. SMAD3 regulates the diverse functions of rat granulosa cells relating to the FSHR/PKA signaling pathway[J]. Reproduction, 2013, 146(2): 169-179. DOI:10.1530/REP-12-0325 |
| [13] |
YU M M, LIU J X. MicroRNA-30d-5p promotes ovarian granulosa cell apoptosis by targeting Smad2[J]. Exp Ther Med, 2020, 19(1): 53-60. |
| [14] |
DENG M, HOU S Y, TONG B D, et al. The Smad2/3/4 complex binds miR-139 promoter to modulate TGFβ-induced proliferation and activation of human Tenon's capsule fibroblasts through the Wnt pathway[J]. J Cell Physiol, 2019, 234(8): 13342-13352. DOI:10.1002/jcp.28011 |
| [15] |
CHEN L, TOKE N H, LUO S, et al. A reinforcing HNF4-SMAD4 feed-forward module stabilizes enterocyte identity[J]. Nat Genet, 2019, 51(5): 777-785. DOI:10.1038/s41588-019-0384-0 |
| [16] |
NEWMAN A C, KEMP A J, DRABSCH Y, et al. Autophagy acts through TRAF3 and RELB to regulate gene expression via antagonism of SMAD proteins[J]. Nat Commun, 2017, 8(1): 1537. DOI:10.1038/s41467-017-00859-z |
| [17] |
DING Z H, WU C J, CHU G C, et al. SMAD4-dependent barrier constrains prostate cancer growth and metastatic progression[J]. Nature, 2011, 470(7333): 269-273. DOI:10.1038/nature09677 |
| [18] |
DU X, LI Q Q, YANG L, et al. SMAD4 activates Wnt signaling pathway to inhibit granulosa cell apoptosis[J]. Cell Death Dis, 2020, 11(5): 373. DOI:10.1038/s41419-020-2578-x |
| [19] |
LEE K P, SHIN Y J, PANDA A C, et al. MiR-431 promotes differentiation and regeneration of old skeletal muscle by targeting Smad4[J]. Genes Dev, 2015, 29(15): 1605-1617. DOI:10.1101/gad.263574.115 |
| [20] |
WANDZIOCH E, ZARET K S. Dynamic signaling network for the specification of embryonic pancreas and liver progenitors[J]. Science, 2009, 324(5935): 1707-1710. DOI:10.1126/science.1174497 |
| [21] |
LIU K, JI F, YANG G, et al. SMAD4 defect causes auditory neuropathy via specialized disruption of cochlear ribbon synapses in mice[J]. Mol Neurobiol, 2016, 53(8): 5679-5691. DOI:10.1007/s12035-015-9454-1 |
| [22] |
YAO W, DU X, ZHANG J B, et al. SMAD4-induced knockdown of the antisense long noncoding RNA BRE-AS contributes to granulosa cell apoptosis[J]. Mol Ther Nucleic Acids, 2021, 25: 251-263. DOI:10.1016/j.omtn.2021.05.006 |
| [23] |
韩红叶. CTSB基因对绵羊卵巢颗粒细胞功能的影响[D]. 保定: 河北农业大学, 2021. HAN H Y. Effect of CTSB gene on the function of ovarian granulosa cells in sheep[D]. Baoding: Hebei Agricultural University, 2021. (in Chinese) |
| [24] |
MATSUDA F, INOUE N, MANABE N, et al. Follicular growth and atresia in mammalian ovaries: regulation by survival and death of granulosa cells[J]. J Reprod Dev, 2012, 58(1): 44-50. DOI:10.1262/jrd.2011-012 |
| [25] |
DAVID C J, MASSAGUÉ J. Contextual determinants of TGFβ action in development, immunity and cancer[J]. Nat Rev Mol Cell Biol, 2018, 19(7): 419-435. |
| [26] |
赵金. BMP15通过BMPR1B调控陕北白绒山羊卵泡颗粒细胞功能的分子机制[D]. 杨凌: 西北农林科技大学, 2021. ZHAO J. The molecular mechanism of BMP15 regulates the function of follicular granulosa cells through BMPR1B in Shanbei white cashmere goat[D]. Yangling: Northwest A&F University, 2021. (in Chinese) |
| [27] |
CHANG H, BROWN C W, MATZUK M M. Genetic analysis of the mammalian transforming growth factor-β superfamily[J]. Endocr Rev, 2002, 23(6): 787-823. DOI:10.1210/er.2002-0003 |
| [28] |
LI Q L, AGNO J E, EDSON M A, et al. Transforming growth factor β receptor type 1 is essential for female reproductive tract integrity and function[J]. PLoS Genet, 2011, 7(10): e1002320. DOI:10.1371/journal.pgen.1002320 |
| [29] |
ZHAO Y, FENG H W, ZHANG Y H, et al. Current understandings of core pathways for the activation of mammalian primordial follicles[J]. Cells, 2021, 10(6): 1491. DOI:10.3390/cells10061491 |
| [30] |
王伟. BMP/Smad信号通路对猪卵泡颗粒细胞的影响[D]. 南京: 南京农业大学, 2010. WANG W. Effects of BMP/Smad signaling on porcine follicular granulosa cells[D]. Nanjing: Nanjing Agricultural University, 2010. (in Chinese) |
| [31] |
LARSSON J, GOUMANS M J, SJÖSTRAND L J, et al. Abnormal angiogenesis but intact hematopoietic potential in TGF-β type Ⅰ receptor-deficient mice[J]. EMBO J, 2001, 20(7): 1663-1673. DOI:10.1093/emboj/20.7.1663 |
| [32] |
徐梦思. TGF β-SMAD信号通路对猪颗粒细胞和繁殖性状的作用研究[D]. 石河子: 石河子大学, 2015. XU M S. The influence of TGF beta SMAD signaling pathway on the pig granulosa cells and reproductive traits[D]. Shihezi: Shihezi University, 2015. (in Chinese) |
| [33] |
UMENO K, SASAKI A, KIMURA N. The impact of oocyte death on mouse primordial follicle formation and ovarian reserve[J]. Reprod Med Biol, 2022, 21(1): e12489. DOI:10.1002/rmb2.12489 |
| [34] |
PEREZ G I, ROBLES R, KNUDSON C M, et al. Prolongation of ovarian lifespan into advanced chronological age by Bax-deficiency[J]. Nat Genet, 1999, 21(2): 200-203. DOI:10.1038/5985 |
| [35] |
LU X R, DUAN A Q, MA X Y, et al. Knockdown of CYP19A1 in buffalo follicular granulosa cells results in increased progesterone secretion and promotes cell proliferation[J]. Front Vet Sci, 2020, 7: 539496. DOI:10.3389/fvets.2020.539496 |
| [36] |
SAI T, GOTO Y, YOSHIOKA R, et al. Bid and Bax are involved in granulosa cell apoptosis during follicular atresia in porcine ovaries[J]. J Reprod Dev, 2011, 57(3): 421-427. DOI:10.1262/jrd.11-007H |
| [37] |
VAN OPDENBOSCH N, LAMKANFI M. Caspases in cell death, inflammation, and disease[J]. Immunity, 2019, 50(6): 1352-1364. DOI:10.1016/j.immuni.2019.05.020 |
| [38] |
庞雪利, 李矿发, 魏兰, 等. IL-8通过上调Bcl-2的表达和下调caspase-3的表达抑制MCF-7乳腺癌细胞凋亡[J]. 细胞与分子免疫学杂志, 2015, 31(3): 307-311. PANG X L, LI K F, WEI L, et al. IL-8 inhibits the apoptosis of MCF-7 human breast cancer cells by up-regulating Bcl-2 and down-regulating caspase-3[J]. Chinese Journal of Cellular and Molecular Immunology, 2015, 31(3): 307-311. (in Chinese) |
| [39] |
ZHANG Y M, JIANG Q, WANG N, et al. Effects of taspine on proliferation and apoptosis by regulating caspase-3 expression and the ratio of Bax/Bcl-2 in A431 cells[J]. Phytother Res, 2011, 25(3): 357-364. DOI:10.1002/ptr.3268 |
| [40] |
ZHOU J, JIN X J, SHENG Z M, et al. miR-206 serves an important role in polycystic ovary syndrome through modulating ovarian granulosa cell proliferation and apoptosis[J]. Exp Ther Med, 2021, 21(3): 179. DOI:10.3892/etm.2021.9610 |
| [41] |
YANG L, ROH Y S, SONG J Y, et al. Transforming growth factor beta signaling in hepatocytes participates in steatohepatitis through regulation of cell death and lipid metabolism in mice[J]. Hepatology, 2014, 59(2): 483-495. DOI:10.1002/hep.26698 |
| [42] |
PANGAS S A, LI X H, ROBERTSON E J, et al. Premature luteinization and cumulus cell defects in ovarian-specific Smad4 knockout mice[J]. Mol Endocrinol, 2006, 20(6): 1406-1422. DOI:10.1210/me.2005-0462 |
(编辑 郭云雁)



