子宫是雌性动物重要的生殖器官,在生殖周期中产生一系列生理变化,为受精卵成功附植和后续胚胎发育提供有利条件。在绵羊中,胚胎在第4天桑椹胚时期开始进入子宫,第6天发育到囊胚,第8天从透明带孵化,球形的囊胚继续生长发育成丝状胚胎,到第14天丝状胚胎的长度可达12~14 cm并获得了植入子宫内膜的能力[1-2]。P4和E2通过调节子宫内膜组织表型为来自输卵管的胚胎准备最佳着床环境,卵巢分泌的P4从妊娠第10天开始诱导胚胎伸长和着床相关的基因表达,IFNT是反刍动物的妊娠识别信号,在妊娠第12~14天的胚胎中显著增加,大量证据表明IFNT具有直接的内分泌作用,胎儿分泌的IFNT作用于子宫内膜,抑制黄体溶解,维持妊娠[3-6]。在反刍动物发情周期黄体期结束时,催产素、P4和E2调节子宫分泌PGF2α,来自垂体和黄体的催产素通过子宫内膜腔上皮中的催产素受体刺激PGF2α的脉冲释放,PGF2α到达黄体并在结构和功能上退化黄体最终导致黄体溶解[7-8]。因此,要维持妊娠,必须保持黄体并延长其寿命,从而延长P4的产生,P4作用于子宫,刺激和维持子宫的功能[9]。在绵羊妊娠第17天的子宫内膜上皮细胞中检测到细胞凋亡水平升高,上皮细胞的凋亡有利于胚胎成功植入[10]。反刍动物的胚胎附植过程与其他哺乳动物相比研究的不够深入,且反刍动物大部分的妊娠丢失都发生在早期妊娠过程中,因此,研究反刍动物妊娠早期子宫内膜和囊胚的变化对改善反刍动物妊娠率有积极作用。
SRIF是一种广泛分布于全身的肽,主要有SRIF-14和SRIF-28两种存在形式,已被证明在体内通过与生长抑素受体家族(SST1-5)结合发挥广泛的作用,包括调节激素分泌、抑制细胞增殖和生长因子的释放,但SRIF在体内的半衰期较短,1~3 min就会被血浆和组织中普遍分布的肽酶迅速降解[11-13]。SRIF由整个中枢神经系统产生,在绵羊下丘脑中部分雌激素受体α表达阳性的细胞同时表达SRIF,且下丘脑中的SRIF能够被E2激活,随后SRIF抑制黄体的间歇性分泌[14-16]。在大鼠下丘脑中,SRIF能够抑制促性腺激素释放激素的分泌和细胞中突触的电信号传递[17]。上述研究表明,SRIF可能通过参与下丘脑中E2的正反馈作用调节哺乳动物的繁殖能力,然而具体的调控方式和作用机制还有待深入研究。早期的研究证实,SRIF可能参与调节人子宫内膜细胞的功能,在人正常子宫内膜、子宫内膜异位症和子宫内膜癌中都发现了SRIF及其受体的表达,且SRIF及其个别受体的异常表达可能诱导了子宫内膜发生病变[18-19]。异位的子宫内膜细胞中SRIF的mRNA水平显著高于正常子宫内膜细胞,SRIF及其类似物能够抑制永生化人子宫内膜基质细胞和原代子宫内膜基质细胞的增殖[20]。但仅在单一物种和单一的细胞系中验证并不足以说明问题,仍需要更多的研究阐明SRIF在子宫内膜中的作用。
大多数绵羊品种都是季节性发情的单胎动物,为了不断提高绵羊的繁殖效率,推进绵羊养殖规模化发展,深入了解绵羊繁殖过程中的生理状态是十分必要的。SRIF在绵羊子宫内膜中的相关研究尚未见报道。因此,本试验以绵羊子宫内膜上皮细胞为研究对象,使用E2、P4和IFNT处理细胞构建容受态子宫内膜上皮细胞模型,探究SRIF-14在绵羊子宫内膜上皮细胞的表达情况,明确SRIF-14对绵羊子宫内膜上皮细胞增殖和凋亡的影响,为进一步研究绵羊子宫内膜上皮细胞的功能提供科学依据。
1 材料与方法 1.1 试验材料绵羊子宫组织来自石河子市牛羊定点屠宰场,子宫组织置于4 ℃生理盐水中4 h内运回实验室。部分组织保存在液氮中用于提取组织RNA和蛋白;部分组织固定在4%多聚甲醛中,用于免疫组化分析。
1.2 主要试剂DMEM/DF12、胎牛血清(FBS)、0.25%胰蛋白酶均购自Gibco公司;100×青-链霉素购自Biosharp公司;20×PBS购自索莱宝公司;SABC免疫组化染色试剂盒购自博士德公司;酶联免疫分析试剂盒购自江莱生物公司;Anti-Cytokeratin 18鼠单克隆抗体购自Abcam公司;Anti-SST兔多克隆抗体购自索莱宝公司;Anti-Csapase 9兔多克隆抗体和Anti-Bcl-2兔多克隆抗体购自Proteintech公司;Anti-Bax兔多克隆抗体、Anti-Cytochrome C鼠单克隆抗体和β-actin鼠单克隆抗体购自碧云天公司;Anti-mouse IgG(H+L)(680)和Anti-rabbit IgG(H+L)(800)荧光二抗购自CST公司;DAB显色试剂盒购自中杉金桥公司;TRIzol购自Invitrogen公司;反转录试剂盒和荧光定量试剂盒购自康为试剂公司;RIPA裂解液和磷酸酶抑制剂混合物C购自碧云天公司;PMSF和SDS-PAGE凝胶制备试剂盒购自索莱宝公司;P4和E2购自Sigma公司; IFNT购自上海生工公司;SRIF-14购自GlpBio公司。
1.3 试验方法1.3.1 绵羊子宫内膜上皮细胞分离培养 使用本课题组先前建立的绵羊子宫内膜上皮细胞分离、纯化和鉴定的方法培养绵羊子宫内膜上皮细胞[21]。使用眼科剪将子宫内膜组织从子宫内分离,置于EP管中剪碎,接种至6孔板中加入1 mL完全培养基,置于37 ℃、5% CO2的细胞培养箱中培养,每48 h更换新鲜的DMEM/F12完全培养基,待细胞汇合至90%左右消化传代,纯化得到原代细胞,待纯化后的上皮细胞长满至80%~90%后消化,接种于新的细胞培养板中, 根据细胞状态进行下一步试验,本试验中所用的原代细胞均为培养至第三代的细胞。
1.3.2 免疫组织化学染色 组织样品用4%多聚甲醛固定,石蜡包埋,5 μm切片。根据免疫组化染色试剂盒对组织切片和细胞染色,4 ℃一抗过夜孵育,PBS洗涤3次,加入DAB显色,镜下观察5~10 min,PBS洗涤中止显色,苏木素复染,显微镜下观察拍照。
1.3.3 细胞处理和药物浓度筛选 当细胞汇合至80%~90%时,将培养基更换为新鲜的DMEM/DF12,加入20 ng ·mL-1的IFNT或加入0.1 μmol ·L-1的P4和1 nmol ·L-1的E2培养12 h, 加入20 ng ·mL-1的IFNT[22]培养12 h, 收取上清-80 ℃保存。SRIF-14浓度梯度设置为1、10、20、40、80、160 μmol ·L-1处理24 h,用CCK-8细胞增殖-毒性检测试剂盒确定药物最佳使用浓度。
1.3.4 总RNA提取与实时荧光PCR 根据上述细胞处理方法处理细胞后,使用TRIzol法提取细胞总RNA,全波长微孔板分光光度计测定RNA浓度。使用Primer 5.0设计RT-qPCR引物,根据cDNA合成试剂盒说明书将总RNA转录为cDNA,使用SYBR Green的说明制备RT-qPCR反应混合物,按照说明书设置反应程序,数据结果使用2-ΔΔCt方法分析。引物由上海生工集团合成,每个试验进行3次重复。RT-qPCR的引物如表 1所示。
|
|
表 1 引物序列表 Table 1 Primer sequences used in the study |
1.3.5 细胞增殖试验 使用CCK-8试剂检测细胞增殖情况,绵羊子宫内膜上皮细胞接种于96孔板中(细胞数约为每孔2×103个细胞),按照“1.3.3”所述方法加入SRIF-14,细胞培养过程中观察细胞状态及密度,之后取出培养板,每24 h去除上清液,PBS冲洗后,每孔加入含10% CCK8的DMEM/DF12培养液,培养箱孵育3 h,用酶标仪在450 nm处测定吸光度值。
1.3.6 ELISA检测 将EEC接种至24孔板,按照上述的方法处理细胞,分别用PGF2α和PGE2 ELISA试剂盒测定收集的培养基上清液中PGF2α和PGE2的浓度,按照试剂说明书所述方法进行数据处理。
1.3.7 蛋白质提取和蛋白印迹分析 细胞处理后,用PBS洗涤3次,配制RIPA裂解液加入PMSF和磷酸酶抑制剂,置于冰上与细胞充分混合。蛋白质浓度通过BCA试剂盒测定,按照4×Loading Buffer说明书加入Loading Buffer,100 ℃煮沸5 min,使用SDS-PAGE凝胶电泳分离蛋白质,半干法转移至PVDF膜上,PBS洗涤5次,每次5 min,用5%脱脂牛奶封闭1 h,PBS洗涤5次,每次5 min,一抗4 ℃过夜孵育,PBS洗涤5次,每次5 min,二抗室温摇床孵育1 h,PBS洗涤5次,每次5 min,双色红外激光成像系统成像。
1.3.8 数据统计与分析 所有数据均使用GraphPad Prism 8或SPSS17.0进行分析。使用t检验或单因素方差分析(one-way ANOVA)的Bonferroni's post-hoc test进行多重比较。所有数据均以“平均值±标准误”表示,P<0.05表示差异显著,P<0.01表示差异极显著。
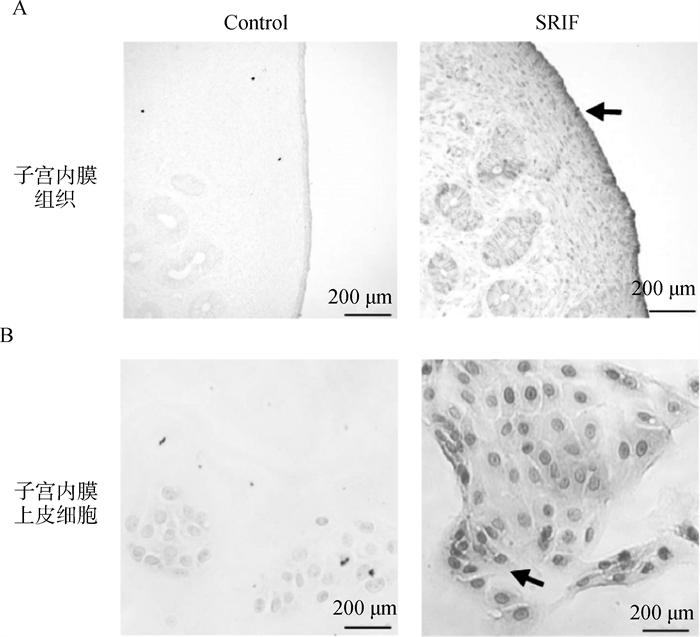
2 结果 2.1 SRIF在绵羊子宫内膜组织和上皮细胞的表达与定位用绵羊子宫内膜组织做石蜡切片,鉴定SRIF在绵羊子宫内膜中的表达情况,结果显示SRIF在绵羊子宫内膜组织中广泛表达(图 1A)。使用分离纯化后的绵羊子宫内膜上皮细胞做细胞免疫化学染色,结果进一步证实SRIF在绵羊子宫内膜上皮细胞中表达(图 1B),为后续试验奠定基础。
|
A.SRIF在绵羊子宫内膜组织中的表达定位(200×);B.SRIF在绵羊子宫内膜上皮细胞中的表达定位(200×)(黑色箭头为SRIF染色) A. Localization of SRIF expression in sheep endometrial tissue (200×); B. Localization of SRIF expression in sheep endometrial epithelial cells (200×) (The black arrows indicate the SRIF staining) 图 1 SRIF在绵羊子宫内膜组织和上皮细胞中的表达与定位 Fig. 1 Expression and localization of SRIF in sheep endometrial tissue and epithelial cells |
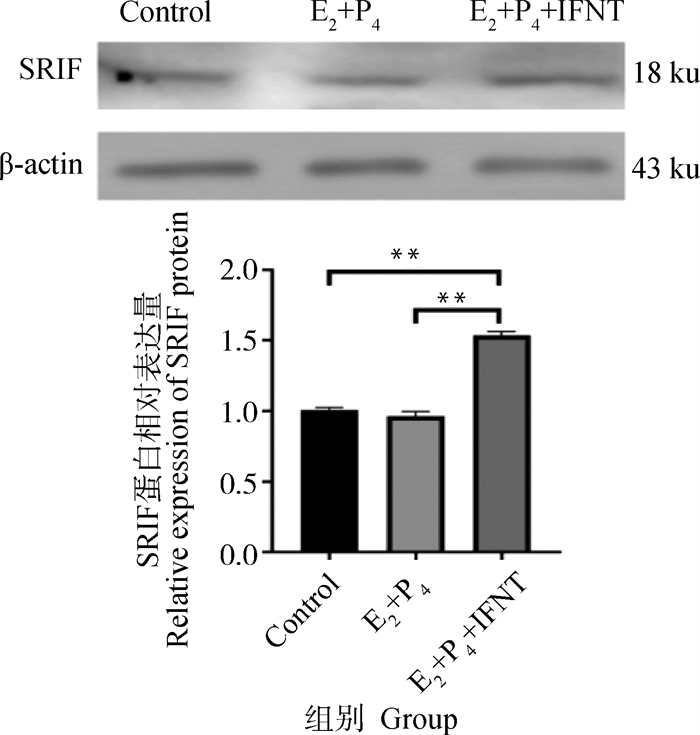
使用E2、P4和IFNT处理绵羊子宫内膜上皮细胞,模拟绵羊早期胚胎植入时子宫内膜的激素水平,检测促胚胎伸长相关基因ISG15、CXCL10、HOXA10和RSAD2的mRNA表达水平(图 2A-D)和PGE2、PGF2α的分泌情况(图 2E、F),发现IFNT单独处理和激素联合处理后,绵羊子宫内膜上皮细胞中胚胎伸长相关基因和PGE2表达水平显著升高,PGF2α分泌水平显著降低,表明细胞经激素处理后,成功构建了容受态绵羊子宫内膜上皮细胞。激素处理后进一步检测细胞中SRIF的蛋白表达水平变化,结果显示激素处理能够诱导SRIF蛋白表达水平提高(图 3)。

|
A-D.激素处理后ISG15、CXCL10、RSAD2和HOXA10的mRNA表达水平;E、F.激素处理后PGE2和PGF2α的分泌水平(*. P < 0.05,**. P < 0.01,下同) A-D. The mRNA expression level of ISG15, CXCL10, RSAD2 and HOXA10 after hormone treatment; E, F. The secretion level of PGE2 and PGF2α after hormone treatment (*. P < 0.05, **. P < 0.01, the same as below) 图 2 E2、P4和IFNT处理绵羊子宫内膜上皮细胞对促孕体伸长因子和PGs的影响 Fig. 2 Effect of E2, P4 and IFNT treatment of sheep endometrial epithelial cells on progesterone elongation factors and PGs |
|
图 3 激素处理促进SRIF蛋白表达 Fig. 3 Hormone treatment promotes SRIF protein expression |
2.3.1 CCK-8法筛选SRIF-14的最佳浓度 设置对照组和处理组,处理组SRIF-14的浓度梯度为1、10、20、40、80、160 μmol ·L-1,细胞处理24 h后,用CCK-8细胞增殖-毒性检测试剂盒测定450 nm处的吸光值(图 4),结果显示当SRIF-14浓度为10 μmol ·L-1及以上时,细胞毒性增强,增殖能力显著下降,因此最终确定SRIF-14在绵羊子宫内膜上皮细胞中的使用浓度为1 μmol ·L-1。

|
图 4 SRIF-14的最佳使用浓度筛选 Fig. 4 Screening of optimal concentration of SRIF-14 |
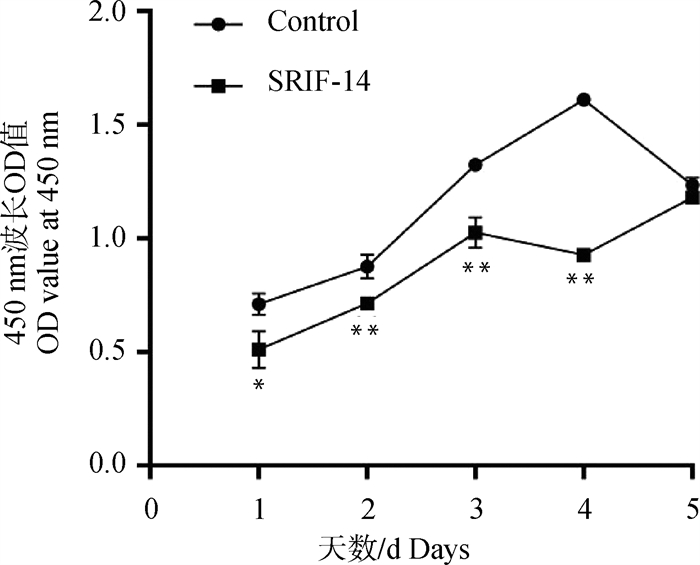
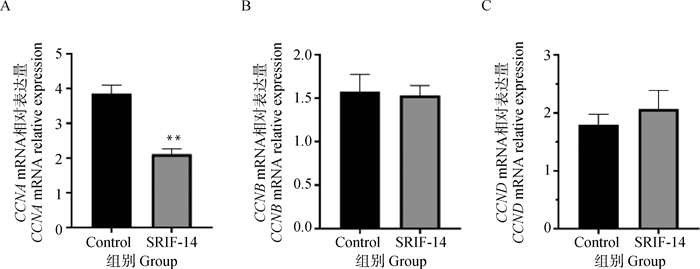
2.3.2 SRIF-14对绵羊子宫内膜上皮细胞增殖能力的影响 使用1 μmol ·L-1的SRIF-14连续处理绵羊子宫内膜上皮细胞5 d,每隔24 h加入CCK-8孵育3 h,检测450 nm波长处的吸光值,结果表明从第1到第4天SRIF-14处理组的增殖能力都显著下降,对照组由于孔内细胞长满在第5天出现增殖水平下降(图 5)。SRIF-14处理24 h后细胞周期蛋白家族中的CCNA的mRNA表达水平显著下降,而CCNB和CCND表达未受显著影响(图 6A-C)。上述结果表明,SRIF-14可能通过抑制CCNA的表达阻止细胞分裂增殖,使细胞周期停留在S期从而抑制细胞增殖。
|
图 5 SRIF-14影响绵羊子宫内膜上皮细胞增殖能力 Fig. 5 SRIF-14 affects the proliferative capacity of sheep endometrial epithelial cells |
|
A.SRIF-14处理后CCNA的mRNA表达水平;B.SRIF-14处理后CCNB的mRNA表达水平;C.SRIF-14处理后CCND的mRNA表达水平 A. The mRNA expression level of CCNA after SRIF-14 treatment; B. The mRNA expression level of CCNB after SRIF-14 treatment; C. The mRNA expression level of CCND after SRIF-14 treatment 图 6 SRIF-14影响绵羊子宫内膜上皮细胞的细胞周期 Fig. 6 SRIF-14 affects the cell cycle of sheep endometrial epithelial cells |
SRIF-14处理细胞24 h后的蛋白结果显示,Cleaved-caspase 9、Bax和Cyt-c表达水平显著升高,而Bcl-2表达水平显著下降(图 7A、B),说明SRIF-14能够诱导绵羊子宫内膜上皮细胞发生凋亡。
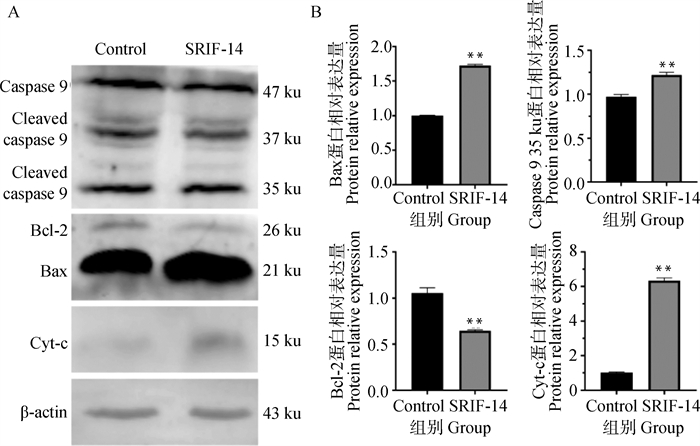
|
A. SRIF-14处理后Csapase 9、Bcl-2、Bax和Cyt-c的蛋白表达变化;B. Csapase 9、Bcl-2、Bax和Cyt-c蛋白表达的定量分析 A. Changes in proteins expression of Csapase 9, Bcl-2, Bax and Cyt-c after SRIF-14 treatment; B. Quantitative analysis of proteins expression of Csapase 9, Bcl-2, Bax and Cyt-c 图 7 SRIF-14促进绵羊子宫内膜上皮细胞发生凋亡 Fig. 7 SRIF-14 promotes apoptosis of sheep endometrial epithelial cells |
收集SRIF-14处理后的绵羊子宫内膜上皮细胞的培养基上清液,使用ELISA试剂盒检测到PGE2的分泌水平与对照组相比显著升高,而PGF2α的分泌水平显著降低(图 8A、B)。说明SRIF-14可能通过抑制PGF2α抑制黄体溶解脉冲的释放,从而达到维持妊娠的目的。
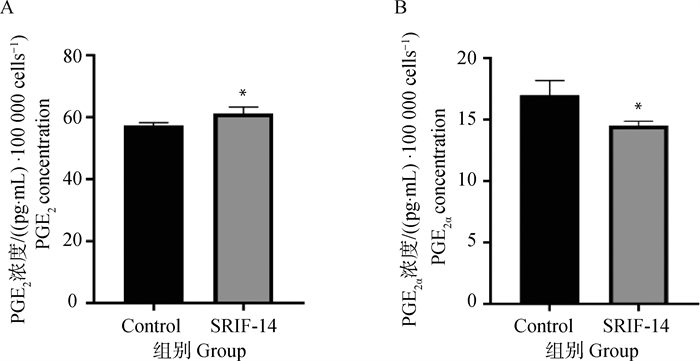
|
A.SRIF-14处理后PGE2的分泌水平;B. SRIF-14处理后PGF2α的分泌水平 A. The secretion level of PGE2 after SRIF-14 treatment; B. The secretion level of PGF2α after SRIF-14 treatment 图 8 SRIF-14影响绵羊子宫内膜上皮细胞PGs的分泌 Fig. 8 SRIF-14 affects the secretion of PGs of sheep endometrial epithelial cells |
SRIF主要是在全身神经系统和外周组织中产生的肽类物质,已被证明是一种广泛的抑制剂,包括抑制细胞增殖活性和多种激素的分泌[23-25]。由于SRIF在体内半衰期短,作用时间不持久且选择性不强,不适宜研究和应用,因此人工合成了多种SRIF类似物,近年来,SRIF及其类似物在多种细胞内的作用机制逐渐被揭示。本研究发现,SRIF在绵羊子宫内膜中广泛表达,外源性添加SRIF-14在绵羊子宫内膜上皮细胞中诱导细胞发生凋亡,这与SRIF及其类似物在其他细胞中的研究结果趋势相一致。在人肝脏星状细胞中的研究结果表明,SRIF类似物奥曲肽呈现出时间和浓度依赖性抑制细胞的增殖,促进细胞凋亡[26]。然而,目前对SRIF在子宫内膜功能中的研究仍然不足,本研究探讨了绵羊早期胚胎植入过程中SRIF-14在子宫内膜上皮细胞的作用,发现SRIF-14促进细胞中PGE2的分泌表达,并诱导细胞发生凋亡,为深入研究SRIF在雌性哺乳动物生殖系统中的作用奠定了基础。
受类固醇激素的影响,母体子宫内膜在一段有限的时间内允许胚胎附着,称为植入窗口期。P4通过抑制E2对子宫内膜上皮细胞的增殖作用,诱导子宫内膜中利于胚胎附植的基因高度表达,在建立子宫内膜容受性方面发挥关键作用[27-29]。本研究中使用P4、E2和IFNT处理绵羊子宫内膜上皮细胞后发现, IFNT单独刺激和P4、E2和IFNT联合刺激后胚胎附植相关基因mRNA表达均升高,这与反刍动物胚胎附植期间子宫内膜组织中的表达变化趋势相一致,表明激素处理能够在一定程度上模拟子宫内膜上皮细胞的植入窗口期[30-33]。IFNT通过阻断子宫内膜上皮中雌激素和催产素受体的上调,从而阻止黄体溶解性PGF2α的产生,同时诱导黄体对PGF2α产生耐药性,进一步确保黄体不会溶解,P4继续分泌以维持妊娠[34-36]。在发情周期第10天的母羊子宫内注射IFNT细胞信号阻断剂U0126,会诱导黄体溶解产生PGF2α脉冲[37]。本研究中, IFNT处理绵羊子宫内膜上皮细胞后PGF2α水平下降、PGE2升高,且促孕体伸长相关基因的mRNA表达水平均显著上升,提示细胞水平上的验证能够部分体现动物水平上发生的变化。
绵羊胚胎着床过程本质上是胚胎滋养细胞的增殖、迁移和侵袭,最终在子宫内膜上皮着床成功[38]。大多数哺乳动物胚胎着床过程中子宫内膜上皮细胞的适时增殖和凋亡与胚胎植入密切相关,已有的研究表明,当绵羊丝状胚胎开始发生附植时,子宫内膜上皮细胞中检测到Caspase 3阳性细胞数量增加,胚胎滋养细胞吞噬Caspase 3阳性上皮细胞最终植入子宫内膜,绵羊子宫内膜上皮细胞从妊娠第17天到第20天开始逐渐发生凋亡,Caspase 3阳性细胞数量也在增加[10, 39]。对大多数哺乳动物的研究表明,胚胎着床的过程触发了子宫内膜上皮细胞的凋亡,影响胚胎着床过程中上皮细胞凋亡的因素有很多,本研究结果表明,使用SRIF-14处理绵羊子宫内膜上皮细胞,能够抑制细胞增殖,使细胞分裂周期停滞在S期;同时诱导细胞发生凋亡,增加细胞中Cleaved-caspase 9、Bax和Cyt-c的蛋白表达。其次,在SRIF-14处理后的细胞培养基上清液中PGE2分泌水平的上升也能够证实其在绵羊子宫内膜上皮细胞中发挥重要作用。PGE2对反刍动物具有黄体保护的作用,并且通过调节细胞有丝分裂和血管生成等过程参与子宫内膜蜕膜化和胚胎植入的过程[40]。大量的研究证实,生殖相关的激素诱导子宫内膜产生的PGE2作为一种黄体保护机制,能够延长反刍动物黄体的寿命从而维持妊娠。
4 结论本研究通过激素处理构建了容受态绵羊子宫内膜上皮细胞,确定了SRIF在子宫内膜上皮细胞中的表达特征,明确SRIF-14对绵羊子宫内膜上皮细胞有抑制增殖和促进凋亡的作用,结合其对PGs分泌功能的影响,推测SRIF-14可能在绵羊胚胎附植过程中发挥关键作用。本研究的结果初步阐明了SRIF-14在绵羊子宫内膜上皮细胞中的生理功能,为该基因调控绵羊胚胎附植的相关分子机制研究奠定了基础。
| [1] |
OJOSNEGROS S, SERIOLA A, GODEAU A L, et al. Embryo implantation in the laboratory: an update on current techniques[J]. Hum Reprod Update, 2021, 27(3): 501-530. DOI:10.1093/humupd/dmaa054 |
| [2] |
骆金红, 陈祥, 尚以顺, 等. 转录组测序筛选山羊妊娠早期胚胎附植相关基因[J]. 畜牧兽医学报, 2022, 53(5): 1465-1474. LUO J H, CHEN X, SHANG Y S, et al. Transcriptome sequencing screening the genes related to goat embryo attachment in early pregnancy[J]. Acta Veterinaria et Zootechnica Sinica, 2022, 53(5): 1465-1474. (in Chinese) |
| [3] |
BROOKS K, BURNS G, SPENCER T E. Biological roles of hydroxysteroid (11-Beta) dehydrogenase 1 (HSD11B1), HSD11B2, and glucocorticoid receptor (NR3C1) in sheep conceptus elongation[J]. Biol Reprod, 2015, 93(2): 38. |
| [4] |
SPENCER T E, JOHNSON G A, BURGHARDT R C, et al. Progesterone and placental hormone actions on the uterus: insights from domestic animals[J]. Biol Reprod, 2004, 71(1): 2-10. DOI:10.1095/biolreprod.103.024133 |
| [5] |
YANG D Q, JIANG T T, LIU J G, et al. Interferon-τ regulates prostaglandin release in goat endometrial stromal cells via JAB1-unfolded protein response pathway[J]. Theriogenology, 2018, 113: 237-246. DOI:10.1016/j.theriogenology.2018.03.007 |
| [6] |
LI R, WANG X Q, HUANG Z Y, et al. The role of epithelial progesterone receptor isoforms in embryo implantation[J]. iScience, 2021, 24(12): 103487. DOI:10.1016/j.isci.2021.103487 |
| [7] |
SILVIA W J, LEWIS G S, MCCRACKEN J A, et al. Hormonal regulation of uterine secretion of prostaglandin F2α during luteolysis in ruminants[J]. Biol Reprod, 1991, 45(5): 655-663. DOI:10.1095/biolreprod45.5.655 |
| [8] |
WATHES D C, LAMMING G E. The oxytocin receptor, luteolysis and the maintenance of pregnancy[J]. J Reprod Fertil Suppl, 1995, 49: 53-67. |
| [9] |
MOOR R M, ROWSON L E A, HAY M F, et al. The corpus luteum of the sheep: effect of the conceptus on luteal function at several stages during pregnancy[J]. J Endocrinol, 1969, 43(2): 301-307. DOI:10.1677/joe.0.0430301 |
| [10] |
SEO H, BAZER F W, BURGHARDT R C, et al. Immunohistochemical examination of trophoblast syncytialization during early placentation in sheep[J]. Int J Mol Sci, 2019, 20(18): 4530. DOI:10.3390/ijms20184530 |
| [11] |
SCHONBRUNN A, KITAINDA V. Receptors|Somatostatin Receptors-ScienceDirect[J]. Ref Module Life Sci, 2021, 6: 273-279. |
| [12] |
WARREN T G, SHIELDS D. Expression of preprosomatostatin in heterologous cells: biosynthesis, posttranslational processing, and secretion of mature somatostatin[J]. Cell, 1984, 39(3): 547-555. DOI:10.1016/0092-8674(84)90461-6 |
| [13] |
PRADAYROL L, JÖRNVALL H, MUTT V, et al. N-terminally extended somatostatin: The primary structure of somatostatin-28[J]. FEBS Lett, 1980, 109(1): 55-58. DOI:10.1016/0014-5793(80)81310-X |
| [14] |
MCCOSH R B, SZELIGO B M, BEDENBAUGH M N, et al. Evidence that endogenous somatostatin inhibits episodic, but not surge, secretion of LH in female sheep[J]. Endocrinology, 2017, 158(6): 1827-1837. DOI:10.1210/en.2017-00075 |
| [15] |
FERGANI C, ROUTLY J E, JONES D N, et al. Activation of cells containing estrogen receptor alpha or somatostatin in the medial preoptic area, arcuate nucleus, and ventromedial nucleus of intact ewes during the follicular phase, and alteration after lipopolysaccharide[J]. Biol Reprod, 2014, 91(6): 141. |
| [16] |
吴家轩. 早期妊娠对绵羊胸腺和淋巴结表达生殖激素受体的影响[D]. 天津: 河北工程大学, 2022. WU J X. Effects of early pregnancy on the expression of reproductive hormone receptors in ovine lymph nodes and the thymus[D]. Tianjin: Hebei University of Engineering, 2022. (in Chinese) |
| [17] |
KOYAMA M, YIN C Z, ISHⅡ H, et al. Somatostatin inhibition of GnRH neuronal activity and the morphological relationship between GnRH and somatostatin neurons in rats[J]. Endocrinology, 2012, 153(2): 806-814. DOI:10.1210/en.2011-1374 |
| [18] |
ZHAO Y H, PENG L, LI X, et al. Expression of somatostatin and its receptor 1-5 in endometriotic tissues and cells[J]. Exp Ther Med, 2018, 16(5): 3777-3784. |
| [19] |
赵倩. SST在子宫内膜癌细胞系中的表达及作用的初步探究[D]. 唐山: 华北理工大学, 2017. ZHAO Q. Exploring expression and function of SST in endometrial cancer cell line[D]. Tangshan: North China University of Science and Technology, 2017. (in Chinese) |
| [20] |
ANNUNZIATA M, LUQUE R M, DURÁN-PRADO M, et al. Somatostatin and somatostatin analogues reduce PDGF-induced endometrial cell proliferation and motility[J]. Hum Reprod, 2012, 27(7): 2117-2129. DOI:10.1093/humrep/des144 |
| [21] |
凌芳, 郝科兴, 陈慧慧, 等. 绵羊子宫内膜上皮细胞和基质细胞的分离与鉴定[J]. 畜牧与兽医, 2021, 53(7): 64-68. LING F, HAO K X, CHEN H H, et al. Isolation and identification of endometrial epithelial cells and stromal cells in sheep[J]. Animal Husbandry & Veterinary Medicine, 2021, 53(7): 64-68. (in Chinese) |
| [22] |
杨迪琦. 内质网应激在激素调控山羊子宫内膜上皮细胞功能中的作用及其机制研究[D]. 杨凌: 西北农林科技大学, 2019. YANG D Q. The role of endoplasmic reticulum stress in goat endometrial epithelial cells function under hormone treatment[D]. Yangling: Northwest A&F University, 2019. (in Chinese) |
| [23] |
GVNTHER T, TULIPANO G, DOURNAUD P, et al. International Union of Basic and Clinical Pharmacology.CV.Somatostatin receptors: structure, function, ligands, and new nomenclature[J]. Pharmacol Rev, 2018, 70(4): 763-835. DOI:10.1124/pr.117.015388 |
| [24] |
SHAMSI B H, CHATOO M, XU X K, et al. Versatile functions of somatostatin and somatostatin receptors in the gastrointestinal system[J]. Front Endocrinol (Lausanne), 2021, 12: 652363. DOI:10.3389/fendo.2021.652363 |
| [25] |
KOERKER D J, RUCH W, CHIDECKEL E, et al. Somatostatin: hypothalamic inhibitor of the endocrine pancreas[J]. Science, 1974, 184(4135): 482-484. DOI:10.1126/science.184.4135.482 |
| [26] |
蒋亚玲. 奥曲肽对人肝星状细胞增殖、凋亡及STAT3、p-STAT3、SOCS3表达的影响[D]. 泸州: 四川医科大学, 2015. JIANG Y L. Effects of octreotide on the proliferation, apoptosis and expressions of STAT3, p-STAT3 and SOCS3 in human hepatic stellate cells[D]. Luzhou: Sichuan Medical University, 2015. (in Chinese) |
| [27] |
HALASZ M, SZEKERES-BARTHO J. The role of progesterone in implantation and trophoblast invasion[J]. J Reprod Immunol, 2013, 97(1): 43-50. DOI:10.1016/j.jri.2012.10.011 |
| [28] |
杨丽春. circRNA211/miR-431/CSF1网络对奶山羊子宫内膜容受性建立的影响[D]. 杨凌: 西北农林科技大学, 2021. YANG L C. Effects of Circrna211/miR-431/CSF1 network on the establishment of endometrial receptivity in dairy goats[D]. Yangling: Northwest A&F University, 2021. (in Chinese) |
| [29] |
KACZYNSKI P, BAUERSACHS S, BARYLA M, et al. Estradiol-17β-induced changes in the porcine endometrial transcriptome in vivo[J]. Int J Mol Sci, 2020, 21(3): 890. DOI:10.3390/ijms21030890 |
| [30] |
CHENG L, XIANG M, HU X Z, et al. Duplex quantitative polymerase chain reaction of ISG15 and RSAD2 increases accuracy of early pregnancy diagnosis in dairy cows[J]. Ann Anim Sci, 2019, 19(2): 383-401. DOI:10.2478/aoas-2019-0001 |
| [31] |
WANG Y J, HAN X, ZHANG L Y, et al. Early pregnancy induces expression of STAT1, OAS1 and CXCL10 in ovine spleen[J]. Animals (Basel), 2019, 9(11): 882. |
| [32] |
SAKUMOTO R, IGA K, HAYASHI K G, et al. Gene expression of CCL8 and CXCL10 in peripheral blood leukocytes during early pregnancy in cows[J]. J Anim Sci Biotechnol, 2018, 9(1): 46. DOI:10.1186/s40104-018-0263-z |
| [33] |
ZHAO S, WU Y, GAO H, et al. Roles of interferon-stimulated gene 15 protein in bovine embryo development[J]. Reprod Fertil Dev, 2017, 29(6): 1209-1216. DOI:10.1071/RD15209 |
| [34] |
BAZER F W, YING W, WANG X Q, et al. The many faces of interferon tau[J]. Amino Acids, 2015, 47(3): 449-460. DOI:10.1007/s00726-014-1905-x |
| [35] |
BAZER F W, THATCHER W W. Chronicling the discovery of interferon tau[J]. Reproduction, 2017, 154(5): F11-F20. DOI:10.1530/REP-17-0257 |
| [36] |
AROSH J A, BANU S K, MCCRACKEN J A. Novel concepts on the role of prostaglandins on luteal maintenance and maternal recognition and establishment of pregnancy in ruminants[J]. J Dairy Sci, 2016, 99(7): 5926-5940. DOI:10.3168/jds.2015-10335 |
| [37] |
LEE J H, STANLEY J A, MCCRACKEN J A, et al. Intrauterine coadministration of ERK1/2 inhibitor U0126 inhibits interferon TAU action in the endometrium and restores luteolytic PGF2alpha pulses in sheep[J]. Biol Reprod, 2014, 91(2): 46. |
| [38] |
ZHANG S, LIN H Y, KONG S B, et al. Physiological and molecular determinants of embryo implantation[J]. Mol Aspects Med, 2013, 34(5): 939-980. |
| [39] |
车思成. miR-184通过STC2-IGF1调控奶山羊子宫内膜上皮细胞凋亡的研究[D]. 杨凌: 西北农林科技大学, 2020. CHE S C. miR-184 regulates apoptosis of endometrial epithelial cells in dairy goats via STC2-IGF1[D]. Yangling: Northwest A&F University, 2020. (in Chinese) |
| [40] |
AROSH J A, LEE J H, STEPHEN S D, et al. Intrauterine infusion of interferon tau selectively directs intraluteal prostaglandin biosynthesis towards PGE2 and activates EP2 and EP4-mediated signaling in the corpus luteum at the time of establishment of pregnancy in ruminants[J]. Biol Reprod, 2011, 85(Suppl_1): 373. DOI:10.1093/biolreprod/85.s1.373 |
(编辑 郭云雁)



