20世纪90年代,科学家先后在骆驼和鲨鱼体内发现了一种独特的抗体,它们天然缺失轻链和重链第一恒定区(constant region 1, CH1),故将其命名为重链抗体(heavy chain antibodies,HCAbs)[1-2]。后续研究发现,重链抗体的重链可变区(variable domain of heavy chain of heavy-chain antibody,VHH)是HCAbs结合抗原的主要功能域,克隆此结构域后所形成的VHH是具有完整抗体功能特性的最小抗体,其大小可达到纳米级,所以也称之为纳米抗体(nanobodies,Nb)。特殊的结构赋予其优越的抗原结合力、稳定性、组织穿透力等性能,随着Nb在兽医领域研究的逐步深入,也逐渐展现出优秀的应用前景。本文重点对Nb的结构、特性、筛选与表达策略以及在兽医领域的研究现状进行综述,分析其在动物疫病防控、动物产品检验等方面的应用前景和发展方向,以期对深化和推广Nb在兽医领域的应用提供参考。
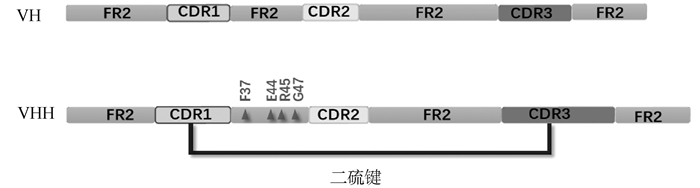
1 纳米抗体的结构Nb晶体为椭圆形,由3个互补决定区(complementarity-determining region,CDR)和位于其两侧的4个骨架区(framework region,FR)构成,大小为2.5 nm×4 nm,分子量为12~15 ku。传统抗体、HCAbs和Nb的结构示意见图 1,传统抗体重链可变区(variable region of the heavy chain of conventional antibodies,VH)和VHH的结构示意见图 2。

|
图 1 各类抗体结构示意图 Fig. 1 Schematic diagram of the structure of antibodies |
|
图 2 VH、VHH结构示意图 Fig. 2 Schematic diagram of the structure of VH and VHH |
VHH的CDR1和CDR3普遍比VH更长,VHH CDR3平均长度有16~18个氨基酸,而VH仅为9~13个氨基酸,VHH长CDR3区形成一个大的指状凸环结构嵌入抗原分子的裂隙,增加与抗原接触面积,使VHH具有更强的抗原结合能力[3]。此外,其CDR1、CDR3区存在一个半胱胺酸残基形成的额外二硫键,呈现凸环结构以固定CDR3区,该结构也可以结合抗原结构中的裂隙,增加VHH识别表位的多样性[4]。
1.2 FR2结构域VH FR2区高度保守的疏水氨基酸Val37、Gly44、Leu45和Trp47参与和轻链的相互作用,而VHH为适应缺失轻链,使用更亲水的氨基酸Phe或Tyr37、Glu44、Arg45和Gly47替代,且部分FR2被CDR3形成的凸环所覆盖,这显著增加了VHH的亲水性和稳定性[5]。
2 纳米抗体的理化特性纳米抗体特殊的结构赋予了其优于传统抗体的诸多优良理化特性,突破了传统抗体免疫原性高、生产成本较高、组织穿透力弱、稳定性低等瓶颈。
2.1 低免疫原性免疫原性与分子量呈正相关,分子量越大,免疫原性越高,Nb分子量仅为传统抗体的10%,使其引起体液或细胞免疫应答的几率大大降低。此外,Nb缺少可结晶段(fragment crystallizable,Fc)避免了补体反应,而且在骆驼科动物中编码Nb的基因与人类VH家族3系和4系基因序列同源性高达80%,因此Nb对人的免疫原性低,且具有较好的生物相容性,在人类和其他动物试验中,Nb的重复给药均未引起机体体液和细胞免疫应答,目前尚无Nb免疫原性造成不良反应的报道[6-8]。
2.2 易于制备与表达传统抗体表达时容易形成包涵体,Nb因其FR2区氨基酸性质的改变具有更强的亲水性和溶解性,可以在多种表达系统进行高效表达且产物多为可溶性,也易于利用外源亲和标签进行纯化[9]。这降低了研发和生产成本,解决了传统抗体难以低成本规模化制备的难题。
2.3 高抗原结合性虽然Nb远小于传统抗体,但却拥有与其相当的抗原结合活性,这得益于Nb长CDR3区形成凸环结构能识别传统抗体无法到达的靶抗原内部、深处狭小裂隙处,可以结合半抗原、酶活性位点,具有广泛抗原结合能力,并有助于发现传统抗体无法识别的药物新靶点[10-11]。
2.4 组织穿透性强Nb凭借体积小、分子量小的优势,拥有更强的组织穿透能力,能到达传统抗体不可及的病灶组织,如实体瘤;还能穿透血脑屏障为脑部给药,为大脑疾病研究提供新途径;同时易被肾组织快速滤过,避免肾毒性;在血液中清除速度快且半衰期短,当Nb进入组织时,多余未结合的Nb能快速被清除,可结合成像技术用于体内疾病的无创伤诊断[12]。
2.5 高稳定性Nb内部的二硫键使其具有耐热性和蛋白水解抗性。温度高于65 ℃会令常规抗体丧失变性后的可逆性(复性作用),失去抗体原有功能;而Nb具备高温耐受性,在90 ℃高温下拥有可逆的去折叠能力,在37 ℃孵育1周后有80%结合抗原能力[13]。利用Nb在室温下长期储存仍能保有活性的特点,有望解决传统抗体需冷链运输和储存的难题。而Nb在非生理条件pH、蛋白酶、离液剂环境仍能保持稳定构象[14]。这表明Nb可以实现口服或雾化方式给药,在治疗动物胃肠道和呼吸道疫病上具有良好应用前景。
2.6 易于基因工程改造Nb为单域结构,基因序列简单,可作为一种理想的构建单元,根据不同的需求构建多价、多特异性或融合性Nb(与牛血清白蛋白、IgG-Fc、放射性同位素等结合),并增强其对目标的特异性和功能性。
3 纳米抗体的筛选与表达根据不同试验目的选择相应文库技术进行建库和Nb靶向筛选,再选择适宜的表达系统表达,使得Nb的制备正逐渐成为一个技术成熟、高效、成本可控的标准化过程。
3.1 纳米抗体文库的类型根据获得的Nb基因来源分为免疫、天然和合成Nb文库,其在建库方法、库容量和特点上存在差异,Nb文库的类型和特点如表 1所示。
|
|
表 1 纳米抗体文库的类型和特点 Table 1 Types and characteristics of nanobody libraries |
主要利用噬菌体展示、酵母展示、酵母双杂交、核糖体展示和高通量测序等技术筛选Nb,其中噬菌体展示技术是应用最广泛的体外Nb筛选技术。噬菌体展示技术通过将抗体基因序列插入噬菌体外壳蛋白结构基因中,使抗体与噬菌体外壳蛋白形成融合蛋白,并随着子代噬菌体的重新组装展示在噬菌体表面,实现表型与基因型的统一[17]。
3.3 纳米抗体的表达策略与传统单克隆抗体需要进行繁琐的细胞培养相比,Nb的优势在于可以在原核宿主(大肠杆菌系统)、真核宿主(酵母、真菌、昆虫细胞、哺乳动物细胞)及植物宿主(植物细胞)中表达。大肠杆菌表达系统是最常用的表达平台,其操作简便、生产成本低,但存在部分表达产物会形成包涵体、缺乏翻译后修饰、胞内形式不利于二硫键形成等缺点;酵母表达系统可以产生高水平的Nb,其胞外氧化环境有利于对抗体进行翻译后折叠、修饰和分泌,促进二硫键的形成,但可能存在过度糖基化的问题;植物表达系统具有低成本和安全性,并且能够进行翻译后修饰,常使用本氏烟草叶和拟南芥种子进行高效表达[18]。
4 纳米抗体在动物疫病防控的应用多克隆抗体和单克隆抗体已经在动物疫病防控上得到广泛应用,但这两种抗体均各有局限性。如上所述,Nb具有多种优于传统抗体的优良特性,使其成为传统抗体的有力补充,有望成为新的防控动物疫病的有效手段。
4.1 用于动物疫病的预防防控动物疫病的关键在于控制传染源、切断传播途径和保护易感动物,Nb在被动免疫、构建疫苗载体、监测疫苗质量上极具发展潜力。
4.1.1 被动免疫 被动免疫是提前给易感动物注射抗体以起到免疫保护作用,Nb与IgG或IgA的Fc融合能预防动物疫病[19]。例如将产肠毒素大肠杆菌(Enterotoxigenic Escherichia coli,ETEC)的Nb与球蛋白IgA的Fc融合,并在拟南芥和毕赤酵母中大规模生产,制备成口服饲料对仔猪被动免疫,可以有效抑制菌毛黏附,防止仔猪感染ETEC[20-21]。再如将针对鞭毛和外膜蛋白的抗弯曲杆菌Nb融合到鸡IgA和IgY的恒定结构域,在本氏烟草叶子和拟南芥种子中表达,可以抑制弯曲杆菌的定植,未来可以将Nb制备成饲料添加剂预防弯曲杆菌[22]。
4.1.2 构建疫苗载体 针对黏膜表面受体的疫苗可以有效诱导肠道病原体黏膜免疫反应,但口服递送的亚单位疫苗在肠上皮细胞存在吸收不良、运输效率低下和免疫反应较弱的问题,成为黏膜疫苗接种的重要瓶颈。制备靶向猪氨肽酶N (porcine aminopeptidase N,pAPN)的Nb与鼠IgG2a的Fc融合形成二价融合蛋白,给猪只口服后在猪肠道上皮细胞中显示体内内化,能够引发全身和黏膜抗体反应[23]。证明了Nb作为肠道病原体疫苗抗原递送载体的巨大潜力。
4.1.3 监测疫苗质量 Nb具有高抗原结合能力,能精准识别蛋白质表面裂隙、蛋白质结构域和亚基,可以用于监测蛋白质构象。蛋白质纳米粒子构象状态分析是疫苗质量控制的关键步骤,布鲁菌LS蛋白(Brucella lumazine synthase,BLS)是通用疫苗载体,将仅识别BLS天然构象的Nb作为分子探针,可以在基于BLS平台的疫苗制备过程中监测疫苗质量[24]。再如,FMD疫苗的功效主要取决于完整病毒粒子(146 S)的含量,在疫苗制造、配制和储存过程中,146 S可能分解成12 S亚基,降低了疫苗效力,通过筛选能广泛识别146 S的Nb,制备双抗体夹心ELISA(double antibody sandwich ELISA,DAS-ELISA)进行抗原定量,可以监测疫苗完整衣壳的数量和稳定性,从而评估疫苗质量[25]。
4.2 用于动物疫病的诊断早期、快速、正确的诊断对于动物疫病防控至关重要,临床上各种动物病原体混合感染或继发感染的情况已成常态,目前动物重要疫病的诊断技术已经比较丰富,然而还存在操作复杂、便利性差等缺点。
4.2.1 ELISA检测 在生产诊断中,目前使用常规抗体制备的ELISA检测试剂需要冷链运输和储存,不利于临床诊断,而Nb的高稳定性则有望改变这一局面,基于辣根过氧化物酶、生物素等标记Nb建立的酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA),在猪、禽、牛等动物病毒病的诊断上已取得较大进展(表 2)。
|
|
表 2 基于纳米抗体的ELISA检测方法 Table 2 Nanobody-based ELISA detection method |
4.2.2 体内定位和成像 Nb对分子靶标的稳定性、亲和力和特异性高,靶向性和穿透性强,在肾组织能被快速清除,具有构建不同形式(放射性核素、磁性离子、量子点标记)抗体的灵活性,可以作为良好的靶向示踪分子应用于体内定位和成像。通过从免疫Nb文库中获得靶向O型口蹄疫病毒(foot and mouth disease virus,FMDV)的病毒颗粒或猪流行性腹泻病毒(porcine epidemic diarrhea virus,PEDV)、猪瘟病毒(classical swine fever virus,CSFV)结构蛋白的Nb,与量子点结合构成纳米探针,可以在细胞内进行病毒示踪和病毒成像;Nb也可以与超顺磁性纳米珠共轭,构建用于分离病毒的免疫磁性纳米珠,可以从临床样品中分离病毒或在体外捕获病毒粒子[40-42]。
4.3 用于动物疫病的治疗抗体在对抗病毒、细菌等感染方面都能发挥重要的天然防御作用,其应用于动物疫病的治疗已有数十年的历史,但传统抗体因尺寸大不易穿透组织影响治疗效果、生产步骤繁琐且成本高限制其发展。作为传统抗体的有利替代品,Nb拥有的小尺寸、强抗原结合能力、组织穿透性强等优势为研发高效治疗方法提供新选择。
4.3.1 抗病毒治疗 Nb是中和抗病毒试剂的主要来源,其通过抑制靶标与受体间相互作用治疗动物病毒病。笔者分别以新城疫病毒(Newcastle disease virus,NDV)HN蛋白和F潜在中和表位为靶标,筛选具有良好反应活性和中和活性的Nb,其中靶向HN的Nb能识别NDV感染的细胞[43-44]。Zhang等[45]在毕赤酵母体内将靶向猪呼吸与繁殖障碍综合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV) nsp9的Nb与猪IgG Fc融合表达,之后发现该嵌合抗体通过内吞作用进入宿主细胞体内并发挥抗病毒作用。而将PRRSV nsp9的Nb与细胞穿膜肽(cell penetrating peptide,CPP)融合表达也能进入宿主细胞,可以减弱PRRSV感染后引起的症状,发挥抗病毒功能[46]。以上,Nb有望成为治疗动物病毒病的新型工具。
4.3.2 抗菌素治疗 临床上使用口服或静脉注射抗生素治疗细菌病,但抗生素滥用和耐药菌的出现给细菌类疾病的治疗带来难题。Nb的特异性和靶向性能够靶向细菌表面蛋白,通过拮抗细菌黏附宿主细胞等方式治疗细菌感染。炭疽芽胞杆菌(Bacillus anthracis)能引起急性人畜共患细菌病,筛选靶向其S-层蛋白Sap的Nb经表达纯化后通过皮下注射给炭疽病小鼠模型,结果显示炭疽芽胞杆菌的增殖被抑制,小鼠模型中的病原菌被清除[47]。这证实了Nb的抗菌治疗能力。
5 纳米抗体在动物产品检验中的应用 5.1 检验食源性病原体动物源性食品中常存在各类细菌和真菌毒素,这导致食源性疾病严重影响人类健康,而保障食品安全最重要的措施是建立快速有效的检测方法。近年来,Nb应用于动物产品检验的研究多有报道,研究人员针对动物产品(牛奶、肉等)中的食源性致病菌,筛选其特异性高、反应性好的Nb作为识别元件,并基于抗原抗体特异性反应开发出各类检验方法,表 3列出了用于检验动物产品中食源性病原体的Nb,这为准确高效检测食源性病原体提供了新思路,有助于提高动物产品的质量安全水平。
|
|
表 3 用于检验动物产品中食源性病原体的纳米抗体 Table 3 Nanobody for detection of foodborne pathogens in animal products |
在规模化和集约化养殖条件下,为追求养殖利益,生产中常用抗生素和杀菌剂来防控动物疫病,用激素和促生长剂来提高动物生长性能和饲料利用效率,这可能会导致动物源性食品中存在药物残留,对人类健康造成潜在危害。发展快速、准确的兽药残留检验技术是防范其危害的最后一道防线,而Nb的出现带来了新技术力量。
孔雀石绿是一种杀菌剂,曾被广泛应用于水产养殖业,但其进入人体后代谢产物具有高残留和致畸、致癌、致突变等毒性,已被我国列入《食品动物禁用的兽药及其化合物清单》,但实际生产上仍存在滥用的现象。目前检验孔雀石绿的方法为液相色谱-质谱联用方法,但其检测成本高,操作复杂且耗时长。通过从免疫的孔雀石绿文库中筛选Nb,以此制备胶体金免疫层析检测试纸条,其检测时间仅需15 min,检测限为0.5 ng·mL-1,判定速度快,灵敏度高[55]。
莱克多巴胺(ractopamine,RAC)是一种苯酚胺类的β-肾上腺素兴奋剂,盐酸克伦特罗(clenbuterol hydrochloride,CL)是一种β2型肾上腺素受体激动剂,两者均会对人体产生毒副作用,众多国家都已禁止将两者用于畜禽养殖。已经成功从天然Nb库中靶向筛选出对RAC、CL反应性良好的Nb,这为后续研发基于Nb技术的药残检测方法奠定基础[56-57]。
6 研究展望综上所述,Nb因其特殊结构展现出了低免疫原性、易于制备与表达、高抗原结合性、组织穿透性强、高稳定性和易于改造等诸多优良理化特性,同时其制备技术成熟、成本可控,有潜力成为替代传统抗体应用于动物疫病预防、诊断、治疗以及动物产品食源性病原体和药物残留检验等领域的优秀迭代产品。随着研究的深入,Nb此前的一些局限性也正在逐步得到修正和弥补,例如通过CRISPR-Cas9技术将骆驼基因转入小鼠,可以获得能产生Nb的小鼠,解决了骆驼类和鲨鱼类等试验动物不易获得、免疫操作困难等问题,为Nb的建库提供了新选择[58];又如通过构建多聚化Nb或与Fc融合、聚乙二醇化等方法,可以解决Nb体积和分子质量小导致半衰期短,影响治疗时效的问题,从而提高其在体内的治疗效果,但这一做法会增加Nb尺寸,可能会减弱Nb活性,未来要继续探索最佳构建方案,增加融合Nb在体内作用时间和作用效果。
笔者认为,Nb在兽医领域的应用场景广泛、前景明朗,下一步,一是可以加强Nb与其他新兴技术(生物传感器、微流控芯片、高通量测序、单颗粒冷冻电镜技术等)的协同研究和应用,最大限度发挥Nb的优良特性,并不断优化和弥补其局限性;二是要建立和推广商用Nb筛选和制备技术,推动Nb应用商品化。广西属于养猪大省,近年来,猪肠道冠状病毒病的发生制约着本地养猪产业的发展,笔者团队致力于研发能实现猪口服给药的纳米抗体,为新时代兽医发展提质增效带来新动能。
| [1] |
HAMERS-CASTERMAN C, ATARHOUCH T, MUYLDERMANS S, et al. Naturally occurring antibodies devoid of light chains[J]. Nature, 1993, 363(6428): 446-448. DOI:10.1038/363446a0 |
| [2] |
GREENBER A S, AVILA D, HUGHES M, et al. A new antigen receptor gene family that undergoes rearrangement and extensive somatic diversification in sharks[J]. Nature, 1995, 374(6518): 168-173. DOI:10.1038/374168a0 |
| [3] |
NGUYEN V K, HAMERS R, WYNS L, et al. Camel heavy-chain antibodies: Diverse germline VHH and specific mechanisms enlarge the antigen-binding repertoire[J]. EMBO J, 2000, 19(5): 921-930. DOI:10.1093/emboj/19.5.921 |
| [4] |
GOVAERT J, PELLIS M, DESCHACHT N, et al. Dual beneficial effect of interloop disulfide bond for single domain antibody fragments[J]. J Biol Chem, 2012, 287(3): 1970-1979. DOI:10.1074/jbc.M111.242818 |
| [5] |
VATTEKATTE A M, SHINADA N K, NARWANI T J, et al. Discrete analysis of camelid variable domains: sequences, structures, and in-silico structure prediction[J]. PeerJ, 2020, 8: e8408. DOI:10.7717/peerj.8408 |
| [6] |
DESCHACHT N, DE GROEVE K, VINCKE C, et al. A novel promiscuous class of camelid single-domain antibody contributes to the antigen-binding repertoire[J]. J Immunol, 2010, 184(10): 5696-5704. DOI:10.4049/jimmunol.0903722 |
| [7] |
MUYLDERMANS S. Nanobodies: Natural single-domain antibodies[J]. Annu Rev Biochem, 2013, 82: 775-797. DOI:10.1146/annurev-biochem-063011-092449 |
| [8] |
LI C, ZHAN W Q, YANG Z L, et al. Broad neutralization of SARS-CoV-2 variants by an inhalable bispecific single-domain antibody[J]. Cell, 2022, 185(8): 1389-1401.e18. DOI:10.1016/j.cell.2022.03.009 |
| [9] |
LIU W S, SONG H P, CHEN Q, et al. Recent advances in the selection and identification of antigen-specific nanobodies[J]. Mol Immunol, 2018, 96: 37-47. DOI:10.1016/j.molimm.2018.02.012 |
| [10] |
ZAVRTANIK U, LUKAN J, LORIS R, et al. Structural basis of epitope recognition by heavy-chain camelid antibodies[J]. J Mol Biol, 2018, 430(21): 4369-4386. DOI:10.1016/j.jmb.2018.09.002 |
| [11] |
AL QARAGHULI M M, FERRO V A. Analysis of the binding loops configuration and surface adaptation of different crystallized single-domain antibodies in response to various antigens[J]. J Mol Recognit, 2017, 30(4): e2592. DOI:10.1002/jmr.2592 |
| [12] |
BAO G F, TANG M, ZHAO J, et al. Nanobody: A promising toolkit for molecular imaging and disease therapy[J]. EJNMMI Res, 2021, 11(1): 6. DOI:10.1186/s13550-021-00750-5 |
| [13] |
GOLDMAN E R, LIU J L, ZABETAKIS D, et al. Enhancing stability of camelid and shark single domain antibodies: an overview[J]. Front Immunol, 2017, 8: 865. DOI:10.3389/fimmu.2017.00865 |
| [14] |
SALVADOR J P, VILAPLANA L, MARCO M P. Nanobody: Outstanding features for diagnostic and therapeutic applications[J]. Anal Bioanal Chem, 2019, 411(9): 1703-1713. DOI:10.1007/s00216-019-01633-4 |
| [15] |
PARDON E, LAEREMANS T, TRIEST S, et al. A general protocol for the generation of nanobodies for structural biology[J]. Nat Protoc, 2014, 9(3): 674-693. DOI:10.1038/nprot.2014.039 |
| [16] |
LIU B Y, YANG D W. Easily established and multifunctional synthetic nanobody libraries as research tools[J]. Int J Mol Sci, 2022, 23(3): 1482. DOI:10.3390/ijms23031482 |
| [17] |
王加利, 和似琦, 康子茜, 等. 噬菌体抗体展示技术及其在抗新冠病毒抗体发现中的应用[J]. 生物技术通报, 2022, 38(5): 248-256. WANG J L, HE S Q, KANG Z X, et al. Antibody phage display technology and its application in the discovery of anti-SARS-CoV-2 Antibodies[J]. Biotechnology Bulletin, 2022, 38(5): 248-256. DOI:10.13560/j.cnki.biotech.bull.1985.2021-0862 (in Chinese) |
| [18] |
LIU Y K, HUANG H. Expression of single-domain antibody in different systems[J]. Appl Microbiol Biotechnol, 2018, 102(2): 539-551. DOI:10.1007/s00253-017-8644-3 |
| [19] |
DE GREVE H, VIRDI V, BAKSHI S, et al. Simplified monomeric VHH-Fc antibodies provide new opportunities for passive immunization[J]. Curr Opin Biotechnol, 2020, 61: 96-101. DOI:10.1016/j.copbio.2019.11.006 |
| [20] |
VIRDI V, CODDENS A, DE BUCK S, et al. Orally fed seeds producing designer IgAs protect weaned piglets against enterotoxigenic Escherichia coli infection[J]. Proc Natl Acad Sci U S A, 2013, 110(29): 11809-11814. DOI:10.1073/pnas.1301975110 |
| [21] |
VIRDI V, PALACI J, LAUKENS B, et al. Yeast-secreted, dried and food-admixed monomeric IgA prevents gastrointestinal infection in a piglet model[J]. Nat Biotechnol, 2019, 37(5): 527-530. DOI:10.1038/s41587-019-0070-x |
| [22] |
VANMARSENILLE C, ELSEVIERS J, YVANOFF C, et al. In planta expression of nanobody-based designer chicken antibodies targeting Campylobacter[J]. PLoS One, 2018, 13(9): e0204222. DOI:10.1371/journal.pone.0204222 |
| [23] |
BAKSHI S, GARCIA R S, VAN DER WEKEN H, et al. Evaluating single-domain antibodies as carriers for targeted vaccine delivery to the small intestinal epithelium[J]. J Control Release, 2020, 321: 416-429. DOI:10.1016/j.jconrel.2020.01.033 |
| [24] |
ALZOGARAY V, URRUTIA M, BERGUER P, et al. Characterization of folding-sensitive nanobodies as tools to study the expression and quality of protein particle immunogens[J]. J Biotechnol, 2019, 293: 17-23. DOI:10.1016/j.jbiotec.2019.01.001 |
| [25] |
LI H Z, DEKKER A, SUN S Q, et al. Novel capsid-specific single-domain antibodies with broad foot-and-mouth disease strain recognition reveal differences in antigenicity of virions, empty capsids, and virus-like particles[J]. Vaccines (Basel), 2021, 9(6): 620. DOI:10.3390/vaccines9060620 |
| [26] |
MA Z Q, WANG T Y, LI Z W, et al. A novel biotinylated nanobody-based blocking ELISA for the rapid and sensitive clinical detection of porcine epidemic diarrhea virus[J]. J Nanobiotechnol, 2019, 17(1): 96. DOI:10.1186/s12951-019-0531-x |
| [27] |
王天宇. 基于猪流行性腹泻病毒S蛋白纳米抗体的阻断ELISA方法的建立[D]. 杨凌: 西北农林科技大学, 2019. WANG T Y. Establishment of blocking ELISA method based on nanobody against porcine epidemic diarrhea virus S protein[D]. Yangling: Northwest A&F University, 2019. (in Chinese) |
| [28] |
DU T F, ZHU G, WU X P, et al. Biotinylated single-domain antibody-based blocking ELISA for detection of antibodies against swine influenza virus[J]. Int J Nanomed, 2019, 14: 9337-9349. DOI:10.2147/IJN.S218458 |
| [29] |
朱家宏. 基于非洲猪瘟病毒P72蛋白纳米抗体的竞争ELISA检测方法的建立[D]. 杨凌: 西北农林科技大学, 2020. ZHU J H. Establishment of a competitive ELISA detection method based on African swine fever virus p72 protein nanobodies[D]. Yangling: Northwest A&F University, 2020. (in Chinese) |
| [30] |
MU Y, JIA C Y, ZHENG X, et al. Correction to: A nanobody-horseradish peroxidase fusion protein-based competitive ELISA for rapid detection of antibodies against porcine circovirus type 2[J]. J Nanobiotechnol, 2021, 19(1): 66. DOI:10.1186/s12951-021-00815-6 |
| [31] |
樊杰. 猪传染性胃肠炎病毒N蛋白纳米抗体的制备和基于纳米抗体竞争ELISA的建立[D]. 杨凌: 西北农林科技大学, 2021. FAN J. Preparation of nanobodies against transmissible gastroenteritis virus N protein and development of the nanobody-based competitive ELISA[D]. Yangling: Northwest A&F University, 2021. (in Chinese) |
| [32] |
DUAN H, CHEN X, ZHAO J K, et al. Development of a nanobody-based competitive enzyme-linked immunosorbent assay for efficiently and specifically detecting antibodies against genotype 2 porcine reproductive and respiratory syndrome viruses[J]. J Clin Microbiol, 2021, 59(12): e01580-21. |
| [33] |
王坤. 基于禽流感病毒NP蛋白纳米抗体建立鸡血清中禽流感抗体检测的竞争ELISA[D]. 杨凌: 西北农林科技大学, 2020. WANG K. Establishment of a competitive ELISA for detection of avian influenza antibody in chicken serum based on avian influenza virus NP protein nanobody[D]. Yangling: Northwest A&F University, 2020. (in Chinese) |
| [34] |
SHENG Y M, WANG K, LU Q Z, et al. Nanobody-horseradish peroxidase fusion protein as an ultrasensitive probe to detect antibodies against Newcastle disease virus in the immunoassay[J]. J Nanobiotechnol, 2019, 17(1): 35. DOI:10.1186/s12951-019-0468-0 |
| [35] |
陈天祥. 禽戊型肝炎病毒ORF2截短蛋白纳米抗体的制备和竞争ELISA检测方法的建立[D]. 杨凌: 西北农林科技大学, 2021. CHEN T X. Preparation of nanobodies against a truncated protein of avian HEV ORF2 and development of a competitive ELISA[D]. Yangling: Northwest A&F University, 2021. (in Chinese) |
| [36] |
JI P P, ZHU J H, LI X X, et al. Fenobody and RANbody-based sandwich enzyme-linked immunosorbent assay to detect Newcastle disease virus[J]. J Nanobiotechnol, 2020, 18(1): 44. DOI:10.1186/s12951-020-00598-2 |
| [37] |
周子恒. 牛病毒性腹泻病毒纳米抗体ELISA检测方法的初步研究[D]. 石河子: 石河子大学, 2019. ZHOU Z H. Preliminary study on ELISA method of bovine viral diarrhea virus nanobody[D]. Shihezi: Shihezi University, 2019. (in Chinese) |
| [38] |
ZHU M, GONG X, HU Y, et al. Streptavidin-biotin-based directional double nanobody sandwich ELISA for clinical rapid and sensitive detection of influenza H5N1[J]. J Transl Med, 2014, 12: 352. DOI:10.1186/s12967-014-0352-5 |
| [39] |
LU Q Z, LI X X, ZHAO J K, et al. Nanobody-horseradish peroxidase and -EGFP fusions as reagents to detect porcine parvovirus in the immunoassays[J]. J Nanobiotechnol, 2020, 18(1): 7. DOI:10.1186/s12951-019-0568-x |
| [40] |
YANG S L, LI L, YIN S H, et al. Single-domain antibodies as promising experimental tools in imaging and isolation of porcine epidemic diarrhea virus[J]. Appl Microbiol Biotechnol, 2018, 102(20): 8931-8942. DOI:10.1007/s00253-018-9324-7 |
| [41] |
YANG S L, YUAN L, SHANG Y J, et al. Selection and characterization of CSFV-Specific single-domain antibodies and their application along with immunomagnetic nanobeads and quantum dots[J]. Biomed Res Int, 2020, 2020: 3201630. |
| [42] |
WANG D, YANG S L, YIN S H, et al. Characterization of single-domain antibodies against foot and mouth disease virus (FMDV) serotype O from a camelid and imaging of FMDV in baby hamster kidney-21 cells with single-domain antibody-quantum dots probes[J]. BMC Vet Res, 2015, 11: 120. DOI:10.1186/s12917-015-0437-2 |
| [43] |
高小龙, 胡湘云, 付向晶, 等. 新城疫病毒F蛋白纳米抗体的筛选及活性鉴定[J]. 畜牧兽医学报, 2016, 47(8): 1645-1651. GAO X L, HU X Y, FU X J, et al. Screening and characterization of VHH against newcastle disease virus fusion protein[J]. Acta Veterinaria et Zootechnica Sinica, 2016, 47(8): 1645-1651. (in Chinese) |
| [44] |
GAO X L, HU X Y, TONG L N, et al. Construction of a camelid VHH yeast two-hybrid library and the selection of VHH against haemagglutinin-neuraminidase protein of the Newcastle disease virus[J]. BMC Vet Res, 2016, 12: 39. DOI:10.1186/s12917-016-0664-1 |
| [45] |
ZHANG L, WANG L Z, CAO S S, et al. Nanobody Nb6 fused with porcine IgG Fc as the delivering tag to inhibit porcine reproductive and respiratory syndrome virus replication in porcine alveolar macrophages[J]. Vet Res, 2021, 52(1): 25. DOI:10.1186/s13567-020-00868-9 |
| [46] |
李阔阔. 猪繁殖与呼吸综合征病毒Nsp9纳米抗体在体内抗病毒感染的初步验证[D]. 杨凌: 西北农林科技大学, 2019. LI K K. Preliminary validation of swine reproductive and respiratory syndrome virus Nsp9 nanobody for antiviral infection in vivo[D]. Yangling: Northwest A&F University, 2019. (in Chinese) |
| [47] |
FIORAVANTI A, VAN HAUWERMEIREN F, VAN DER VERREN S E. Structure of S-layer protein Sap reveals a mechanism for therapeutic intervention in anthrax[J]. Nat Microbiol, 2019, 4(11): 1805-1814. DOI:10.1038/s41564-019-0499-1 |
| [48] |
TU Z, CHEN Q, LI Y P, et al. Identification and characterization of species-specific nanobodies for the detection of Listeria monocytogenes in milk[J]. Anal Biochem, 2016, 493: 1-7. DOI:10.1016/j.ab.2015.09.023 |
| [49] |
HE Y X, REN Y R, GUO B, et al. Development of a specific nanobody and its application in rapid and selective determination of Salmonella enteritidis in milk[J]. Food Chem, 2020, 310: 125942. DOI:10.1016/j.foodchem.2019.125942 |
| [50] |
高杨. 沙门菌PhoN蛋白单克隆抗体和纳米抗体的制备及初步应用[D]. 扬州: 扬州大学, 2021. GAO Y. Preparation and application of different types of antibodies against Salmonella PhoN protein[D]. Yangzhou: Yangzhou University, 2021. (in Chinese) |
| [51] |
HU Y Z, SUN Y, GU J X, et al. Selection of specific nanobodies to develop an immuno-assay detecting Staphylococcus aureus in milk[J]. Food Chem, 2021, 353: 129481. DOI:10.1016/j.foodchem.2021.129481 |
| [52] |
JI Y W, LI X, LU Y L, et al. Nanobodies based on a sandwich immunoassay for the detection of Staphylococcal enterotoxin B free from interference by protein A[J]. J Agric Food Chem, 2020, 68(21): 5959-5968. DOI:10.1021/acs.jafc.0c00422 |
| [53] |
SUN T Q, ZHAO Z Q, LIU W T, et al. Development of sandwich chemiluminescent immunoassay based on an anti-Staphylococcal enterotoxin B nanobody-alkaline phosphatase fusion protein for detection of Staphylococcal enterotoxin B[J]. Anal Chim Acta, 2020, 1108: 28-36. DOI:10.1016/j.aca.2020.01.032 |
| [54] |
TANG X Q, CATANANTE G, HUANG X R, et al. Screen-printed electrochemical immunosensor based on a novel nanobody for analyzing aflatoxin M1 in milk[J]. Food Chem, 2022, 383: 132598. DOI:10.1016/j.foodchem.2022.132598 |
| [55] |
高海岗. 孔雀石绿纳米抗体的制备及其免疫层析检测方法的建立与应用[D]. 扬州: 扬州大学, 2021. GAO H G. Preparation of malachite green nanobody and establishment and application of immuno-chromatography detection method[D]. Yangzhou: Yangzhou University, 2021. (in Chinese) |
| [56] |
翟圆君. 骆驼天然单域重链抗体库的构建及抗莱克多巴胺纳米抗体的初步筛选[D]. 郑州: 郑州大学, 2017. ZHAI Y J. Construction of camelid single-domain antibody library and Perliminayry biopanning of nanobody against ractopamine[D]. Zhengzhou: Zhengzhou University, 2017. (in Chinese) |
| [57] |
翟艳芳. 天然纳米抗体库的构建及抗盐酸克伦特罗纳米抗体的初步筛选[D]. 郑州: 郑州大学, 2020. ZHAI Y F. Construction of natural nanobody library and preliminary screening of anti-clenbuterol nanobody[D]. Zhengzhou: Zhengzhou University, 2020. (in Chinese) |
| [58] |
XU J L, XU K, JUNG S, et al. Nanobodies from camelid mice and llamas neutralize SARS-CoV-2 variants[J]. Nature, 2021, 595(7866): 278-282. DOI:10.1038/s41586-021-03676-z |
(编辑 范子娟)



