2. 湖南省畜禽安全生产协同创新中心, 长沙 410128;
3. 宁夏大学动物科技学院, 银川 750021
2. Hunan Co-Innovation Center of Safety Animal Production, Changsha 410128, China;
3. College of Animal Science and Technology, Ningxia University, Yinchuan 750021, China
近年来,随着全球规模化畜牧业的快速发展,母猪生产效益成为影响生猪养殖经济效益的关键因素。规模化养殖过程中,由于生理因素、环境、遗传背景、疾病等多种原因,母猪经常出现发情异常、屡配不孕、流产死胎和弱仔等繁殖障碍,又称母猪繁殖障碍综合征(SRDS),严重影响了养殖业的可持续发展和经济效益。因此,有关SRDS的研究越来越受到国内外学者的关注。本文在近年来SRDS的研究基础上,从发病原因、发病机理、防治措施等方面进行综述,旨在为SRDS的科学防控提供参考。
1 遗传因素对母猪繁殖障碍综合征的影响遗传因素引起的母猪繁殖障碍主要有先天性卵巢发育不全、两性畸形、生殖道畸形和内陷乳头等。猪的先天性卵巢发育不全往往是由于缺少一条X染色体所致。大量的研究证明,猪的内陷乳头属于遗传性畸形,且受常染色体单隐性基因控制[1-2]。两性畸形分为真两性畸形和假两性畸形,真两性畸形是指同时具备雌雄性腺的个体,生殖道的特性介于雌雄两性之间;假两性畸形是指只具有一种性别的性腺,而生殖道又具有另一性别的特征。对具有雌性核型(XX性别逆转)和发达睾丸结构的两性间性的分析表明,这种状态经常出现于缺乏SRY基因的动物(SRY-阴性)[3]。生殖道畸形有子宫角畸形和子宫颈畸形等。卵巢囊肿属于多基因遗传病, 受遗传和环境因素的共同影响。有研究表明, 雌激素受体基因PvuII(ESR/PvuII)多态性与卵泡囊肿高度相关,ESR/PvuII基因型母猪患卵巢囊肿概率较低,而RBP4基因的+249-63 G>C处的SNP位点检测为CC基因型的母猪患卵泡囊肿的风险较高,为基因治疗提供了新途径,可以通过基因选择来降低此类疾病的发生,从而提高母猪的繁殖率[4-5]。建立完善的种畜系谱资料,设立科学合理的交配制度,避免个体近交,实施严格的淘汰制度等一系列降低遗传因素对母猪繁殖障碍综合征影响的对策,对提高母猪繁殖效率至关重要。
2 机能性繁殖障碍综合征机能性繁殖障碍主要由卵巢功能障碍、持久性黄体、卵巢发育不全等因素引起。卵巢功能障碍表现为由垂体激素缺乏引起的暂时性紊乱。miRNA-146表达的上调通过降低白细胞介素-6(IL-6)和肿瘤坏死因子-α(TNF-α)的表达来减轻卵巢功能障碍, 其潜在机制与抑制Toll样受体4/核因子(κBTLR4/NF-κB)信号通路逆转卵巢功能障碍相关[6]。褪黑素通过磷酸肌醇三激酶/蛋白激酶B(PI3K-Akt)通路调节脱氢表雄甾酮(DHEA)诱导的多囊卵巢综合征(PCOS)中的自噬来改善卵巢功能障碍[7]。持久性黄体是由于周期黄体或妊娠黄体超过正常周期仍发挥功能的一种黄体。持久性黄体能够持续分泌孕酮,导致母猪下丘脑-垂体-卵巢轴功能不能正常运转,从而使发情周期停止,母猪出现乏情,可通过肌肉注射PGF2α或氯前列烯醇进行治疗。后天性卵巢发育不全是由于长时间处于慢性消化系统疾病或慢性呼吸系统疾病等因素所引起。先天性卵巢发育不全的母猪应对其进行淘汰或育肥处理,而由后天原因所导致的卵巢发育不全可通过激素处理促进其卵巢恢复。母猪机能性繁殖障碍与生殖激素有关,因此深入研究生殖激素对繁殖障碍的影响,以及如何通过生殖激素水平调控提高母猪繁殖性能意义重大。
3 环境对母猪繁殖障碍综合征的影响良好的环境是动物生存和健康的必要条件,影响母猪繁殖障碍综合征的环境因素主要有温度、湿度、空气质量以及猪舍类型等。温度和湿度可通过影响母猪体内激素的分泌和母猪机体健康影响母猪的繁殖性能。当温度超过28 ℃会延缓母猪性成熟,温度超过30 ℃会造成母猪内分泌系统失衡,持续的高温环境(26 ℃以上)会导致热应激,致使雌性激素分泌减少,出现发情异常、降低母猪受孕率、影响胚胎附植和发育、引起流产和弱仔数增加等问题[8-9]。妊娠前期适宜温度为13~19 ℃,妊娠后期适宜温度为16~20 ℃[10]。母猪繁殖适宜的相对湿度为60%~70%,湿度过大易造成母猪患皮肤病和肢蹄病,隐性发情及屡配不孕等现象增加;当湿度过低时,舍内粉尘含量增加,引起猪呼吸受阻。研究表明,长期处于高温高湿环境下,空怀母猪的发情间期延长,妊娠母猪的弱仔率和死胎率显著增加,初产母猪的配种后返情率升高[11]。家养母猪在夏末秋初会表现出一段称为季节性不育的繁殖性能受损时期,内分泌环境在这一时期会令卵巢孕激素分泌下降,并伴随卵母细胞发育能力降低,因卵母细胞质量差而导致的胚胎发育不良可能导致胚胎无法着床或维持妊娠。季节性不孕机制涉及下丘脑-垂体-性腺轴和环境变化的复杂相互作用[12]。排泄物未被及时清理是造成猪舍内刺鼻气味的原因之一,当空气中氨气、硫化氢、一氧化碳等有毒气体含量较高时,会引起母猪繁殖障碍。研究表明,氨气对母猪的生产性能存在影响,妊娠母猪舍NH3浓度越低妊娠母猪生产性能越好[13],当CO2浓度过高时,母猪易感染传染病。母猪误食发霉饲料导致体内毒素富集,从而诱发母猪繁殖障碍(表 1)。栏舍类型对母猪的繁殖性能存在不同程度的影响,单栏舍有利于控制母猪膘情和减少机械性流产,但是运动量明显下降,后期容易发生流产;群饲栏舍能够增加母猪运动量,但是为了争夺资源和形式明显的等级关系会发生争斗,导致机械性流产和跛足等,缩短了母猪的利用年限,增加了淘汰率[14-16]。合适的猪舍有助于母猪发挥更大的繁殖潜能。随着环控设备的更新迭代,环境对母猪繁殖障碍的影响有所下降,但母猪饲喂栏舍的改进仍需深入研究。
|
|
表 1 霉菌毒素对母猪繁殖障碍综合征的影响 Table 1 Effect of mycotoxins on reproductive disorder syndrome in sows |
母猪营养在生产过程发挥着重要的作用(表 2),营养的均衡对母猪的生产性能和利用年限有决定性作用。大量研究表明,营养是母猪繁殖障碍综合征的重要影响因素之一。特别是能量、蛋白质和维生素的摄入不足会导致体内氨基酸失衡,导致细胞代谢紊乱,从而引起母猪繁殖障碍综合征的发生。母猪的营养状况决定着受孕率和胎儿的生长发育,营养过剩导致母猪体况肥胖、短暂不孕,营养缺乏使得生殖激素合成减少,从而导致不孕引起母猪繁殖性障碍。当微量元素含量较高时,会引起机体中毒。
|
|
表 2 部分营养对母猪繁殖障碍综合征的影响 Table 2 Effect of partial nutrition on reproductive disorder syndrome in sows |
近年来,通过在正常生殖周期为母猪提供更多营养的方式增加了产奶量和产仔数。此外,妊娠母猪的饲粮应确保充足的母体蛋白质和脂肪沉积,以优化胎儿生长。含有13.82 MJ·kg-1代谢能和10.5% 粗蛋白的妊娠母猪日粮可以提高繁殖性能、产仔性能和初乳质量[24]。能量和蛋白质是促进卵母细胞成熟、胚胎与胎儿发育的重要营养基础,对于母猪繁殖寿命和终身繁殖力具有关键调控作用。淀粉的分解产物,通过影响下丘脑-垂体-性腺轴的活性,进而促进母猪的情期启动和胎儿发育。脂肪可以通过瘦素信号通路作用发挥繁殖调控作用。纤维被肠道微生物代谢产生短链脂肪酸作用于不同的受体,进而在情期启动、炎性反应等方面发挥作用。蛋白质分解产生的氨基酸通过不同的途径影响母猪的繁殖性能[25-26]。膳食纤维可以与微生物相互作用调节母猪的繁殖性能,其摄入水平会改变循环激素和代谢物的生理水平,最终影响卵巢的功能促进母猪卵巢中卵泡和卵母细胞的成熟,以及通过促进母猪结肠中5-羟色胺的合成和从母体向胎盘的转运,从而提高胎盘5-羟色胺水平,进而改善胎盘发育和功能,最终促进胎儿生长[27-28]。胎儿在生长发育期间对铁的需求迅速增加,易导致妊娠母猪缺铁。当母猪无法从日粮中获取足够的铁以满足妊娠需求时则会严重影响繁殖性能和仔猪生长,缺铁性贫血可导致不良妊娠结果,如流产和死胎[29]。因此,研究母猪不同发育阶段营养需要对于提高母猪繁殖性能和减少饲料资源浪费意义重大。
5 疾病引起的母猪繁殖障碍综合征引起母猪繁殖障碍的疾病为两大类:非传染性和传染性疾病,非传染性疾病主要有子宫内膜炎,传染性疾病主要由病毒、细菌、寄生虫等引起。病毒主要包括猪细小病毒、猪繁殖与呼吸综合征病毒、猪圆环病毒、猪伪狂犬病病毒等。病毒感染导致的母猪繁殖障碍严重影响着我国生猪产业的健康发展[35-37]。致使母猪发生繁殖障碍的因素较多,且部分疾病的临床症状相似,难以区分,存在混合感染,使得诊断和治疗更为复杂,临床防控亦存在一定难度。
5.1 子宫内膜炎子宫内膜炎是母猪生殖系统中的一种疾病,也是造成母猪繁殖障碍的重要原因之一。子宫内膜炎分为急性子宫内膜炎和慢性子宫内膜炎,主要是根据病原体侵入子宫的深度作为判断依据。造成的原因有病原菌感染、环境卫生、营养、管理等[38]。研究表明,肠道微生物群也是引起子宫内膜炎的原因之一[39-40]。子宫内膜容受性和蜕膜化作为胚胎附植的重要环节,影响哺乳动物的成功妊娠和繁殖性能,慢性子宫内膜炎(CE)导致蜕膜化受损以及子宫内膜局部免疫异常,从而导致着床失败[41-42]。严重CE可能通过损害子宫内膜容受性和干扰受孕而降低生殖能力[43]。研究表明,子宫内膜炎使得子宫肌层中P物质(SP)蛋白质受体(NK1R)和神经激肽A(NKA)蛋白质受体(NK2R)蛋白的表达增加,NK1R/SP和NK2R/NKA系统参与发炎子宫的收缩功能表明,这些系统影响自发性子宫内膜炎/子宫炎过程中炎症症状的严重程度[44]。便秘会导致子宫炎和乳腺炎,影响仔猪的生长和存活[45-46]。子宫内膜炎通过降低受孕率、增加流产率和增加胎儿畸形率,对母猪繁殖能力造成影响,因此母猪患子宫内膜炎后应及时治疗,以保证其正常繁殖能力。
采取“预防为主,治疗为辅”的防控措施,生产上加强饲养管理、生物安全防控以及保健等工作。在治疗方面,传统治疗主要采用子宫冲洗、子宫灌注、肌肉注射和应用子宫收缩剂等方式,子宫冲洗药物常用盐酸吖啶黄溶液、高锰酸钾溶液、利凡诺溶液和碘制剂等,肌肉注射药物主要有地塞米松及抗生素类如青霉素、链霉素和磺胺类药物等,但抗生素治疗会出现药物残留和耐药性,迫切需要寻找安全高效的疗法[47-48];非传统的治疗方法有免疫调节剂、干细胞治疗法、针灸和耦合剂等[49-50]。Wang等[51]研究表明,紫丁香(SOL)提取物的4种主要成分(木犀草素、山奈酚、齐墩果酸和芦丁)均能表现出炎症抑制能力且可通过抑制Toll样受体/核因子κB(TLRs/NF-κB)信号通路来治疗子宫内膜炎,是一种潜在治疗子宫内膜炎的药物。随着畜牧业向健康绿色的方向发展,中药疗法越来越受到人们的关注,中草药提取物展现出前所未有的优势,中药具有多种活性成分,其药理活性是多个靶点和成分的协同作用。
5.2 猪伪狂犬病病毒感染猪伪狂犬是由猪伪狂犬病病毒(Pseudorabies virus,PRV)感染所引起的疾病,症状因动物所处时期不同如妊娠母猪流产、产死胎、木乃伊等现象,造成母猪屡配不孕、不发情、返情。PRV有显性感染和隐性感染两种感染方式,成年猪多为隐性感染,可以持续向外排毒,成为该病的重要传染源[52]。PRV主要致病基因为gB、gE、gC等[53]。PRV主要通过呼吸道感染,病毒先在鼻咽部黏膜及扁桃体处大量繁殖,后经淋巴管扩散到局部淋巴结,经过神经通路到达嗅神经、舌咽神经和三叉神经,病毒在糖蛋白的作用下吸附于神经轴突末端并将囊膜蛋白和核衣壳释放到轴突胞质内,核衣壳进入细胞核,在相关酶和蛋白质的作用下,激活病毒早期基因,完成DNA和衣壳的复制,再经过高尔基体的加工和组装最终排出胞外。合成的核衣壳进入脊髓和脑部,引起神经细胞感染,导致脊髓和脑炎症,可引起舌、咽神经的麻痹。PRV可以经白细胞摄取进入血液循环到达身体各部位,特别是胎盘组织,侵入胎儿机体后可以造成死产或流产[54]。伪狂犬病病毒的转录因子能够调节病毒自身的基因表达和被侵染细胞的基因表达,从而有利于自身的繁殖[55]。有研究表明,大齿蛇提取出来的黄酮类化合物二氢杨梅素、桔梗多糖、三七多糖可以在体外抗PRV[56-57]。为开发新的抗PRV提供了新思路。但是大多数研究仅停留在体外研究水平,能否在体内实现抗PRV值得深入研究,以及不同中草药提取物按不同比例混合添加是否具有优于单种添加的抗PRV效果值得探究。
PRV基因株分为基因Ⅰ型和基因Ⅱ型,自2011年以来我国感染的主要是基因Ⅱ型及其变异株[53, 58]。目前防控伪狂犬病使用的疫苗有灭活疫苗、基因缺失疫苗、弱毒疫苗,一些基因工程疫苗还在研究中尚未大范围使用,如重组疫苗、亚单位疫苗及核酸疫苗[59],其中应用较多的是伪狂犬gE基因缺失疫苗。如今我国市场上流通的伪狂犬病疫苗较多,疫苗的选择应根据当地流行的伪狂犬病毒株选择合适的PRV疫苗,且选择后应基本稳定的使用同一种疫苗,避免几种疫苗混合使用,使PRV产生变异。因此制定合理的免疫程序,加强猪舍卫生清洁,提升落实生物安全防控措施,定期对猪群抗体进行抽检,以为猪场伪狂犬病净化提供调整基础显得尤为重要。
5.3 猪细小病毒感染猪细小病毒(porcine parvovirus,PPV)是引起母猪繁殖障碍的病原体之一。PPV的基因组为单股负链DNA。有非结构蛋白NS1、NS2、NS3和结构蛋白VP1、VP2等。VP2是病毒最主要的免疫原性蛋白,能够刺激机体产生免疫反应。妊娠母猪在不同阶段感染PPV表现出的症状不同:在妊娠初期(35 d前)感染,病毒可通过胎盘屏障由母体垂直传播给胎儿,导致胎儿死亡并在子宫内溶解吸收,此后母猪通常表现为反复发情和久配不孕;在妊娠中期(35~70 d)感染,易导致流产胎儿死亡,临床表现为产木乃伊胎儿和腐败胎儿;在妊娠后期(70 d后)感染,对母猪和胎儿影响较小,胎儿可存活,但多为弱仔,后期可能会导致死亡[60]。猪细小病毒流行病学特征主要是病毒在环境中的高度稳定性。
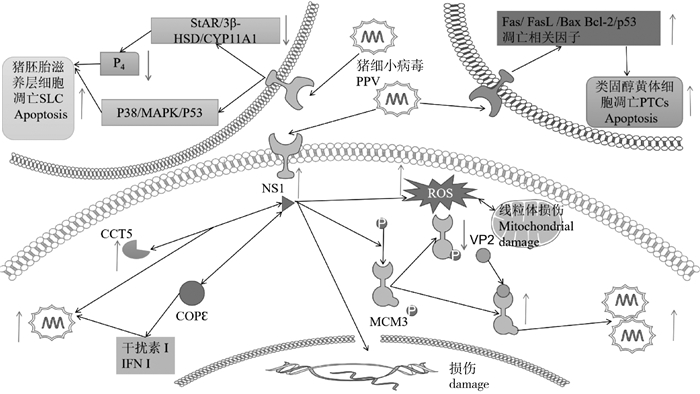
|
MCM3.微小染色体维持蛋白3;NS1.非结构蛋白1;VP2.结构蛋白VP2;COPε.衣壳蛋白COPε;ROS.活性氧基团; P38/MAPK/P53. P38/促分裂原活化蛋白激酶/P53信号通路; StAR/3β-HSD/CYP11A1.类固醇敏感调节蛋白/3β-羟基类固醇脱氢酶/胆固醇侧裂分解酶 MCM3. Minichromosome maintenance protein 3; NS1. Non-structural protein 1; VP2. Structural protein VP2; COPε. Coatomer protein COPε; ROS. Reactive oxygen species; P38/MAPK/P53. P38/mitogen-activated protein kinase/P58 signal pathway; StAR/3β-HSD/CYP11A1. Steroidogenic acute regulatory protein/3β-hydroxysteroid dehydrogenase/P450 cholesterol side-chain cleavage enzyme 图 1 PPV导致母猪繁殖障碍作用机制[61-67] Fig. 1 PPV mechanism of action leading to reproductive dysfunction in sows[61-67] |
MCM3是微小染色体维持蛋白3,参与调控微小染色体维持蛋白复合物的形成,并与DNA的复制起始点结合,影响细胞DNA的复制合成。有研究表明,PPV中结构蛋白VP2可以劫持MCM3促进自身复制[61]。NS1可以参与诱导细胞周期阻滞、细胞凋亡和组织损伤以及DNA受损,而且NS1可以与宿主蛋白CCT5相互结合,使得CCT5表达量增多NS1表达增多;以及与COPε相互作用调节Ⅰ型干扰素信号,从而促进PPV的复制[62-63]。Zhang等[64]研究表明PPV感染引起妊娠母猪的流产与PPV诱导的细胞凋亡有关,PPV诱导细胞凋亡主要由非结构蛋白NS1所致,是通过内部线粒体途径诱导细胞凋亡,且诱导细胞产生的ROS与细胞凋亡存在关系。猪胚胎滋养层细胞(PTCs)是PPV致病的主要靶细胞,PTCs的功能异常与繁殖障碍密切相关。有研究表明PPV通过调控Fas、FasL、Bax、Bcl-2和p53表达水平诱导胚胎滋养层细胞凋亡,进而导致胚胎死亡[65]。PPV感染可以导致母猪黄体组织受损,诱导黄体细胞产生核破碎和核固缩,抑制黄体细胞产生孕酮和诱导黄体细胞凋亡。PPV抑制孕酮的产生是通过抑制孕酮合成过程中关键蛋白类固醇敏感调节蛋白(StAR)及关键酶3β-羟基类固醇脱氢酶(3β-HSD)和胆固醇侧裂分解酶(CYP11A1)的表达来抑制孕酮产生以及激活P38、MAPK、P53等途径诱导类固醇黄体细胞(steroidogenic luteal cells,SLC)凋亡,减少孕酮的产生,进而导致流产和不孕等母猪繁殖障碍的产生[66-67]。Ma等[68]研究表明从蜂胶中提取出来的阿魏酸可以通过细胞凋亡抑制PPV的复制。现有的研究表明,PPV导致母猪繁殖障碍的靶点较多,靶点的筛选以及如何利用靶点来开发低成本的高效药物具有重要的研究价值。
猪细小病毒疫苗主要有灭活疫苗、弱毒疫苗、DNA疫苗等。目前PPV的防治只能够通过疫苗防治,对于猪场来说,选择合适的疫苗进行免疫至关重要。主要应用的是灭活疫苗和弱毒疫苗,各猪场应根据当地疫病流行情况选择合适的疫苗。
5.4 猪繁殖与呼吸综合征病毒感染猪繁殖与呼吸综合征(porcine reproductive and respiratory syndrome,PRRS)又称猪蓝耳病,是由猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)感染所致。蓝耳病的临床表现为妊娠母猪发热、厌食、呼吸困难,晚期出现流产、早产,怀孕母猪生殖衰竭,新生猪和生长猪轻型或重型呼吸道疾病和猪生长死亡率的增加。感染母猪可通过粪便、唾液、乳汁等方式向外排毒且排毒周期长[69]。研究表明,不同品种的猪对PRRSV适应能力不同,且通过使用PRRSV感染母猪的数据训练标记,在PRRS爆发期间改善生殖性能的基因组选择可能更准确[70]。
PRRSV到达子宫内膜结缔组织可能与通过子宫内膜血管迁移的血单核细胞有关,病毒复制通过凋亡和可能的继发性坏死导致局部感染细胞和周围细胞死亡,进而可能导致胎儿与胎盘发生脱离或细胞变性,引起胎儿死亡[71]。PRRSV感染妊娠母猪可使子宫内膜、胎盘、血管和子宫肌层出现炎症损伤,以及感染生殖组织使得血管内皮生长因子免疫标记强度降低,可能会改变母胎界面细胞中的细胞增殖和黏膜下的血管生成,从而影响到胎儿的生存能力[72-73]。PRRSV2感染后可以使封闭蛋白1、封闭蛋白4和紧密连接蛋白1的强度降低,紧密连接上皮通透性改变,病毒可能以细胞旁途径跨越母胎边界感染胎儿[74]。有关PRRSV影响猪生殖力的机制研究较少,其对母猪繁殖力的影响机制还需要进一步的研究。患蓝耳病的母猪在妊娠后期发生流产的潜在原因与病毒突破胎盘屏障相关。
我国目前对PRRSV的防控主要是靠疫苗,其疫苗种类有弱毒疫苗、灭活疫苗和基因工程疫苗等。由于PRRSV是RNA病毒致使它变异频繁、毒株多样,使得疫苗研发困难重重。目前减毒疫苗在我国应用广泛,但实际应用中出现的回复突变、毒力增强、毒株重组等现象令人担忧[75]。Jiang等[76]研究表明,在同一猪场中检测到3种不同的PPRSV,并将其与接种的减毒JXA1-P80疫苗进行基因序列分析,结果表明,三种PRRSV不完全相同,但都与JXA1-P80有很高的同源性,因此推断可能是减毒疫苗回复突变所致。接种疫苗的动物如果感染变异PRRSV,由于变异PRRSV与接种毒株基因差异较大,可以逃避免疫系统反应,变异PRRSV在体内的繁殖致使宿主患病[77]。PRRSV多变性、进化性以与宿主作用免疫逃逸性等一系列因素,使得它的致病性和免疫难以琢磨[78],因此研究PRRSV的免疫逃逸机制以及PRRSV复制分子调控机制对于PRRSV开发新的抗病毒策略至关重要。在进行疫苗接种时,要合理使用疫苗,避免产生病毒重组。如今基因编辑技术逐渐成熟,分子层面研究更加深入,是否可以找到PRRSV在母猪体内的结合受体,对其进行封闭或其基因进行基因编辑,值得深入研究探讨。
有研究表明,用泰山马尾松花粉多糖作为佐剂与疫苗联合接种,免疫猪体内抗体滴度显著增高,植物多糖是潜在的佐剂,具有免疫增强、免疫调节等功能[85-86],为新免疫佐剂的开发提供了新的方向,植物多糖本身具有的抗病和抗应激等能力,可能在一定程度上可以缓解被PRRSV感染猪只被细菌和亚病毒的感染风险。茶多酚可以在体外抑制PRRSV复制,并抑制NF-κB信号通路的激活,抑制PRRSV复制转录复合体的核心成分非结构蛋白2的合成[87]。角叉菜胶、熊果酸衍生物和双香豆素可以在体外抑制PRRSV[88-90]。芦荟提取物中的大黄素可以在体外抑制PRRSV感染,并通过激活TLR3发挥抗病毒作用[91]。由此可见,尽管中草药提取物中活性成分可以在体外抑制PRRSV,是否能够成为生产有效防止PRRSV的药物和疫苗佐剂还需要进行体内实验进一步验证,但为开发新的抗PRRSV药物提供了新思路。
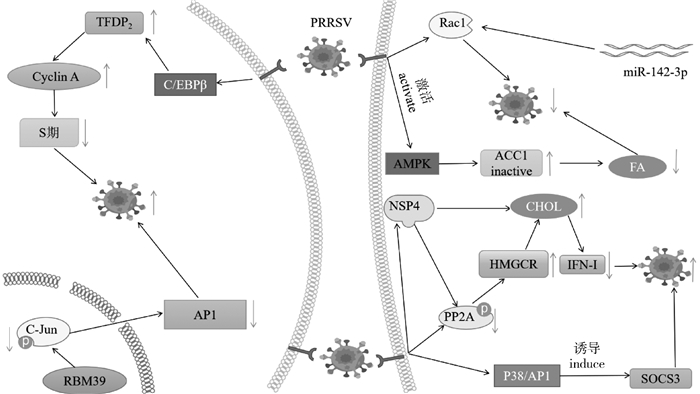
|
Rac1.Ras相关的C3肉毒毒素底物1;miR-142-3p.微小RNA-142-3P;AMPK.腺苷5-单磷酸活化蛋白激酶; ACC1.乙酰辅酶a羧化酶1;FA.脂肪酸; CHOL.胆固醇; SOCS.细胞因子信号传导抑制因子; PP2A.蛋白磷酸酶2;HMGCR.3-羟基-3-甲基戊二酰辅酶A还原酶; IFN1.干扰素1;P38/AP1.P38/蛋白激酶1;NSP4.非结构蛋白4;TFDP2.转录因子DP2;Cyclin A.细胞周期素A; C/EBPβ.转录因子C/EBPs家族成员; RBM39.RNA结合基序蛋白质39;C-Jun. c-Jun蛋白 Rac1. Ras-related C3 botulinum toxin substrate 1; miR-142-3p. microRNAs-142-3P; AMPK: Adenosines 5-monophosphate-activated protein kinase; ACC1. Acetyl-CoA carboxylase 1; FA. Fatty acid; CHOL. Cholesterol; SOCS. Suppressor of cytokine signaling; PP2A. Protein phosphatase 2; HMGCR. 3-hydroxy-3-methylglutaryl coenzyme A reductase; IFN1. Interferon1; P38/AP1. P38/activation protein-1; NSP4. Non-Structural protein 4; TFDP2. Transcription factor DP2; C/EBPβ. transcription factor C/EBPs family members; RBM39. RNA binding motif protein 39; C-Jun: C-Jun protein 图 2 PRRSV复制与抑制机制[79-84] Fig. 2 PRRSV replication and repression mechanisms[79-84] |
猪圆环病毒(porcine circovirus,PCV)为现在已知的最小的动物病毒,猪圆环病毒包括4种基因型(PCV 1~4),除PCV1(Porcine circovirus type1)外其他3种基因型均对猪有致病性,其中PCV2(porcine circovirus type2)与母猪繁殖障碍有关。PCV-2是一种封闭的环状单链DNA病毒。PCV2感染可致使母猪出现繁殖障碍,具体表现为返情率增加、妊娠阶段出现流产、产弱仔、死胎等[92]。PCV2可以通过母体垂直传递给胎儿,病毒在胎儿中复制轻则导致心肌炎、间质性肺炎等重则导致胎儿干尸化死亡。PCV2感染导致胚胎死亡率、断奶前死亡率等一系列繁殖障碍问题增加,受PCV2影响的生殖障碍通常由大量后备母猪组成,但是在PCV2血清型为阴性的猪场,PCV2也会影响经产母猪的繁殖性能[93-94]。
PCV2病毒通过受感染猪的呼吸道和口腔分泌物、尿液和粪便传播。PCV2可以通过其衣壳蛋白与细胞上病毒受体结合,因病毒附着受体有多种,因此对猪的多种组织和器官具有侵染性。有研究表明,不同品种的猪被PCV2的感染的几率不同,因此猪的基因可以影响PCV2对宿主的感染性[95]。PCV2感染母猪卵泡细胞数量和颗粒细胞数量减少,初级生长卵泡透明带瓦解,会引起无法正常排卵,导致繁殖障碍[96]。PCV2能够感染母猪黄体细胞并造成不同程度的损伤,且能够通过抑制StAR、3β-HSD、CYP11A1等类固醇合成酶的表达来降低母猪黄体细胞的孕酮水平,导致繁殖障碍[97]。有研究表明,三七总皂苷、牛蒡子素可以缓解被PCV2感染诱导的小鼠氧化应激,从而在一定程度上抑制PCV2的复制[98-99]。这为开发新的缓解PCV2感染所致的症状提供了新思路和中草药提取物应用前景。
PCV2除了具有PCV-2a和PCV-2b等基因型外,还具有IM1和IM2重组不稳定基因型,PCV2只有一种血清型,但有多种基因型。研究发现,PCV-2a疫苗对其它基因型存在交叉保护作用[100-101]。PCV2疫苗主要包括灭活疫苗、弱毒疫苗和基因工程疫苗等。PCV2可以和PRRSV、PPV等病毒共同感染,因此养殖场应该制定合理的免疫方案,提高生物安全意识。
6 展望近年来,越来越多的研究表明,母猪繁殖障碍主要由激素不平衡、炎症反应、代谢紊乱、繁殖器官受损、感染病原体、营养不良等因素引起。在实际生产中,准确鉴定出母猪繁殖障碍的病因存在一定的困难,因此需要从基础饲养管理避免此类问题的发生,对于母猪繁殖障碍应建立监测系统及行之有效的防控对策。细致全面地了解病原体对母猪生殖系统的损害机制,将有助于开发和改进治疗药物或疫苗。此外,针对母猪繁殖过程中的激素调节机制进行更加深入的研究,有助于了解繁殖基本规律,为提高母猪繁殖性能提供参考。总之,深入研究母猪繁殖障碍相关发病机制,有利于掌握母猪繁殖的机理和规律,最终为提高生产效益和保障食品安全做出更多积极贡献。
| [1] |
陈斌. 遗传原因造成种猪繁殖障碍的综合分析[J]. 猪业科学, 2014, 31(6): 46-48. CHEN B. Comprehensive analysis of genetic causes causing reproductive obstacles in breeding pigs[J]. Swine Industry Science, 2014, 31(6): 46-48. (in Chinese) |
| [2] |
杨利国. 动物繁殖学[M]. 3版. 北京: 中国农业出版社, 2019: 225-226. YANG L G. Animal reproduction[M]. 3rd ed. Beijing: China Agriculture Press, 2019: 225-226. (in Chinese) |
| [3] |
ŚWITOŃSKI M, JACKOWIAK H, GODYNICKI S, et al. Familial occurrence of pig intersexes (38, XX; SRY-negative) on a commercial fattening farm[J]. Anim Reprod Sci, 2002, 69(1-2): 117-124. DOI:10.1016/S0378-4320(01)00168-3 |
| [4] |
WANG H T, CHEN L, JIANG Y W, et al. Association of gene polymorphisms of estrogen receptor, follicle-stimulating hormone β and leptin with follicular cysts in Large White sows[J]. Theriogenology, 2017, 103: 143-148. DOI:10.1016/j.theriogenology.2017.03.030 |
| [5] |
WANG F G, CHEN L, CHEN S X, et al. Association of RBP-4 gene polymorphisms with follicular cysts in large white sows[J]. Reprod Domest Anim, 2019, 54(7): 972-978. DOI:10.1111/rda.13447 |
| [6] |
HE F P, LIU Y H, LI T, et al. MicroRNA-146 attenuates lipopolysaccharide induced ovarian dysfunction by inhibiting the TLR4/NF-κB signaling pathway[J]. Bioengineered, 2022, 13(5): 11611-11623. DOI:10.1080/21655979.2022.2070584 |
| [7] |
XIE F F, ZHANG J H, ZHAI M X, et al. Melatonin ameliorates ovarian dysfunction by regulating autophagy in PCOS via the PI3K-Akt pathway[J]. Reproduction, 2021, 162(1): 73-82. |
| [8] |
ZHANG W F, HENG J H, KIM S W, et al. Dietary enzymatically-treated Artemisia annua L. supplementation could alleviate oxidative injury and improve reproductive performance of sows reared under high ambient temperature[J]. J Therm Biol, 2020, 94: 102751. DOI:10.1016/j.jtherbio.2020.102751 |
| [9] |
杨薇. 猪舍温度对后备母猪培育的影响研究[D]. 重庆: 西南大学, 2020. YANG W. Study on the influence of pig house temperature on the gilts breeding[D]. Chongqing: Southwest University, 2020. (in Chinese) |
| [10] |
袁雄坤, 姜丽丽, 陶诗煜, 等. 母猪热应激敏感指标体系的研究进展[J]. 中国农业科学, 2020, 53(22): 4691-4699. YUAN X K, JIANG L L, TAO S Y, et al. Research progresses on sensitive index system of heat stress in sows[J]. Scientia Agricultura Sinica, 2020, 53(22): 4691-4699. (in Chinese) |
| [11] |
孙亚楠, 黄强, 岳隆耀, 等. 影响我国母猪繁殖性能的主要因素分析[J]. 猪业科学, 2019, 36(12): 104-107. SUN Y N, HUANG Q, YUE L Y, et al. Analysis of main factors affecting reproductive performance of Chinese sows[J]. Swine Industry Science, 2019, 36(12): 104-107. (in Chinese) |
| [12] |
BERTOLDO M J, HOLYOAKE P K, EVANS G, et al. Seasonal variation in the ovarian function of sows[J]. Reprod Fertil Dev, 2012, 24(6): 822-834. DOI:10.1071/RD11249 |
| [13] |
杨润泉, 方热军, 杨飞云, 等. 环境温湿度和猪舍空气质量对妊娠母猪生产性能的影响[J]. 家畜生态学报, 2016, 37(12): 40-43, 59. YANG R Q, FANG R J, YANG F Y, et al. Effect of environmental temperature, humidity, and air quality on performance of pregnant sows[J]. Journal of Domestic Animal Ecology, 2016, 37(12): 40-43, 59. (in Chinese) |
| [14] |
JOHNSTON L J, LI Y Z. Performance and well-being of sows housed in pens retrofitted from gestation stalls[J]. J Anim Sci, 2013, 91(12): 5937-5945. DOI:10.2527/jas.2013-6767 |
| [15] |
CHOE J, KIM S, CHO J H, et al. Effects of different gestation housing types on reproductive performance of sows[J]. Anim Sci J, 2018, 89(4): 722-726. DOI:10.1111/asj.12977 |
| [16] |
KOKETSU Y, IIDA R. Sow housing associated with reproductive performance in breeding herds[J]. Mol Reprod Dev, 2017, 84(9): 979-986. DOI:10.1002/mrd.22825 |
| [17] |
GAO D Y, CAO X X, REN H H, et al. Immunotoxicity and uterine transcriptome analysis of the effect of zearalenone (ZEA) in sows during the embryo attachment period[J]. Toxicol Lett, 2022, 357: 33-42. DOI:10.1016/j.toxlet.2021.12.017 |
| [18] |
ZHOU J C, ZHAO L H, HUANG S M, et al. Zearalenone toxicosis on reproduction as estrogen receptor selective modulator and alleviation of zearalenone biodegradative agent in pregnant sows[J]. J Anim Sci Biotechnol, 2022, 13(1): 36. DOI:10.1186/s40104-022-00686-3 |
| [19] |
WARET-SZKUTA A, LARRAILLET L, OSWALD I P, et al. Unusual acute neonatal mortality and sow agalactia linked with ergot alkaloid contamination of feed[J]. Porcine Health Manag, 2019, 5: 24. DOI:10.1186/s40813-019-0131-z |
| [20] |
SHIN K T, GUO J, NIU Y J, et al. The toxic effect of aflatoxin B1 on early porcine embryonic development[J]. Theriogenology, 2018, 118: 157-163. DOI:10.1016/j.theriogenology.2018.06.002 |
| [21] |
徐盛玉, 王定越, 吴德. 镰刀菌毒素对母猪繁殖性能的影响及其作用途径[J]. 动物营养学报, 2010, 22(1): 24-30. XU S Y, WANG D Y, WU D. Effects and action pathway of fusarium toxins on reproduction performance of sows[J]. Chinese Journal of Animal Nutrition, 2010, 22(1): 24-30. (in Chinese) |
| [22] |
LAN M, ZHANG Y, WAN X, et al. Melatonin ameliorates ochratoxin A-induced oxidative stress and apoptosis in porcine oocytes[J]. Environ Pollut, 2020, 256: 113374. DOI:10.1016/j.envpol.2019.113374 |
| [23] |
YANG X, LIU P L, CUI Y L, et al. Review of the reproductive toxicity of T-2 toxin[J]. J Agric Food Chem, 2020, 68(3): 727-734. DOI:10.1021/acs.jafc.9b07880 |
| [24] |
FANG L H, JIN Y H, JEONG J H, et al. Effects of dietary energy and protein levels on reproductive performance in gestating sows and growth of their progeny[J]. J Anim Sci Technol, 2019, 61(3): 154-162. DOI:10.5187/jast.2019.61.3.154 |
| [25] |
吴德, 林燕, 王亚. 母猪能量和蛋白质营养研究进展[J]. 动物营养学报, 2022, 34(10): 6167-6177. WU D, LIN Y, WANG Y. Research progress on energy and protein nutrition of sows[J]. Chinese Journal of Animal Nutrition, 2022, 34(10): 6167-6177. (in Chinese) |
| [26] |
王洁, 张龙林, 丁亚南, 等. 妊娠期日粮能量水平对母猪繁殖性能影响的研究进展[J]. 中国畜牧杂志, 2022, 58(4): 47-53. WANG J, ZHANG L L, DING Y N, et al. Advances in effects of dietary energy on reproductive performance of pregnant sow[J]. Chinese Journal of Animal Science, 2022, 58(4): 47-53. DOI:10.19556/j.0258-7033.20210305-07 (in Chinese) |
| [27] |
TIAN M, CHEN J M, LIU J X, et al. Dietary fiber and microbiota interaction regulates sow metabolism and reproductive performance[J]. Anim Nutr, 2020, 6(4): 397-403. DOI:10.1016/j.aninu.2020.10.001 |
| [28] |
LI Y, YANG M, ZHANG L J, et al. Dietary fiber supplementation in gestating sow diet improved fetal growth and placental development and function through serotonin signaling pathway[J]. Front Vet Sci, 2022, 9: 831703. DOI:10.3389/fvets.2022.831703 |
| [29] |
MEANS R T. Iron deficiency and iron deficiency anemia: implications and impact in pregnancy, fetal development, and early childhood parameters[J]. Nutrients, 2020, 12(2): 447. DOI:10.3390/nu12020447 |
| [30] |
张荣飞, 朴香淑. 母猪赖氨酸需要研究进展[J]. 中国畜牧杂志, 2011, 47(6): 65-68, 75. ZHANG R F, PU X S. Research progress on sow lysine is needed[J]. Chinese Journal of Animal Science, 2011, 47(6): 65-68, 75. (in Chinese) |
| [31] |
PINELLI-SAAVEDRA A. Vitamin E in immunity and reproductive performance in pigs[J]. Reprod Nutr Dev, 2003, 43(5): 397-408. DOI:10.1051/rnd:2003034 |
| [32] |
吴小玲, 石建凯, 张攀, 等. 硒对母猪繁殖性能的影响及其作用机制[J]. 动物营养学报, 2018, 30(2): 444-450. WU X L, SHI J K, ZHANG P, et al. Effects of selenium on reproductive performance of sows and its mechanism[J]. Chinese Journal of Animal Nutrition, 2018, 30(2): 444-450. (in Chinese) |
| [33] |
GARNER T B, HESTER J M, CAROTHERS A, et al. Role of zinc in female reproduction[J]. Biol Reprod, 2021, 104(5): 976-994. DOI:10.1093/biolre/ioab023 |
| [34] |
ZANG J J, CHEN J S, TIAN J, et al. Effects of magnesium on the performance of sows and their piglets[J]. J Anim Sci Biotechnol, 2014, 5(1): 39. DOI:10.1186/2049-1891-5-39 |
| [35] |
徐丽华, 苏菲, 余斌, 等. 2017—2020年浙江省猪主要病毒性传染病的流行病学调查与分析[J]. 中国兽医学报, 2022, 42(2): 223-229. XU L H, SU F, YU B, et al. Epidemiological investigation and analysis of main viral infectious diseases in pigs in Zhejiang province from 2017 to 2020[J]. Chinese Journal of Veterinary Science, 2022, 42(2): 223-229. DOI:10.16303/j.cnki.1005-4545.2022.02.04 (in Chinese) |
| [36] |
ZHOU H, PAN Y, LIU M D, et al. Prevalence of porcine pseudorabies virus and its coinfection rate in Heilongjiang Province in China from 2013 to 2018[J]. Viral Immunol, 2020, 33(8): 550-554. DOI:10.1089/vim.2020.0025 |
| [37] |
TANG Q W, GE L R, TAN S G, et al. Epidemiological survey of four reproductive disorder associated viruses of sows in Hunan Province during 2019-2021[J]. Vet Sci, 2022, 9(8): 425. DOI:10.3390/vetsci9080425 |
| [38] |
李洪宇, 陈华丽, 赵宝凯. 母猪子宫内膜炎治疗控制方案[J]. 黑龙江畜牧兽医, 2017(4): 134-136. LI H Y, CHEN H L, ZHAO B K. Treatment and control protocol for endometritis in sows[J]. Heilongjiang Animal Science and Veterinary Medicine, 2017(4): 134-136. DOI:10.13881/j.cnki.hljxmsy.2017.0323 (in Chinese) |
| [39] |
ZHANG L, WANG L K, DAI Y M, et al. Effect of sow intestinal flora on the formation of endometritis[J]. Front Vet Sci, 2021, 8: 663956. DOI:10.3389/fvets.2021.663956 |
| [40] |
KITAYA K, TAKEUCHI T, MIZUTA S, et al. Endometritis: new time, new concepts[J]. Fertil Steril, 2018, 110(3): 344-350. DOI:10.1016/j.fertnstert.2018.04.012 |
| [41] |
秦雪, 沙懿文, 杨梦豪, 等. 非编码RNA调控哺乳动物子宫内膜容受性和蜕膜化的研究进展[J]. 畜牧兽医学报, 2023, 54(4): 1347-1358. QIN X, SHA Y W, YANG M H, et al. Advances in regulation of non-coding RNA on mammalian endometrial receptivity and decidualization[J]. Acta Veterinaria et Zootechnica Sinica, 2023, 54(4): 1347-1358. (in Chinese) |
| [42] |
SINGH N, SETHI A. Endometritis-Diagnosis, Treatment and its impact on fertility-A Scoping Review[J]. JBRA Assist Reprod, 2022, 26(3): 538-546. |
| [43] |
PIRTEA P, CICINELLI E, DE NOLA R, et al. Endometrial causes of recurrent pregnancy losses: Endometriosis, adenomyosis, and chronic endometritis[J]. Fertil Steril, 2021, 115(3): 546-560. DOI:10.1016/j.fertnstert.2020.12.010 |
| [44] |
BRZOZOWSKA M, ROMANIEWICZ M, CAŁKA J, et al. Effects of substance P and neurokinin A on the contractile activity of inflamed porcine uterus[J]. Int J Mol Sci, 2022, 23(21): 13184. DOI:10.3390/ijms232113184 |
| [45] |
OLIVIERO C, HEINONEN M, VALROS A, et al. Environmental and sow-related factors affecting the duration of farrowing[J]. Anim Reprod Sci, 2010, 119(1-2): 85-91. DOI:10.1016/j.anireprosci.2009.12.009 |
| [46] |
YU X R, FU C S, CUI Z C, et al. Inulin and isomalto-oligosaccharide alleviate constipation and improve reproductive performance by modulating motility-related hormones, short-chain fatty acids, and feces microflora in pregnant sows[J]. J Anim Sci, 2021, 99(10): skab257. DOI:10.1093/jas/skab257 |
| [47] |
胡玥. 雌激素调节猪炎性子宫内膜细胞的分子机制[D]. 重庆: 西南大学, 2017. HU Y. Molecular mechanisms of estrogen regulating inflammatory endometrial cells in pigs[D]. Chongqing: Southwest University, 2017. (in Chinese) |
| [48] |
李洪宇, 陈华丽, 赵宝凯. 母猪子宫内膜炎治疗控制方案[C]//第六届全球猪业论坛暨第十六届(2019)中国猪业发展大会会刊. 武汉: 中国畜牧业协会, 2019: 221-225. LI H Y, CHEN H L, ZHAO B K. Treatment and control protocol for endometritis in sows[C]//Proceedings of the 6th Global Pig Industry Forum and the 16th (2019) China Pig Industry Development Conference. Wuhan: China Animal Agriculture Association, 2019: 221-225. (in Chinese) |
| [49] |
CANISSO I F, SEGABINAZZI L G T M, FEDORKA C E. Persistent breeding-induced endometritis in mares-A multifaceted challenge: from clinical aspects to immunopathogenesis and pathobiology[J]. Int J Mol Sci, 2020, 21(4): 1432. DOI:10.3390/ijms21041432 |
| [50] |
SCOGGIN C F. Endometritis: Nontraditional therapies[J]. Vet Clin North Am Equine Pract, 2016, 32(3): 499-511. DOI:10.1016/j.cveq.2016.08.002 |
| [51] |
WANG X Z, SONG X J, LIU C, et al. Active components and molecular mechanism of Syringa oblata Lindl. in the treatment of endometritis based on pharmacology network prediction[J]. Front Vet Sc, 2022, 9: 885952. DOI:10.3389/fvets.2022.885952 |
| [52] |
袁红, 练斯南, 张衡, 等. 新型猪伪狂犬病流行情况及净化措施[J]. 中国动物检疫, 2016, 33(3): 58-62. YUAN H, LIAN S N, ZHANG H, et al. The epidemic situation and purification measures of the new swine pseudorabies[J]. China Animal Health Inspection, 2016, 33(3): 58-62. DOI:10.3969/j.issn.1005-944X.2016.03.021 (in Chinese) |
| [53] |
孙颖, 王雪莹, 梁婉, 等. 2018年伪狂犬病病毒的流行特征及其遗传变异分析[J]. 畜牧兽医学报, 2020, 51(3): 584-593. SUN Y, WANG X Y, LIANG W, et al. Epidemiological and evolutionary characteristics of pseudorabies virus in China in 2018[J]. Acta Veterinaria et Zootechnica Sinica, 2020, 51(3): 584-593. (in Chinese) |
| [54] |
VERPOEST S, CAY B, FAVOREEL H, et al. Age-dependent differences in pseudorabies virus neuropathogenesis and associated cytokine expression[J]. J Virol, 2017, 91(2): e02058-16. |
| [55] |
许力士. 伪狂犬病毒GXLB-2015、GXGG-2016株gI/gE双基因缺失并表达EGFP株的构建及其生物学特性分析[D]. 南宁: 广西大学, 2019. XU L S. Construction of poseudorabies virus GXLB-2015, GXGG-2016 gI/gE gene deletin with EGFP expressing strain and its biological characteristics[D]. Nanning: Guangxi University, 2019. (in Chinese) |
| [56] |
HUAN C C, ZHOU Z Y, YAO J T, et al. The antiviral effect of panax notoginseng polysaccharides by inhibiting PRV adsorption and replication in vitro[J]. Molecules, 2022, 27(4): 1254. DOI:10.3390/molecules27041254 |
| [57] |
XING Y X, WANG L M, XU G L, et al. Platycodon grandiflorus polysaccharides inhibit Pseudorabies virus replication via downregulating virus-induced autophagy[J]. Res Vet Sci, 2021, 140: 18-25. DOI:10.1016/j.rvsc.2021.08.004 |
| [58] |
HU R M, WANG L Y, LIU Q Y, et al. Whole-genome sequence analysis of pseudorabies virus clinical isolates from pigs in China between 2012 and 2017 in China[J]. Viruses, 2021, 13(7): 1322. DOI:10.3390/v13071322 |
| [59] |
FREULING C M, MÜLLER T F, METTENLEITER T C. Vaccines against pseudorabies virus (PrV)[J]. Vet Microbiol, 2017, 206: 3-9. DOI:10.1016/j.vetmic.2016.11.019 |
| [60] |
张秀娟. 猪细小病毒及其非结构蛋白NS1和NS2诱导猪胎盘滋养层细胞自噬作用与机制研究[D]. 杨凌: 西北农林科技大学, 2020. ZHANG X J. The effects and mechanism of porcine placental trophoblast cell autophagy induced by porcine parvovirus and its non-structural proteins NS1 and NS2[D]. Yangling: Northwest A&F University, 2020. (in Chinese) |
| [61] |
邵婷. 猪细小病毒VP2劫持宿主蛋白MCM3促进自身复制机制研究[D]. 杨凌: 西北农林科技大学, 2021. SHAO T. The mechanism of porcine parvovirus VP2 promote own replication by hijacking host protein MCM3[D]. Yangling: Northwest A&F University, 2021. |
| [62] |
CHEN S B, CHEN N N, MIAO B C, et al. Coatomer protein COPε, a novel NS1-interacting protein, promotes the replication of porcine parvovirus via attenuation of the production of type Ⅰ interferon[J]. Vet Microbiol, 2021, 261: 109188. DOI:10.1016/j.vetmic.2021.109188 |
| [63] |
DU Q, ZHANG X Z, XU N, et al. Chaperonin CCT5 binding with porcine parvovirus NS1 promotes the interaction of NS1 and COPε to facilitate viral replication[J]. Vet Microbiol, 2022, 274: 109574. DOI:10.1016/j.vetmic.2022.109574 |
| [64] |
ZHANG J L, FAN J H, LI Y, et al. Porcine parvovirus infection causes pig placenta tissue damage involving nonstructural protein 1 (NS1)-induced intrinsic ROS/mitochondria-mediated apoptosis[J]. Viruses, 2019, 11(4): 389. DOI:10.3390/v11040389 |
| [65] |
张洪玲. 猪细小病毒诱导猪胎盘滋养层细胞凋亡信号转导通路研究[D]. 杨凌: 西北农林科技大学, 2016. ZHANG H L. Signal transduction pathways of apoptosis induced by PPV infection in porcine placenta trophoblast cells[D]. Yangling: Northwest A&F University, 2016. (in Chinese) |
| [66] |
张樑. 猪细小病毒诱导猪黄体细胞凋亡及抑制孕酮产生机制研究[D]. 杨凌: 西北农林科技大学, 2018. ZHANG L. Mechanisms on porcine luteal cells apoptosis and inhibition of progestrone production induced by porcine parvovirus[D]. Yangling: Northwest A&F University, 2018. (in Chinese) |
| [67] |
ZHANG L, WANG Z Y, ZHANG J, et al. Porcine parvovirus infection impairs progesterone production in luteal cells through mitogen-activated protein kinases, p53, and mitochondria-mediated apoptosis[J]. Biol Reprod, 2018, 98(4): 558-569. DOI:10.1093/biolre/ioy014 |
| [68] |
MA X, GUO Z H, ZHANG Z Q, et al. Ferulic acid isolated from propolis inhibits porcine parvovirus replication potentially through Bid-mediate apoptosis[J]. Int Immunopharmacol, 2020, 83: 106379. DOI:10.1016/j.intimp.2020.106379 |
| [69] |
RAHE M C, MURTAUGH M P. Mechanisms of adaptive immunity to porcine reproductive and respiratory syndrome virus[J]. Viruses, 2017, 9(6): 148. DOI:10.3390/v9060148 |
| [70] |
HICKMANN F M W, BRACCINI NETO J, KRAMER L M, et al. Host genetics of response to porcine reproductive and respiratory syndrome in sows: reproductive performance[J]. Front Genet, 2021, 12: 707870. DOI:10.3389/fgene.2021.707870 |
| [71] |
LUNNEY J K, FANG Y, LADINIG A, et al. Porcine reproductive and respiratory syndrome virus (PRRSV): pathogenesis and interaction with the immune system[J]. Annu Rev Anim Biosci, 2016, 4: 129-154. DOI:10.1146/annurev-animal-022114-111025 |
| [72] |
NOVAKOVIC P, DETMER S E, SULEMAN M, et al. Histologic changes associated with placental separation in gilts infected with porcine reproductive and respiratory syndrome virus[J]. Vet Pathol, 2018, 55(4): 521-530. DOI:10.1177/0300985818765067 |
| [73] |
BARRERA-ZARATE J A, DETMER S E, PASTERNAK J A, et al. Effect of porcine reproductive and respiratory syndrome virus 2 on angiogenesis and cell proliferation at the maternal-fetal interface[J]. Vet Pathol, 2022, 59(6): 940-949. DOI:10.1177/03009858221105053 |
| [74] |
GUIDONI P B, PASTERNAK J A, HAMONIC G, et al. Decreased tight junction protein intensity in the placenta of porcine reproductive and respiratory syndrome virus-2 infected fetuses[J]. Placenta, 2021, 112: 153-161. DOI:10.1016/j.placenta.2021.07.300 |
| [75] |
杨汉春, 周磊. 猪繁殖与呼吸综合征病毒的遗传变异与演化[J]. 生命科学, 2016, 28(3): 325-336. YANG H C, ZHOU L. Genetic variation and evolution of porcine reproductive and respiratory syndrome virus[J]. Chinese Bulletin of Life Sciences, 2016, 28(3): 325-336. (in Chinese) |
| [76] |
JIANG Y F, XIA T Q, ZHOU Y J, et al. Characterization of three porcine reproductive and respiratory syndrome virus isolates from a single swine farm bearing strong homology to a vaccine strain[J]. Vet Microbiol, 2015, 179(3-4): 242-249. DOI:10.1016/j.vetmic.2015.06.015 |
| [77] |
RAHE M C, MURTAUGH M P. Mechanisms of adaptive immunity to porcine reproductive and respiratory syndrome virus[J]. Viruses, 2017, 9(6): 148. DOI:10.3390/v9060148 |
| [78] |
BAI W J, WANG Z J, SUN P, et al. The molecular characteristic analysis of PRRSV GSWW/2015 strain and its pathogenicity to pigs[J]. BMC Vet Res, 2018, 14(1): 240. DOI:10.1186/s12917-018-1548-3 |
| [79] |
YAO Y, ZHANG X, LI S H, et al. miR-142-3p suppresses porcine reproductive and respiratory syndrome virus (PRRSV) infection by directly targeting Rac1[J]. Vet Microbiol, 2022, 269: 109434. DOI:10.1016/j.vetmic.2022.109434 |
| [80] |
LONG S W, ZHOU Y R, BAI D C, et al. Fatty acids regulate porcine reproductive and respiratory syndrome virus infection via the AMPK-ACC1 signaling pathway[J]. Viruses, 2019, 11(12): 1145. DOI:10.3390/v11121145 |
| [81] |
LUO X G, CHEN X X, QIAO S L, et al. Porcine reproductive and respiratory syndrome virus increases SOCS3 production via activation of p38/AP-1 signaling pathway to promote viral replication[J]. Vet Microbiol, 2021, 257: 109075. |
| [82] |
KE W T, ZHOU Y R, LAI Y N, et al. Porcine reproductive and respiratory syndrome virus nsp4 positively regulates cellular cholesterol to inhibit type Ⅰ interferon production[J]. Redox Biol, 2022, 49: 102207. |
| [83] |
ZHU M, LI X Y, SUN R Q, et al. The C/EBPβ-dependent induction of TFDP2 facilitates porcine reproductive and respiratory syndrome virus proliferation[J]. Virol Sin, 2021, 36(6): 1341-1351. |
| [84] |
SONG Y N, GUO Y Y, LI X Y, et al. RBM39 alters phosphorylation of c-Jun and binds to viral RNA to promote PRRSV proliferation[J]. Front Immunol, 2021, 12: 664417. |
| [85] |
PENG J, YUAN Y M, DU Y J, et al. Potentiation of Taishan Pinus massoniana pollen polysaccharide on the immune response and protection elicited by a highly pathogenic porcine reproductive and respiratory syndrome virus glycoprotein 5 subunit in pigs[J]. Mol Cell Probes, 2016, 30(2): 83-92. |
| [86] |
刘杰, 李柏珍, 伍树松, 等. 枸杞多糖的生理功能及其在动物生产中的应用[J]. 动物营养学报, 2023, 35(4): 2129-2142. LIU J, LI B Z, WU S S, et al. Physiological functions of Lycium barbarum polysaccharide and its application in animal production[J]. Chinese Journal of Animal Nutrition, 2023, 35(4): 2129-2142. (in Chinese) |
| [87] |
WANG X, DONG W J, ZHANG X X, et al. Antiviral mechanism of tea polyphenols against porcine reproductive and respiratory syndrome virus[J]. Pathogens, 2021, 10(2): 202. |
| [88] |
GUO C H, ZHU Z B, YU P, et al. Inhibitory effect of iota-carrageenan on porcine reproductive and respiratory syndrome virus in vitro[J]. Antivir Ther, 2019, 24(4): 261-270. |
| [89] |
CHEN Y, LI H, WU L, et al. Ursolic acid derivatives are potent inhibitors against porcine reproductive and respiratory syndrome virus[J]. RSC Adv, 2020, 10(38): 22783-22796. |
| [90] |
李倬伟, 王方, 王君君, 等. 双香豆素对猪繁殖与呼吸综合征病毒的体外抑制作用[J]. 畜牧兽医学报, 2023, 54(3): 1160-1168. LI Z W, WANG F, WANG J J, et al. Inhibitory effect of dicumarol on highly pathogenic porcine reproductive and respiratory syndrome virus in vitro[J]. Acta Veterinaria et Zootechnica Sinica, 2023, 54(3): 1160-1168. (in Chinese) |
| [91] |
XU Z C, HUANG M Y, XIA Y B, et al. Emodin from Aloe inhibits Porcine reproductive and Respiratory syndrome virus via toll-like receptor 3 activation[J]. Viruses, 2021, 13(7): 1243. |
| [92] |
吕其壮. 猪圆环病毒2型ORF5蛋白功能分析和ORF4蛋白拮抗细胞凋亡机制研究[D]. 杨凌: 西北农林科技大学, 2016. LV Q Z. Functional analysis of putative ORF5 protein of porcine circovirus type 2 and antiapoptotic mechanism of viral ORF4 protein[D]. Yangling: Northwest A&F University, 2016. (in Chinese) |
| [93] |
PENSAERT M B, SANCHEZ R E Jr, LADEKJÆR-MIKKELSEN A S, et al. Viremia and effect of fetal infection with porcine viruses with special reference to porcine circovirus 2 infection[J]. Vet Microbiol, 2004, 98(2): 175-183. |
| [94] |
MAK C K, YANG C, JENG C R, et al. Reproductive failure associated with coinfection of porcine circovirus type 2 and porcine reproductive and respiratory syndrome virus[J]. Can Vet J, 2018, 59(5): 525-530. |
| [95] |
MENG X J. Porcine circovirus type 2 (PCV2): pathogenesis and interaction with the immune system[J]. Annu Rev Anim Biosci, 2013, 1: 43-64. |
| [96] |
孙庆帅, 陈燕虹, 姚伦, 等. 猪圆环病毒2型和3型混合感染引起的母猪繁殖障碍诊治[J]. 中国畜牧兽医, 2022, 49(10): 3982-3993. SUN Q S, CHEN Y H, YAO L, et al. Diagnosis and treatment of reproductive disorders in sows caused by co-infection of PCV2 and PCV3[J]. China Animal Husbandry & Veterinary Medicine, 2022, 49(10): 3982-3993. (in Chinese) |
| [97] |
李川. 猪圆环病毒2型对猪黄体细胞的损伤及其机制研究[D]. 长沙: 湖南农业大学, 2021. LI C. Damage of porcine circovirus type 2 to porcine luteal cells and the mechanism[D]. Changsha: Hunan Agricultural University, 2021. (in Chinese) |
| [98] |
CAO M X, WANG X R, HU W Y, et al. Regulatory effect of Panax notoginseng saponins on the oxidative stress and histone acetylation induced by porcine circovirus type 2[J]. J Vet Med Sci, 2022, 84(4): 600-609. |
| [99] |
WU L J, CHEN J, ZHOU D N, et al. Anti-inflammatory activity of arctigenin against PCV2 infection in a mouse model[J]. Vet Med Sci, 2022, 8(2): 700-709. |
| [100] |
FRANZO G, SEGALÉS J. Porcine circovirus 2 genotypes, immunity and vaccines: multiple genotypes but one single serotype[J]. Pathogens, 2020, 9(12): 1049. |
| [101] |
WANG H J, GU J Y, XING G, et al. Genetic diversity of porcine circovirus type 2 in China between 1999-2017[J]. Transbound Emerg Dis, 2019, 66(1): 599-605. |
(编辑 郭云雁)



