2. 江西农业大学动物科学技术学院,南昌 330095
2. College of Animal Science and Technology of Jiangxi Agricultural University, Nanchang 330095, China
2013年我国发生了H7N9禽流感,该病毒会致家禽死亡,随着研发疫苗的投入使用,禽流感病毒才慢慢得到控制[1]。屠宰冷藏后的冰鲜鸡成为一种销售趋势,冰鲜鸡因其“规模养殖、集中屠宰、冷链配送、生鲜上市”的安全健康的生产售卖方式得到了广大消费者的喜爱[2]。消费者从之前购买活鸡时看羽毛色泽转向了购买冰鲜鸡时看胴体包装性状。皮肤紧凑不松散,肤色鲜嫩,毛孔细而密的冰鲜鸡更容易引起消费者的购买欲[3]。近年来的研究多集中于鸡皮肤嫩度、皮肤色泽方面,但在鸡胴体性状,如皮肤毛孔等方面的研究比较少,因此冰鲜鸡良好的胴体包装性状还需投入更多的研究。
毛囊生成毛孔,毛囊是皮肤一个复杂的微型器官,由真皮细胞和上皮细胞信号分子互相作用发育而来[4]。皮肤毛囊的形成在个体的一生中只发生一次,并且形成于胚胎期,其数量在这时已经固定,之后通常不会再增加[5]。研究表明,鸡皮肤毛囊分为两种类型,初级毛囊(primary hair follicle,PF)和次级毛囊(secondary hair follicle,SF)[6]。黄羽肉鸡在胚胎期E7-E9的表皮基板出现在真皮凝结的上方,皮肤出现突起,在E10-E11开始出现前后端伸长不对称的羽芽,在E12时表皮内陷形成PF,到E15时,PF密度达到最大,并且出现SF,SF密度开始增大[7]。研究表明,PF和SF互不干扰独立生长[8]。然而,在某些特殊的情况下,毛囊再增加或减少的情况是有可能的。在成熟鹿再次新生的鹿角上,新生的皮肤会长出新的毛囊[9]。毛囊发育会经历3个阶段的周期性循环,即快速增长的生长期、细胞凋亡驱动的退化期以及相对静止期[10-11]。毛囊的形态发生涉及到多条通路,依赖于Wnt(wnt signaling pathway)信号通路、β-连环蛋白(β-catenin)、SHH信号通路(sonic hedgehog signaling pathway)、NOTCH信号通路(notch signaling pathway)和骨形态发生蛋白(bone morphogenetic protein,BMP)等,这些通路的信号分子在上皮细胞和真皮细胞之间相互作用[12-13]。Wnt3a是Wnt家族具有代表性的一种分泌蛋白,位于鸡的2号染色体上,主要通过促进β-catenin的积累,激活经典的Wnt/β-catenin信号通路,从而诱导皮肤毛囊的生长发育[14]。研究发现,Wnt3a基因还可以通过激活Wnt/β-catenin信号通路促进皮肤黑色素形成[15]。Wnt3a基因缺失会使神经嵴细胞凋亡,导致皮肤生成黑色素的功能丧失[16]。单核苷酸多态性(single nucleotide poly-morphism,SNP)是在基因组上由单个核苷酸变异引起的DNA序列多态性,是DNA分子标记技术的一种[17]。研究发现,Wnt3a基因的SNPs位点与花山麻鸡皮肤毛囊密度具有相关性,表明Wnt3a基因是诱导鸡皮肤毛囊发育的关键调控因子,是影响鸡皮肤毛囊生长发育的重要候选基因[18]。目前,分子标记技术在家禽优质胴体如鸡肤色和屠宰性能等研究中应用较广泛。研究发现,醛脱氢酶1家族成员A3(aldehyde dehydrogenase family 1 member A3,ALDH1A3)基因SNP位点与鸡肤色具有显著相关性,g.703 T>C位点CC基因型个体屠宰后肩部皮肤黄度大于CT和TT基因型个体,表明ALDH1A3基因可以作为鸡肤色性状的候选基因,有分子育种的潜能[19]。对商品化松鸡品系的G0S2(G0/G1 switch gene 2)基因进行克隆和测序,研究发现鸡G0S2基因的g.102 G>A位点AA和AG基因型个体的活重和腹脂重均高于GG基因型个体,该位点与鸡活重和腹脂重显著相关[20]。研究还发现,前黑素浓缩激素(pro melanin concentrating hormone,PMCH)基因中有7个SNPs,其中c.81 A>T位点与鸡腿部剪切力和胸部剪切力显著相关[21]。鸡皮肤毛孔作为冰鲜鸡胴体性状的评价指标之一具有重要的经济价值。皮肤毛孔数量变异度为52.35,遗传力为0.723,具有高遗传力,表明环境对皮肤毛孔数量性状影响较小[22]。Wnt3a基因是调控鸡皮肤毛囊生长发育的重要因子,基于DNA分子标记技术能够发现Wnt3a基因中某个核苷酸的变异,有助于了解它的遗传变异能力,可以通过基因分型来筛选优质毛囊密度性状个体进而进行辅助选择育种。那么Wnt3a基因多态性与崇仁麻鸡的皮肤毛囊密度性状是否具有相关性?筛选检测到的SNPs位点在崇仁麻鸡皮肤毛囊性状中究竟有着怎样的影响?因此,本试验以崇仁麻鸡为研究对象,探究鸡皮肤毛囊密度性状与Wnt3a基因多态位点的相关性,筛选出能提高皮肤毛囊密度的分子标记,为之后进一步进行鸡皮肤毛囊分子育种研究提供理论参考。
1 材料与方法 1.1 试验动物及样品采集试验动物崇仁麻鸡来自江西省抚州市崇仁县崇仁麻鸡原种场的原种和B系,B系是原种和快大白羽肉鸡杂交后再横交固定。随机选取体重相近且健康的崇仁麻鸡原种母鸡200只和公鸡100只以及B系母鸡200只和公鸡100只。每只鸡右脚戴上脚号并记录,用加了抗凝剂的采血管在鸡翅静脉采血1 mL写上编号后放于-20 ℃冰箱中冷冻保存,用于DNA的提取。屠宰拔毛后,在每只鸡的背部、胸部、大腿部相同的位置2 cm×2 cm面积内测量皮肤毛囊密度并采集两份皮肤毛囊样品,一份样品装入中性多聚甲醛固定液中常温避光保存,用于制作毛囊切片,测量毛囊直径和皮肤厚度,另一份样品装入冻存管迅速置于液氮速冻,并放入-80 ℃冰箱保存,用于RNA的提取。
1.2 主要试剂和仪器血液基因组柱式小量提取试剂盒(CW2087M)、2xEs Taq MasterMix(CW0690H)、超纯RNA提取试剂盒(CW0581M)均购自江苏康为世纪生物科技股份有限公司,FastKing cDNA第一链合成试剂盒(KR116)、SuperReal荧光定量预混试剂增强版(SYBR Green)(FP205)均购自北京天根生化科技有限公司。高速冷冻离心机(Neofuge 15R)、基因扩增仪(MGL96G)、三用恒温水箱(HH-W600)、电泳仪电源(DYY-4C)、罗氏LightCycler96实时荧光定量PCR仪、多样品组织研磨仪(TissueLyser-24)等。
1.3 毛囊性状的测定毛囊密度的测定:在每只鸡背部、胸部和大腿部皮肤相同位置2 cm×2 cm面积内数毛孔个数并计算密度(个·cm-2)。
毛囊直径和皮肤厚度的测定:将样品送往江西爱思博生物科技服务有限公司制作HE染色切片,并用电子显微镜观察切片,测量皮肤厚度(μm)和毛囊直径(μm),每个样本测3个毛囊取平均值。
1.4 引物的设计与合成如表 1所示,引物根据NCBI数据库中Wnt3a基因序列(登录号:NC_052533)来设计,根据相关研究[18]与皮肤毛囊性状相关的位点设计3对引物,分别来自于第二外显子、第三外显子和第三内含子。如表 2所示,根据NCBI数据库中Wnt3a和内参β-actin相关mRNA序列设计实时荧光定量引物。均由上海生工生物工程股份有限公司对引物进行合成。
|
|
表 1 Wnt3a基因SNP位点引物序列 Table 1 The primer sequences for SNP loci of Wnt3a gene |
|
|
表 2 Wnt3a基因实时荧光定量引物 Table 2 The real-time fluorescent quantitative primers for Wnt3a gene |
按照血液基因组柱式小量提取试剂盒步骤提取DNA,用电泳和紫外分光光度计检测其纯度和浓度,以质检合格的DNA为模板进行PCR扩增。PCR反应体系为20 μL:2×Es Taq MasterMix 10 μL,上游引物1 μL,下游引物1 μL,DNA模板1 μL,双蒸水7 μL。反应程序为:预变性94 ℃持续2 min;变性94 ℃持续30 s,退火60 ℃持续30 s,延伸72 ℃持续30 s,35个循环;终延伸72 ℃持续2 min。扩增后的PCR产物以2%浓度的琼脂糖凝胶进行电泳检测,120 V,80 mA,15 min跑胶,再送至上海生工生物工程股份有限公司进行基因测序。测序后先用BioEdit(7.0.5.3)软件进行序列比对,再用Chromas(2.6.5)软件查看峰图对突变位点进行筛选。
1.6 总RNA的提取和实时荧光定量PCR按照超纯RNA提取试剂盒步骤提取RNA,对提取的总RNA进行2%的凝胶电泳检测,再用紫外分光光度计对纯度和浓度进行检测,质检合格的总RNA按照反转录试剂盒合成第一链cDNA。按照SYBR Green 1试剂进行Real Time PCR,优化荧光实时定量PCR的反应条件,确定反应体系为20 μL:2×SuperReal PreMix Plus 10 μL, 正向引物0.6 μL,反向引物0.6 μL,cDNA模板1 μL,RNase-free ddH2O 7.8 μL。每个样本和内参都设置3个重复。采用两步法PCR反应程序进行反应:预变性95 ℃持续15 min,循环1次;PCR反应时变性95 ℃持续10 s,退火/延伸60 ℃持续30 s,循环40次;之后是熔解曲线95 ℃持续10 s,65 ℃持续60 s,97 ℃持续1 s。
1.7 统计分析试验数据采用SPSS22.0软件独立样本t检验进行显著性分析,以“平均值±标准差”表示,P < 0.05表示差异显著,P < 0.01表示差异极显著,P>0.05表示差异不显著。
找到SNPs位点后,统计各位点的基因型、基因型频率、等位基因频率、杂合度(He)、有效等位基因数(Ne)和多态信息含量(PIC)。再采用SPSS22.0软件进行卡方检验(X2)来验证Hardy-Weinberg遗传平衡。采用广义线性模型对毛囊密度和基因相关位点进行分析,数学模型为:Yij=μ+Gi+eij,其中Yij为性状观测值,μ为总体均数,Gi为基因型效应,eij为随机误差,不同基因型性状间的差异用Duncan法进行多重比较,最终以“平均数±标准差”表示。
实时荧光定量PCR采用公式2-ΔΔct计算原种和B系Wnt3a基因的mRNA相对表达量,用SPSS22.0软件进行独立样本t检验分析,最后结果用GraphPad 5.0绘图表示。
2 结果 2.1 崇仁麻鸡皮肤毛囊形态结构及性状的测定2.1.1 毛囊的类型和结构 如图 1所示,鸡皮肤毛囊分为初级毛囊(PF)和次级毛囊(SF)两种类型。初级毛囊较次级毛囊发育早,且两种类型的毛囊生长发育互不干扰,独立存在[23]。毛囊由外到内主要的结构是:结缔组织鞘、毛囊壁、外根鞘、内根鞘、真皮乳头和羽枝嵴。羽枝嵴最后会形成脊柱,即羽毛的主干部分[24]。
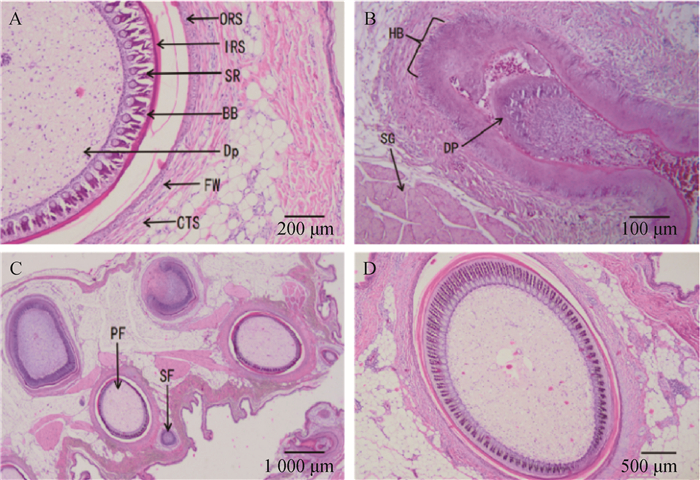
|
A.毛囊结构(横切100×):ORS. 外根鞘;IRS. 内根鞘;SR. 羽轴嵴;BB. 羽小枝;Dp. 真皮髓;FW. 毛囊壁;CTS. 结缔组织鞘。B.毛囊结构(纵切100×):HB. 毛球;DP. 真皮乳头;SG. 皮脂腺。C.毛囊类型(横切20×):PF. 初级毛囊;SF. 次级毛囊。D.初级毛囊(横切40×) A. Hair follicle structure (cross cut 100×): ORS. Outer root sheath; IRS. Internal root sheath; SR. Scapus ridge; BB. Barbules; Dp. Dermal pulp; FW. Follicle wall; CTS. Connective tissue sheath. B. Hair follicle structure (longitudinal cut 100×): HB. Hair bulb; DP. Dermal papillae; SG. Sebaceous gland. C. Hair follicle type (cross cut 20×): PF. Primary hair follicle; SF. Secondary hair follicles. D. Primary hair follicles (cross cut 40×) 图 1 鸡毛囊HE染色 Fig. 1 HE staining of chicken hair follicles |
2.1.2 毛囊密度、直径和皮肤厚度的测定 在崇仁麻鸡原种和B系中,分别在背部、胸部和大腿部各部位相同位置测量毛囊密度、毛囊直径和皮肤厚度。结果见表 3。
|
|
表 3 鸡皮肤毛囊性状测定 Table 3 Determination of skin hair follicle traits in chicken |
2.2.1 Wnt3a基因SNP位点的筛选 在崇仁麻鸡原种和B系公、母鸡中均发现了3个突变位点及多种基因型。如图 2所示,在第2外显子发现了1个SNP位点g.2587569,发生G>A突变,只有两种基因型GG和AG。如图 3所示,在第3外显子发现了1个SNP位点g.2555812,发生T>C突变,有3种基因型CC、TT、CT。如图 4所示,在第3内含子上发现了1个SNP位点g.2555377,发生T>C突变,有3种基因型CC、TT、CT。
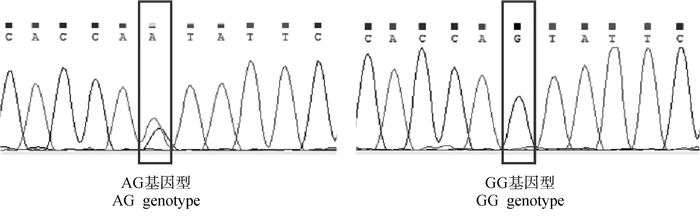
|
图 2 鸡Wnt3a基因第2外显子不同基因型测序峰图 Fig. 2 Sequencing peak of different genotypes in exon 2 of chicken Wnt3a gene |
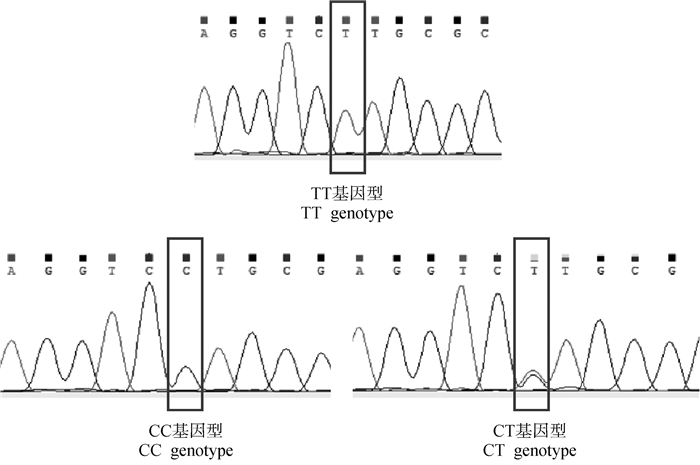
|
图 3 鸡Wnt3a基因第3外显子不同基因型测序峰图 Fig. 3 Sequencing peak of different genotypes in exon 3 of chicken Wnt3a gene |
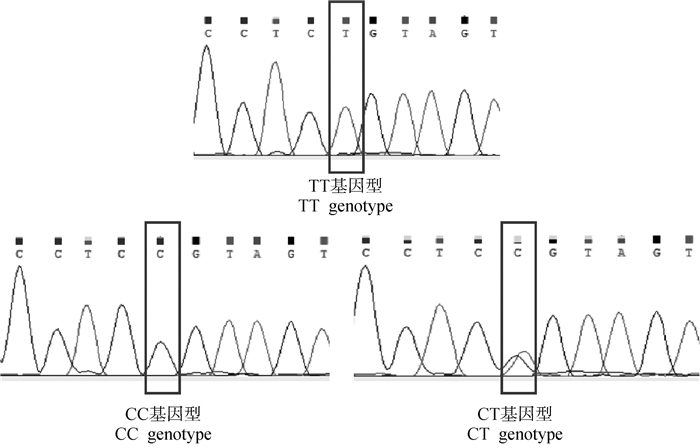
|
图 4 鸡Wnt3a基因第3内含子不同基因型测序峰图 Fig. 4 Sequencing peak of different genotypes in intron 3 of chicken Wnt3a gene |
2.2.2 哈迪-温伯格平衡检验 用卡方检验法来验证Hardy-Weinberg平衡检验是否符合遗传定律。如表 4所示,崇仁麻鸡原种和B系的公、母鸡Wnt3a基因3个SNPs位点基因型分布的实际观测值和理论观测值都无显著差异(P>0.05),因此符合遗传定律,可以进行下一步分析。
|
|
表 4 Wnt3a基因SNP位点的Hardy-Weinberg平衡检验 Table 4 Hardy-Weinberg equilibrium test for SNP loci of Wnt3a gene |
2.2.3 Wnt3a基因各SNP位点遗传参数 如表 5所示,在原种中,Wnt3a基因的g.2587569 G>A位点GG是优势基因型,G为优势等位基因;g.2555812 T>C位点CC是优势基因型,C为优势等位基因;g.2555377 T>C位点CT是优势基因型,C为优势等位基因。g.2587569 G>A位点是低度多态,PIC < 0.25;g.2555812 T>C位点是中度多态位点,0.25 < PIC < 0.5;g.2555377 T>C位点是高度多态位点,PIC>0.5。如表 6所示,在B系中,Wnt3a基因的g.2587569 G>A位点GG是优势基因型,G为优势等位基因;g.2555812 T>C位点CC和CT均是优势基因型,C为优势等位基因;g.2555377 T>C位点CT是优势基因型,T为优势等位基因。g.2587569 G>A位点是低度多态,PIC < 0.25;g.2555812 T>C和g.2555377 T>C位点都是高度多态,PIC>0.5。
|
|
表 5 原种Wnt3a基因SNP位点遗传参数 Table 5 Genetic parameters of SNP loci of protospecies Wnt3a gene |
|
|
表 6 B系Wnt3a基因各SNP位点遗传参数 Table 6 Genetic parameters of each SNP loci of B strain Wnt3a gene |
2.2.4 Wnt3a基因SNP位点和崇仁麻鸡皮肤毛囊密度相关性 如表 7所示,在原种母鸡中,g.2555812 T>C和g.2555377 T>C位点CC基因型个体背部皮肤毛囊密度显著高于CT基因型个体(P < 0.05)。在公鸡中,g.2555812 T>C位点CC基因型个体背部毛囊密度显著高于其他两种基因型个体(P < 0.05),g.2555377 T>C位点CC基因型个体背部毛囊密度显著高于CT基因型个体(P < 0.05)。如表 8所示,在B系中,g.2555812 T>C位点在母鸡和公鸡的CC基因型个体背部毛囊密度显著高于其他两种基因型个体(P < 0.05),g.2555377 T>C位点在母鸡中CC基因型个体背部毛囊密度显著高于CT基因型个体(P < 0.05),在公鸡中CC基因型个体背部毛囊密度显著高于其他两个基因型个体(P < 0.05)。
|
|
表 7 Wnt3a基因SNPs位点基因型与原种鸡各部位皮肤毛囊密度相关性分析 Table 7 Correlation analysis of Wnt3a gene SNPs loci genotypes with skin hair follicle density in different parts of protospecies |
|
|
表 8 Wnt3a基因SNP位点基因型与B系鸡各部位皮肤毛囊密度相关性分析 Table 8 Correlation analysis of Wnt3a SNP loci genotypes with skin hair follicle density in various parts of B strain |
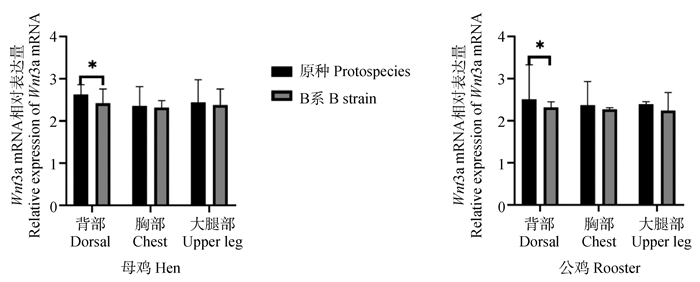
如图 5所示,Wnt3a基因在崇仁麻鸡原种和B系的背部、胸部和大腿部皮肤中均有表达,且表达量比较高。同性别相比较,Wnt3a基因在原种背部皮肤毛囊中的表达量显著高于在B系背部皮肤毛囊中的表达量(P < 0.05)。Wnt3a基因在原种和B系公、母鸡的胸部和大腿部表达量无显著差异(P>0.05)。
|
*表示差异显著(P < 0.05) * indicates significant difference(P < 0.05) 图 5 Wnt3a基因在鸡各部位皮肤毛囊组织中的相对表达量 Fig. 5 Relative expression of Wnt3a gene in chicken skin hair follicles |
不同品种和不同性别的鸡皮肤毛孔性状在不同日龄和不同皮肤部位都有比较大的差异。在本研究中,原种和B系同性别同皮肤部位相比较,原种母鸡背部毛囊密度极显著高于B系(P < 0.01),大腿部毛囊密度显著高于B系(P < 0.05),背部和大腿部毛囊直径显著低于B系(P < 0.05)。原种公鸡背部毛囊密度极显著高于B系(P < 0.01),胸部毛囊密度极显著低于B系(P < 0.01),背部和大腿部毛囊直径显著低于B系(P < 0.05)。原种公鸡胸部皮肤厚度显著低于B系(P < 0.05),原种公、母鸡大腿部皮肤厚度均显著低于B系(P < 0.05)。研究结果得出,原种和B系相比较,原种公、母鸡背部和大腿部皮肤毛囊密度大且直径小,B系恰好相反皮肤毛囊密度小且直径大,表明相较于B系,原种皮肤毛囊更加细密。前人研究发现,茶花鸡大腿部和背部的毛囊密度高于狼山鸡大腿部和背部,而毛囊直径低于狼山鸡,表明茶花鸡大腿部和背部的皮肤毛囊相较于狼山鸡更加细密[25]。研究表明,不同类型的鸡毛囊密度和直径差异显著与调控毛囊基因的通路表达有关,Wnt信号通路在毛囊诱导过程中起关键作用,是毛囊再生的关键调控因子[26-27]。经典的Wnt/β-catenin通路参与了毛囊羽芽、倒钩嵴和边缘板等结构的形成[28]。Wnt家族成员众多,至少由19种分泌蛋白组成[29]。Wnt3a和Wnt7a基因可作为诱导信号,诱导小鼠真皮乳头保持生长初期状态[30]。Wnt10b基因几乎只局限于在表皮基板中表达。Wnt5a基因诱导真皮凝结物和真皮乳头的形成[31]。在鹅毛囊发育研究中发现,Wnt5a基因抑制毛囊的发育,呈现负向调控[32]。随后在小鼠毛发上经研究证实Wnt5a基因抑制毛囊从休止期到生长期的转变[33]。研究表明,Wnt7b基因是毛囊干细胞稳态和毛囊周期性循环的重要调节因子[34]。除了Wnt信号通路外,还有SHH通路是真皮乳头发育成熟的关键调控因子,Notch信号通路决定干细胞命运,而BMP通路作为强有力的抑制剂,抑制毛囊的生长发育[35-37]。原种和B系各皮肤部位的皮肤厚度有差异,根据相关研究表明可能与耐热性不同有关[38-39],B系更加活泼好动,在高温天气为了平衡散热毛孔相较于原种更加粗大,B系体型更大,腿部脂肪沉积多于原种。
3.2 Wnt3a基因遗传效应及多态性分析卡方(χ2)检验表明,Wnt3a基因序列筛选发现的3个SNPs位点基因型分布的实际观测值和理论观测值差异不显著(P>0.05),符合遗传平衡定律,说明试验选择的样本群体基数够大、随机性较强。Wnt3a基因的遗传多态性分析发现,在原种中g.2555812 T>C位点呈现中度多态,0.25 < PIC < 0.5,g.2555377 T>C位点是高度多态,PIC>0.5。在B系中,g.2555812 T>C位点和g.2555377 T>C位点都是高度多态,PIC>0.5,表明这两个SNPs位点有较高的遗传变异潜力,遗传信息含量较丰富。g.2587569 G>A位点只有两种基因型AG和GG,而没有AA基因型,推测可能是因为该基因型还跟其他表型有关,比如快慢羽或羽色,可能已经被选育淘汰。研究表明,在花山麻鸡皮肤毛囊中发现Wnt3a基因的g.2587569 G>A位点有两种基因型AA和GG,无AG基因型[18],与本研究结果不一致,推测与人工选育有关,该研究发现的其他两个位点都有3种基因型CC、TT、CT和本研究结果是一致的,该研究发现g.2555377 T>C位点中CC基因型个体的背部毛囊密度显著高于其他两种基因型,而g.2555812 T>C位点3种基因型个体间的背部毛囊密度没有显著差异,在本研究中,这两个位点的CC基因型个体背部毛囊密度与其他基因型个体背部均有显著差异,两个研究结果不一致推测可能是由于品种间的差异或人工选育造成的。在本研究中,Wnt3a基因的g.2587569 G>A和g.2555812 T>C位点处于编码序列的外显子区域,没有发生氨基酸的改变属于同义突变[40-41]。由于蛋白翻译存在密码子的偏好性,常用的密码子变成不常用密码子,其作用对mRNA二级结构和蛋白质折叠有一定的影响[42-43]。g.2555377 T>C位点发生在非编码序列内含子区域不编码蛋白质,但突变的碱基可能会引起mRNA翻译发生改变,从而引起蛋白结构功能的变化,最终影响鸡皮肤毛囊密度性状的变化[44]。根据本研究结果,这种变化对鸡皮肤毛囊密度性状的影响是正向的,g.2555812 T>C和g.2555377 T>C位点碱基都是从胸腺嘧啶突变成胞嘧啶,而纯合子CC基因型个体的背部皮肤毛囊密度显著高于其他基因型个体,说明CC基因型是有利基因型。由实时荧光定量PCR结果得出,Wnt3a基因在崇仁麻鸡各部位皮肤毛囊都有比较高的表达,这也验证了Wnt3a基因在皮肤毛囊发育中的重要作用,这与束婧婷的研究结果一致,Wnt3a基因在花山麻鸡和清远麻鸡皮肤毛囊中也呈现比较高的表达[18]。
3.3 鸡Wnt3a基因多态性在皮肤毛囊分子育种上的应用皮肤毛孔作为冰鲜鸡胴体外观性状评价指标之一,毛孔分布的均匀度、密集程度和粗细都会影响鸡胴体表观质量。上市日龄的鸡胴体背部、胸部和大腿部是被注意到最直观的部位,若这3个部位的毛孔粗大又疏散很难引起消费者的购买欲,可能会被认为是不新鲜、不优质的冰鲜鸡。SNP遗传稳定性高、数量多分布范围广以及检测的准确性高,在畜禽分子标记筛选中被大量应用[45]。本研究以崇仁麻鸡为试验对象,在Wnt3a基因上发现筛选到的g.2555812 T>C和g.2555377 T>C位点与鸡背部皮肤毛囊密度有显著相关性,均有3种基因型CC、TT和CT。在原种和B系中均是CC基因型个体背部毛囊密度高于其他两种基因型个体。根据这个研究结果,可以利用SNP分子标记技术快速便捷的筛选优质皮肤毛囊性状鸡胴体。比起传统遗传育种,崇仁麻鸡Wnt3a基因多态性的检测可以在种鸡生长发育的早期判断筛选出高密度皮肤毛孔个体,降低了筛选的难度,缩短了育种的时间,可以节省一些成本,能有效提高冰鲜鸡市场经济效益。但是难点在于鸡皮肤毛孔密度在屠宰后才能测定,而为了保障测量的准确性在群体基数上一定要够大够随机才行。鸡皮肤毛孔数量性状遗传力高,受环境影响较小。基于Wnt3a基因多态性可以分析筛选与皮肤毛囊密度相关的分子标记,以期为个体早期选育出优质皮肤毛囊密度性状鸡胴体提供理论依据,但在进行分子育种之前一定得有进一步验证才准确。
综上所述,本试验在前人研究的基础上在崇仁麻鸡原种和B系中再次验证了Wnt3a基因是影响鸡皮肤毛囊生长发育的重要候选基因之一。由本研究结果得出,虽然是相同的基因相同的SNP位点,但在不同品种的鸡皮肤毛囊上会体现出不一样的表型和遗传效应。
4 结论崇仁麻鸡原种皮肤毛孔相较于B系更加细密,Wnt3a基因g.2555812 T>C位点的CC基因型和g.2555377 T>C位点的CC基因型是崇仁麻鸡皮肤毛囊的有利基因型,可作为鸡皮肤毛囊密度性状的分子标记,进行分子标记辅助选择育种培育出优质皮肤毛囊的肉鸡。
| [1] |
周勇, 李知新, 鲁宏伟, 等. 我国H5和H7N9亚型高致病性禽流感的监测及疫情暴发分析[J]. 畜牧兽医学报, 2022, 53(9): 3093-3106. ZHOU Y, LI Z X, LU H W, et al. Surveillance and outbreak analysis of H5 and H7N9 subtypes of highly pathogenic avian influenza in China[J]. Acta Veterinaria et Zootechnica Sinica, 2022, 53(9): 3093-3106. (in Chinese) |
| [2] |
ZENG H, DE REU K, GABRIËL S, et al. Salmonella prevalence and persistence in industrialized poultry slaughterhouses[J]. Poult Sci, 2021, 100(4): 100991. DOI:10.1016/j.psj.2021.01.014 |
| [3] |
刘国信. 转变消费观念推广"冰鲜鸡"是大势所趋[J]. 养禽与禽病防治, 2016(11): 34-36. LIU G X. Change the concept of consumption, the promotion of "chilled chicken" is the trend[J]. Poultry Husbandry and Disease Control, 2016(11): 34-36. (in Chinese) |
| [4] |
WANG X S, TREDGET E E, WU Y J. Dynamic signals for hair follicle development and regeneration[J]. Stem Cells Dev, 2012, 21(1): 7-18. DOI:10.1089/scd.2011.0230 |
| [5] |
LEE J, RABBANI C C, GAO H Y, et al. Hair-bearing human skin generated entirely from pluripotent stem cells[J]. Nature, 2020, 582(7812): 399-404. DOI:10.1038/s41586-020-2352-3 |
| [6] |
LI G, TANG X L, ZHANG S P, et al. SIRT7 activates quiescent hair follicle stem cells to ensure hair growth in mice[J]. EMBO J, 2020, 39(18): e104365. DOI:10.15252/embj.2019104365 |
| [7] |
XIE W Y, CHEN M J, JIANG S G, et al. Investigation of feather follicle morphogenesis and the expression of the Wnt/β-catenin signaling pathway in Yellow-feathered broiler chick embryos[J]. Br Poult Sci, 2020, 61(5): 557-565. DOI:10.1080/00071668.2020.1758302 |
| [8] |
WU P, JIANG T X, LEI M X, et al. Cyclic growth of dermal papilla and regeneration of follicular mesenchymal components during feather cycling[J]. Development, 2021, 148(18): dev198671. DOI:10.1242/dev.198671 |
| [9] |
GEYFMAN M, PLIKUS M V, TREFFEISEN E, et al. Resting no more: re-defining telogen, the maintenance stage of the hair growth cycle[J]. Biol Rev Camb Philos Soc, 2015, 90(4): 1179-1196. DOI:10.1111/brv.12151 |
| [10] |
STENN K S, PAUS R. Controls of hair follicle cycling[J]. Physiol Rev, 2001, 81(1): 449-494. DOI:10.1152/physrev.2001.81.1.449 |
| [11] |
JI S F, ZHU Z Y, SUN X Y, et al. Functional hair follicle regeneration: an updated review[J]. Signal Transduct Target Ther, 2021, 6(1): 66. DOI:10.1038/s41392-020-00441-y |
| [12] |
HARDY M H. The secret life of the hair follicle[J]. Trends Genet, 1992, 8(2): 55-61. DOI:10.1016/0168-9525(92)90350-D |
| [13] |
SHANG F Z, WANG Y, MA R, et al. Screening of microRNA and mRNA related to secondary hair follicle morphogenesis and development and functional analysis in cashmere goats[J]. Funct Integr Genomics, 2022, 22(5): 835-848. DOI:10.1007/s10142-022-00842-y |
| [14] |
KIRIKOSHI H, SEKIHARA H, KATOH M. Expression of WNT14 and WNT14B mRNAs in human cancer, up-regulation of WNT14 by IFNγ and up-regulation of WNT14B by β-estradiol[J]. Int J Oncol, 2001, 19(6): 1221-1225. |
| [15] |
GUO H Y, YANG K, DENG F, et al. Wnt3a inhibits proliferation but promotes melanogenesis of melan-a cells[J]. Int J Mol Med, 2012, 30(3): 636-642. DOI:10.3892/ijmm.2012.1028 |
| [16] |
GUO H Y, XING Y Z, LIU Y X, et al. Wnt/β-catenin signaling pathway activates melanocyte stem cells in vitro and in vivo[J]. J Dermatol Sci, 2016, 83(1): 45-51. DOI:10.1016/j.jdermsci.2016.04.005 |
| [17] |
TANG M S, WANG T, ZHANG X F. A review of SNP heritability estimation methods[J]. Brief Bioinform, 2022, 23(3): bbac067. DOI:10.1093/bib/bbac067 |
| [18] |
束婧婷, 姬改革, 屠云洁, 等. 鸡Wnt3a基因组织表达差异与SNPs对鸡毛囊密度性状的遗传效应[J]. 中国畜牧兽医, 2021, 48(5): 1672-1680. SHU J T, JI G G, TU Y J, et al. Tissue expression analysis of Wnt3a gene and genetic effects of SNPs on feather follicle density in chicken[J]. China Animal Husbandry & Veterinary Medicine, 2021, 48(5): 1672-1680. (in Chinese) |
| [19] |
吴静文. 鸡皮肤黄度的遗传规律及相关分子标记的鉴定[D]. 广州: 华南农业大学, 2020. WU J W. Characterization of chicken skin yellowness and ldentification of related molecular markers[D]. Guangzhou: South China Agricultural University, 2020. (in Chinese) |
| [20] |
YANG X, XIAN Y R, LI Z H, et al. G0S2 gene polymorphism and its relationship with carcass traits in chicken[J]. Animals (Basel), 2022, 12(7): 916. |
| [21] |
SUN G R, LI M, LI H, et al. Molecular cloning and SNP association analysis of chicken PMCH gene[J]. Mol Biol Rep, 2013, 40(8): 5049-5055. DOI:10.1007/s11033-013-2606-3 |
| [22] |
赵振华, 黎寿丰, 黄华云, 等. 优质肉鸡胴体外观性状遗传力及相关性分析[J]. 四川农业大学学报, 2015, 33(1): 89-92. ZHAO Z H, LI S F, HUANG H Y, et al. Estimates of heritability and correlations for the carcass appearance performance of high-quailty broiler chickens[J]. Journal of Sichuan Agricultural University, 2015, 33(1): 89-92. DOI:10.16036/j.issn.1000-2650.2015.01.015 (in Chinese) |
| [23] |
SCHNEIDER M R, SCHMIDT-ULLRICH R, PAUS R. The hair follicle as a dynamic miniorgan[J]. Curr Biol, 2009, 19(3): R132-R142. DOI:10.1016/j.cub.2008.12.005 |
| [24] |
YU M K, WU P, WIDELITZ R B, et al. The morphogenesis of feathers[J]. Nature, 2002, 420(6913): 308-312. DOI:10.1038/nature01196 |
| [25] |
姬改革, 束婧婷, 单艳菊, 等. 鸡皮肤毛囊性状研究进展[J]. 中国家禽, 2019, 41(10): 46-49. JI G G, SHU J T, SHAN Y J, et al. Research progress of skin hair follicle traits in chicken[J]. China Poultry, 2019, 41(10): 46-49. (in Chinese) |
| [26] |
RISHIKAYSH P, DEV K, DIAZ D, et al. Signaling involved in hair follicle morphogenesis and development[J]. Int J Mol Sci, 2014, 15(1): 1647-1670. DOI:10.3390/ijms15011647 |
| [27] |
SONG Y P, LIU C, ZHOU Y X, et al. Regulation of feather follicle development and Msx2 gene SNP degradation in Hungarian white goose[J]. BMC Genomics, 2022, 23(1): 821. DOI:10.1186/s12864-022-09060-z |
| [28] |
JENNI L, GANZ K, MILANESI P, et al. Determinants and constraints of feather growth[J]. PLoS One, 2020, 15(4): e0231925. DOI:10.1371/journal.pone.0231925 |
| [29] |
RIM E Y, CLEVERS H, NUSSE R. The Wnt pathway: from signaling mechanisms to synthetic modulators[J]. Annu Rev Biochem, 2022, 91: 571-598. DOI:10.1146/annurev-biochem-040320-103615 |
| [30] |
CHATTERJEE A, PAUL S, BISHT B, et al. Advances in targeting the WNT/β-catenin signaling pathway in cancer[J]. Drug Discov Today, 2022, 27(1): 82-101. DOI:10.1016/j.drudis.2021.07.007 |
| [31] |
SICK S, REINKER S, TIMMER J, et al. WNT and DKK determine hair follicle spacing through a reaction-diffusion mechanism[J]. Science, 2006, 314(5804): 1447-1450. DOI:10.1126/science.1130088 |
| [32] |
李瑶, 孙远, 鲍忠省, 等. Wnt5a基因在鹅皮肤中的定量定位表达特性[J]. 吉林农业大学学报, 2014, 36(4): 475-478, 493. LI Y, SUN Y, BAO Z S, et al. Characteristics of quantitative and positioning expression of Wnt5a Gene in Goose Skin[J]. Journal of Jilin Agricultural University, 2014, 36(4): 475-478, 493. (in Chinese) |
| [33] |
XING Y Z, MA X G, GUO H Y, et al. Wnt5a Suppresses β-catenin Signaling during Hair Follicle Regeneration[J]. Int J Med Sci, 2016, 13(8): 603-610. DOI:10.7150/ijms.15571 |
| [34] |
KANDYBA E, KOBIELAK K. Wnt7b is an important intrinsic regulator of hair follicle stem cell homeostasis and hair follicle cycling[J]. Stem Cells, 2014, 32(4): 886-901. DOI:10.1002/stem.1599 |
| [35] |
TAO Y F, ZHOU X L, LIU Z W, et al. Expression patterns of three JAK-STAT pathway genes in feather follicle development during chicken embryogenesis[J]. Gene Expr Patterns, 2020, 35: 119078. DOI:10.1016/j.gep.2019.119078 |
| [36] |
XIE W Y, CHEN M J, JIANG S G, et al. The Wnt/β-catenin signaling pathway is involved in regulating feather growth of embryonic chicks[J]. Poult Sci, 2020, 99(5): 2315-2323. DOI:10.1016/j.psj.2020.01.002 |
| [37] |
HU X W, ZHANG X K, LIU Z W, et al. Exploration of key regulators driving primary feather follicle induction in goose skin[J]. Gene, 2020, 731: 144338. DOI:10.1016/j.gene.2020.144338 |
| [38] |
ASADOLLAHPOUR NANAEI H, KHARRATI-KOOPAEE H, ESMAILIZADEH A. Genetic diversity and signatures of selection for heat tolerance and immune response in Iranian native chickens[J]. BMC Genomics, 2022, 23(1): 224. DOI:10.1186/s12864-022-08434-7 |
| [39] |
ZHUANG Z X, CHEN S E, CHEN C F, et al. Genomic regions and pathways associated with thermotolerance in layer-type strain Taiwan indigenous chickens[J]. J Therm Biol, 2020, 88: 102486. DOI:10.1016/j.jtherbio.2019.102486 |
| [40] |
GILLEN S L, WALDRON J A, BUSHELL M. Codon optimality in cancer[J]. Oncogene, 2021, 40(45): 6309-6320. DOI:10.1038/s41388-021-02022-x |
| [41] |
BAILEY S F, MORALES L A A, KASSEN R. Effects of synonymous mutations beyond codon bias: the evidence for adaptive synonymous substitutions from microbial evolution experiments[J]. Genome Biol Evol, 2021, 13(9): evab141. DOI:10.1093/gbe/evab141 |
| [42] |
PARVATHY S T, UDAYASURIYAN V, BHADANA V. Codon usage bias[J]. Mol Biol Rep, 2022, 49(1): 539-565. DOI:10.1007/s11033-021-06749-4 |
| [43] |
CALLENS M, PRADIER L, FINNEGAN M, et al. Read between the Lines: diversity of nontranslational selection pressures on local codon usage[J]. Genome Biol Evol, 2021, 13(9): evab097. DOI:10.1093/gbe/evab097 |
| [44] |
PANARO M A, CALVELLO R, MINIERO D V, et al. Imaging intron evolution[J]. Methods Protoc, 2022, 5(4): 53. DOI:10.3390/mps5040053 |
| [45] |
刘继强, 郝晓东, 武丽娜, 等. 全基因组SNP分型技术在畜禽遗传育种研究中的应用[J]. 畜牧兽医学报, 2022, 53(12): 4123-4137. LIU J Q, HAO X D, WU L N, et al. Application of whole genome SNP genotyping technology in livestock and poultry genetics and breeding[J]. Acta Veterinaria et Zootechnica Sinica, 2022, 53(12): 4123-4137. (in Chinese) |
(编辑 郭云雁)



