果胶是一类广泛存在于植物细胞壁中胶层和初生壁中的酸性杂多糖,与纤维素、半纤维素共同构成细胞壁,对于维持细胞结构起着重要作用。主要存在于果渣、饼粕、糟糠等食品加工副产品中,其分子量在60 000~318 000 g ·mol-1,并随植物来源、果实或植物阶段、提取条件和方法而变化[1]。果胶于1790年首次在苹果渣中发现[2],直到1825年法国药剂师Braconnot[3]才真正从胡萝卜中分离出这种水溶性物质,并命名为“pectin”,来源于希腊语“pectos”,意为凝固、凝结。之后,人们逐渐认识到果胶的作用,因其具有良好的凝胶性和乳化稳定性,被广泛应用于食品工业中,用作乳化剂、稳定剂、凝胶剂、增稠剂和护色剂等[4]。但在单胃动物营养中果胶被看成是一种抗营养因子[5],因为果胶的黏性影响了本身和其他营养物质在消化道中的消化和吸收利用,需要对其生物降解以提高饲料的生物学效价。
1 果胶的分类、结构与功能 1.1 果胶的分类根据果胶侧链结合的物质及理化性质,可分为原果胶、果胶及果胶酸三大类。“原果胶”是指植物中存在的不溶于水的果胶物质,经限制性水解后产生果胶或果胶酸,存在于植物的完整组织中;“果胶酸”是一种胶态聚半乳糖醛酸,含有的甲酯基团比例可忽略不计,果胶酸通过甲酯化则变成了果胶;“果胶”是果胶酸部分甲酯化且含有中性糖的果胶物质,通常被称为聚半乳糖醛酸甲酯。在果胶中,半乳糖醛酸单元的羧基高达75%通过酯化作用与甲醇连接,其通过与细胞壁中的纤维素结合,为细胞壁提供刚性[6]。
1.2 果胶的结构果胶是自然界中最复杂的生物大分子之一,其主要成分是D-半乳糖醛酸,由α-1, 4糖苷键连接形成主链。其他糖单位,包括核糖、半乳糖、阿拉伯糖和蔗糖,插入到聚合物中。主链中的羧基部分能够被酯化,根据酯化程度的不同又可分为高甲氧基果胶和低甲氧基果胶。根据果胶分子结构中主链和侧链组成的不同,多糖结构分为高半乳糖醛酸(HGA)、鼠李半乳糖醛酸Ⅰ (RG Ⅰ)和鼠李半乳糖醛酸Ⅱ (RG Ⅱ)[7-9]。由于其线性结构,聚半乳糖醛酸(HG)区域通常被称为“平滑区”,而包括RG-Ⅰ、RG-Ⅱ在内的分支区被称为“毛发区”[7, 10]。但是,关于这三个结构域是如何组装到一起的仍然有争议。典型的假设是指HG、RG-Ⅰ和RG-Ⅱ主链共价交联形成嵌段共聚物的模型,但三个主要结构域的相对位置仍不完全清楚。
1.3 果胶的分布果胶广泛存在于植物的根、茎、叶、果实和种子中,是细胞壁的重要组成部分,不同植物的果胶含量不同,甚至同种植物的不同部位、不同生长时期的果胶含量也不相同。通常双子叶植物及部分植物种皮或果皮中的果胶含量较多,草类植物的果胶含量较少,而单子叶植物中的果胶含量一般为双子叶植物的1/10左右。玉米、豆粕、苜蓿、秸秆类等饲料原料中均含有果胶:其中玉米、小麦等谷物中果胶含量不到1%,大部分为淀粉,约占65%~70%;秸秆类饲料中果胶含量较低,胶含量只有0%~5%[11];苜蓿中果胶含量较高,约为10%~15%。许多食品工业原料也被发掘可作为饲料原料,如柑橘皮、苹果皮、山楂、向日葵盘、甜菜渣等[12],对部分蔬菜的果胶含量进行了研究[13]。因此,在生产实践中,开发非常规饲料用作单胃动物的饲料原料时,应降低其果胶含量,以提高其营养价值和利用效率。
1.4 果胶的功能1.4.1 果胶的益生作用 果胶对人类健康具有多种积极作用。研究表明,果胶能减缓食后血糖和胰岛素浓度的升高,食物中添加一定量的果胶对糖尿病患者有益。20世纪60年代,研究发现果胶能降低胆固醇水平。后续研究表明,果胶物质能降低血液总胆固醇、低密度脂蛋白胆固醇、极低密度脂蛋白胆固醇、低密度脂蛋白胆固醇和高密度脂蛋白胆固醇比等[14-15]。果胶还可以与癌细胞表面的半乳糖凝集素(半乳糖结合凝集素)结合,干扰细胞-细胞或细胞-基质黏附,抑制转移性病变[16],诱导癌细胞凋亡[17]。
1.4.2 果胶的营养作用 果胶可被反刍动物的瘤胃微生物降解产生乙酸、丙酸等挥发性脂肪酸而被动物体吸收利用。不仅为反刍动物提供能量,还对瘤胃内环境的稳定具有极强的调控作用。Van Soest[18]报道果胶在反刍动物营养中具有独特的作用,含果胶丰富的饲料具有和金属离子如钙离子、镁离子、钠离子、钾离子等具有较强亲和能力和离子交换能力,当瘤胃环境pH过低时,饲料中的果胶类物质可把阳离子释放到瘤胃液中,对瘤胃内环境起到稳定和缓冲作用。果胶的这些特点,使其成为理想的用于瘤胃发酵的碳水化合物。李勇等[19]研究发现,高果胶饲粮对维持绵羊瘤胃内环境稳定和促进氮利用方面有一定的积极作用。
1.4.3 果胶的抗营养作用 由于果胶吸水后黏性大大增加,所以果胶对单胃动物的蛋白质消化和利用有负面作用。它降低了营养物质与消化酶类的接触。黏性多糖不但抑制营养物质的消化吸收,而且还能与肠道分泌的消化酶结合,降低消化酶活性,甚至引起肠黏膜形态和功能的变化。此外,果胶含丰富的羧基,能够螯合消化道中的二价离子,尤其是钙离子,从而抑制了单胃动物对钙的吸收利用。因此,果胶在单胃动物营养中被看成是一种抗营养因子[5]。据报道,饲粮中果胶类物质太多会降低肉鸡的生产性能,影响糖类和蛋白质等营养成分的利用率[20]。生长猪饲粮中添加4%和8%的苹果果胶显著降低了猪的回肠氨基酸消化率,增加了食糜黏度,可引起胃肠功能的改变,导致氨基酸的消化率和利用率降低[21]。有研究推测,果胶通过改变肠道微生物区系对仔鹅生长性能、屠宰性能、养分利用率等产生不利影响[22]。
2 果胶的降解 2.1 果胶的降解方法果胶的降解方法主要是化学法和酶解法。化学法降解通常是用酸水解果胶,最大的特点是降解速度快(特别是在加热的条件下),降解完全,得到大量单糖,寡糖产率低。由于降解过程中加入了各种反应试剂,使降解反应的控制难度增大、降解产物的分离纯化不易进行。因此,目前较少采用单纯酸水解的方法制备寡聚半乳糖醛酸。酶法降解果胶多糖,即选用特定的一种或几种酶对果胶分子进行降解,让其选择性地切断果胶分子中的α-1,4糖苷键,制备特定的果胶寡糖。该方法不发生副反应,反应条件温和,工艺较易控制,对果胶分子结构几乎没有破坏,是一种较为理想的降解方法。
2.2 果胶酶降解2.2.1 果胶酶的定义与来源 果胶酶是降解果胶物质的生物催化剂[23-25],能直接作用于植物细胞壁间质及细胞壁成分,从而崩解细胞壁, 释放细胞内的养分。果胶酶分布很广,主要存在于高等植物和微生物中,细菌、放线菌、酵母和霉菌都能代谢合成果胶酶。由于生长速度快、分布广泛、发酵时间短和更容易获得基因改造,而且催化专一、侵蚀性小、环保节能,微生物酶正在取代化学催化剂[26-27]。据报道,35%的果胶酶来自细菌,55%来自真菌和酵母,15%来自植物或动物[28]。自20世纪70年代以来,主要从微生物特别是真菌中商业化制备果胶酶[29]。
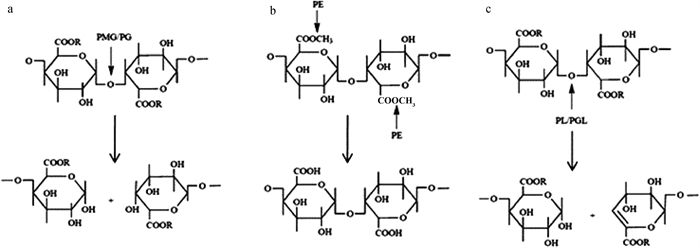
2.2.2 果胶酶的分类与作用 根据酶委员会和国际生物化学联合会,果胶酶属于水解酶类[6]。按照作用方式的不同可以分为原果胶酶、果胶酯酶和解聚酶(水解酶和裂解酶)[25-26]。原果胶酶水解不溶性原果胶为水溶性果胶,切断聚甲氧基半乳糖醛酸和阿拉伯糖之间的化学键;果胶酯酶催化果胶的甲氧基去酯化形成果胶酸;水解酶(聚半乳糖醛酸酶和聚甲基半乳糖醛酸酶)分别催化果胶酸和果胶中α-1, 4糖苷键的水解;而裂解酶(聚半乳糖醛酸裂解酶和聚甲基半乳糖醛酸裂解酶)催化α-1, 4糖苷键的裂解,通过反式消除反应形成不饱和半乳糖醛酸和半乳糖醛酸甲酯,具体见表 1和图 1。
|
|
表 1 果胶酶的分类与作用方式 Table 1 Classification and mode of action of pectinases |
|
a. PMG和PG的作用方式和产物:PG形成饱和半乳糖醛酸、PMG形成饱和甲氧基半乳糖醛酸;b. PE的作用方式和产物:PE形成果胶酸;c. PL和PGL的作用方式和产物:PGL形成不饱和半乳糖醛酸、PL形成不饱和甲氧基半乳糖醛酸。PG.聚半乳糖醛酸酶;PMG.聚甲基半乳糖醛酸酶;PE.果胶酯酶;PL.裂解酶;PGL.聚半乳糖醛酸裂解酶 a. Mode of action and products of PMG and PG: Saturated galacturonic acid formed by PG and saturated methoxylated galacturonide by PMG; b. Mode of action and products of PE: Pectic acid formed by PE; c. Mode of action and products of PGL and PL: Unsaturated galacturonic acid formed by PGL and unsaturated methoxylated galacturonide by PL. PG. Polygalacturonases; PMG. Polymethylgalacturonases; PE. Pectin esterase; PL. Pectin lyase; PGL.Polygalacturonate lyase 图 1 果胶酶的作用机理[26] Fig. 1 Mechanism of action of pectinase[26] |
2.3.1 果胶酶在轻工业中的应用 果胶酶的应用非常广泛,它们在食品、纺织、饮料、纸浆和造纸、生物燃料工业等领域都有着多种应用[6]。果胶酶占全球工业酶市场的25%,且其应用占比还在不断增加[30]。果胶酶的首次商业应用始于1930年,用于澄清果汁,后来被用于酿造葡萄酒和果汁。
2.3.2 果胶酶在饲料工业中的应用 果胶是单胃动物饲料中的抗营养因子。果胶酶能够使果胶质完全分解或部分降解为小分子物质,使细胞中的营养物质释放出来,有利于机体的吸收和利用;有效降低饲料黏度,提高动物的生产性能与饲料利用率;同时可以降低饲料中的纤维含量,促进纤维中营养物质的释放[31],因而越来越受到全球范围内饲料行业的高度重视[32]。果胶酶通过降低饲料黏度,促进了营养物质吸收,减少了动物排便,减少了环境污染[26, 31, 33]。此外,果胶酶的单位酶活相对较高,催化效率较高,具有很好的应用前景[34]。
在饲料工业中,果胶酶一般与纤维素酶、半纤维素酶、淀粉酶、蛋白酶等酶制剂复配使用,以提高饲料的营养价值和适口性[35]。果胶酶首先作用于植物细胞壁的外层,使细胞壁松散,为其他酶发挥作用提供便利,因此,果胶酶在植物细胞壁降解的初始阶段非常重要。有研究表明,当豆粕在饲料中的含量较高时,“木聚糖酶+纤维素酶+果胶酶”的组合比单用“木聚糖酶+纤维素酶”更好[36]。目前,对饲用果胶酶比较详细、深入的研究报道较少。
3 产果胶酶微生物 3.1 产果胶酶微生物的分类据报道,在某些植物、细菌、真菌、酵母、昆虫、线虫[37]中均发现了果胶酶的存在,目前国内的工业化果胶酶大多来自于微生物固态发酵。产生果胶酶的微生物主要包括细菌和真菌。真菌产生各种果胶酶,包括聚甲基半乳糖醛酸酶(PMG)、聚半乳糖醛酸酶(PG)和果胶酯酶(PE),其中黑曲霉应用较广泛。一些细菌(地衣芽孢杆菌、气单胞菌、乳酸杆菌等)、念珠菌和放线菌(如链霉菌)也被使用,其中,丝状真菌是最常用的。产果胶酶的真菌有曲霉菌(Aspergillus)、青霉菌(Penicillium)、根瘤菌(Rhizobium Frank)、镰刀菌(Fusarium)、白地霉(Geotrichum candidum)、腐霉属(Pythium)、酿酒酵母(Saccharomy cescerevisiae)等;产果胶酶的细菌有欧文氏菌(Erwinia)、假单胞菌(Pseudomonas adaceae)、芽孢杆菌(Bacillus)、梭状芽胞杆菌(Clostridium)、放线菌属(Actinomyces)等。美国食品药品管理局(Food and Drug Administration,FDA)认为,在所有产果胶酶的微生物中最安全的菌株是黑曲霉(Aspergillus niger)[33]。
3.2 产果胶酶微生物的来源产果胶酶的微生物来源广泛,主要从变质的水果、土壤、腐烂的农业废弃物、动物等中分离出来。Geetha等[38]从收集的废弃果皮,如橙皮、柑橘皮中筛选到一批细菌和真菌,经鉴定细菌为芽孢杆菌属和假单胞菌属。真菌培养物被鉴定为黑曲霉、黄曲霉和产黄青霉菌。发现所有细菌和真菌培养物均产生可观水平的果胶水解酶。Naga Padma等[39]使用橙皮作为底物,从变质的水果、蔬菜和土壤中分离出酵母菌,在液态发酵条件下获得了最大果胶酶活性为21 U ·mL-1。Zeni等[40]从农业废料样品中分离出20个菌株能够合成活性高于3 U ·mL-1的果胶酶,其中黑曲霉ATCC 9642微生物和新分离的W23、W43和D2(青霉菌)酶活性为30、41、43和45 U ·mL-1。Siddiqui等[41]从腐烂果皮分离到1株嗜热真菌菌株,经分子生物学鉴定,菌株为脓毒根瘤菌。纯化的酶是分子量为32 ku的单体,首次在该物种中纯化聚半乳糖醛酸酶,该酶水解果胶的最适温度为55 ℃,最适pH为5.0,在pH 2.5~4.5之间具有良好的稳定性。姜晓霞等[42]研究发现,在日粮中添加从鹅盲肠筛选得到的草酸青酶产的果胶酶能显著提高肉鸡后期的生产性能,这可能是试验所用的产果胶酶是动物源性的,与其它来源的酶相比,在温度、pH等方面能更好地适应动物的消化道生理条件,从而更充分地发挥自身的作用。表 2列出了部分产果胶酶微生物的来源及分类。
|
|
表 2 一些产果胶酶微生物来源及分类 Table 2 Sources and classification of some microorganisms producing pectinase |
近年来,通过重组DNA技术,如基因克隆、表达、突变等对产果胶酶微生物进行改良。基因工程为酶学家提供了各种技术,使他们能够以具有成本效益的方式生产大量商业用途的特定酶[30]。近几十年来,主要从曲霉菌、炭疽菌、镰刀菌和灰霉菌等中克隆表达果胶酶基因,基因总数至少有70个,对果胶酶的序列、结构、生物学特性等方面有了更深入的了解。果胶酯酶基因从黑曲霉、棘孢曲霉和米曲霉中分离,多聚半乳糖醛酸酶基因从黑曲霉、马克斯克鲁维酵母、酿酒酵母、青霉菌、农杆菌、热厌氧杆菌以及许多植物病原真菌中分离。随着分子生物学的出现,对果胶酶基因的克隆和在各种宿主中的表达进行了大量的研究。Gonçalves等[48]使用转基因的灰假单胞菌构建体来实现果胶酶的生产。与野生型菌株相比,这种重组结构体与果胶酶基因结合,使培养物中果胶裂解酶和聚半乳糖醛酸酶的产量分别增加了13和424倍。Zhang等[49]将青霉菌的Exo-PG基因克隆到带有GAL1启动子的质粒中,并在酵母中进行异源表达,成功地在培养基中产生了酶活性为6.67 U ·mL-1的重组酶。研究发现,通过紫外线诱导的灰青霉菌突变体产生果胶酶的能力比野生菌株增加了7.8倍[50]。有研究人员筛选出1株特异性灰青霉菌株(PG63)并开发出高效的转化系统,用于获得高效表达果胶裂解酶的菌株。他们用两种不同方式对其进行遗传改造,使两种类型的转化菌株都具有了果胶裂解酶(PL)活性的特征,而且相同条件下产生的PL活性比对照菌株高132倍[51]。后续研究还发现,重组灰霉菌菌株105能利用低成本的甘蔗汁,大量生产细胞外果胶裂解酶(PL),重组菌株105的PL产量是对照菌株的112倍[52]。在现代生物技术时代,科学家们通过这些技术不仅能够研究感兴趣的特定基因,还能获得特定蛋白质的定向表达和过表达。
3.4 发酵条件工业上生产果胶酶的方法有液体深层发酵(SMF)和固态发酵(SSF),而固态发酵的酶产量更高。底物选择、工艺条件、含水率、培养时间、接种量、pH、温度、抑制剂/激活剂的存在以及碳源和氮源的加入都是影响果胶酶生物合成的关键因素。通过深层和半固体发酵估计果胶酶产量,并且观察到半固体发酵的多聚半乳糖醛酸酶产量高于深层发酵的多聚半乳糖醛酸酶产量。用于固态发酵的底物主要来自水稻、玉米、根茎、块茎和豆类等谷物。除此之外,果渣、芒果皮、橘子皮及其他水果和蔬菜废弃物也被大量利用。
4 研究现状与发展趋势果胶酶在一定条件下催化反应的能力很强,在很多工业部门中都是重要的生物催化剂。果胶酶能够有效地降解植物饲料中的细胞壁,补充动物内源酶的不足,消除抗营养因子,提高饲料转化率。目前国内外生产的果胶酶主要是从土壤和腐败植物分离的菌株发酵获得,而且研发刚刚起步,存在着发酵和提取工艺不够成熟和产酶量低等关键技术问题。因此,为了降低饲料生产成本,目前用于饲料生产的酶制剂还只能添加没有纯化的复合酶制剂,果胶酶的应用只在小规模试用,并未得到大规模的普及。微生物果胶酶是工业领域的主要酶,它们被广泛用于各种工业中,并且新的应用仍在不断涌现。饲料行业中果胶酶仍然存在菌种产量低、成本高、易失活且添加量和添加方式不明确等一系列问题。因此,筛选高酶产量菌株或者利用生物技术对目标菌株进行改造变得十分迫切。
酶工程技术是能将酶或者微生物细胞、动植物细胞等在一定的生物反应装置中,利用酶所具有的生物催化功能,借助工程手段将相应的原料转化成有用物质并应用于社会生活的一门科学技术。它包括酶制剂的制备,酶的固定化,酶的修饰与改造及酶反应器等方面内容。可以使用酶工程方法提高酶的活性,但在酶处理过程中,需要在特定的温度范围内进行,维持该温度范围会大大增加工业成本。因此,使用耐热酶十分有必要,而且在广泛的温度和pH范围内稳定的菌株会很有优势。所以,筛选、发现及构建具有高细胞外果胶酶活性、在较宽的温度和pH范围内具有较长时间稳定性的新型微生物,会是近期研究的重点。安全、有效的产果胶酶菌株的分离及改造具有重要意义。
| [1] |
SAYAH M Y, CHABIR R, BENYAHIA H, et al. Yield, esterification degree and molecular weight evaluation of pectins isolated from orange and grapefruit peels under different conditions[J]. PLoS One, 2016, 11(9): e0161751. DOI:10.1371/journal.pone.0161751 |
| [2] |
VAUQUELIN M. Analyse du tamarin[J]. Annales de Chimie, 1790, 5: 92-106. |
| [3] |
BRACONNOT H. Recherches sur un nouvel acide universellement répandu dans tous les végétaux[J]. Annales de Chimie et de Physique, 1825, 28(2): 173-178. |
| [4] |
CHEN J, LIU W, LIU C M, et al. Pectin modifications: A review[J]. Crit Rev Food Sci Nutr, 2015, 55(12): 1684-1698. DOI:10.1080/10408398.2012.718722 |
| [5] |
LANGHOUT D J, SCHUTTE J B, VAN LEEUWEN P, et al. Effect of dietary high-and low-methylated citrus pectin on the activity of the ileal microflora and morphology of the small intestinal wall of broiler chicks[J]. Br Poult Sci, 1999, 40(3): 340-347. DOI:10.1080/00071669987421 |
| [6] |
HAILE S, AYELE A. Pectinase from microorganisms and its industrial applications[J]. Sci World J, 2022, 2022: 1881305. DOI:10.1155/2022/1881305 |
| [7] |
LARA-ESPINOZA C, CARVAJAL-MILLÁN E, BALANDRÁN-QUINTANA R, et al. Pectin and pectin-based composite materials: beyond food texture[J]. Molecules, 2018, 23(4): 942. DOI:10.3390/molecules23040942 |
| [8] |
PICOT-ALLAIN M C N, RAMASAWMY B, EMMAMBUX M N. Extraction, characterisation, and application of pectin from tropical and sub-tropical fruits: a review[J]. Food Rev Int, 2022, 38(3): 282-312. |
| [9] |
ROPARTZ D, RALET M C. Pectin structure[M]//KONTOGIORGOS V. Pectin: Technological and Physiological Properties. Cham: Springer, 2020: 17-36.
|
| [10] |
MELLINAS C, RAMOS M, JIMÉNEZ A, et al. Recent trends in the use of pectin from agro-waste residues as a natural-based biopolymer for food packaging applications[J]. Materials (Basel), 2020, 13(3): 673. DOI:10.3390/ma13030673 |
| [11] |
MULLEN C A, BOATENG A A, GOLDBERG N M, et al. Bio-oil and bio-char production from corn cobs and stover by fast pyrolysis[J]. Biomass Bioenergy, 2010, 34(1): 67-74. DOI:10.1016/j.biombioe.2009.09.012 |
| [12] |
BRETT C T, WALDRON K W. Physiology and biochemistry of plant cell walls[M]. 2nd ed. London: Chapman & Hall, 1996.
|
| [13] |
REDDY P L, SREERAMULU A. Isolation, identification and screening of pectinolytic fungi from different soil samples of chittoor district[J]. Int J Life Sci Biotechnol Pharma Res, 2012, 1(3): 186-193. |
| [14] |
TERPSTRA A H M, LAPRÉ J A, DE VRIES H T, et al. The hypocholesterolemic effect of lemon peels, lemon pectin, and the waste stream material of lemon peels in hybrid F1B hamsters[J]. Eur J Nutr, 2002, 41(1): 19-26. DOI:10.1007/s003940200002 |
| [15] |
王宏博, 高雅琴, 李维红, 等. 果胶在反刍动物营养中的研究进展[C]//中国畜牧兽医学会养羊学分会全国养羊生产与学术研讨会议论文集. 北京: 《中国草食动物》杂志社, 2010: 31-33. WANG H B, GAO Y Q, LI W H, et al. Research progress of pectin in ruminant nutrition[C]//Collected Papers of the National Sheep Production and Academic Seminar of the Sheep Raising Branch of the Chinese Animal Husbandry and Veterinary Association. Beijing: Chinese Herbivorous Animal Magazine, 2010: 31-33. (in Chinese) |
| [16] |
INOHARA H, RAZ A. Effects of natural complex carbohydrate (citrus pectin) on murine melanoma cell properties related to galectin-3 functions[J]. Glycoconjugate J, 1994, 11(6): 527-532. DOI:10.1007/BF00731303 |
| [17] |
JACKSON C L, DREADEN T M, THEOBALD L K, et al. Pectin induces apoptosis in human prostate cancer cells: Correlation of apoptotic function with pectin structure[J]. Glycobiology, 2007, 17(8): 805-819. DOI:10.1093/glycob/cwm054 |
| [18] |
VAN SOEST P J. What constitutes alfalfa quality: new considerations[C]//Proceedings of the 25th Natl Alfalfa Symposium. Liverpool, NY, 1995: 27-28.
|
| [19] |
李勇, 郝正里, 李发弟, 等. 不同组合饲粮对绵羊瘤胃代谢参数的影响[J]. 草业学报, 2011, 20(3): 136-142. LI Y, HAO Z L, LI F D, et al. Effect of different combinations of diet on rumen metabolic parameters of sheep[J]. Acta Prataculturae Sinica, 2011, 20(3): 136-142. (in Chinese) |
| [20] |
YU B, TSAI C C, HSU J C, et al. Effect of different sources of dietary fibre on growth performance, intestinal morphology and caecal carbohydrases of domestic geese[J]. Br Poult Sci, 1998, 39(4): 560-567. DOI:10.1080/00071669888773 |
| [21] |
BURACZEWSKA L, ŚWIĘCH E, TUSŚNIO A, et al. The effect of pectin on amino acid digestibility and digesta viscosity, motility and morphology of the small intestine, and on N-balance and performance of young pigs[J]. Livest Sci, 2007, 109(1-3): 53-56. DOI:10.1016/j.livsci.2007.01.058 |
| [22] |
赵凤至. 饲粮中果胶对仔鹅生产性能、养分利用率及肠道微生物区系的影响[D]. 扬州: 扬州大学, 2018. ZHAO F Z. Effects of pectin in the diet on production performance, nutrient utilization and intestinal microflora in geese[D]. Yangzhou: Yangzhou University, 2018. (in Chinese) |
| [23] |
KHAN M, NAKKEERAN E, UMESH-KUMAR S. Potential application of pectinase in developing functional foods[J]. Annu Rev Food Sci Technol, 2013, 4: 21-34. DOI:10.1146/annurev-food-030212-182525 |
| [24] |
KAVUTHODI B, THOMAS S K, SEBASTIAN D. Co-production of pectinase and biosurfactant by the newly isolated strain Bacillus subtilis BKDS1[J]. Microbiol Res J Int, 2015, 10(2): 1-12. |
| [25] |
OUMER O J. Pectinase: Substrate, production and their biotechnological applications[J]. Int J Environ, Agric Biotechnol, 2017, 2(3): 1007-1014. |
| [26] |
GARG G, SINGH A, KAUR A, et al. Microbial pectinases: an ecofriendly tool of nature for industries[J]. 3 Biotech, 2016, 6(1): 47. DOI:10.1007/s13205-016-0371-4 |
| [27] |
AMIN F, BHATTI H N, BILAL M. Recent advances in the production strategies of microbial pectinases-A review[J]. Int J Biol Macromol, 2019, 122: 1017-1026. DOI:10.1016/j.ijbiomac.2018.09.048 |
| [28] |
KAVUTHODI B, SEBASTIAN D. Review on bacterial production of alkaline pectinase with special emphasis on Bacillus species[J]. Biosci Biotech Res Commun, 2018, 11(1): 18-30. DOI:10.21786/bbrc/11.1/4 |
| [29] |
SHARMA N, RATHORE M, SHARMA M. Microbial pectinase: sources, characterization and applications[J]. Rev Environ Sci Bio/Technol, 2013, 12(1): 45-60. DOI:10.1007/s11157-012-9276-9 |
| [30] |
NAKKEERAN E, UMESH-KUMAR S, SUBRAMANIAN R. Aspergillus carbonarius polygalacturonases purified by integrated membrane process and affinity precipitation for apple juice production[J]. Bioresource Technology, 2011, 102: 3293-3297. DOI:10.1016/j.biortech.2010.10.048 |
| [31] |
ABDULLA J M, ROSE S P, MACKENZIE A M, et al. Feeding value of field beans (Vicia faba L. var. minor) with and without enzyme containing tannase, pectinase and xylanase activities for broilers[J]. Arch Anim Nutr, 2017, 71(2): 150-164. DOI:10.1080/1745039X.2017.1283823 |
| [32] |
李瑜. 腐烂苹果中产果胶酶菌株的分离及产酶条件的优化[D]. 杨凌: 西北农林科技大学, 2009. LI Y. Separation of pectinase-producing strain in rotten apple and optimization of the enzyme production[D]. Yangling: Northwest A&F University, 2009. (in Chinese) |
| [33] |
BHARDWAJ V, DEGRASSI G, BHARDWAJ R K. Microbial pectinases and their applications in industries: A review[J]. Int Res J Eng Technol, 2017, 4(8): 829-836. |
| [34] |
许毅. 果胶酶对肉鸡玉米豆粕型日粮养分利用率的影响[D]. 南京: 南京农业大学, 2004. XU Y. Study on the effects of pectinase on the nutrition utilization of corn-soybean meal diet in broilers[D]. Nanjing: Nanjing Agricultural University, 2004. (in Chinese) |
| [35] |
李渤南, 王庆华. 饲用酶制剂的国内外研究进展[J]. 中国禽业导刊, 2002, 19(4): 30. LI B N, WANG Q H. Research progress of feed enzyme preparation at home and abroad[J]. Guide to Chinese Poultry, 2002, 19(4): 30. (in Chinese) |
| [36] |
MALATHI V, DEVEGOWDA G. In vitro evaluation of nonstarch polysaccharide digestibility of feed ingredients by enzymes[J]. Poult Sci, 2001, 80(3): 302-305. DOI:10.1093/ps/80.3.302 |
| [37] |
SHRESTHA S, RAHMAN S, QIN W S. New insights in pectinase production development and industrial applications[J]. Appl Microbiol Biotechnol, 2021, 105(24): 9069-9087. DOI:10.1007/s00253-021-11705-0 |
| [38] |
GEETHA M, SARANRAJ P, MAHALAKSHMI S, et al. Screening of pectinase producing bacteria and fungi for its pectinolytic activity using fruit wastes[J]. Int J Biochem Biotech Sci, 2012, 1: 30-42. |
| [39] |
NAGA PADMA P, ANURADHA K, REDDY G. Pectinolytic yeast isolates for cold-active polygalacturonase production[J]. Innov Food Sci Emerg Technol, 2011, 12(2): 178-181. DOI:10.1016/j.ifset.2011.02.001 |
| [40] |
ZENI J, CENCE K, GRANDO C E, et al. Screening of pectinase-producing microorganisms with polygalacturonase activity[J]. Appl Biochem Biotechnol, 2011, 163(3): 383-392. DOI:10.1007/s12010-010-9046-5 |
| [41] |
SIDDIQUI M A, PANDE V, ARIF M. Production, purification, and characterization of polygalacturonase from Rhizomucor pusillus isolated from decomposting orange peels[J]. Enzyme Res, 2012, 2012: 138634. DOI:10.1155/2012/138634 |
| [42] |
姜晓霞, 王宝维, 孙鹏, 等. 鹅源草酸青霉所产果胶酶对肉鸡生长性能及血液生化指标的影响[J]. 中国家禽, 2009, 31(24): 9-12. JIANG X X, WANG B W, SUN P, et al. Effects of pectinase produced by Penicillium oxalicum currie & thom on growth performance and blood biochemical index of broilers[J]. China Poultry, 2009, 31(24): 9-12. DOI:10.16372/j.issn.1004-6364.2009.24.025 (in Chinese) |
| [43] |
KAUR S, KAUR H P, PRASAD B, et al. Production and optimization of pectinase by Bacillus sp. isolated from vegetable waste soil[J]. Indo Am J Pharm Res, 2016, 6(1): 4185-4190. |
| [44] |
KC S, UPADHYAYA J, JOSHI D R, et al. Production, characterization, and industrial application of pectinase enzyme isolated from fungal strains[J]. Fermentation, 2020, 6(2): 59. DOI:10.3390/fermentation6020059 |
| [45] |
AGGARWAL R, DUTTA T, SHEIKH J. Extraction of pectinase from Candida isolated from textile mill effluent and its application in bio-scouring of cotton[J]. Sustain Chem Pharm, 2020, 17: 100291. DOI:10.1016/j.scp.2020.100291 |
| [46] |
HAILE M, KANG W H. Isolation, identification, and characterization of pectinolytic yeasts for starter culture in coffee fermentation[J]. Microorganisms, 2019, 7(10): 401. DOI:10.3390/microorganisms7100401 |
| [47] |
TASKIN M. Co-production of tannase and pectinase by free and immobilized cells of the yeast Rhodotorula glutinis MP-10 isolated from tannin-rich persimmon (Diospyros kaki L.) fruits[J]. Bioprocess Biosyst Eng, 2013, 36(2): 165-172. DOI:10.1007/s00449-012-0771-8 |
| [48] |
GONÇALVES D B, TEIXEIRA J A, BAZZOLLI D M S, et al. Use of response surface methodology to optimize production of pectinases by recombinant Penicillium griseoroseum T20[J]. Biocatal Agric Biotechnol, 2012, 1(2): 140-146. DOI:10.1016/j.bcab.2011.09.002 |
| [49] |
ZHANG S, AMIN F, XIONG M, et al. High-yield intracellular production of an exo-polygalacturonase enzyme via heterologous expression of Penicillium notatum gene in Saccharomyces cerevisiae[J]. Int Food Res J, 2021, 28(4): 664-671. DOI:10.47836/ifrj.28.4.03 |
| [50] |
LIMA J O, PEREIRA J F, DE ARAÚJO E F, et al. Pectin lyase overproduction by Penicillium griseoroseum mutants resistant to catabolite repression[J]. Braz J Microbiol, 2017, 48(3): 602-606. DOI:10.1016/j.bjm.2016.12.009 |
| [51] |
CARDOSO P G, RIBEIRO J B, TEIXEIRA J A, et al. Overexpression of the plg1 gene encoding pectin lyase in Penicillium griseoroseum[J]. J Ind Microbiol Biotechnol, 2008, 35(3): 159-166. DOI:10.1007/s10295-007-0277-6 |
| [52] |
CARDOSO P G, TEIXEIRA J A, DE QUEIROZ M V, et al. Pectin lyase production by recombinant Penicillium griseoroseum strain 105[J]. Can J Microbiol, 2010, 56(10): 831-837. DOI:10.1139/w10-072 |
(编辑 范子娟)



