2. 中国科学院亚热带农业生态研究所 亚热带农业 生态过程重点实验室 畜禽养殖污染控制与资源化技术国家工程实验室 湖南省畜禽健康养殖工程技术研究中心动 物营养生理与代谢过程湖南省重点实验室, 长沙 410125;
3. 北京农学院动物科学技术学院奶牛营养学北京市重点实验室, 北京 102206
2. Hunan Key Laboratory of Animal Nutritional Physiology and Metabolism, Hunan Livestock and Poultry Health Breeding Engineering Technology Research Center, National Engineering Laboratory of Pollution Control and Resource Technology for Livestock and Poultry Breeding, Key Laboratory of Agro-ecological Processes in Subtropical Region, Institute of Subtropical Agriculture, Chinese Academy of Sciences, Changsha 410125, China;
3. Beijing Key Laboratory of Dairy Cattle Nutrition, Animal Science and Technology College, Beijing University of Agriculture, Beijing 102206, China
反刍动物肠道中存在着丰富的微生物群落,其数量大且种类多样。肠道微生物与宿主相互依存影响,构成了以细菌占据主导地位的肠道微生物系统[1]。反刍动物的肠道可分为小肠和大肠,不同肠段的化学性质、营养情况以及免疫活性存在差异,这些差异影响了不同肠段肠道微生物群落的组成。
1 肠道微生物的功能虽然肠道微生物在不同肠段的组成存在差异,但总体功能可大致分为营养代谢、免疫和维持肠道稳态[2]。
1.1 营养与代谢功能肠道微生物除了能够合成多种氨基酸和蛋白质外,其具备的一些代谢特性是宿主本身不具备的。例如,反刍动物自身不能合成降解纤维素的酶系,主要依赖肠道中具有纤维素分解活性的微生物来分解食物中纤维素,其他营养物质如淀粉、脂肪和蛋白质等的分解利用需要肠道微生物的参与。分解后得到的小分子产物需要通过肠道及其他组织的转运蛋白运输到细胞内部发挥作用[3],而肠道中部分微生物能够增加转运蛋白的含量[4]。这种肠道微生物与宿主共生的关系极大提高了能量的利用率,对宿主的营养与代谢具有深远的影响。
1.2 免疫功能肠道微生物与宿主免疫系统间存在着密切的交流和协作机制。肠道微生物产生的短链脂肪酸(short-chain fatty acids,SCFA)可作为能源物质被肠道上皮细胞和外周组织吸收,从而使肠屏障发挥正常的免疫功能[5]。Petersson等[6]发现,在没有肠道微生物群的情况下,肠道上皮和黏膜免疫系统的发育减缓,黏液屏障的厚度变薄,但是将微生物产生的脂多糖和肽聚糖注射到结肠黏膜表面后,能刺激肠道黏液的产生,使肠道黏液层的厚度在40 min内恢复到正常厚度。肠道黏液层是贯穿胃肠道的重要生物学屏障,能够阻止致病菌的定植[7],该研究表明肠道微生物在肠黏膜发挥免疫过程中至关重要。
新生反刍动物肠道中含有较高丰度的致病菌,如大肠杆菌(Escherichia coli)、志贺菌属(Shigella genera)和沙门菌(Salmonella)等,容易引起动物腹泻,是断奶前犊牛死亡率高的主要原因[8]。肠道微生物通过两种方式调节宿主肠道黏膜免疫,一种是增强宿主肠道生物学屏障,阻止病原菌的定植,另一种通过其特定组分刺激免疫细胞如Tregs细胞、Th17细胞的分化,从而增强宿主免疫功能[9]。
1.3 维持肠道稳态健康的肠道环境是平衡而稳定的,肠道稳态的调节主要由肠道微生物进行。幼龄动物肠道微生物的定植受物种间竞争及环境因素的制约,这两者共同决定了肠道微生物群的组成。环境因素包括饮食、宿主来源的产物及微生物来源的产物。如肠道中的双歧杆菌(Bifidobacterium)和乳酸杆菌(Lactobacillus)会分解低聚糖产生酸类物质,使肠道内pH降低,抑制病原菌的生长与繁殖[10]。另外,饮食摄入的益生元可以在结肠中被益生菌发酵并产生SCFA[11],当SCFA浓度升高时可抑制沙门菌等有害菌的生长[12]。致病性大肠杆菌是引起新生犊牛腹泻的主要原因,在犊牛出生后的第1周饲喂双歧杆菌和乳酸杆菌可以有效降低新生犊牛的腹泻发生率[13],一旦肠道微生物群发展成熟,微生物间竞争及环境因素就能阻止新的微生物定植,防止感染。但过多的致病菌能够通过其毒力因子引发肠道炎症反应来克服这种定植抵抗。因此肠道微生物在维持肠道稳态上有着重要意义,肠道微生物群失调意味着肠道稳态的破坏。
2 肠道微生物的定植规律人们普遍认为新生儿肠道是无菌的[14],微生物群落在出生后开始迅速定植[15]。但最新的研究表明,在生产前新生儿肠道便存在着低多样性、低生物量的具有代谢活性的微生物群落[16]。Smith[17]的研究表明,大肠杆菌和链球菌(Streptococcus)在出生后8 h内定植于犊牛肠道的所有区域,在出生8 h后,产气荚膜梭菌(Clostridium perfringens)开始在犊牛的盲肠中定植,并在产后18 h能在其他肠道区域检测到[18]。产气荚膜梭菌可以发酵葡萄糖、乳糖和蔗糖等物质产生SCFA,作为能源物质供宿主使用。产气荚膜梭菌在生命初期就开始在肠道中定植,与反刍动物生命初期的饮食习惯相适应。在出生后第1天,能检测到乳酸杆菌,并且在出生后1周龄内在肠道的所有区域占优势。出生后第2天,盲肠和粪便中检测到类杆菌(Bacteroides)[17],3~7日龄犊牛的肠道中双歧杆菌和乳酸杆菌的比例较高,但大肠杆菌的含量较低。这些研究表明,肠道的初始定植菌主要是需氧和兼性厌氧细菌,通过消耗可用的氧气来创建厌氧环境,以利于专性厌氧肠道微生物群,如双歧杆菌和类杆菌的定植,这与肠道细菌在其他新生哺乳动物中的定植进化相似[18]。
出生24 h后,链球菌和肠杆菌(Enterobacteriaceae)在肠道中大量存在,在犊牛的后肠道中检测到了很高丰度的大肠杆菌、志贺菌属以及少量的致病菌,如沙门菌及肠球菌(Enterococcus)等[19]。说明在生命早期,新生犊牛易患上肠道疾病,可能导致死亡。这也是目前畜牧业所面临的一个重要挑战,加强对幼龄反刍动物肠道微生物调控的研究对提高新生儿存活率具有重要意义。
在出生后24 h还检测到了相对丰度极低的乳酸杆菌的存在,表明严格厌氧菌此时已经开始在肠道中定植,拟杆菌在乳酸杆菌之后定植,犊牛出生2 d后在可在盲肠和粪便中检测到[17, 19]。新生反刍动物的饮食大多为初乳,富含糖、脂、蛋白质等物质,但是研究发现,在3~5日龄的犊牛肠道中就已经有了少量纤维素降解细菌的存在,而且它们的数量会在2~3周龄时变的丰富[20]。一般来说,反刍动物在出生3~4周龄时会逐渐开始摄入少量饲料,但是由于在生命早期瘤胃还没有发育完全,不能通过瘤胃发酵摄入纤维素等物质,因此,来自后肠道的能量可能是犊牛在这个阶段的主要能量来源,对生命最初几周龄的幼龄反刍动物来说,后肠道微生物发酵更加重要[21]。
反刍动物出生7 d后,肠道微生物的物种多样性再次增加,多样性在门水平上已经和成年反刍动物相似,之前丰度最高的变形菌门(Proteobacteria)逐渐被厚壁菌门(Firmicutes)、变形菌门、拟杆菌门和放线菌门(Actinobacteria)所替代。在检测的肠道区域中,普氏栖粪杆菌(Faecalibacterium prausnitzii)、拟杆菌属占据了主导地位,其次是乳酸杆菌、丁酸球菌(Butyricicoccus)和双歧杆菌等,但是随着年龄的增加,普氏栖粪杆菌在总菌群中所占比例会逐渐降低,而乳杆菌和双歧杆菌的相对丰度在逐渐升高[19]。产后5周龄,在犊牛消化道内观察到黄色瘤胃球菌(Ruminococcus flavefaciens)和其他纤维降解菌,但是未观察到链球菌属和乳球菌属(Lactococcus lactis)[22]。这种现象表明,在出生后5周龄,生命最早期定植的好氧菌和兼性厌氧菌基本被其他厌氧菌群取代,并且肠道内已经定植了大量的纤维素降解细菌,肠道微生物发酵产生的SCFA为幼龄反刍动物的生长发育提供了能量来源。
到了6~8周龄时,犊牛肠道微生物组成和成年牛相似,厚壁菌门、拟杆菌门和变形菌门占主导地位。另外,肠道中早期定植的好氧和兼性厌氧菌群下降到了一个恒定的水平,并被双歧杆菌和乳酸杆菌等严格厌氧菌取代[23]。对成年奶牛粪便中的微生物进行16S rDNA扩增子测序发现,在门水平上,厚壁菌门(637%)和变形菌门(183%)是主要优势菌,其次是拟杆菌门(76%)和放线菌门(68%),其他菌门仅占很小一部分[24]。成年反刍动物不同于幼龄反刍动物,它们的饮食主要为植物,富含大量纤维素,所以和能量代谢相关的拟杆菌门在成年反刍动物肠道中则为绝对的优势菌群,大约占总细菌的70%以上,且基本上为普雷沃氏菌(Prevotella)[25]。本文总结的新生反刍动物从出生到8周龄肠道微生物的定植规律如图 1所示。最初定植的是需氧及兼性厌氧菌,24 h后严格厌氧菌开始定植,且有致病菌定植。3~5日内有少量的纤维素降解菌定植,1周龄后肠道微生物丰富度增加,门水平上已与成年动物相似。5周龄后最初定植的需氧及兼性厌氧菌已经被严格厌氧菌取代,6~8周龄肠道微生物组成已与成年动物相似。
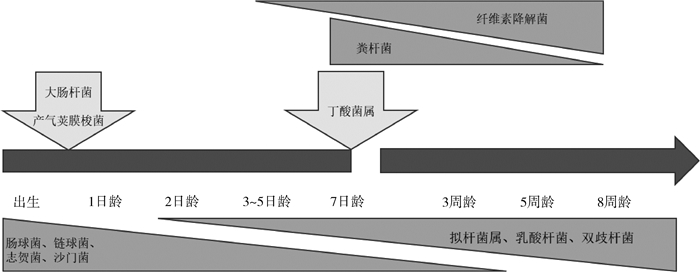
|
图 1 新生反刍动物从出生到8周龄肠道微生物的定植规律 Fig. 1 Colonization pattern of gut microorganisms in newborn ruminants from birth to 8 weeks old |
新生反刍动物需要饲喂初乳,其饲喂策略会显著影响生命初期肠道微生物定植。Fischer等[26]研究表明,延迟初乳饲喂会延缓肠道微生物的定植过程,从而导致动物断奶前潜在的感染风险。在生产中,为了减少病原菌污染,加热初乳也是一种常见策略,有研究表明,在出生后的12 h内喂食经过热处理的初乳可以增加双歧杆菌,减少大肠杆菌在犊牛小肠的定植[27]。同时,有研究尝试向初乳中添加日粮添加剂以改善反刍动物生命初期的健康,例如Yang等[28]向初乳中添加甘露寡糖,发现向初乳中添加甘露寡糖能促进乳酸菌的定植。
断奶期间,反刍动物肠道微生物发生剧烈变化,断奶前的日粮组成是变化的主要因素。断奶过程中固体饲料的添加是调控肠道微生物定植的一个关键窗口,随着固体饲料逐渐替代母乳,降解纤维素的肠道细菌如普雷沃氏菌和瘤胃球菌(Ruminococcus)所占比例逐渐增加,最终成为优势菌[29]。为了使幼龄反刍动物顺利断奶,生产中常用开食料进行母乳与饲料间的过渡,开食料中的淀粉也是影响肠道微生物定植的因素。戴求仲等[30]研究表明,提高饲粮直/支链淀粉比值能增加后肠道中肠球菌、乳酸杆菌和双歧杆菌数量,减少大肠杆菌数量。
3.2 益生菌和益生元等益生菌是有活性的微生物,可以通过改善宿主肠道微生物平衡而对宿主产生有益影响,其作为饲料添加剂而被广泛应用于畜牧业中[3]。常见的益生菌有乳酸杆菌、酵母菌(Saccharomyces)、芽孢杆菌(Bacillus)、双歧杆菌等。双歧杆菌和乳酸杆菌可以定植和黏附在新生儿的肠道黏膜上,与致病细菌竞争,从而减少腹泻的发生率,增加幼龄反刍动物的体重[31]。Zhao等[32]给断奶前的犊牛饲喂益生菌,将从成年牛的粪便和组织中分离出来的益生菌添加到饲粮中饲喂给断奶前的犊牛,虽然没有改变粪便细菌的丰富度和多样性,但是益生菌处理组的犊牛粪便中的发酵菌和有益菌的数量明显增多,一些条件致病菌如蜡样芽孢杆菌(Bacillus cereus)、阪崎肠杆菌(Enterobacter sakazakii)的生长受到明显抑制,有效减少肠道中病原性大肠杆菌O157:H7的数量。但He等[33]研究发现,在新生犊牛的代乳粉中补充酵母菌并没有影响犊牛的采食量、平均日增重和粪便评分等,对引起腹泻的大肠杆菌以及肠道有益菌的影响都微乎其微,在犊牛没有疾病的情况下,喂养酵母益生菌对犊牛的生长性能和健康没有明显效果。肠道微生物会随着时间的推移产生变化,因此对于幼龄反刍动物日粮添加益生菌的研究中也应该注意年龄因素对结果的影响。
益生元指一些不被宿主消化吸收,能够选择性地促进体内有益菌的代谢和增殖,从而改善宿主健康的有机物质。常见的益生元有低聚糖类、微藻类、多糖类、蛋白质水解物及天然植物提取物等。有研究表明,添加低聚果糖能选择性地促进双歧杆菌、罗伊氏乳杆菌和韦荣氏球菌在瘤胃及后肠道定植,显著抑制了沙门菌和大肠杆菌在肠道上皮的黏附[34]。Sharma等[35]的研究发现,以每头犊牛4 g·d-1的甘露寡糖作为益生元添加到5~7日龄的犊牛的饲粮中,可以在犊牛粪便中检测到更多的乳酸杆菌和双歧杆菌数量,减少粪便中大肠杆菌的数量,还可以改善犊牛的采食量,提高饲料转化率。肠道中许多革兰阴性细菌依靠菌毛附着于肠上皮,甘露寡糖会与这些细菌的菌毛特异性结合,从而使它们不能黏附于肠上皮,而且甘露寡糖在小肠中不能被酶消化,所以与甘露寡糖结合的病原性细菌很可能不与上皮细胞结合就离开了肠道[36]。此外,甘露寡糖还会被肠道中的双歧杆菌和乳酸菌分解为短链脂肪酸,降低肠道pH,从而抑制致病细菌生长[37]。同样,Castro等[38]也发现,给新生犊牛的代乳粉中添加低聚半乳糖可以增加结肠中乳酸杆菌和双歧杆菌相对丰度且犊牛具有更发达的肠道上皮结构,还减少了粪杆菌属、梭菌属和螺旋菌属等菌属的相对丰度,不过这种结果在犊牛出生的前2周比较明显,到了第4周时对照组和处理组没有显著差异,这可能说明在整个肠道微生物定植过程的早期更容易受到影响。
将益生菌与益生元结合使用的生物制剂称为合生元,能同时发挥益生菌和益生元的作用。接种新鲜的瘤胃液对幼龄反刍动物有积极的影响。出生后接种新鲜的瘤胃液可以促进瘤胃发育,增加断奶前羔羊的平均日增重[39],但接种瘤胃液引起的肠道微生物变化仍不清楚。据报道,接种瘤胃液不仅促进了羔羊结肠中微生物的定植,而且在断奶时更容易从母乳过渡到固体饲料,这有利于反刍动物在断奶后阶段的生长,将降低反刍动物的负担[40]。所以瘤胃液可视为一种潜在的益生元,在对反刍动物肠道微生物的营养调控中具有一定价值。
后生元是益生菌经加工处理后的益生菌代谢物成分统称,包括菌体与代谢产物。有研究表明,在断奶后羔羊的日粮中添加0.9% 的植物乳杆菌RG14后生元可改善生长性能、营养摄入和营养消化率[41]。说明后生元是一种潜在的饲料添加剂,可用于促进断奶后反刍动物的瘤胃发酵和生长。
4 小结近年来,对于反刍动物胃肠道微生物的研究已经越来越多,但是由于肠道内微生物的种类较多且数量庞大,所以到目前为止,对反刍动物胃肠道微生物的认识仍有不足。与成年反刍动物稳定的肠道微生物群落不同,幼龄反刍动物的肠道微生物群落需要经历一些明显的特定时期变化,例如从非反刍期到反刍期,从断奶前到断奶后,从好氧细菌的定植到厌氧细菌取代好氧细菌。肠道微生物的改变窗口可能会成为针对肠道微生物定植的早期干预提供机会,如添加益生菌和益生元,以增强免疫系统,改善健康状况,促进幼龄反刍动物的发育。
目前,对肠道微生物定植的最佳干预时间的研究还很少。此外,改变的肠道微生物如何影响幼龄反刍动物的肠道微生物发展,以及对幼龄反刍动物健康和发育的长期影响值得进一步研究。因此,有必要通过基于基因组学或代谢组学的方法进一步识别关键元素,并探索特定肠道微生物的功能作用,更全面地了解肠道微生物群落的发展规律,以便有针对性地进行调控。
| [1] |
SAVAGE D C. Microbial ecology of the gastrointestinal tract[J]. Ann Rev Microbiol, 1977, 31: 107-133. DOI:10.1146/annurev.mi.31.100177.000543 |
| [2] |
LEY R E, PETERSON D A, GORDON J I. Ecological and evolutionary forces shaping microbial diversity in the human intestine[J]. Cell, 2006, 124(4): 837-848. DOI:10.1016/j.cell.2006.02.017 |
| [3] |
徐函, 吴艳萍, 梅小强, 等. 益生菌影响动物营养物质消化吸收及肝脏代谢的研究进展[J]. 动物营养学报, 2018, 30(10): 3850-3856. XU H, WU Y P, MEI X Q, et al. Research progress of probiotics effects on animal digestion, absorption and liver metabolism of nutrients[J]. Chinese Journal of Animal Nutrition, 2018, 30(10): 3850-3856. (in Chinese) |
| [4] |
JAHROMI M F, ALTAHER Y W, SHOKRYAZDAN P, et al. Dietary supplementation of a mixture of Lactobacillus strains enhances performance of broiler chickens raised under heat stress conditions[J]. Int J Biometeorol, 2016, 60(7): 1099-1110. DOI:10.1007/s00484-015-1103-x |
| [5] |
SEKIROV I, RUSSELL S L, ANTUNES L C M, et al. Gut microbiota in health and disease[J]. Physiol Rev, 2010, 90(3): 859-904. DOI:10.1152/physrev.00045.2009 |
| [6] |
PETERSSON J, SCHREIBER O, HANSSON G C, et al. Importance and regulation of the colonic mucus barrier in a mouse model of colitis[J]. Am J Physiol Gastrointest Liver Physiol, 2011, 300(2): G327-G333. DOI:10.1152/ajpgi.00422.2010 |
| [7] |
谭支良. 动物胃肠道微生态理论与实践[J]. 应用生态学报, 2003, 14(1): 148-150. TAN Z L. Micro-ecology in animal stomach and digestive tracts-theory and practice[J]. Chinese Journal of Applied Ecology, 2003, 14(1): 148-150. DOI:10.3321/j.issn:1001-9332.2003.01.033 (in Chinese) |
| [8] |
UETAKE K. Newborn calf welfare: a review focusing on mortality rates[J]. Anim Sci J, 2013, 84(2): 101-105. DOI:10.1111/asj.12019 |
| [9] |
李苗, 孙迪, 付冰冰, 等. 肠道菌群与自身免疫性疾病研究进展[J]. 中国微生态学杂志, 2015, 27(10): 1233-1237. LI M, SUN D, FU B B, et al. Research on gut microbiota and autoimmune disease: progress review[J]. Chinese Journal of Microecology, 2015, 27(10): 1233-1237. DOI:10.13381/j.cnki.cjm.201510032 (in Chinese) |
| [10] |
CORCIONIVOSCHI N, DRINCEANU D, STEF L, et al. Probiotics-identification and ways of action[J]. Innovative Rom Food Biotechnol, 2010, 6: 1-11. |
| [11] |
ROODPOSHTI P M, DABIRI N. Effects of probiotic and prebiotic on average daily gain, fecal shedding of Escherichia coli, and immune system status in newborn female calves[J]. Asian-Australas J Anim Sci, 2012, 25(9): 1255-1261. DOI:10.5713/ajas.2011.11312 |
| [12] |
OHLAND C L, MACNAUGHTON W K. Probiotic bacteria and intestinal epithelial barrier function[J]. Am J Physiol Gastrointest Liver Physiol, 2010, 298(6): G807-G819. DOI:10.1152/ajpgi.00243.2009 |
| [13] |
ABE F, ISHIBASHI N, SHIMAMURA S. Effect of administration of bifidobacteria and lactic acid bacteria to newborn calves and piglets[J]. J Dairy Sci, 1995, 78(12): 2838-2846. DOI:10.3168/jds.S0022-0302(95)76914-4 |
| [14] |
YÁÑEZ-RUIZ D R, ABECIA L, NEWBOLD C J. Manipulating rumen microbiome and fermentation through interventions during early life: a review[J]. Front Microbiol, 2015, 6: 1133. |
| [15] |
KLEIN-JÖBSTL D, SCHORNSTEINER E, MANN E, et al. Pyrosequencing reveals diverse fecal microbiota in simmental calves during early development[J]. Front Microbiol, 2014, 5: 622. |
| [16] |
BI Y L, TU Y, ZHANG N F, et al. Multiomics analysis reveals the presence of a microbiome in the gut of fetal lambs[J]. Gut, 2021, 70(5): 853-864. DOI:10.1136/gutjnl-2020-320951 |
| [17] |
SMITH H W. The development of the flora of the alimentary tract in young animals[J]. J Pathol Bacteriol, 1965, 90(2): 495-513. |
| [18] |
JOST T, LACROIX C, BRAEGGER C P, et al. New insights in gut microbiota establishment in healthy breast fed neonates[J]. PLoS One, 2012, 7(8): e44595. DOI:10.1371/journal.pone.0044595 |
| [19] |
ALIPOUR M J, JALANKA J, PESSA-MORIKAWA T, et al. Publisher correction: The composition of the perinatal intestinal microbiota in cattle[J]. Sci Rep, 2018, 8(1): 13792. DOI:10.1038/s41598-018-31494-3 |
| [20] |
FONTY G, GOUET P, JOUANY J P, et al. Ecological factors determining establishment of cellulolytic bacteria and protozoa in the rumens of meroxenic lambs[J]. J Gen Microbiol, 1983, 129(1): 213-223. |
| [21] |
田全华, 赵旭, 刘勇, 等. 饲粮添加黄芪和葡聚糖硫酸钠盐刺激对羔羊后肠道发酵和微生物组成的影响[J]. 中国畜牧兽医, 2021, 48(9): 3242-3253. TIAN Q H, ZHAO X, LIU Y, et al. Effects of Astragalus membranaceus and dextran sodium sulfate stimulation on intestinal hindgut fermentation and microbial composition of lambs[J]. China Animal Husbandry & Veterinary Medicine, 2021, 48(9): 3242-3253. DOI:10.16431/j.cnki.1671-7236.2021.09.015 (in Chinese) |
| [22] |
UYENO Y, SEKIGUCHI Y, KAMAGATA Y. rRNA-based analysis to monitor succession of faecal bacterial communities in Holstein calves[J]. Lett Appl Microbiol, 2010, 51(5): 570-577. DOI:10.1111/j.1472-765X.2010.02937.x |
| [23] |
BRYANT M P, SMALL N, BOUMA C, et al. Studies on the composition of the ruminal flora and fauna of young calves[J]. J Dairy Sci, 1958, 41(12): 1747-1767. DOI:10.3168/jds.S0022-0302(58)91160-3 |
| [24] |
MAO S Y, ZHANG R Y, WANG D S, et al. The diversity of the fecal bacterial community and its relationship with the concentration of volatile fatty acids in the feces during subacute rumen acidosis in dairy cows[J]. BMC Vet Res, 2012, 8: 237. DOI:10.1186/1746-6148-8-237 |
| [25] |
JAMI E, ISRAEL A, KOTSER A, et al. Exploring the bovine rumen bacterial community from birth to adulthood[J]. ISME J, 2013, 7(6): 1069-1079. DOI:10.1038/ismej.2013.2 |
| [26] |
FISCHER A J, SONG Y, HE Z, et al. Effect of delaying colostrum feeding on passive transfer and intestinal bacterial colonization in neonatal male Holstein calves[J]. J Dairy Sci, 2018, 101(4): 3099-3109. DOI:10.3168/jds.2017-13397 |
| [27] |
MALMUTHUGE N, CHEN Y H, LIANG G X, et al. Heat-treated colostrum feeding promotes beneficial bacteria colonization in the small intestine of neonatal calves[J]. J Dairy Sci, 2015, 98(11): 8044-8053. DOI:10.3168/jds.2015-9607 |
| [28] |
YANG C, ZHANG T X, TIAN Q H, et al. Supplementing mannan oligosaccharide reduces the passive transfer of immunoglobulin G and improves antioxidative capacity, immunity, and intestinal microbiota in neonatal goats[J]. Front Microbiol, 2022, 12: 795081. DOI:10.3389/fmicb.2021.795081 |
| [29] |
LI Z P, LIU H L, LI G Y, et al. Molecular diversity of rumen bacterial communities from tannin-rich and fiber-rich forage fed domestic sika deer (Cervus nippon) in China[J]. BMC Microbiol, 2013, 13: 151. DOI:10.1186/1471-2180-13-151 |
| [30] |
戴求仲, 刘绍伟, 李湘, 等. 饲粮直/支链淀粉比对黄羽肉鸡血液生化指标和后肠微生物菌群的影响[J]. 动物营养学报, 2010, 22(4): 904-910. DAI Q Z, LIU S W, LI X, et al. Effects of dietary amylose/amylopectin ratio on blood biochemical parameters and hindgut microbial flora of yellow broilers[J]. Chinese Journal of Animal Nutrition, 2010, 22(4): 904-910. DOI:10.3969/j.issn.1006-267x.2010.04.014 (in Chinese) |
| [31] |
XU H Y, HUANG W Q, HOU Q C, et al. The effects of probiotics administration on the milk Production, milk components and fecal bacteria microbiota of dairy cows[J]. Sci Bull (Beijing), 2017, 62(11): 767-774. DOI:10.1016/j.scib.2017.04.019 |
| [32] |
ZHAO T, DOYLE M P, HARMON B G, et al. Reduction of carriage of enterohemorrhagic Escherichia coli O157:H7 in cattle by inoculation with probiotic bacteria[J]. J Clin Microbiol, 1998, 36(3): 641-647. DOI:10.1128/JCM.36.3.641-647.1998 |
| [33] |
HE Z X, FERLISI B, ECKERT E, et al. Supplementing a yeast probiotic to pre-weaning Holstein calves: feed intake, growth and fecal biomarkers of gut health[J]. Anim Feed Sci Technol, 2017, 226: 81-87. DOI:10.1016/j.anifeedsci.2017.02.010 |
| [34] |
UYENO Y, SHIGEMORI S, SHIMOSATO T. Effect of probiotics/prebiotics on cattle health and productivity[J]. Microbes Environ, 2015, 30(2): 126-132. DOI:10.1264/jsme2.ME14176 |
| [35] |
SHARMA A N, KUMAR S, TYAGI A K. Effects of mannan-oligosaccharides and Lactobacillus acidophilus supplementation on growth performance, nutrient utilization and faecal characteristics in Murrah buffalo calves[J]. J Anim Physiol Anim Nutr (Berl), 2018, 102(3): 679-689. DOI:10.1111/jpn.12878 |
| [36] |
SPRING P, WENK C, DAWSON K A, et al. The effects of dietary mannaoligosaccharides on cecal parameters and the concentrations of enteric bacteria in the ceca of salmonella-challenged broiler chicks[J]. Poult Sci, 2000, 79(2): 205-211. DOI:10.1093/ps/79.2.205 |
| [37] |
MIZOTA T. Functional and nutritional foods containing bifidogenic factors: Oligosaccharides and probiotic bacteria[J]. Bull Int Dairy Fed, 1996(313): 31-35. |
| [38] |
CASTRO J J, GOMEZ A, WHITE B A, et al. Changes in the intestinal bacterial community, short-chain fatty acid profile, and intestinal development of preweaned holstein calves.1.Effects of prebiotic supplementation depend on site and age[J]. J Dairy Sci, 2016, 99(12): 9682-9702. DOI:10.3168/jds.2016-11006 |
| [39] |
ZHONG R Z, SUN H X, LI G D, et al. Effects of inoculation with rumen fluid on nutrient digestibility, growth performance and rumen fermentation of early weaned lambs[J]. Livest Sci, 2014, 162: 154-158. DOI:10.1016/j.livsci.2013.12.021 |
| [40] |
PALMA-HIDALGO J M, JIMÉNEZ E, POPOVA M, et al. Inoculation with rumen fluid in early life accelerates the rumen microbial development and favours the weaning process in goats[J]. Anim Microbiome, 2021, 3(1): 11. DOI:10.1186/s42523-021-00073-9 |
| [41] |
IZUDDIN W I, LOH T C, SAMSUDIN A A, et al. Effects of postbiotic supplementation on growth performance, ruminal fermentation and microbial profile, blood metabolite and GHR, IGF-1 and MCT-1 gene expression in post-weaning lambs[J]. BMC Vet Res, 2019, 15(1): 315. DOI:10.1186/s12917-019-2064-9 |
(编辑 范子娟)



