2. 贵州省动物疫病研究室生物制品工程技术研究中心, 贵阳 550025
2. Guizhou Animal Biological Products Engineering Technology Research Center, Guiyang, Guizhou 550025, China
产气荚膜梭菌(Clostridium perfringens,Cp)作为一种厌氧、产孢子的革兰阳性菌,能以极快速度在食物、伤口或肠道中增殖而致病[1-3]。它可产生多种毒素,根据毒素类型的不同将其分为A、B、C、D、E、F、G型[4-5]。其广泛分布于各种环境、动物和人类的胃肠道中,可引起坏死性肠炎、人气性坏疽、食物中毒和非食源性胃肠道疾病等[6-7]。其中, A型能广泛引起人类和畜禽的气性坏疽、肠炎和肠毒素血症等,危害极大。中国作为一个鸭肉消费大国,根据联合国粮农组织提供的数据显示,中国在2013年肉鸭总数占全球的40%以上,是世界上肉鸭产量最多的国家。而近年来关于鸭感染产气荚膜梭菌的报道也不断增多,Xiu等[8]从山东采集了424份泄殖腔拭子和环境样本,其中, 207份(48.82%)检测为阳性,从每个阳性样本中至少分离1株产气荚膜梭菌,共分离到402株产气荚膜菌均为A型。表明A型产气荚膜梭菌对鸭的危害极大,因此了解A型产气荚膜梭菌对鸭的感染机制变得十分重要。
代谢组学是近年来生命科学领域的一种新兴方法,可全景式地揭示机体营养物质代谢过程中的种类和数量的变化,从而探究这些变化背后的规律[9]。其中, 气相色谱-质谱(GC-MS)作为代谢组学研究中最有效、可重现和最常用的分析平台之一,一直是热门选择[10]。课题组前期发现鸭肠炎病毒单独感染会引起Cp丰度增高以及鸭肠炎病毒和CpA共感染鸭后会加剧肠道的炎症进程[11, 12]。但关于CpA感染鸭的代谢组学研究较少,因此本试验采用液相色谱-质谱联用(LC-MS)技术,探究CpA感染鸭66、90和114 h时回肠的差异代谢物和相关代谢通路,为CpA感染鸭的致病机制提供科学依据。
1 材料与方法 1.1 菌株及实验动物A型产气荚膜梭菌(CVCC2030)购自中国兽医药品监察所微生物菌种保藏中心。1日龄健康试验鸭24只,购自广东省鸣燕禽业有限公司,经ELISA检测试验鸭血清CpA抗体与CpA核酸检测均为阴性。
1.2 鸭感染CpA样本采集、剖检病理观察以及CpA的PCR检测1日龄健康鸭24只,饲养至37日龄,随机分为感染组(66、90和114 h)和对照组,每组6只,感染组鸭以灌胃接种8 mL CpA菌液(1×108 CFU·mL-1),每日一次,每次间隔24 h,连续灌胃4 d,对照组灌同体积生理盐水。感染组CpA连续灌胃4 d,最后一次灌喂后间隔66、90和114 h时将试验鸭麻醉后颈静脉放血处死,取感染组(间隔66、90和114 h)18只鸭的回肠样本各1份,共计18份样本;对照组在生理盐水连续灌胃4 d后,间隔66 h时无菌采集6只鸭的回肠样本1份,共计6份样本。
剖检病理观察:将试验鸭麻醉后颈静脉放血处死,迅速打开鸭胸腔和腹腔,观察脾、十二指肠和回肠等组织器官大体病变情况。
使用DNA提取试剂盒提取采集的回肠DNA样本,进行PCR扩增,检测CpA α毒素基因,同时将PCR产物送至生工生物工程(上海)股份有限公司,进行DNA测序鉴定。
1.3 鸭回肠样品的LC-MS检测色谱条件:使用BEHC18色谱柱(2.1 mm×100 mm,1.7 μm, 美国Waters公司),柱温45 ℃,流速0.35 mL·min-1,正离子流动相0.1%甲酸的水溶液(A液)、0.1%甲酸及100%甲醇混合液(B液),负离子流动相含10 mmol·L-1甲酸氨的水溶液(A液)、含10 mmol·L-1甲酸氨及95%甲醇混合液(B液)。
质谱条件:使用Q Exactive HF质谱仪数据采集,电喷雾离子源(ESI)参数设置:鞘气流速40,辅助气流速10,喷雾电压正3.80 kV和负3.20 kV,离子传输管温度320 ℃,辅助气加热温度350 ℃。
1.4 数据处理将LC-MS/MS采集的质谱原始数据(raw文件)导入Compound Discoverer 3.1进行数据处理。采用PCA、PLS-DA和单变量分析相结合的方式筛选CpA感染回肠差异代谢物。筛选条件:1)PLS-DA模型前两个主成分的VIP≥1;2)Fold-change≥1.2或者≤0.83;3)P-value < 0.05。对差异代谢物进行聚类分析,分析时对数据进行log2转换和z-score标准化(zero-mean normalization)处理。基于KEGG数据库对差异代谢物进行代谢通路富集分析,利用超几何检验找出显著富集的Pathway条目。
1.5 CpA感染鸭回肠差异氨基酸验证1.5.1 试验分组、代谢物及标准溶液制备 为验证非靶向代谢组学数据的正确性,进一步对感染114 h鸭回肠差异代谢物丙氨酸(Ala)、缬氨酸(Val)进行了验证性检测。称取适量采集样本于2 mL EP管中,加入10%甲酸甲醇溶液-H2O (1∶1)溶液和钢珠,涡旋振荡后放入组织研磨器中研磨、离心后取上清液, 加入10%甲酸甲醇-H2O(1∶1)溶液,涡旋振荡后取稀释后的样本, 加入双同位素内标,再涡旋振荡取上清液经0.22 μm膜过滤,将过滤液加入到检测瓶中。
再称取丙氨酸、缬氨酸标准品适量,用甲醇或水配制单标母液,取适量的各母液制成混合标准品,用水稀释至合适浓度,制成工作标准溶液,称取适量的2种同位素标准品,用水配制混标母液浓度为100 ng·mL-1。
1.5.2 代谢组测序条件设计 色谱条件:使用ACQUITY UPLC®BEH C18色谱柱(2.1 mm×100 mm,1.7 μm,美国Waters公司),进样量5 μL,柱温40 ℃,流动相A:10%甲醇水(含0.1%甲酸),流动相B:50%甲醇水(含0.1%甲酸)。
质谱条件:电喷雾电离(ESI)源,正离子电离模式。温度500 ℃,电压5 500 V,碰撞气6 psi,气帘气30 psi,雾化气和辅助气均为50 psi。采用多重反应监测(MRM)方法进行扫描。
1.5.3 样本质控和氨基酸标准曲线 采用LC-MS检测技术对丙氨酸、缬氨酸标准溶液进行日间精密度、重复性、回收率检测,评价仪器分析稳定性及重复性,将工作标准溶液进样6次,计算日内精密度,以RSD表示,浓度质控样本平行处理8份。
对各工作标准溶液分别进行LC-MS检测,以工作标准溶液的浓度为横坐标,峰面积比值为纵坐标,考察线性范围并绘制标准曲线,得到缬氨酸、丙氨酸的氨基酸的线性回归方程。
1.5.4 回肠差异氨基酸定量分析 根据建立的样品预处理和仪器分析方法,进行对照组和感染114 h回肠差异代谢物缬氨酸、丙氨酸进行定量分析。分析中使用的多元统计分析方法为PCA和PLS-DA分析。
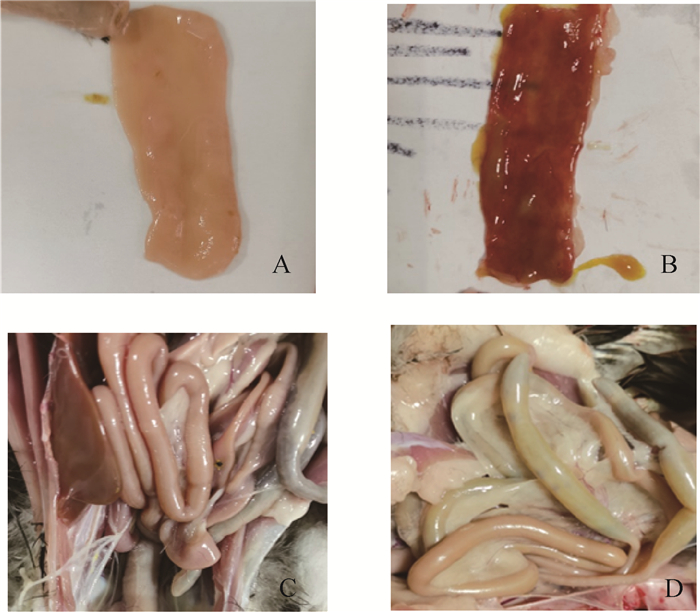
2 结果 2.1 感染后CpA的剖检病理观察经观察,感染组鸭小肠臌气、肠黏膜变薄、回肠充血、出血(图 1B、D),对照组鸭无肉眼可见病变(图 1A、C),结果表明,CpA感染组鸭剖检病理变化与CpA感染典型病变相似。
|
A、C. 对照组鸭肠道;B、D. 感染组鸭肠道 A, C. Intestines of control duck; B, D. Intestines of infected duck 图 1 A型产气荚膜梭菌感染鸭肠道大体病变 Fig. 1 Gross intestinal lesions of ducks infected with Clostridium perfringens type A |
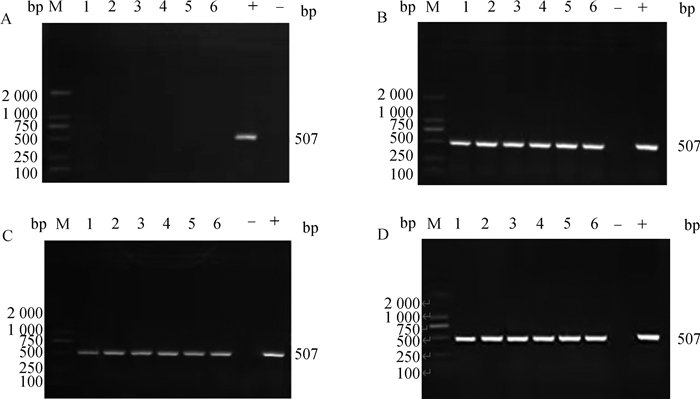
采用PCR方法对试验鸭组织DNA样本进行CpA核酸检测。结果显示,对照组样本中均未出现与预期片段大小相符的特异性片段(图 2A),检出率为0(0/6);感染66、90和114 h鸭组织样本均出现与预期片段大小相符(507 bp)的特异性条带(图 2B~D),检出率为100%(18/18),将测序序列进行BLAST分析,结果与参考基因的同源性均达到99%。结果表明,对照组CpA检测均为阴性,感染组CpA检测均为阳性。综合剖检病理观察和PCR检测结果,试验鸭的CpA人工感染建立成功。
|
A. 对照组;B. 感染组66 h;C. 感染组90 h;D. 感染组114 h。M.DL2000 DNA相对分子质量标准;1~6.样品;-.阴性对照;+.阳性对照 A. Control group; B. Infection group for 66 hours; C. Infection group for 90 hours; D. Infection group 114 hours. M.DL2000 DNA marker; 1-6. Samples; -.Negative control; +.Positive control 图 2 A型产气荚膜梭菌感染鸭病原核酸检测结果 Fig. 2 Detection results of pathogenic nucleic acid in ducks infected with CpA |
QC样本色谱图结果显示,正负离子模式下所有QC样本BPC进行重叠,谱图重叠良好,保留时间和峰响应强度均波动小(图 3)。结果表明,仪器在整个样本检测和分析过程中状态良好,信号稳定。
|
图 3 正(A)、负(B)离子模式下QC样本BPC Fig. 3 BPC of QC samples in positive (A) and negative (B) ion modes |
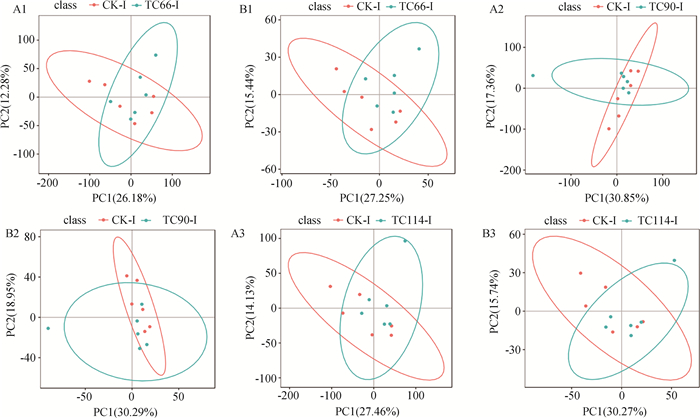
2.4.1 差异代谢物PCA分析 正离子模式下感染66、90和114 h,第一主成分(PC1)贡献率分别为26.18%、30.85% 和27.46%,第二主成分(PC2)为12.28%、17.36% 和14.13%,累计贡献率分别为38.46%、48.21% 和41.59%;负离子模式下PC1贡献率分别为27.25%、30.29%和30.27%,PC2贡献率分别为15.44%、18.95%和15.74%,PC累计贡献率分别为42.69%、49.24%和46.01%(图 4)。结果表明,PCA图中回肠样本有部分重叠,提示感染组与对照组间可能存在相同的离子化合物。
|
A1、A2、A3表示正离子模式,B1、B2、B3表示负离子模式,CK-I表示对照组回肠,TC66-I、TC90-I和TC114-I分别表示感染66、90和114 h回肠。每个图标代表一个样本,横坐标代表第一主成分PC1,纵坐标代表第二主成分PC2 A1, A2, A3 represent positive ion mode, B1, B2, B3 represent negative ion mode, CK-I represents control group ileum, and TC66-I, TC90-I, and TC114-I represent infected ileum at 66, 90 and 114 hours, respectively. Each icon represents a sample, with the horizontal axis representing the first principal component PC1 and the vertical axis representing the second principal component PC2 图 4 A型产气荚膜梭菌感染鸭回肠PCA图 Fig. 4 PCA of duck ileum infected with Clostridium perfringens type A |
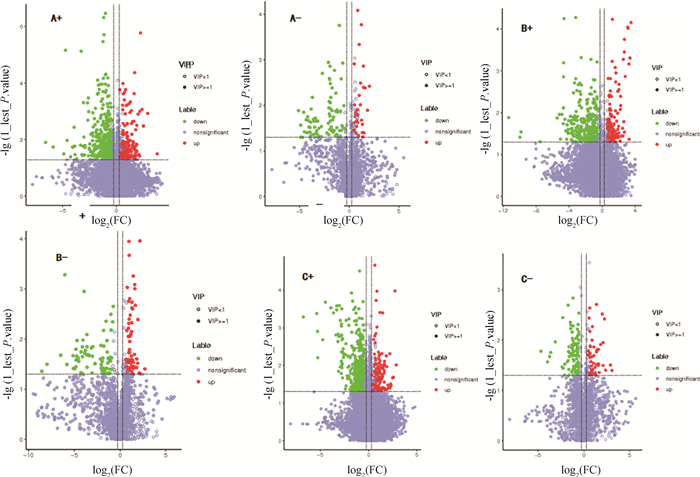
2.4.2 单变量分析和差异代谢物筛选 采用火山图对CpA感染鸭回肠样本差异代谢物进行可视化分析,结果显示,感染鸭66、90和114 h总差异代谢物种类分别有14、16和24种(图 5)。采用VIP、FC和P值对CpA感染鸭回肠样本进行差异代谢物筛选,结果显示:正负离子模式下感染鸭66 h时前5位差异代谢物(P值最小)分别是青霉素、前列腺素b1、12-羟基十二烷酸、3-羟基丁酸和N-乙酰基-d-氨基葡萄糖(表 1),90 h时是磷酸烯醇丙酮酸、十六烷二酸、2-磷酸甘油酸酯、脂蛋白b4和前列腺素b1(表 2),114 h时是青霉素、前列腺素b1、2, 4-二羟基苯甲酸、8z, 11z, 14z-二十碳三烯酸、花生四烯酸和二十二碳三烯酸(表 3)。
|
图中A+~C+表示正离子模式下对照组与66、90和114 h感染组鸭回肠比较,A-~C-表示负离子模式下对照组与66、90和114 h感染组鸭回肠比较 In the figure, A+-C+ represents the comparison of the ileum between the control group and the 66, 90, and 114 hour infected groups of ducks in the positive ion mode, while A--C-represents the comparison of the ileum between the control group and the 66, 90, and 114 hour infected groups of ducks in the negative ion mode 图 5 A型产气荚膜梭菌感染鸭回肠火山图 Fig. 5 Duck ileal volcano map infected with Clostridium perfringens type A |
|
|
表 1 感染组66 h回肠差异代谢物 Table 1 66 h ileal differential metabolites in infection group |
|
|
表 2 感染组90 h回肠差异代谢物 Table 2 90 h ileal differential metabolites in infection group |
|
|
表 3 感染组114 h回肠差异代谢物 Table 3 114 h ileal differential metabolites in infection group |
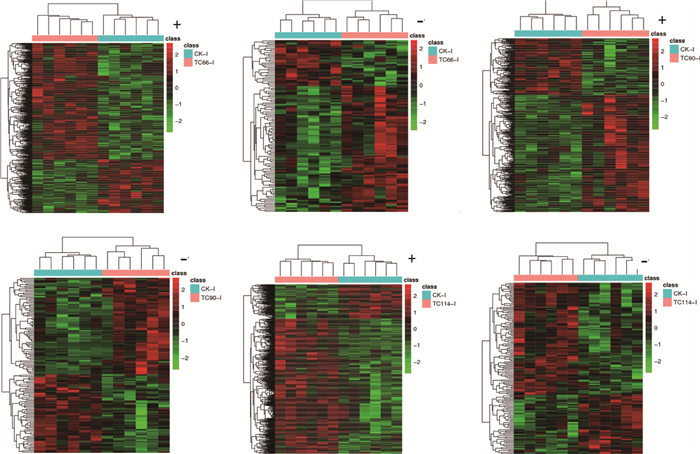
2.4.3 差异代谢物聚类分析 采用差异代谢物聚类对对照组和感染组(66、90和114 h)鸭回肠样本筛选出来的差异代谢物进行分析。结果显示,在正、负离子模式下,对照组和感染组(66、90、114 h)代谢物组内差异均较小,重复性好,且对照组与感染组(66、90、114 h)组间差异均区分明显(图 6)。结果表明,CpA感染鸭后回肠代谢物发生明显改变。
|
“+”表示正离子模式,“-”表示负离子模式,CK-I表示对照组回肠,TC66-I、TC90-I和TC114-I分别表示66、90和114 h感染组回肠 "+" represents the positive ion mode, "-" represents the negative ion mode, CK-I represents the control group ileum, and TC66-I, TC90-I, and TC114-I represent the infected group ileum at 66, 90 and 114 hours, respectively 图 6 A型产气荚膜梭菌感染鸭回肠差异代谢物聚类分析 Fig. 6 Cluster analysis of differential metabolites in duck ileum infected with CpA |
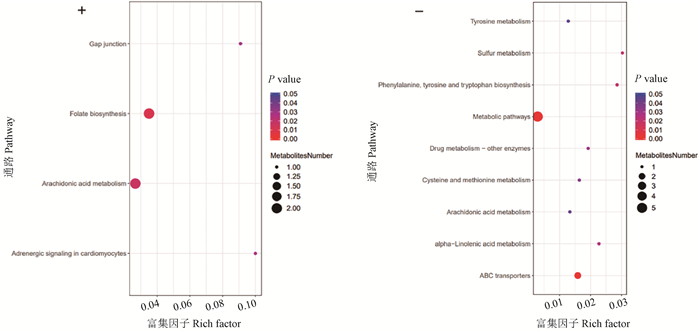
采用KEGG数据库对CpA感染鸭回肠样本的显著性差异代谢物进行代谢通路富集分析。结果显示,感染66 h时差异代谢物主要富集的代谢通路共13条(图 7),其中:正离子模式下有4条,即细胞间隙连接、叶酸生物合成、花生四烯酸代谢和心肌细胞肾上腺素能信号传导;负离子模式下有9条,即酪氨酸代谢、硫代谢、苯丙氨酸、酪氨酸和色氨酸生物合成、代谢途径、药物代谢-其他酶、半胱氨酸和蛋氨酸代谢、花生四烯酸代谢、α-亚麻酸代谢和ABC转运蛋白。
|
“+”表示正离子模式,“-”表示负离子模式 "+" represents the positive ion mode, "-" represents the negative ion mode 图 7 A型产气荚膜梭菌感染鸭66 h回肠气泡图 Fig. 7 66-hour ileal bubbles in ducks infected with Clostridium perfringens type A |
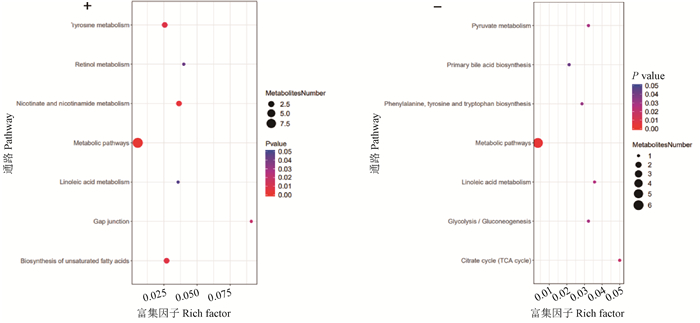
感染90 h时差异代谢物主要富集的代谢通路共14条(图 8),其中, 正离子模式下有7条,即视黄醇代谢、酪氨酸代谢、烟酸和烟酰胺代谢、代谢途径、亚油酸代谢、细胞间隙连接和不饱和脂肪酸的生物合成;负离子模式下有7条,即丙酮酸代谢、初级胆汁酸生物合成、苯丙氨酸、酪氨酸和色氨酸生物合成、代谢途径、亚油酸代谢、糖酵解/糖异生和柠檬酸循环(TCA循环)。
|
“+”表示正离子模式,“-”表示负离子模式 "+" represents the positive ion mode, "-" represents the negative ion mode 图 8 A型产气荚膜梭菌感染鸭90 h回肠气泡图 Fig. 8 90-hour ileal bubbles in ducks infected with Clostridium perfringens type A |
感染114 h时差异代谢物主要富集的代谢通路共28条(图 9),其中, 正离子模式下有8条,即酪氨酸代谢、色氨酸代谢、类固醇激素生物合成、神经活性配体-受体相互作用、细胞色素P450对异生素的代谢、代谢途径、细胞间隙连接和花生四烯酸代谢;负离子模式下有20条,即血管平滑肌收缩、丙酮酸代谢、PPAR信号通路、苯丙氨酸、酪氨酸和色氨酸的生物合成、坏死性凋亡、代谢途径、亚油酸代谢、GnRH信号通路、糖酵解/糖化、细胞凋亡、脂肪酸生物合成、柠檬酸循环(TCA循环)、碳代谢、不饱和脂肪酸的生物合成、氨基酸的生物合成、精氨酸生物合成、花生四烯酸代谢、丙氨酸、天冬氨酸和谷氨酸代谢和2-氧代羧酸代谢。
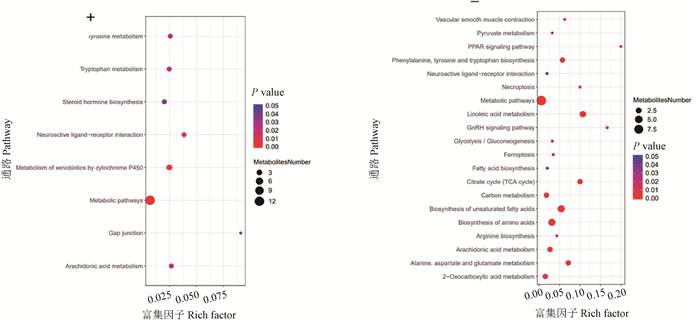
|
“+”表示正离子模式,“-”表示负离子模式。 "+" represents the positive ion mode, "-" represents the negative ion mode 图 9 A型产气荚膜梭菌感染鸭114 h回肠气泡图 Fig. 9 114-hour ileal bubbles in ducks infected with Clostridium perfringens type A |
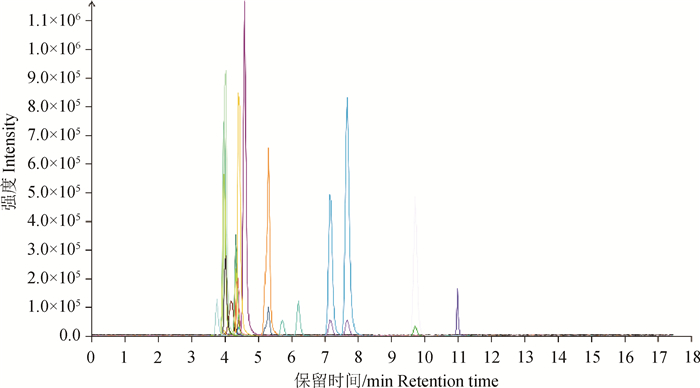
2.6.1 样本质控结果 采用总离子流图对感染组114 h鸭回肠样本进行可视化检查。结果显示,样品仪器分析信号强、峰容积大且保留时间重复性好,表明检测过程中仪器稳定性较好,样本重复性好,可进行下一步检测(图 10)。
|
图 10 感染组总离子流图 Fig. 10 Total ion current map of infection group |
氨基酸标准曲线结果采用Graphad Prim 8软件,绘制缬氨酸和丙氨标准曲线方程(图 11),缬氨酸线线性回归方程:y=38 650x+55 030,相关系数r为0.990 9;丙氨酸线性回归方程:y=9 026x+14 820,相关系数r为0.995 8。综上表明,所建标准曲线相关系数均>0.99,线性关系良好。
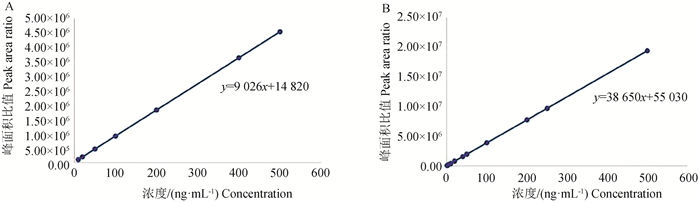
|
图 11 缬氨酸(A)和丙氨酸(B)标准曲线方程 Fig. 11 Valine (A) and alanine (B) standard curve equations |
2.6.2 回肠差异氨基酸定量分析结果 采用PCA对CpA感染鸭114 h回肠样本进行统计分析。结果显示,PC1贡献率为84.3%;PC2贡献率为6.3%,PC累计贡献率90.6%。表明对照组和感染组114 h回肠样本均有部分重叠,可能存在相同的离子化合物(图 12)。
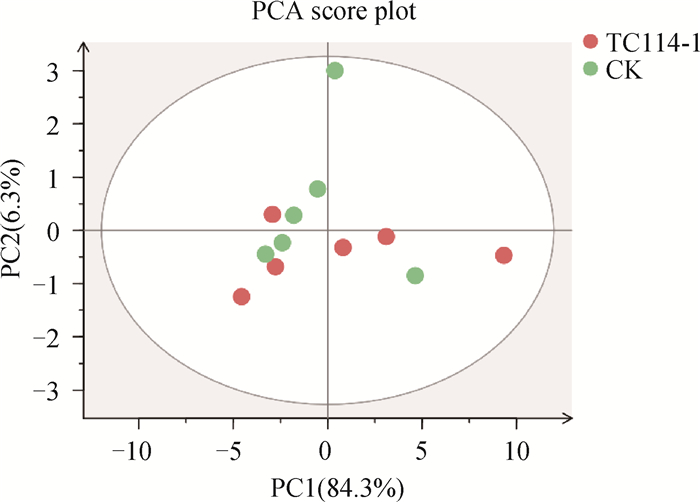
|
图 12 A型产气荚膜梭菌感染鸭回肠PCA图 Fig. 12 PCA of duck ileum infected by Clostridium perfringens type A |
采用信噪比法对12只鸭对照组和感染114 h回肠差异代谢物缬氨酸和丙氨酸进行定量检测验证,计算每个组的平均值,再计算FC值。结果显示,感染114 h缬氨酸平均含量为115.671 μg·g-1组织,对照组为229.808 μg·g-1组织,平均含量下降1.98倍;感染114 h丙氨酸平均含量为457.242 μg·g-1组织,对照组为154.426 μg·g-1组织,平均含量上升2.97倍(图 13)。结果表明,感染114 h回肠缬氨酸和丙氨酸含量变化趋势均与非靶向代谢组学检测结果一致。
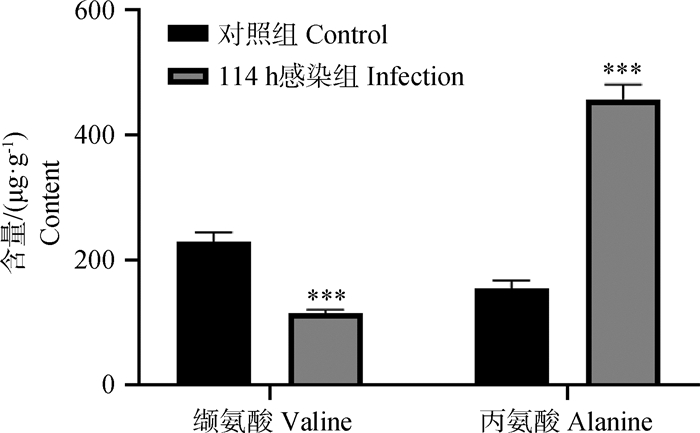
|
***.P < 0.01 图 13 114 h感染组与对照组回肠丙氨酸和缬氨酸含量 Fig. 13 Contents of alanine and valine in ileum of 114 h infection group and control group |
产气荚膜梭菌作为一种重要的肠道病原体,可引起人和畜禽气性坏疽、坏死性肠炎、动物肠毒素血症、人类食物中毒等[13-15]。其中, 对家禽的危害严重,尤其以CpA对鸭危害极大,威胁着鸭养殖业的发展。因此为探究CpA感染鸭的致病机制,试验选取37日龄的鸭感染CpA,剖检后发现回肠有明显的病变,同时PCR检测显示为阳性,提示CpA感染模型建立成功。检测感染66、90、114 h时鸭回肠的代谢物,发现筛选出差异代谢物数量与种类较多且有所差异,且随着感染时间的延长,差异代谢物数量逐渐增加,研究结果与课题组前期DEV和CpA共感染鸭回肠检测到的总差异代谢物数量变化趋势一致,表明CpA感染鸭后,随着感染时间的增加,更多差异代谢物参与回肠炎症反应。KEGG富集分析显示,花生四烯酸、色氨酸、烟酸和烟酰胺等相关免疫与炎症代谢通路发生显著变化。
花生四烯酸(AA),又称二十烷-5、8、11、14-四烯酸,是一种ω-6多不饱和脂肪酸(PFA),主要以磷脂的形式存在于细胞膜中[16]。当细胞处于应激状态时,AA被磷脂酶A2(PLA2)和磷脂酶C(PLC)释放为游离花生四烯酸,成为促炎生物活性的前体。作为生物体内分布最广泛的内源性活性物质,花生四烯酸前体介质通过3种代谢途径进行调节其代谢通路包括环氧合酶(COX)、脂氧合酶(LOX) 和细胞色素P450(CYP450) 3种途径[17]。CpA感染鸭后回肠AA代谢通路中AA和环氧合酶途径中的前列腺素b1、前列腺素a2、以及细胞色素P450途径中的二十碳三烯酸等相关代谢物都产生显著变化,表明CpA感染鸭后回肠黏膜受到刺激后产生炎症反应,提示AA代谢通过调节多种代谢物参与机体的免疫反应。
丙酮酸作为一种内源性有机酸,在生化过程中起关键作用,是脂质、葡萄糖和蛋白质代谢等代谢过程中的重要中间体,同时作为代谢燃料的来源[18-20]。它可用于合成多种氨基酸,如L-色氨酸、L-亮氨酸、L-苯基乙酰甲醇或合成维生素B6和B12等。同时丙酮酸在氧化还原中扮演着重要角色,参与抗氧化应激的同时还可以抵抗由过氧化氢造成的氧化损伤[21-22]。大量研究表明丙酮酸及其衍生物具有抗炎活性:抑制肿瘤坏死因子-α(TNF-α)和白细胞介素-6(IL-6),并抑制促炎物质的表达如诱导氮氧化酶合酶(iNOS)、环氧合酶-2(COX-2)和其他促炎介质等[23-25]。在本试验中丙酮酸代谢通路的相关差异代谢物4-羟基苯基丙酮酸、磷酸烯醇丙酮酸等都产生显著变化,提示CpA感染鸭后可能是回肠黏膜受损有关而产生炎症和机体自身抗炎症反应。
在免疫系统中,色氨酸代谢与不同形式的免疫控制和细胞内在的抗病原体反应有关,尤其许多色氨酸代谢产物活性物质是控制肠道炎症的关键[26-27]。研究发现饲粮添加色氨酸能够缓解热应激引起的氧化应激损伤,通过抑制NLRP3炎症小体及下游级联反应,减轻炎症反应[28]。在基础饲粮中色氨酸水平能够满足肉鸡生长的情况下,添加色氨酸虽然对肉鸡后期生长性能和器官指数以及十二指肠和空肠的发育没有显著影响,但可以提高肉鸡血清的抗氧化能力和免疫功能[29]。而色氨酸在动物体内主要有3条代谢途径:包括哺乳动物主要途径犬尿氨酸(kynurenine,KYN)途径;和通过色氨酸羟化酶催化生产5-羟色胺(5-hydroxytryptamine,5-HT)途径;此外就是肠道细菌代谢途径[30]。其中肠道细菌会代谢过量的膳食色氨酸,产生一些抗炎代谢产物,如吲哚乙酸(IAA)、吲哚硫酸(ISA)、吲哚- 3-乙醛(IAAld)、吲哚-丙烯酸(IA)、吲哚-3-醛(IAld)和色胺等[31]。在本次试验中,CpA感染感染鸭66、90和114 h后,引起回肠中色氨酸中相关代谢物吲哚-3-乙醇发生显著变化,表明CpA感染鸭后回肠发生炎症反应,引起肠黏膜发生损伤。
此外色氨酸还能合成烟酸和烟酰胺来调节炎症与免疫反应。烟酸是动物机体必不可少的维生素之一,具有抗炎、抗氧化[32]、调节脂代谢[33]、缓解应激、降血糖[34]、抗癌[35]等多种生物学功能。而烟酰胺则通过直接清除ROS/自由基或间接提高细胞的抗氧化能力来减轻细胞的氧化应激,此外烟酰胺及其代谢物除了具有抗炎特性还能延缓细胞衰老[36]。研究发现添加烟酸血清中应激指标含量显著降低,同时抑制热应激牦牛全血中输氧相关因子含量的降低和血清中炎症因子含量的升高,促进了血氧稳恒和维持正常免疫状态[37]。在本试验中,CpA感染感染鸭后,烟酸和烟酰胺代谢通路引起炎症变化,此外还有半胱氨酸和蛋氨酸[38-39]、亚油酸[40]代谢通路都与免疫和炎症有关,在CpA感染鸭回肠引起其通路变化。
4 结论通过PCR检测确定感染模型建立,通过非靶向代谢组学方法探究CpA感染鸭不同时段回肠中代谢物的变化。通过分析回肠中差异代谢物和使用KEGG富集分析CpA感染鸭相关代谢通路。同时采用信噪比法对回肠差异代谢物定量检测验证测序结果准确性。综上,CpA感染鸭的致病机制可能通过调控相关氨基酸的代谢通路影响炎症机制。
| [1] |
GOHARI I M, NAVARRO M A, LI J H, et al. Pathogenicity and virulence of Clostridium perfringens[J]. Virulence, 2021, 12(1): 723-753. DOI:10.1080/21505594.2021.1886777 |
| [2] |
XU W P, WANG H R, LIU L X, et al. Prevalence and characterization of Clostridium perfringens isolated from different chicken farms in China[J]. Anaerobe, 2021, 72: 102467. DOI:10.1016/j.anaerobe.2021.102467 |
| [3] |
LIU Y, XIU L, MIAO Z M, et al. Occurrence and multilocus sequence typing of Clostridium perfringens isolated from retail duck products in Tai'an region, China[J]. Anaerobe, 2020, 62: 102102. DOI:10.1016/j.anaerobe.2019.102102 |
| [4] |
王娜, 段世宇, 程振涛, 等. 产气荚膜梭菌唾液酸酶研究进展[J]. 中国兽医学报, 2022, 42(1): 191-198. WANG N, DUAN S Y, CHENG Z T, et al. Research progress of sialidase from Clostridium perfringens[J]. Chinese Journal of Veterinary Science, 2022, 42(1): 191-198. DOI:10.16303/j.cnki.1005-4545.2022.01.30 (in Chinese) |
| [5] |
NAVARRO M A, MCCLANE B A, UZAL F A. Mechanisms of action and cell death associated with Clostridium perfringens toxins[J]. Toxins (Basel), 2018, 10(5): 212. DOI:10.3390/toxins10050212 |
| [6] |
ZHANG T F, ZHANG W T, AI D Y, et al. Prevalence and characterization of Clostridium perfringens in broiler chickens and retail chicken meat in central China[J]. Anaerobe, 2018, 54: 100-103. DOI:10.1016/j.anaerobe.2018.08.007 |
| [7] |
ABDELRAHIM A M, RADOMSKI N, DELANNOY S, et al. Large-scale genomic analyses and toxinotyping of Clostridium perfringens implicated in foodborne outbreaks in france[J]. Front Microbiol, 2019, 10: 777. DOI:10.3389/fmicb.2019.00777 |
| [8] |
XIU L, LIU Y, WU W, et al. Prevalence and multilocus sequence typing of Clostridium perfringens isolated from 4 duck farms in Shandong province, China[J]. Poult Sci, 2020, 99(10): 5105-5117. DOI:10.1016/j.psj.2020.06.046 |
| [9] |
李胤豪, 张清月, 闫素梅. 代谢组学在反刍动物营养代谢应用中的研究进展[J]. 中国农业大学学报, 2022, 27(11): 104-116. LI Y H, ZHANG Q Y, YAN S M. Advance in the application of metabolomics to nutrition research of ruminant livestock[J]. Journal of China Agricultural University, 2022, 27(11): 104-116. (in Chinese) |
| [10] |
BEALE D J, PINU F R, KOUREMENOS K A, et al. Review of recent developments in GC-MS approaches to metabolomics-based research[J]. Metabolomics, 2018, 14(11): 152. DOI:10.1007/s11306-018-1449-2 |
| [11] |
杨霞, 蒲翠敏, 胡安东, 等. 鸭肠炎病毒感染对鸭肠道菌群多样性的影响[J]. 中国预防兽医学报, 2020, 42(8): 772-778. YANG X, PU C M, HU A D, et al. Effects of duck enteritis virus infection on the intestinal microbiota diversity of ducks[J]. Chinese Journal of Preventive Veterinary Medicine, 2020, 42(8): 772-778. (in Chinese) |
| [12] |
毕文文, 田琴, 张黔东, 等. 鸭肠炎病毒和A型产气荚膜梭菌共感染对鸭十二指肠代谢组学影响的研究[J]. 中国预防兽医学报, 2022, 44(9): 927-933. BI W W, TIAN Q, ZHANG Q D, et al. Effects of coinfection of duck enteritis virus and Clostridium perfringens type A on duodenal metabolomics in ducks[J]. Chinese Journal of Preventive Veterinary Medicine, 2022, 44(9): 927-933. (in Chinese) |
| [13] |
钟佳鑫, 王媛媛, 白璐璐, 等. 产气荚膜梭菌分子分型研究进展[J]. 疾病监测, 2022, 37(9): 1248-1256. ZHONG J X, WANG Y Y, BAI L L, et al. Progress in research of molecular typing of Clostridium perfringens[J]. Disease Surveillance, 2022, 37(9): 1248-1256. (in Chinese) |
| [14] |
TAKEHARA M, KOBAYASHI K, NAGAHAMA M. Toll-like receptor 4 protects against Clostridium perfringens infection in mice[J]. Front Cell Infect Microbiol, 2021, 11: 633440. DOI:10.3389/fcimb.2021.633440 |
| [15] |
YADAV J P, KAUR S, DHAKA P, et al. Prevalence, molecular characterization, and antimicrobial resistance profile of Clostridium perfringens from India: a scoping review[J]. Anaerobe, 2022, 77: 102639. DOI:10.1016/j.anaerobe.2022.102639 |
| [16] |
WANG T Q, FU X J, CHEN Q F, et al. Arachidonic acid metabolism and kidney inflammation[J]. Int J Mol Sci, 2019, 20(15): 3683. DOI:10.3390/ijms20153683 |
| [17] |
蔡亚玮, 刘建宏, 马宁. 花生四烯酸靶向代谢组学在炎症中的研究现状[J]. 中国临床药理学杂志, 2021, 37(19): 2721-2723, 2728. CAI Y W, LIU J H, MA N. Research status of arachidonic acid-targeted metabonomics in inflammation[J]. The Chinese Journal of Clinical Pharmacology, 2021, 37(19): 2721-2723, 2728. (in Chinese) |
| [18] |
ZHANG Q X, LYU W R, YU M B, et al. Investigating the inotropic effect of pyruvic acid on the isolated rat heart and its underlying mechanism[J]. Environ Toxicol Pharmacol, 2019, 71: 103206. DOI:10.1016/j.etap.2019.103206 |
| [19] |
JAAP V M. Modeling biochemical aspects of energy metabolism in mammals[J]. J Nutr, 2002, 132(10): 3195-3202. DOI:10.1093/jn/131.10.3195 |
| [20] |
ZHANG J, GAO N F. Application of response surface methodology in medium optimization for pyruvic acid production of Torulopsis glabrata TP19 in batch fermentation[J]. J Zhejiang Univ Sci B, 2007, 8(2): 98-104. DOI:10.1631/jzus.2007.B0098 |
| [21] |
闵昌国, 车东升, 张天芮. 丙酮酸对猪早期胚胎发育的影响[J]. 动物营养学报, 2021, 33(4): 1832-1840. MIN C G, CHE D S, ZHANG T R. Effects of pyruvate on early embryonic development in pigs[J]. Chinese Journal of Animal Nutrition, 2021, 33(4): 1832-1840. DOI:10.3969/j.issn.1006-267x.2021.04.004 (in Chinese) |
| [22] |
LOPALCO A, DEEKEN R, DOUGLAS J, et al. Some preformulation studies of pyruvic acid and other α-Keto carboxylic acids in aqueous solution: pharmaceutical formulation implications for these peroxide scavengers[J]. J Pharm Sci, 2019, 108(10): 3281-3288. DOI:10.1016/j.xphs.2019.05.030 |
| [23] |
KŁADNA A, MARCHLEWICZ M, PIECHOWSKA T, et al. Reactivity of pyruvic acid and its derivatives towards reactive oxygen species[J]. Luminescence, 2015, 30(7): 1153-1158. |
| [24] |
VARMA S D, HEGDE K R, KOVTUN S. Oxidative damage to lens in culture: reversibility by pyruvate and ethyl pyruvate[J]. Ophthalmologica, 2006, 220(1): 52-57. |
| [25] |
CHEN W, JIA Z Q, ZHU H, et al. Ethyl pyruvate inhibits peroxynitrite-induced DNA damage and hydroxyl radical generation: implications for neuroprotection[J]. Neurochem Res, 2010, 35(2): 336-342. |
| [26] |
COMAI S, BERTAZZO A, BRUGHERA M, et al. Tryptophan in health and disease[J]. Adv Clin Chem, 2020, 95: 165-218. |
| [27] |
MELHEM N J, TALEB S. Tryptophan: from diet to cardiovascular diseases[J]. Int J Mol Sci, 2021, 22(18): 9904. |
| [28] |
欧阳经鑫, 李秋粉, 周华, 等. 饲粮添加色氨酸对热应激肉鸡肝脏、肠道抗氧化能力和炎症反应的影响[J]. 中国兽医学报, 2022, 42(6): 1256-1262, 1269. OUYANG J X, LI Q F, ZHOU H, et al. Effects of dietary tryptophan supplementation on antioxidant capacity and inflammatory response in liver and intestine of broilers subjected to heat stress[J]. Chinese Journal of Veterinary Science, 2022, 42(6): 1256-1262, 1269. (in Chinese) |
| [29] |
伏春燕, 董以雷, 阎佩佩, 等. 饲粮色氨酸水平对肉鸡生长性能、血清生化指标、器官指数及肠道组织形态的影响[J]. 动物营养学报, 2021, 33(10): 5545-5556. FU C Y, DONG Y L, YAN P P, et al. Effects of dietary tryptophan levels on growth performance, serum biochemical indices, organ indexes and intestinal morphology of broilers[J]. Chinese Journal of Animal Nutrition, 2021, 33(10): 5545-5556. (in Chinese) |
| [30] |
林俊, 杜蕾, 齐仁立. 色氨酸及其代谢物调控肌肉生长发育的研究进展[J]. 中国畜牧杂志, 2022, 58(6): 21-25. LIN J, DU L, QI R N. Research progress of tryptophan and its metabolites in regulating muscle growth and development[J]. Chinese Journal of Animal Science, 2022, 58(6): 21-25. (in Chinese) |
| [31] |
王荣蛟, 莫苏, 袁再美, 等. 肠道微生物的色氨酸代谢物对宿主肠道健康影响的研究进展[J]. 中国畜牧杂志, 2022, 58(3): 7-12. WANG R J, MOE MOE S, YUAN Z M, et al. Research progress on the effects of tryptophan metabolites from intestinal microorganisms on host health[J]. Chinese Journal of Animal Science, 2022, 58(3): 7-12. (in Chinese) |
| [32] |
GODIN A M, FERREIRA W C, ROCHA L T S, et al. Nicotinic acid induces antinociceptive and anti-inflammatory effects in different experimental models[J]. Pharmacol Biochem Behav, 2012, 101(3): 493-498. |
| [33] |
JULIUS U, FISCHER S. Nicotinic acid as a lipid-modifying drug-a review[J]. Atheroscler Suppl, 2013, 14(1): 7-13. |
| [34] |
ADAMS G G, IMRAN S, WANG S, et al. The hypoglycemic effect of pumpkin seeds, Trigonelline (TRG), Nicotinic acid (NA), and D-Chiro-inositol (DCI) in controlling glycemic levels in diabetes mellitus[J]. Crit Rev Food Sci Nutr, 2014, 54(10): 1322-1329. |
| [35] |
JAIN N S, UTREJA D, KAUR K, et al. Novel derivatives of nicotinic acid as promising anticancer agents[J]. Mini-Rev Med Chem, 2021, 21(7): 847-882. |
| [36] |
BOO Y C. Mechanistic basis and clinical evidence for the applications of nicotinamide (Niacinamide) to control skin aging and pigmentation[J]. Antioxidants (Basel), 2021, 10(8): 1315. |
| [37] |
王雪莹, 王之盛, 薛白, 等. 烟酸对热应激牦牛生长性能、营养物质表观消化率和血液指标的影响[J]. 动物营养学报, 2020, 32(5): 2228-2240. WANG X Y, WANG Z S, XUE B, et al. Effects of niacin on growth performance, nutrient apparent digestibility and blood indexes of yak under heat-stress[J]. Chinese Journal of Animal Nutrition, 2020, 32(5): 2228-2240. (in Chinese) |
| [38] |
MARTÍNEZ Y, LI X, LIU G, et al. The role of methionine on metabolism, oxidative stress, and diseases[J]. Amino Acids, 2017, 49(12): 2091-2098. |
| [39] |
STOJANOVIĆ M, ŠĆEPANOVIĆL, TODOROVIĆ D, et al. Suppression of methionine-induced colon injury of young rats by cysteine and N-acetyl-L-cysteine[J]. Mol Cell Biochem, 2018, 440(1-2): 53-64. |
| [40] |
SZCZUKO M, KIKUT J, KOMORNIAK N, et al. The role of arachidonic and linoleic acid derivatives in pathological pregnancies and the human reproduction process[J]. Int J Mol Sci, 2020, 21(24): 9628. |
(编辑 白永平)



