2. 广东省畜禽健康养殖与环境控制企业 重点实验室, 新兴 527400;
3. 国家非洲猪瘟区域实验室(广州), 广州 510642;
4. 广东省动物源性人兽共患病 预防与控制重点实验室, 广州 510642;
5. 岭南现代农业科学与技术广东省实验室茂名分中心, 茂名 525000
2. Guangdong Provincial Key Laboratory of Livestock and Poultry Health and Environmental Control, Xinxing 527400, China;
3. National African Swine Fever Regional Laboratory(Guangzhou), Guangzhou 510642, China;
4. Guangdong Provincial Key Laboratory for Prevention and Control of Zoonoses, Guangzhou 510642, China;
5. Guangdong Provincial Laboratory of Modern Agricultural Science and Technology, Maoming Branch Center, Maoming 525000, China
非洲猪瘟(African swine fever, ASF)是由非洲猪瘟病毒(African swine fever virus, ASFV)引起的一种猪的急性、烈性、高度接触性传染病。急性型ASF发病快、病程短,表现为高热、皮肤发绀、组织器官严重出血等临床症状,死亡率接近100%[1]。2018年8月,ASF首次传入我国,随后迅速蔓延,对我国养猪业构成重大威胁,防控形势异常严峻[2]。
ASFV是已知的唯一可通过虫媒传播的囊膜双链DNA病毒,基因组大小为170~193 kb,编码68种结构蛋白和100多种非结构蛋白[3]。由于ASFV结构的多样性、对外界环境具有较强的抵抗力和复杂的免疫逃避机制,导致对ASF的防控较为困难,目前国内尚未有安全有效的商品化疫苗和防治药物[4]。因此对ASF早期快速的诊断是防控疫情的关键。当前ASFV的检测方法有普通PCR、荧光定量PCR、双抗体夹心ELISA等,其中荧光定量PCR对比其他检测方法具有灵敏度高、检测周期短、特异性高等优点,因此其成为我国常用的ASFV检测方法[5-7]。
2022年6月8日,首个ASFV I177L缺失商品化疫苗于越南正式批准上市[8]。有研究表明,该ASFV弱毒疫苗在安全方面可能存在水平传播的风险,并且随着感染代次的增加,病毒仍具有较高的滴度,由于该疫苗毒水平传播的风险可能会给生猪产业的生物安全带来较大的威胁,因此给ASF防控带来了一定的难度和挑战[5]。ASFV I177L基因缺失疫苗是在野生型ASFV毒株的基础上敲除了I177L基因,为防控ASFV I177L基因缺失疫苗株流入我国,建立一种有效的鉴别ASFV-G-ΔI177L基因缺失毒株的检测方法迫在眉睫。
1 材料与方法 1.1 病毒核酸及病毒猪繁殖与呼吸综合征病毒(PRRSV)、经典猪瘟病毒(CSFV)、2型圆环病毒(PCV-2)、伪狂犬病病毒(PRV)和猪流行性腹泻病毒(PEDV)由华南农业大学兽医学院传染病教研室保存。非洲猪瘟病毒(ASFV GZ201801)和非洲猪瘟病毒I177L基因缺失毒株(ASFV-G-ΔI177L)由华南农业大学国家非洲猪瘟区域实验室(广州)保存。
1.2 仪器设备和主要试剂QuantStudioTM7 Flex实时荧光定量PCR仪购自美国ThermoFisherScientific公司;PrimeScriptTMRT reagent Kit(Perfect Real Time)和RNase-free Water购自日本TaKaRa公司;THUNDERBIRDTM Probe qPCR Mix购自日本TOYOB公司;RaPure Viral RNA/DNA Kit购自Magen公司;引物和探针均有上海Invitrogen公司合成。以上实验仪器和试剂均由华南农业大学兽医学院传染病教研室提供。
1.3 引物和探针设计根据GenBank中公布的ASFV I177L基因序列,应用Primer Premier 6.0引物设计软件,设计特异性引物和探针。I177L探针5′端修饰基团为FAM,3′端淬灭基团为BHQ1。B646L基因引物是直接使用参考文献[7]中所设计的引物。所有引物探针均由英潍捷基公司合成。表 1为合成引物探针的序列及扩增片段大小。
|
|
表 1 TaqMan FQ-PCR中使用的引物和探针 Table 1 Primers and probes used in TaqMan FQ-PCR |
使用RaPure Viral RNA/DNA Kit试剂盒,按说明书操作提取ASFV GZ201801、ASFV-G-ΔI177L、PRRSV、CSFV、PCV-2、PRV和PEDV的核酸。其中, 使用TaKaRa逆转录试剂盒将提取的PRRSV、CSFV和PEDV的RNA样品进行逆转录并获得cDNA。
1.5 TaqMan FQ-PCR方法引物/探针浓度与反应条件的优化根据公式:质粒拷贝数(拷贝·μL-1)=浓度(ng·μL-1)×10-9×6.023×1023(碱基数×660)计算重组质粒pMD18-I177L和pMD18-B646L的拷贝数,结果分别为2.2×1011和1.60×1011copies·μL-1。并将pMD18-I177L标准质粒按10倍倍比稀释10个梯度,最终稀释浓度为2.2×101~2.2×1010copies·μL-1,反应体系为20 μL。引物和探针分别稀释至终浓度为0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8 μmol·L-1,采用矩阵法筛选最佳引物/探针组合浓度;反应程序为95 ℃ 20 s;95 ℃ 3 s,58~62 ℃ 30 s,40个循环; 设计退火温度分别为58、59、60、61、62 ℃,对阳性样品进行特异性扩增,记录结果,优化最佳退火温度。
1.6 标准质粒重组质粒pMD18-I177L和pMD18-B646L为华南农业大学兽医学院传染病教研室保存。
1.7 特异性试验提取ASFV GZ201801、ASFV-G-ΔI177L、PRRSV、CSFV、PCV-2、PRV和PEDV的核酸,并将PRRSV、CSFV和PEDV的RNA进行反转录以获得cDNA,以ASFV GZ201801作为阳性对照1,ASFV-G-ΔI177L作为阳性对照2,无酶水为阴性对照,按照优化好的反应条件进行TaqMan FQ-PCR扩增,以确定该检测方法的特异性。
1.8 灵敏性试验和标准曲线的建立将pMD18-I177L重组质粒标准品按10倍倍比稀释10个梯度,最终浓度在2.2×101~2.2×1010copies·μL-1,每个梯度做3个重复,以无酶水为阴性对照,按照优化好的反应条件进行ASFV FQ-PCR灵敏性试验。以得到的Ct值为纵坐标,I177L基因拷贝数的对数为横坐标绘制标准曲线,并观察其线性关系。根据FQ-PCR检测的扩增曲线判断所能检测的最低拷贝数。
1.9 重复性试验以2.2×103、2.2×105和2.2×107copies·μL-1的阳性重组质粒pMD18-I177L为模板,按照已优化的TaqMan FQ-PCR反应条件进行扩增,分别进行3次批内和批间重复试验,验证该检测方法的重复性。
1.10 临床样本检测在本实验室收集的临床样本中随机抽取170份样本(编号1~170),采用本研究建立的TaqMan FQ-PCR方法进行检测,使用2.2×105copies·μL-1阳性标准质粒作为阳性对照,无酶水作为阴性对照。以OIE推荐的ASFV qPCR检测方法作为金标准与本研究建立的TaqMan FQ-PCR检测方法进行比对。
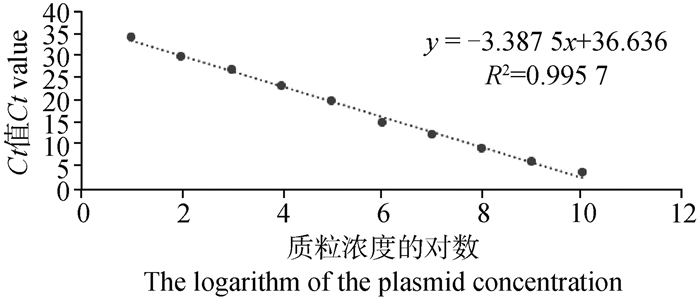
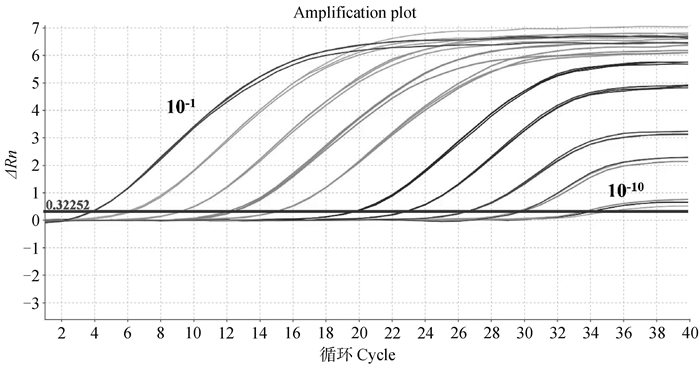
2 结果 2.1 TaqMan FQ-PCR灵敏度以及标准曲线的建立将pMD18-I177L质粒标准品按10倍倍比稀释10个梯度(最终浓度在2.2×101~2.2×1010 copies·μL-1) 后进行TaqMan FQ-PCR检测(每个梯度做三个重复),使用软件绘制TaqMan FQ-PCR标准曲线。如图 1所示,pMD18-I177L阳性质粒标准曲线斜率为-3.387 5,R2>0.99,说明10个稀释梯度样品呈现很强的线性关系。该方法最低可以检测到10-10阳性质粒的稀释度,图 2通过计算得出本TaqMan FQ-PCR所能检测pMD18-I177L最低拷贝量为2.2×101 copies·μL-1。
|
y=-3.387 5x+36.636, R2=0.995 7 图 1 pMD18-I177L TaqMan FQ-PCR标准曲线的建立 Fig. 1 pMD18-I177L TaqMan FQ-PCR standard curve |
|
图 2 TaqMan FQ-PCR灵敏性测试 Fig. 2 TaqMan FQ-PCR sensitivity test |
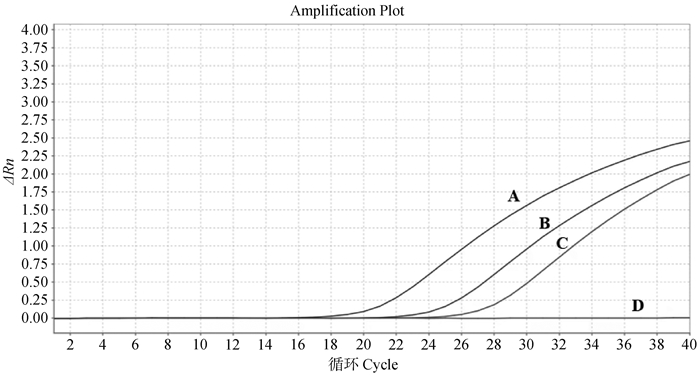
分别使用B646L基因片段引物和I177L基因片段引物对ASFV、ASFV-G-ΔI177L、PRRSV、CSFV、PCV-2、PRV、PEDV的核酸样品和无酶水进行FQ-PCR特异性检测,如图 3所示,B646L基因片段引物可以扩增出ASFV和ASFV-G-ΔI177L,I177L基因片段引物只能扩增出ASFV,而不能扩增出ASFV-G-ΔI177L,PRRSV、PEDV、PCV-2、PRV、CSFV的核酸样品和无酶水均未出现扩增曲线。
|
A. ASFV用B646L引物检测;B. ASFV用I177L引物检测;C. ASFV-G-ΔI177L用B646L引物检测;D. ASFV-G-ΔI177L用引物I177L检测,PRRSV、CSFV、PCV-2、PRV、PEDV和无酶水用引物B646L和引物I177L检测 A. ASFV detected with B646L primer; B. ASFV detected with I177L primer; C. ASFV-G-ΔI177L Detected with B646L primer; D. ASFV-G-ΔI177L detected with primer I177L PRRSV, CSFV, PCV-2, PRV, PEDV and enzyme-free water were detected by primers B646L and I177L 图 3 TaqMan FQ-PCR特异性结果 Fig. 3 TaqMan FQ-PCR specific results |
|
|
表 2 TaqMan FQ-PCR方法重复性试验结果 Table 2 Repetitive test results of TaqMan FQ-PCR method |
|
|
表 3 临床样本检测 Table 3 Clinical sample testing |
选取2.2×103、2.2×105、2.2×107copies·μL-1三个浓度的pMD18-I177L阳性重组质粒,按照优化好的TaqMan FQ-PCR反应条件进行扩增,批内重复和批间重复试验变异系数(CV值)均<1.8%,表明建立的TaqMan FQ-PCR检测方法具有良好的重复性和稳定性。
2.4 TaqMan FQ-PCR检测猪临床样本使用本研究建立的TaqMan FQ-PCR方法检测170份猪临床核酸样本,结果表明,检测样本中ASFV阳性样本有5个,其余165个样本均为ASFV阴性。5个阳性样品的TaqMan FQ-PCR扩增结果发现,B646L FAM通道和I177L FAM通道出现扩增曲线,表明这些阳性样本均为ASFV野毒株感染。使用该方法检测的结果与OIE推荐使用方法结果一致。
3 讨论ASF是由ASFV感染引起的一种致死率高达100%的猪烈性传染病。并于2018年8月在我国辽宁沈阳首次被报道,此后,该病毒迅速蔓延到32个省、自治区和直辖市,给养猪业和其他相关行业造成了重大损失[9]。ASFV的基因组庞大,并且使用各种机制来逃避宿主免疫系统[10],例如Ⅰ型干扰素(IFN)反应,细胞凋亡,炎症反应和特定靶基因的激活[11]。由于ASFV复杂的生物学特性和逃避机制,ASF尚无安全、高效的商品化疫苗[12]。
Borca等[13]在2021年5月报道其开发的ASFV-G-ΔI177L基因缺失减毒疫苗可以提供完全的同源保护,并且还构建出该毒株体外适应的细胞系以供其大规模繁殖。2022年6月,越南政府批准上市首个ASFV基因缺失减毒疫苗(商品名为NAVET-ASFVAC),此疫苗对生长育肥猪的抗ASFV有效,但仍然存在排毒现象,同时该研究缺乏田间试验。我国和越南是邻国,有广泛的商业贸易往来,尤其是一些猪类商品的交易,所以存在疫苗毒株传入的较高风险。因此建立一种能有效鉴别ASFV野毒株和ASFV-G-ΔI177L基因缺失毒的检测方法迫在眉睫。
荧光定量PCR较其他检测方法具有更高的灵敏性、特异性和重复性,因此其成为ASFV早期诊断的主要检测方法之一。本研究针对B646L基因和I177L基因开发了一种TaqMan FQ-PCR检测方法,用于区分野生型ASFV毒株和ASFV-G-ΔI177L缺失毒株。ASFV I177L基因缺失株是在野生型ASFV的基础上敲除了I177L基因,B646L基因是ASFV的保守基因,若通过该检测方法只检测到B646L基因的扩增曲线,而未检测到I177L基因的扩增曲线,则说明该样品为ASFV-G-ΔI177L毒株。若同时检测到B646L基因和I177L基因的扩增曲线,则说明是野生型ASFV毒株样品。当没有检测到B646L基因的扩增曲线,则说明样品为ASFV阴性。该检测方法的特异性试验表明,与猪常见的病毒不具有特异性反应。本方法检测到pMD18-I177L阳性标准品的最低拷贝量为2.2×101 copies·μL-1,较先前报道的研究[14]中所建立的I177L检测方法具有更低的检测下限,并且本方法建立的标准曲线具备很强的线性关系。批内重复和批间重复试验变异系数(CV值)均<1.8%,表明建立的TaqMan FQ-PCR检测方法具有良好的重复性和稳定性,试验结果真实可靠。同时,采用本TaqMan FQ-PCR方法检测170份猪临床样本,发现其中含有5份ASFV野毒株样本,该检测结果与OIE推荐的检测方法一致。提示本研究中并未监测到基因缺失株,也说明基因缺失株在临床的流行率偏低,ASFV野毒株依然是当前主要流行毒株。
4 结论成功建立一种快速ASFV-G-ΔI177L荧光定量PCR检测方法,该方法具有良好的特异性、敏感性和稳定性,为临床ASFV的鉴别诊断提供了理论依据。
| [1] |
WU K K, LIU J M, WANG L X, et al. Current state of global African Swine fever vaccine development under the prevalence and transmission of ASF in China[J]. Vaccines (Basel), 2020, 8(3): 531. DOI:10.3390/vaccines8030531 |
| [2] |
FAN Y Q, CHEN W Y, JIANG C G, et al. Host Responses to Live-Attenuated ASFV (HLJ/18-7GD)[J]. Viruses, 2022, 14(9): 2003. DOI:10.3390/v14092003 |
| [3] |
CHATHURANGA K, LEE J S. African swine fever virus (ASFV): immunity and vaccine development[J]. Vaccines (Basel), 2023, 11(2): 199. DOI:10.3390/vaccines11020199 |
| [4] |
WANG Z Y, AI Q Y, HUANG S L, et al. Immune escape mechanism and vaccine research progress of African swine fever virus[J]. Vaccines (Basel), 2022, 10(3): 344. DOI:10.3390/vaccines10030344 |
| [5] |
TRAN X H, PHUONG L T T, HUY N Q, et al. Evaluation of the safety profile of the ASFV vaccine candidate ASFV-G-ΔI177L[J]. Viruses, 2022, 14(5): 896. DOI:10.3390/v14050896 |
| [6] |
URBANO A C, FERREIRA F. African swine fever control and prevention: an update on vaccine development[J]. Emerg Microbes Infect, 2022, 11(1): 2021-2033. DOI:10.1080/22221751.2022.2108342 |
| [7] |
陈孝军, 马俊, 陈熊男, 等. 1株非洲猪瘟病毒p30蛋白单克隆抗体识别的B细胞抗原表位的鉴定[J]. 畜牧兽医学报, 2022, 53(7): 2239-2251. CHEN X J, MA J, CHEN X N, et al. Identification of the B cell epitopes recognized by a monoclonal antibody against the p30 protein of African swine fever virus[J]. Acta Veterinaria et Zootechnica Sinica, 2022, 53(7): 2239-2251. (in Chinese) |
| [8] |
HUANG Z, XU Z Y, CAO H X, et al. A Triplex PCR method for distinguishing the wild-type African swine fever virus from the deletion strains by detecting the gene insertion[J]. Front Vet Sci, 2022, 9: 921907. DOI:10.3389/fvets.2022.921907 |
| [9] |
CAO S N, LU H P, WU Z, et al. A duplex fluorescent quantitative PCR assay to distinguish the genotype Ⅰ and Ⅱ strains of African swine fever virus in Chinese epidemic strains[J]. Front Vet Sci, 2022, 9: 998874. DOI:10.3389/fvets.2022.998874 |
| [10] |
WANG G G, XIE M J, WU W, et al. Structures and functional diversities of ASFV proteins[J]. Viruses, 2021, 13(11): 2124. DOI:10.3390/v13112124 |
| [11] |
LI Z Y, CHEN W X, QIU Z L, et al. African swine fever virus: a review[J]. Life (Basel), 2022, 12(8): 1255. |
| [12] |
王涛, 孙元, 罗玉子, 等. 非洲猪瘟防控及疫苗研发: 挑战与对策[J]. 生物工程学报, 2018, 34(12): 1931-1942. WANG T, SUN Y, LUO Y Z, et al. Prevention, control and vaccine development of African swine fever: challenges and countermeasures[J]. Chinese Journal of Biotechnology, 2018, 34(12): 1931-1942. (in Chinese) |
| [13] |
BORCA M V, RAI A, RAMIREZ-MEDINA E, et al. A cell culture-adapted vaccine virus against the current African swine fever virus pandemic strain[J]. J Virol, 2021, 95(14): e0012321. DOI:10.1128/JVI.00123-21 |
| [14] |
曾繁聪, 姜含雨, 辛宁, 等. 基于非洲猪瘟病毒I177L和p72基因的双重TaqMan荧光定量PCR鉴别检测方法的建立[J]. 中国预防兽医学报, 2022, 44(9): 952-957. ZENG F C, JIANG H Y, XIN N, et al. The development of a duplex TaqMan real-time PCR assay targeting the African swine fever virus I177L and p72 genes[J]. Chinese Journal of Preventive Veterinary Medicine, 2022, 44(9): 952-957. (in Chinese) |
(编辑 白永平)



