非洲猪瘟(African swine fever, ASF)是由非洲猪瘟病毒(African swine fever virus, ASFV)感染家猪和野猪引起的一种急性、出血性、高度接触性传染病,被世界动物卫生组织(WOAH)列为必须报告的动物疫病[1]。家猪感染ASFV强毒株可引起严重的出血性疾病,致死率高达100%[2]。2018年,ASF传入我国并迅速扩散[3],给我国的养猪业造成了巨大的经济损失。由于ASFV基因类型多,免疫逃避机制复杂多样,目前还没有开发出针对该病毒的疫苗和有效的防治药物,只能依靠隔离和扑杀等严格的生物安全防控方式来控制疫情[4]。
ASFV属于非洲猪瘟病毒科非洲猪瘟病毒属,是一种大型双链DNA病毒,病毒基因组为170~190 kb,可编码150多种蛋白质,包括多种结构蛋白及参与DNA复制和修复的各种酶等[5-6]。迄今为止,仅有60多种病毒蛋白的生物学功能被报道,严重阻碍该病疫苗和防治药物的研发。ASFV主要感染猪巨噬细胞,这些细胞具有氧化性并对病毒基因组造成持续损害[7]。在众多参与病毒复制和修复的酶中,有一类酶可修复宿主因子对ASFV基因组的损伤[8],统称为碱基切除修复系统(base-excision repair, BER),包括AP核酸内切酶(ASFV AP)[9-10]、DNA修复聚合酶(ASFV Pol X)[11]和DNA连接酶(ASFV LIG)[12]。其中,ASFV LIG(NP419L)是修复系统中唯一的DNA连接酶,它在ASFV的DNA修复过程中催化DNA加入反应,将DNA链上的缺口连接起来,并在病毒基因组的诱变中起重要作用[13]。有研究认为抑制其活性可能会破坏ASFV的DNA修复过程并损害基因组稳定性[13],因此深入研究NP419L蛋白的功能有助于了解ASFV复制的机制。此外,目前多数使用p30、p72、p54和pp62等ASFV的结构蛋白作为靶抗原检测ASF的抗体[14-15],而NP419L蛋白能否做为抗体检测的靶抗原仍未见相关报道。因此,为了能够深入研究NP419L蛋白的生物学功能和免疫学特性,需要制备抗该蛋白的抗体。
骆驼科动物体内存在一种特殊的抗体,天然缺失轻链和重链第一恒定区,被称为重链抗体(heavy chain antibodies, HcAbs)[16]。与传统抗体不同,HcAb仅通过重链可变区(variable domains of heavy chain of HcAb, VHH)识别抗原。VHH分子量仅有15 ku左右,是目前已知最小完整的功能抗原结合片段,被称为纳米抗体(nanobody, Nb)[17]。与传统抗体相比,纳米抗体具有分子量小、稳定性高、免疫原性低、特异性强等优点,在病毒性疾病的诊断和治疗方面有广阔的开发前景[18]。目前纳米抗体已被广泛的应用于人和动物重大疫病创新型诊断试剂和防治药物的研发中,例如新型冠状病毒肺炎[19]、中东呼吸综合征[20]、口蹄疫[21]和高致病性禽流感[22-23]等。抗ASFV的p30和p54等蛋白的纳米抗体也已有应用于ASF抗体检测中的报道,并表现出了较高的敏感性和特异性[24-25]。此外,该两个蛋白纳米抗体的制备也为ASFV感染和复制机制的研究提供了有效的材料支撑。为了能够筛选制备抗ASFV NP419L蛋白的纳米抗体,本研究利用原核表达系统表达纯化了该蛋白,免疫双峰驼并采集外周血淋巴细胞,通过噬菌体展示技术筛选获得了6株抗NP419L蛋白的纳米抗体,构建并表达了纳米抗体与辣根过氧化物酶(horseradish peroxidase, HRP)融合蛋白,并对其进行了初步的鉴定和抗体检测应用的评价。本研究为后续ASFV NP419L蛋白功能的深入研究以及基于纳米抗体的ASF诊断技术的研发提供了一种新的策略。
1 材料与方法 1.1 材料1.1.1 质粒、菌株和细胞 原核表达载体pET-28a (+)、噬菌体展示载体pMECS和真核表达载体pCAGEN等商品化载体均为本实验室购买并保存;真核表达载体pCMV-N1-HRP以商品化pEGFP-N1载体为骨架进行基因改造[26],该载体引入了分泌信号肽、HA、HRP和His标签;大肠杆菌感受态细胞Trans 5α和BL21(DE3)购自北京全式金生物技术公司;E. coli TG1感受态细胞购自Beyotime公司;辅助噬菌体M13KO7购自NEB公司;HEK293 T细胞为本实验室保存。
1.1.2 主要试剂 T4 DNA连接酶和限制性核酸内切酶BamH Ⅰ、Xho Ⅰ、Pst Ⅰ、Not Ⅰ等购自NEB公司;RNA提取试剂盒(RNeasy® Plus Mini Kit)购自QIAGEN公司,RT-PCR反转录试剂盒(TransScript® Reverse Transcriptase)、鼠抗HA抗体、鼠抗His抗体、鼠抗FLAG抗体、HRP标记的羊抗鼠IgG和羊抗兔IgG均购自北京全式金生物技术公司;兔抗骆驼多克隆抗体由实验室制备保存[27];转染试剂PEI购自Polysciences公司;无机试剂均为国产分析纯产品;临床34份阳性和47份阴性ASF抗体猪血清为实验室收集并保存,上述血清均通过非洲猪瘟病毒ELISA抗体检测试剂盒(北京金诺百泰生物技术有限公司)鉴定。
1.2 方法1.2.1 ASFV NP419L蛋白的原核表达与纯化 ASFV编码NP419L蛋白的基因序列(GenBank:NC_001 659.2)由GENEWIZ公司合成,连接至pUC56载体。由GENEWIZ公司合成扩增该基因的引物(表 1)。以合成的NP419L基因为模板,ASFV-NP419L-F和ASFV-NP419L-R为引物,PCR扩增目的基因片段。限制性内切酶BamH Ⅰ和Xho Ⅰ酶切PCR产物和pET-28a (+)表达载体,T4连接酶将目的基因连入载体中。测序鉴定正确后得到重组表达质粒pET-28a-NP419L。
|
|
表 1 目的基因扩增引物 Table 1 Primers for amplification of target gene |
阳性重组质粒转化至BL21(DE3)感受态细胞,表达重组蛋白。阳性菌液培养至OD600 nm值为0.6~0.8,加入终浓度为1 mmol·L-1的IPTG,37 ℃诱导表达8 h后收集菌体。以180 W功率超声3 s,暂停3 s,超声40 min裂解菌体后分别收集上清和沉淀,参考Ni-NTA使用说明书纯化目的蛋白。SDS-PAGE和Western blot分析目的蛋白的表达、纯化和抗原性。
1.2.2 动物免疫及血清效价测定 1 mL纯化的重组NP419L蛋白(2 mg·mL-1)与等体积佐剂乳化,颈部皮下多点免疫4周龄雌性双峰驼,共免疫5次。每两周免疫一次,第一次采用完全弗氏佐剂进行乳化,后四次采用不完全弗氏佐剂。第五次免疫一周后采集免疫骆驼的颈静脉血,分离血清和外周血淋巴细胞。参考刘红亮等描述的方法[28],ELISA检测骆驼血清中抗NP419L蛋白的抗体效价。
1.2.3 噬菌体展示文库的构建 参考RNA提取试剂盒说明书提取外周血淋巴细胞总RNA。以提取的RNA为模板,Oligo (dT)20为反转录引物,参考TransScript® Ⅱ反转录试剂盒的说明书,合成cDNA。以cDNA为模板,参考刘红亮等描述的方法[28],巢式PCR扩增VHH基因片段。第一轮PCR以CALL001、CALL002为引物(表 1),PCR产物经12 g·L-1的琼脂糖凝胶电泳分离鉴定,回收大小约700 bp的条带;以第一轮PCR回收产物为模板,VHH-F、VHH-R为上下游引物(表 1)进行第二轮PCR,PCR产物经15 g·L-1的琼脂糖凝胶电泳分离鉴定,回收大小约为400 bp的条带。
限制性内切酶PstⅠ和NotⅠ对第二轮PCR产物和pMECS噬菌体展示载体进行双酶切,T4 DNA连接酶将目的基因连入载体。连接产物电转化至大肠杆菌TG1感受态细胞,涂布于含葡萄糖且氨苄抗性的LB(LB/Amp-GLU)固体平板,37 ℃培养6~8 h,收集菌苔,即为构建的抗NP419L的噬菌体展示文库。取20 μL培养物进行10倍比稀释,取10-3至10-6稀释度的样品涂布于LB/Amp-GLU固体平板,37 ℃培养8 h,计数平板上的菌落。次日,随机挑取48个单克隆加入1 mL LB/Amp-GLU液体培养基,37 ℃振荡培养4~6 h,引物VHH-F和VHH-R进行PCR鉴定,测定文库的阳性率,计算构建的纳米抗体库的库容。阳性克隆送至西安擎科生物技术有限公司,测序获得序列后分析文库的多样性。
1.2.4 ASFV-NP419L特异性纳米抗体的淘选 构建的噬菌体文库接种于含葡萄糖且氨苄抗性的YT(2×YT/Amp-GLU)液体培养基,培养至OD600 nm值为0.6~0.8,加入M13KO7辅助噬菌体,静置离心,加入氨苄和卡那霉素双抗性YT(2×YT/Amp-Kan)液体培养基。过夜培养后收集上清,加入预冷的PEG/NaCl,离心收集沉淀并用PBS重悬,再次离心后收集上清即为救援的重组噬菌体。重组噬菌体进行10的倍比稀释后浸染对数生长期的TG1,涂布于LB/Amp-GLU固体平板,计算重组噬菌体滴度。
原核表达纯化的重组NP419L蛋白包被ELISA板,加入救援的重组噬菌体,37 ℃孵育2 h,加入新鲜配制的三乙胺溶液(0.1 mol·L-1)洗脱结合的噬菌体,加入等体积的Tris-HCl(1 mol·L-1, pH=7.4)中和,即为第一轮洗脱液。参考上述救援噬菌体滴度的测定方法,测定第一轮洗脱液中的噬菌体滴度。将洗脱液浸染对数生长期的TG1,进行第二轮的救援和筛淘。参考上述方法,对构建的噬菌体文库共进行三轮的救援和筛淘。
第三轮淘选后测定滴度的平板上随机挑取96个单克隆,接种于LB/Amp-GLU培养基,37 ℃培养至对数生长期,加入终浓度为1 mmol·L-1的IPTG诱导表达。离心收集菌体沉淀,冻融3次,上清即为包含纳米抗体的粗提物。ELISA鉴定特异结合NP419L蛋白的粗提物。原核表达纯化的重组NP419L蛋白包被ELISA板,2.5%脱脂奶粉封闭;加入上述制备的粗提物,37 ℃孵育1 h;加入抗HA单抗,37 ℃孵育1 h;加入HRP标记的羊抗鼠IgG抗体,37 ℃孵育1 h,加入TMB室温显色15 min,用3 mol·L-1 H2SO4终止反应后,读取OD450 nm值。以包被的血清4型禽腺病毒(fowl adenovirus,FAdV)的Hexon蛋白为阴性对照。以NP419L蛋白为包被抗原的OD450 nm值大于阴性对照的3倍以上,初步鉴定为特异性结合靶蛋白的粗提物。阳性粗提物对应的单克隆菌液送至西安擎科生物技术有限公司测序,获得的序列用MegAlign软件比对,纳米抗体高变区(CDR3区)的氨基酸序列相似性大于95%的定义为同一株纳米抗体。
1.2.5 纳米抗体与HRP融合蛋白的表达 以上述获得的包含编码阳性纳米抗体基因序列的单克隆菌液为模板,VHH-F和VHH-R为引物扩增基因序列,PstⅠ和NotⅠ将PCR产物和pCMV-N1-HRP载体进行双酶切,酶切产物用T4 DNA连接至载体,转化至Trans 5α感受态细胞,测序鉴定。阳性质粒利用PEI转染试剂转染至HEK293 T细胞,培养48 h,收取细胞上清即为表达制备的抗NP419L纳米抗体与HRP融合蛋白。
间接免疫荧光试验(indirect immunofluorescence assay, IFA)鉴定融合蛋白在HEK293 T细胞内的表达。4%多聚甲醛溶液固定转染细胞,1% BSA溶液封闭;依次孵育抗His单抗和FITC标记的羊抗鼠IgG;DAPI染细胞核后,倒置荧光显微镜观察。
ELISA鉴定融合蛋白被分泌表达至细胞上清并具有HRP的反应活性。将收集的上清直接包被ELISA板,2.5%脱脂奶粉封闭1 h,直接加入TMB显色液避光显色,加入3 mol·L-1 H2SO4终止反应,读取OD450 nm值。与阴性对照相比,鉴定上清中是否含有纳米抗体与HRP融合蛋白。
1.2.6 融合蛋白与原核表达NP419L蛋白结合的鉴定 ELISA鉴定表达制备的纳米抗体与HRP融合蛋白与原核表达的重组NP419L蛋白的结合。重组NP419L蛋白包被ELISA酶标板,相同载体和系统表达制备的ASFV-p30和FAdV-Hexon蛋白为无关蛋白对照,2.5%脱脂奶粉封闭;分别加入收集的上清(包含抗NP419L纳米抗体与HRP融合蛋白),室温孵育后加入TMB显色液,避光显色15 min后加入3 mol·L-1 H2SO4终止反应,读取OD450 nm值。ELISA测定上清中不同纳米抗体与HRP融合蛋白与NP419L蛋白的结合效价。收集的转染细胞上清进行10的倍比(1∶10、1∶102、1∶103、1∶104)稀释后加入ELISA板中,然后显色、终止反应,根据读取的OD450 nm值确定不同融合蛋白的结合效价。
1.2.7 融合蛋白与真核表达NP419L蛋白的结合 构建带有FLAG标签的NP419L蛋白的真核表达载体。以pET-28a-NP419L质粒为模板,引物为pCAGEN-NP419L-F和pCAGEN-NP419L-R(表 1),PCR扩增靶基因。EcoRⅠ和NotⅠ将PCR产物和pCAGEN真核表达载体分别双酶切,T4 DNA连接酶将靶基因连接至pCAGEN载体,测序鉴定。将阳性质粒转染至HEK293T细胞,培养24 h,4%多聚甲醛固定细胞以及1% BSA溶液封闭;依次孵育抗FLAG单抗和FITC标记的羊抗鼠IgG,DAPI染核后,倒置荧光显微镜下观察重组NP419L蛋白的表达。确定蛋白表达后,IFA鉴定表达制备的纳米抗体与HRP融合蛋白结合真核表达的NP419L蛋白。质粒转染的细胞固定封闭后,加入纳米抗体与HRP融合蛋白室温孵育1 h;依次孵育抗His单抗和FITC标记的羊抗鼠IgG,DAPI染核后倒置荧光显微镜观测结果。
1.2.8 融合蛋白在ASF抗体检测中的初步应用 竞争ELISA初步评价制备的纳米抗体与HRP融合蛋白在ASF抗体检测中的应用。重组NP419L蛋白(400 ng·孔-1)包被ELISA板,2.5%脱脂奶粉封闭;制备的纳米抗体与HRP融合蛋白分别与ASF抗体阳性(34份)和阴性(47份)猪血清混匀后,加入ELISA板中,37 ℃孵育1 h;洗板后每孔加入TMB显色液,避光显色15 min后加入3 mol·L-1 H2SO4终止反应,读取OD450 nm值。比较分析阳性和阴性血清的OD450 nm值,初步评价筛选获得的纳米抗体在ASF抗体检测中的应用。
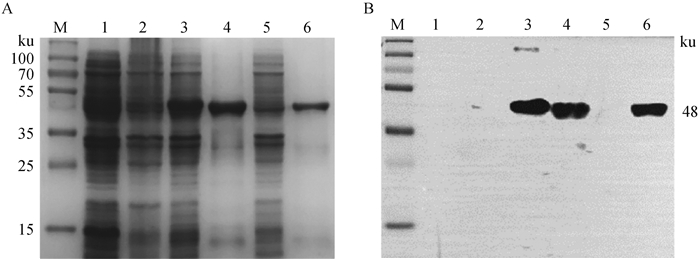
2 结果 2.1 ASFV NP419L重组蛋白的原核表达、纯化及鉴定构建的ASFV NP419L蛋白原核表达质粒转化至BL21(DE3),经IPTG诱导表达后,SDS-PAGE结果显示,成功获得预期大小为48 ku的重组NP419L蛋白(图 1A);菌体超声裂解后,该重组蛋白主要以包涵体的形式存在(图 1A);Ni-NTA亲和层析纯化获得了纯度较高的目的蛋白(图 1A)。Western blot结果显示,表达制备的NP419L重组蛋白与ASF阳性猪血清具有良好的反应性,说明原核表达的重组NP419L蛋白具有良好的抗原性(图 1B)。
|
M. 蛋白质相对分子质量标准;1. pET-28a空载诱导表达菌体;2. 未诱导表达菌体;3. 诱导表达菌体;4. 菌体裂解后沉淀;5. 菌体裂解后上清;6. 纯化的重组蛋白 M. Protein marker; 1.Negative bacteria with induction; 2. Positive bacteria without induction; 3. Positive bacteria with induction; 4. Pellets after sonication; 5. Supernatant after sonication; 6. Purified recombinant protein 图 1 SDS-PAGE (A)和Western blot(B)鉴定原核表达纯化的ASFV NP419L重组蛋白 Fig. 1 Identification of the recombinant ASFV NP419L protein by SDS-PAGE (A) and Western blot analysis (B) |
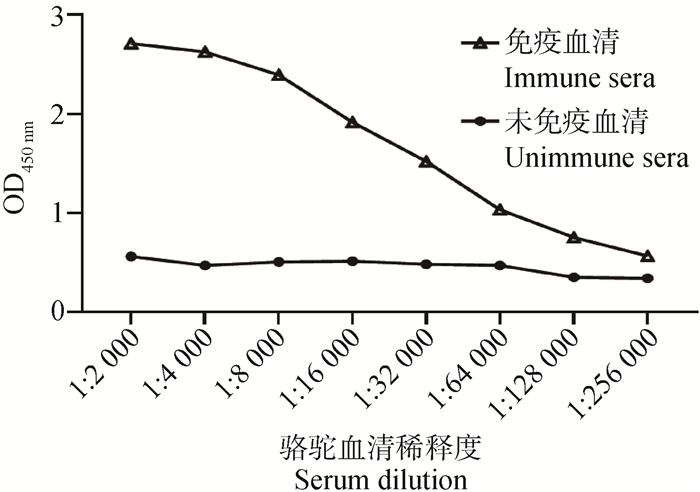
5次免疫后,采集免疫骆驼的血清,ELISA结果显示,免疫骆驼中抗NP419L蛋白特异性抗体效价可达1∶128 000(图 2),表明制备的重组NP419L蛋白具有良好的免疫原性,可刺激骆驼产生较好的免疫应答反应。
|
图 2 ELISA检测免疫骆驼中抗NP419L抗体的效价 Fig. 2 Titers of anti-NP419L antibody titer in the immunized by detection of ELISA |
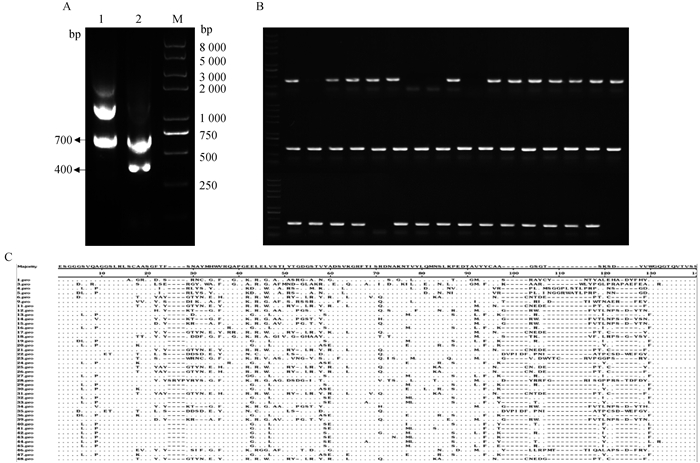
5免后1周采集免疫骆驼的外周血并提取总RNA,以RNA为模板,经巢式RT-PCR成功扩增得到了编码VHH的基因片段,其预期大小为400 bp(图 3A)。经酶切,连接和电转化后,成功构建了库容量为6×108的抗NP419L蛋白的VHH噬菌体展示文库。经菌液PCR鉴定,文库阳性率约为89.5%(图 3B)。阳性单克隆测序结果表明插入的VHH基因没有重复序列(图 3C),说明构建的文库多样性较好。
|
A. 巢式PCR扩增VHH基因(M. DNA相对分子质量标准;1. 第一轮PCR扩增;2. 第二轮PCR扩增);B. PCR鉴定VHH文库阳性率;C. 阳性克隆序列 A. Amplification of VHH gene by nested PCR(M. DNA marker; 1. The first round of PCR; 2. The second round of PCR); B. Identification of VHH library positive rate by PCR; C. The sequences of the positive PCR products in the library 图 3 VHH噬菌体展示文库的构建 Fig. 3 Construction of VHH phage display library |
以表达制备的NP419L重组蛋白为包被抗原,三轮噬菌体展示淘选后,结果显示与对照相比,抗NP419L蛋白的特异性噬菌体比例逐渐升高,由0.7升至85(表 2),表明抗NP419L特异性噬菌体得到有效富集。
|
|
表 2 NP419L特异性噬菌体富集情况 Table 2 Enrichment of phage particles carrying specific anti-NP419L nanobodies |
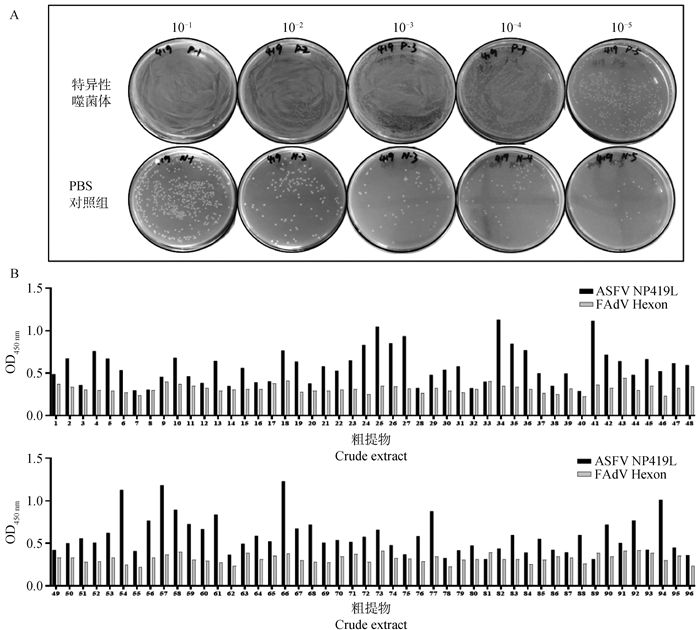
将第三轮淘选的噬菌体进行滴度测定,结果显示与阴性对照组相比,抗NP419L的噬菌体得到明显富集(图 4A)。第三轮淘选后测定滴度的平板上随机挑取96个单克隆,经IPTG诱导制备可溶性的纳米抗体粗提物。利用制备的粗提物进行ELISA,结果显示制备的96个粗提物中有23个可能与NP419L蛋白发生特异性结合(图 4B)。将阳性粗提物对应的单克隆进行测序,根据获得的23个VHH CDR3的氨基酸序列比对结果,成功筛淘获得6株抗NP419L蛋白的特异性纳米抗体,分别命名为ASFV-NP419L-Nb18、-20、-34、-46、-49和-89,且6株纳米抗体均在FR2区存在典型的亲水性氨基酸替换(图 5)。
|
A.噬菌体滴度;B. 间接ELISA检测重组纳米抗体与NP419L的结合 A. Phage titers; B. Detection the reactivity of recombinant nanobodies with NP419L protein by indirect ELISA 图 4 间接ELISA筛选NP419L特异性纳米抗体 Fig. 4 Screening of NP419L-specific nanobodies by Indirect ELISA |

|
图 5 NP419L特异性纳米抗体氨基酸序列比对 Fig. 5 Amino acid sequences alignment of NP419L-specific nanobodies |
获得的抗NP419L纳米抗体的基因序列连接至pCMV-N1-HRP载体,成功构建了纳米抗体与HRP融合蛋白的真核表达载体。阳性质粒转染HEK293 T细胞48 h后,IFA结果显示抗NP419L纳米抗体与HRP融合蛋白成功在细胞中表达(图 6A)。利用收集的上清直接包被ELISA板显色,结果显示,融合蛋白成功分泌至细胞培养上清中,具有HRP与其底物TMB反应的特性(图 6B)。该6株融合蛋白命名为ASFV-NP419L-Nb18-HRP、-20-HRP、-34-HRP、-46-HRP、-49-HRP和-89-HRP。
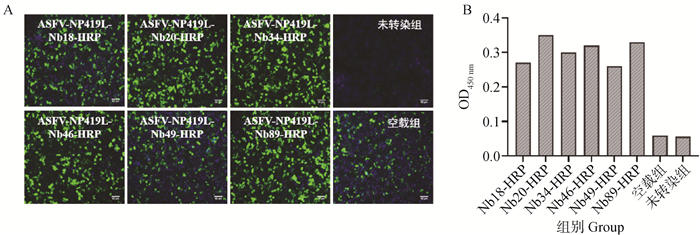
|
A. IFA鉴定细胞中融合蛋白的表达;B. ELISA鉴定融合蛋白分泌至细胞上清中表达 A. Expression of anti-NP419L nanobody-HRP fusion proteins in the HEK293T cells by IFA analysis; B. Secretory expression of anti-NP419L nanobody-HRP fusion proteins in the HEK293T cells by ELISA analysis 图 6 抗NP419L蛋白纳米抗体与HRP融合蛋白在HEK293T细胞中的表达鉴定 Fig. 6 Expression of ani-NP419L nanobodies fused with HRP in the HEK293T cells |
原核表达制备的NP419L蛋白为包被抗原,收集的6株纳米抗体与HRP融合蛋白上清为孵育的一抗,直接ELISA结果显示,与无关抗原相比6株融合蛋白均可特异性结合原核表达制备的ASFV NP419L蛋白(图 7A)。ELISA分析6株融合蛋白结合重组NP419L蛋白的效价,结果表明ASFV-NP419L-Nb20-HRP的结合效价最高,达104; ASFV-NP419L-Nb89-HRP的结合效价最低,在1∶102稀释时已不能结合;其余4株结合效价为103(图 7B)。
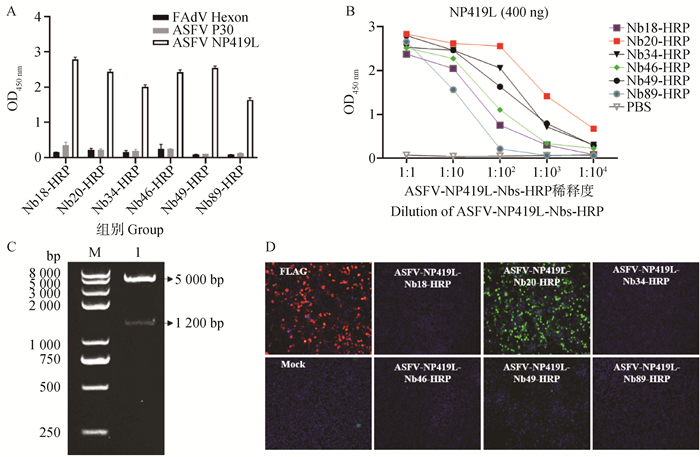
|
A. 融合蛋白特异性结合原核表达的重组NP419L蛋白;B. 上清中融合蛋白结合NP419L蛋白的结合效价;C. 重组NP419L真核表达载体的酶切鉴定(M. DNA相对分子质量标准;1. 阳性质粒的双酶切鉴定); D. IFA鉴定融合蛋白结合真核表达的重组NP419L蛋白 A. Specificity; B. Affinity; C. Enzymatic digestion of recombinant plasmids pCAGEN-NP419L(M. DNA marker; 1. Enzymatic digestion of pCAGEN-NP419L); D. Detection the binding of Nb20 to NP419L in HEK-293T cells by IFA 图 7 抗NP419L纳米抗体与HRP融合蛋白结合不同表达形式NP419L蛋白的鉴定 Fig. 7 Activity identification of NP419L-specific nanobodies |
经EcoRⅠ和NotⅠ双酶切鉴定后,琼脂糖凝胶电泳结果显示成功构建了重组NP419L蛋白的真核表达质粒(图 7C)。阳性质粒转染HEK293 T细胞,利用抗FLAG单抗进行IFA检测发现,重组NP419L蛋白成功在细胞质中表达(图 7D)。利用收集的抗NP419L蛋白纳米抗体与HRP融合蛋白为一抗进行IFA检测,结果发现ASFV-NP419L-Nb20-HRP与HEK293 T细胞中表达的NP419L蛋白结合,其余融合蛋白不结合(图 7D)。
2.7 ASFV-NP419L-Nb20-HRP融合蛋白在ASFV抗体检测中的应用ASFV-NP419L-Nb20-HRP融合蛋白作为检测探针,竞争ELISA检测ASF抗体阳性和阴性猪血清,结果发现47份阴性血清的OD450 nm值在1.17~1.35之间。34份阳性血清中,32份的OD450 nm值在0.21~0.67之间,平均竞争率为73%,统计学分析显示该32份阳性血清显著竞争抑制了ASFV-NP419L-Nb20-HRP融合蛋白与NP419L蛋白的结合(图 8)。另外2份阳性血清用该竞争ELISA方法未检测出,而商品化试剂盒检测结果为弱阳性。上述结果初步表明,制备的ASFV-NP419L-Nb20-HRP融合蛋白可以作为ASF抗体检测的竞争探针,应用于猪血清中ASF抗体检测竞争ELISA试剂盒的开发。

|
***. P < 0.001 图 8 竞争ELISA检测ASF抗体阳性和阴性猪血清 Fig. 8 Competitive ELISA for detection of ASF antibody positive and negative swine serum |
最近有研究发现,我国出现了基因Ⅰ型和低毒力的基因Ⅱ型ASFV毒株[29-30],该类毒株可导致猪的轻度感染和慢性疾病,加大了早期诊断难度,给我国ASF的防控带来更多问题和挑战。因此,仍需要制备抗ASFV不同蛋白的抗体并深入研究它们的生物学特性,为该病诊断技术和疫苗的开发提供理论和材料支撑。纳米抗体作为第三代基因工程抗体,逐渐成为病原体特性研究及疫病诊断和防治技术研发的有效工具。基于ASF对我国养猪业的危害以及纳米抗体易基因工程改造和体外表达成本低的优势,本研究成功筛选制备了6株抗ASFV NP419L蛋白的纳米抗体,并且初步评价了其中1株纳米抗体在ASF抗体检测中的应用。然而,目前针对该病抗体的检测,大多数使用p30、p72、p54和pp62等ASFV主要的结构蛋白为靶抗原。因此,NP419L蛋白与上述蛋白在ASF抗体检测中的差异以及其能否也成为一种理想的检测靶抗原,仍需要后续深入的研究,进而为ASF抗体的检测提供一种新的策略。
本研究通过抗原表达、动物免疫和噬菌体展示筛淘等技术成功筛选了6株抗ASFV NP419L的特异性纳米抗体。然而,前期我们制备其它病原(如新城疫和禽流感病毒)和蛋白的纳米抗体,通常能够筛选到20株左右。比较整个试验的操作过程,作者发现免疫的抗原以可溶形式存在时,筛选获得的纳米抗体较多。本研究中原核表达制备的重组NP419L蛋白以包涵体的形式存在,该蛋白在透析复性过程中也迅速析出而无法完全复性。面对该问题,作者也通过降低诱导表达温度(16 ℃)和转速(150 r·min-1)等表达条件,但是重组NP419L蛋白均以包涵体的形式存在。因此,为了后续能够筛选更多株的抗NP419L蛋白的纳米抗体,建议后续可以用真核表达系统表达制备可溶形式的NP419L蛋白进行免疫。
本研究制备的6株纳米抗体通过体外原核表达的重组NP419L蛋白免疫双峰驼获得,需要鉴定该6株纳米抗体能否结合ASFV内源性NP419L蛋白。基于此,作者先鉴定了6株纳米抗体与HRP融合蛋白与真核表达的NP419L蛋白的结合特性,发现仅ASFV-NP419L-Nb20-HRP可特异性结合真核表达的NP419L蛋白。随后利用该融合蛋白为一抗,IFA和Western blot检测了ASFV感染PAM细胞后的内源性NP419L蛋白,结果均为阴性,该结果似乎提示该融合蛋白不能结合病毒内源性NP419L蛋白。然而,该融合蛋白可作为竞争探针有效检测猪血清中的ASF抗体,提示该纳米抗体识别的表位在ASFV感染猪后可刺激机体产生抗体。因此,作者推测该融合蛋白不能结合内源性NP419L蛋白可能是由于融合蛋白亲和力低或上清中含量低。总之,后续仍需对该株纳米抗体进行免疫学特性研究,验证其作为ASFV NP419L蛋白功能研究工具的可行性。
纳米抗体易被体外基因工程改造,近年来被广泛的应用于疫病诊断和食品检测技术的研发中。例如,在疫病诊断领域,利用纳米抗体与HRP融合蛋白为检测探针,目前已成功建立了鸡新城疫[26]、猪繁殖与呼吸综合征[31]、猪圆环病毒2型[32]等重要动物疫病的抗体竞争ELISA检测方法[33]。此外,也有利用纳米抗体的生物素或胶体金标记,建立了病原的夹心ELISA和胶体金检测试纸条[34]。与基于传统抗体建立的诊断或检测技术相比,该类创新技术展现了生产成本低,耐极端环境和操作简易的特点。本研究成功表达制备了6株抗ASFV NP419L纳米抗体与HRP融合蛋白,其中1株融合蛋白可有效的作为竞争探针检测猪血清中ASF的抗体。但是利用该融合蛋白检测的34份ASF抗体阳性猪血清,结果2份为阴性。该结果提示该融合蛋白作为探针检测ASF的抗体,可能敏感性较低,后续仍需要优化竞争ELISA相关条件,提高该检测方法的敏感性。
4 结论利用大肠杆菌表达系统成功表达并纯化了重组ASFV NP419L重组蛋白,该蛋白具有很好的抗原性;通过双峰驼免疫和文库构建等技术,成功构建了库容为6×108的噬菌体展示文库,利用噬菌体展示技术成功筛选获得6株抗NP419L蛋白的特异性纳米抗体;真核表达了该6株纳米抗体与HRP的融合蛋白,其中1株融合蛋白ASFV-NP419L-Nb20-HRP可结合真核表达的NP419L蛋白,并可与ASF抗体阳性猪血清竞争地结合NP419L蛋白。本研究为后续ASFV NP419L蛋白的功能研究以及该病创新型诊断技术的研发提供了材料支撑。
| [1] |
DIXON L K, SUN H, ROBERTS H. African swine fever[J]. Antiviral Res, 2019, 165: 34-41. DOI:10.1016/j.antiviral.2019.02.018 |
| [2] |
WANG F X, ZHANG H, HOU L N, et al. Advance of African swine fever virus in recent years[J]. Res Vet Sci, 2021, 136: 535-539. DOI:10.1016/j.rvsc.2021.04.004 |
| [3] |
GE S Q, LI J M, FAN X X, et al. Molecular characterization of African swine fever virus, China, 2018[J]. Emerg Infect Dis, 2018, 24(11): 2131-2133. DOI:10.3201/eid2411.181274 |
| [4] |
URBANO A C, FERREIRA F. African swine fever control and prevention: an update on vaccine development[J]. Emerg Microbes Infect, 2022, 11(1): 2021-2033. DOI:10.1080/22221751.2022.2108342 |
| [5] |
DIXON L K, CHAPMAN D A G, NETHERTON C L, et al. African swine fever virus replication and genomics[J]. Virus Res, 2013, 173(1): 3-14. DOI:10.1016/j.virusres.2012.10.020 |
| [6] |
WANG G G, XIE M J, WU W, et al. Structures and functional diversities of ASFV proteins[J]. Viruses, 2021, 13(11): 2124. DOI:10.3390/v13112124 |
| [7] |
AKAIKE T. Role of free radicals in viral pathogenesis and mutation[J]. Rev Med Virol, 2001, 11(2): 87-101. DOI:10.1002/rmv.303 |
| [8] |
FORMAN H J, TORRES M. Redox signaling in macrophages[J]. Mol Aspects Med, 2001, 22(4-5): 189-216. DOI:10.1016/S0098-2997(01)00010-3 |
| [9] |
REDREJO-RODRÍGUEZ M, GARCÍA-ESCUDERO R, YÁÑEZ-MUÑOZ R J, et al. African swine fever virus protein pE296R is a DNA repair apurinic/apyrimidinic endonuclease required for virus growth in swine macrophages[J]. J Virol, 2006, 80(10): 4847-4857. DOI:10.1128/JVI.80.10.4847-4857.2006 |
| [10] |
REDREJO-RODRÍGUEZ M, ISHCHENKO A A, SAPARBAEV M K, et al. African swine fever virus AP endonuclease is a redox-sensitive enzyme that repairs alkylating and oxidative damage to DNA[J]. Virology, 2009, 390(1): 102-109. DOI:10.1016/j.virol.2009.04.021 |
| [11] |
OLIVEROS M, YÁÑEZ R J, SALAS M L, et al. Characterization of an African swine fever virus 20-kDa DNA polymerase involved in DNA repair[J]. J Biol Chem, 1997, 272(49): 30899-30910. DOI:10.1074/jbc.272.49.30899 |
| [12] |
YÁÑEZ R J, VIÑUELA E. African swine fever virus encodes a DNA ligase[J]. Virology, 1993, 193(1): 531-536. DOI:10.1006/viro.1993.1161 |
| [13] |
CHEN Y Q, LIU H H, YANG C, et al. Structure of the error-prone DNA ligase of African swine fever virus identifies critical active site residues[J]. Nat Commun, 2019, 10(1): 387. DOI:10.1038/s41467-019-08296-w |
| [14] |
WAN Y, SHI Z W, PENG G, et al. Development and application of a colloidal-gold dual immunochromatography strip for detecting African swine fever virus antibodies[J]. Appl Microbiol Biotechnol, 2022, 106(2): 799-810. DOI:10.1007/s00253-021-11706-z |
| [15] |
PETROVAN V, MURGIA M V, WU P, et al. Epitope mapping of African swine fever virus (ASFV) structural protein, p54[J]. Virus Res, 2020, 279: 197871. DOI:10.1016/j.virusres.2020.197871 |
| [16] |
HAMERS-CASTERMAN C, ATARHOUCH T, MUYLDERMANS S, et al. Naturally occurring antibodies devoid of light chains[J]. Nature, 1993, 363(6428): 446-448. DOI:10.1038/363446a0 |
| [17] |
MUYLDERMANS S. Nanobodies: natural single-domain antibodies[J]. Annu Rev Biochem, 2013, 82: 775-797. DOI:10.1146/annurev-biochem-063011-092449 |
| [18] |
MUYLDERMANS S. Applications of nanobodies[J]. Annu Rev Anim Biosci, 2021, 9: 401-421. DOI:10.1146/annurev-animal-021419-083831 |
| [19] |
XU J L, XU K, JUNG S, et al. Nanobodies from camelid mice and llamas neutralize SARS-CoV-2 variants[J]. Nature, 2021, 595(7866): 278-282. DOI:10.1038/s41586-021-03676-z |
| [20] |
HE L, TAI W B, LI J F, et al. Enhanced ability of oligomeric nanobodies targeting MERS coronavirus receptor-binding domain[J]. Viruses, 2019, 11(2): 166. DOI:10.3390/v11020166 |
| [21] |
HARMSEN M M, FIJTEN H P D, DEKKER A, et al. Passive immunization of pigs with bispecific llama single-domain antibody fragments against foot-and-mouth disease and porcine immunoglobulin[J]. Vet Microbiol, 2008, 132(1-2): 56-64. DOI:10.1016/j.vetmic.2008.04.030 |
| [22] |
CARDOSO F M, IBAÑEZ L I, VAN DEN HOECKE S, et al. Single-domain antibodies targeting neuraminidase protect against an H5N1 influenza virus challenge[J]. J Virol, 2014, 88(15): 8278-8296. DOI:10.1128/JVI.03178-13 |
| [23] |
ZHU M, GONG X, HU Y H, et al. Streptavidin-biotin-based directional double Nanobody sandwich ELISA for clinical rapid and sensitive detection of influenza H5N1[J]. J Transl Med, 2014, 12: 352. DOI:10.1186/s12967-014-0352-5 |
| [24] |
ZHAO J K, ZHU J H, WANG Y, et al. A simple nanobody-based competitive ELISA to detect antibodies against African swine fever virus[J]. Virol Sin, 2022, 37(6): 922-933. DOI:10.1016/j.virs.2022.09.004 |
| [25] |
ZHAO H J, REN J H, WU S Y, et al. HRP-conjugated-nanobody-based cELISA for rapid and sensitive clinical detection of ASFV antibodies[J]. Appl Microbiol Biotechnol, 2022, 106(11): 4269-4285. DOI:10.1007/s00253-022-11981-4 |
| [26] |
SHENG Y M, WANG K, LU Q Z, et al. Nanobody-horseradish peroxidase fusion protein as an ultrasensitive probe to detect antibodies against Newcastle disease virus in the immunoassay[J]. J Nanobiotechnol, 2019, 17(1): 35. DOI:10.1186/s12951-019-0468-0 |
| [27] |
刘青源. 基于纳米抗体-HRP融合蛋白鸡血清中抗NDV抗体竞争ELISA检测方法的建立[D]. 杨凌: 西北农林科技大学, 2019. LIU Q Y. Establishment of a competitive ELISA assay for anti-NDV antibody in chicken serum based on nanobody-HRP fusion protein[D]. Yangling: Northwest A&F University, 2019. (in Chinese) |
| [28] |
刘红亮. 猪繁殖与呼吸综合征病毒Nsp9蛋白纳米抗体的筛选及其抗病毒功能研究[D]. 杨凌: 西北农林科技大学, 2016. LIU H L. Isolation and antiviral activities analysis of porcine peproductive and respiratory syndrome virus Nsp9- specific nanobodies[D]. Yangling: Northwest A&F University, 2016. (in Chinese) |
| [29] |
SUN E C, ZHANG Z J, WANG Z L, et al. Emergence and prevalence of naturally occurring lower virulent African swine fever viruses in domestic pigs in China in 2020[J]. Sci China Life Sci, 2021, 64(5): 752-765. DOI:10.1007/s11427-021-1904-4 |
| [30] |
SUN E C, HUANG L Y, ZHANG X F, et al. Genotype Ⅰ African swine fever viruses emerged in domestic pigs in China and caused chronic infection[J]. Emerg Microbes Infect, 2021, 10(1): 2183-2193. DOI:10.1080/22221751.2021.1999779 |
| [31] |
DUAN H, CHEN X, ZHAO J K, et al. Development of a nanobody-based competitive enzyme-linked immunosorbent assay for efficiently and specifically detecting antibodies against genotype 2 porcine reproductive and respiratory syndrome viruses[J]. J Clin Microbiol, 2021, 59(12): e0158021. DOI:10.1128/JCM.01580-21 |
| [32] |
MU Y, JIA C Y, ZHENG X, et al. A nanobody-horseradish peroxidase fusion protein-based competitive ELISA for rapid detection of antibodies against porcine circovirus type 2[J]. J Nanobiotechnol, 2021, 19(1): 34. DOI:10.1186/s12951-021-00778-8 |
| [33] |
LU Q Z, LI X X, ZHAO J K, et al. Nanobody-horseradish peroxidase and-EGFP fusions as reagents to detect porcine parvovirus in the immunoassays[J]. J Nanobiotechnol, 2020, 18(1): 7. DOI:10.1186/s12951-019-0568-x |
| [34] |
JI P P, ZHU J H, LI X X, et al. Fenobody and RANbody-based sandwich enzyme-linked immunosorbent assay to detect Newcastle disease virus[J]. J Nanobiotechnol, 2020, 18(1): 44. DOI:10.1186/s12951-020-00598-2 |
(编辑 白永平)



