2. 兰州大学公共卫生学院, 兰州 730000
2. School of Public Health, Lanzhou University, Lanzhou 730000, China
鼠痘病毒(ectromelia virus,ECTV)属于痘病毒科脊索动物痘病毒亚科正痘病毒属的成员,是一种双链DNA病毒,与曾引起人类天花的天花病毒以及近年来引起人兽共患病的猴痘病毒的基因组高度相似[1]。由于ECTV具有限制性的宿主范围,自然宿主为鼠类,使ECTV成为可感染人类痘病毒的一个有效的模式动物病毒,可用于正痘病毒的发病机制、抗病毒药物和疫苗的评价研究。近年来,随着痘病毒感染事件的增加,使得对其深入研究再次重要起来。特别是最近报道猴痘已在非洲、欧洲、美洲等地区103个国家流行,并不断在人际间传播,WHO宣布已构成了国际关注的突发公共卫生事件[2],甚至我国台湾、香港和重庆已出现了输入病例,这使猴痘等感染人类的痘病毒的研究变得更为必要和紧迫。猴痘的临床表现与天花类似,很难与其他一些皮疹病区分开来,主要通过实验室进行鉴别诊断和监测。但是,目前的诊断方法比较费时,且无针对猴痘的特效药物或疫苗,迫切需要更加精准快速的检测技术,以及有效的防治措施[3]。鼠痘病毒作为正痘病毒的模式动物病毒,已成为其生物学特性研究的理想的替代病毒模型。
ECTV及其他许多痘病毒都会产生两种具有抗原性和感染性的病毒粒子:胞内成熟病毒(intracellular mature virus, IMV)和胞外囊膜病毒(extracellular envelope virus, EEV)。IMV是子代病毒组装的核心,EEV介导病毒的传播及致病[4-6]。IMV是最丰富也是最稳定的病毒粒子形式,其膜上有许多蛋白,如L1、H3、A27蛋白等靶标,其中H3则是确定的通过天花疫苗免疫的人类中和抗体的直接靶标[7-9]。EEV则比IMV多一层膜包裹,膜上主要由B5R、A33R、A34R、A36R、A56R、F13L和K2R基因编码相关功能蛋白。研究显示,用VACV A33或其ECTV同源物EVM135免疫小鼠,可保护ECTV易感小鼠不发生死亡[10]。多项研究表明H3L和A33在不同痘病毒株中高度保守且具有免疫优势,并且可能是防止感染的关键因素[11],可以作为痘病毒有效的疫苗抗原或治疗靶点。本研究即通过获取A33和H3L鼠痘病毒同源蛋白——EVM135和EVM085,制备兔抗EVM135和兔抗EVM085多克隆抗体,分析其免疫原性及抗体中和活性,为今后研制ECTV以及其他感染人类痘病毒的诊断方法及防治技术措施奠定基础。
1 材料与方法 1.1 材料ECTV-Moscow株购自美国菌种保藏中心(American Type Culture Collection, ATCC), 由本实验室保存并在CV-1细胞中扩增,病毒基因组用病毒核酸提取试剂盒进行提取。Rosetta感受态细胞、pET-30a载体由本实验室保存。新西兰白兔购自中国农业科学院兰州兽医研究所实验动物中心。
质粒提取试剂盒、胶回收试剂盒、IPTG购自生工生物工程(上海)股份有限公司。镍层析柱购自北京韦氏博慧色谱科技有限公司。DNA Marker、BamHⅠ和XhoⅠ快切酶、Prime Star GXL酶、T4连接酶、病毒核酸提取试剂盒均购自宝日医生物技术(北京)有限公司。蛋白Marker、RIPA裂解液购自Thermo Fisher Scientific公司。驴抗兔荧光二抗购自BioLegend,HRP标记山羊抗兔IgG、HRP标记山羊抗鼠IgG、弗氏完全佐剂、弗氏不完全佐剂购自Sigma公司。
1.2 EVM135和EVM085的跨膜结构及抗原表位预测应用TMHMM Server v.2.0在线软件预测EVM135和EVM085蛋白跨膜结构;应用Predicting Antigenic Peptides在线预测抗原表位。
1.3 正痘病毒属病毒A33和H3L同源蛋白系统进化树构建通过Blast比对,从NCBI网站分别选取正痘病毒属16种不同病毒种A33同源基因的编码序列,包括鼠痘病毒(ectromelia virus)、痘苗病毒(vaccinia virus)、天花病毒(variola virus)、牛痘病毒(cowpox virus)、猴痘病毒(monkeypox virus)、骆驼痘病毒(camelpox virus)、沙鼠痘病毒(taterapox virus)、浣熊痘病毒(raccoonpox virus)、水牛痘病毒(buffalopox virus)及其他7种近几年新鉴定出的正痘病毒(Akhmeta virus、Alaskapox virus、Murmansk poxvirus、ny_014 poxvirus、Orthopoxvirus Abatino、skunkpox virus、volepox virus);18种H3L同源基因编码序列,除以上16种病毒种,还包括马痘病毒(horsepox virus)和兔痘病毒(rabbitpox virus)。应用MEGA软件分别对A33和H3L编码序列进行氨基酸序列进化树编辑。
1.4 引物设计与合成参考NCBI网站GenBank数据库中的ECTV-Moscow株(GenBank: AF012 825.2)EVM135(GenBank: AAM92 440.1)和EVM085(GenBank: AAM92 389.1)基因组序列,分别设计特异性引物,EVM135-P1:GGATCCGTGCGCCTAAATCAATGC,EVM135-P2:CTCGAGTTAGTTCATTATTTTAACAC;EVM085-P1:GGATCCATGGCGGCGGCGAAAAC,EVM085-P2:CTCGAGTTAAAATGAAATCAGTGG。下划线分别表示BamHⅠ和XhoⅠ酶切位点。引物由北京擎科生物科技股份有限公司合成。
1.5 EVM135和EVM085基因的克隆及原核表达质粒的构建以提取的ECTV-Moscow株全基因组DNA为模板进行PCR扩增,反应体系如下(50 μL):5× PrimeSTAR GXL Buffer 10 μL,dNTP Mixture 4 μL,PrimeSTAR GXL DNA Polymerase 2 μL,上、下游引物各2 μL(10 mmol·L-1),模板5 μL,ddH2O补充至50 μL。PCR产物扩增后,胶回收产物与空载体分别进行BamHⅠ和XhoⅠ双酶切,回收目的片段,用T4连接酶16 ℃过夜连接,转化至Rosetta感受态细胞,涂布含卡那霉素的LB平板过夜培养,挑取单克隆菌落送擎科公司测序鉴定。
1.6 重组蛋白的表达纯化及鉴定将测序正确的菌液按1∶100接于5 mL含卡那霉素的LB培养基,37 ℃、200 r·min-1培养约3 h,待菌液OD600 nm为0.6~0.8时,加入终浓度0.5 mmol·L-1 IPTG,37 ℃、200 r·min-1继续诱导培养5 h,12 000 r·min-1离心10 min获取菌体,SDS-PAGE、Western blot鉴定蛋白表达情况。
将已表达的菌液按上述方式扩大培养诱导表达,离心收菌,超声波破碎,离心取沉淀。参照镍亲和层析柱说明书,进行蛋白纯化。两种重组蛋白均以包涵体的形式表达,裂解菌体的缓冲液含8 mol·L-1的尿素,纯化后蛋白放入透析袋,依次用含6、4、2 mol·L-1尿素的透析液分别进行4 ℃过夜透析。透析后的重组蛋白经SDS-PAGE鉴定后,BCA测定蛋白浓度,-80 ℃保存备用。
1.7 多克隆抗体的制备将纯化的重组蛋白分别与弗氏完全佐剂按1∶1混合乳化,免疫新西兰白兔(1 mg·只-1);免疫14 d后,将同样剂量的重组蛋白与弗氏不完全佐剂按1∶1乳化后进行加强免疫;28 d进行再次加强免疫;最后一次免疫后3 d心脏采血,并分离血清检测抗体效价,于-20 ℃保存。
1.8 抗体效价测定纯化后重组蛋白分别稀释至4 μg·mL-1包被96孔酶标板,每孔100 μL,4 ℃过夜;用PBST洗涤3遍,加入50 g·L-1 BSA溶液室温封闭2 h,PBST洗涤3次备用。制备的血清用PBS由1∶10 000稀释到1∶360 000,免疫前血清为阴性对照,每孔100 μL。37 ℃孵育30 min,PBST洗涤3次。加入山羊抗兔IgG-HRP,37 ℃孵育30 min,PBST洗涤5次,加入TMB显色,加入终止液终止反应,测定OD450 nm吸光值,计算P/N值(阳性孔OD值/阴性孔OD值),P/N≥2.1判为阳性。
1.9 抗体免疫印迹检测分别取纯化后的蛋白,EVM135蛋白进行20倍稀释,EVM085进行5倍稀释后,加上样缓冲液沸水中煮10 min,进行SDS-PAGE。随后将蛋白转印至PVDF膜上,用含5%脱脂奶室温封闭1 h。分别用重组蛋白免疫血清(稀释度为1∶2 000)作为一抗4 ℃过夜孵育,HRP标记的山羊抗兔IgG(1∶10 000稀释)作为二抗,经Western blot检测反应性。此外,用ECTV(MOI 1)感染BSR细胞(乳仓鼠肾细胞)24 h后,收集细胞,PBS洗涤两次,加入RIPA裂解液,在冰上裂解15 min,然后于4 ℃ 12 000 r·min-1离心15 min,取上清蛋白,进行SDS-PAGE。同上进行Western blot,检测抗血清对病毒蛋白的识别。
1.10 间接免疫荧光试验(IFA)检测用ECTV(MOI 1)分别感染BSR细胞24和48 h,弃上清,用预冷PBS洗涤3次后用40%多聚甲醛室温固定20 min;0.2%的Triton X-100透膜15 min,PBS洗5次;5%BSA封闭2 h,将免疫血清用PBS分别以1∶500稀释,4 ℃过夜孵育;PBST洗涤3次,每次5 min,加入Alexa Fluor 488标记的驴抗兔IgG室温避光孵育1 h,PBST洗涤3次,每次5 min,用DAPI染色10 min,PBS洗涤3次后,置于激光共聚焦显微镜下观察。
1.11 多克隆抗体中和活性检测采用固定病毒稀释抗体方法进行抗体中和病毒活性检测[12]。待检血清置56 ℃灭活30 min,按1∶2进行系列稀释,加入等体积病毒(100 TCID50·0.1 mL-1),置37 ℃水浴作用1 h。取混合液0.1 mL分别加到已长成单层的96孔细胞培养板中,每一稀释度接种8孔细胞。同时设正常细胞对照和抗体阴性血清对照。将96孔细胞培养板置37 ℃、5% CO2温箱中孵育,每日观察细胞病变效应(CPE)。根据细胞病变程度,用Reed-Muench法计算能抑制50%病毒增殖的血清最高稀释度为中和终点[13]。
2 结果 2.1 EVM135和EVM085跨膜结构及抗原表位预测经TMHMM Server v.2.0在线软件预测,结果显示EVM 135为Ⅱ型跨膜蛋白,N端在胞内,C端在胞膜外(图 1A);EVM 085为Ⅰ型跨膜蛋白,C端在胞内,N端在胞膜外(图 1B)。抗原表位分析结果显示,EVM135有8个抗原决定簇(图 1C),其中3个抗原决定簇位于胞内,其余抗原决定簇位于胞外区。EVM085则有12个抗原决定簇(图 1D),其中11个抗原决定簇位于胞外区,第12个抗原决定簇部分位于胞外区,只有部分在胞内区。为尽量维持蛋白的天然构象,并提高其免疫原性,表达均选取这两个蛋白的胞外区进行。
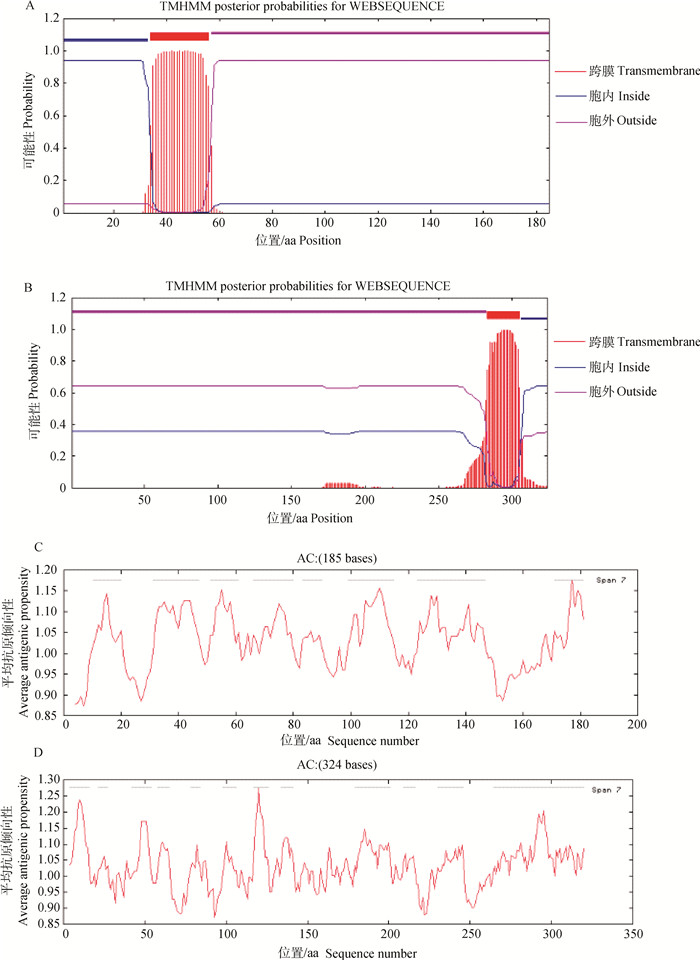
|
A. EVM135的跨膜结构预测;B. EVM085的跨膜结构预测;C. EVM135的抗原表位预测;D. EVM085的抗原表位预测 A, B. Transmembrane prediction of EVM135 and EVM085;C, D.Epitope prediction of EVM 135 and EVM 085 图 1 EVM135和EVM085的跨膜结构及抗原表位预测 Fig. 1 Transmembrane and epitope prediction of EVM135 and EVM085 |
MEGA系统进化树显示鼠痘病毒A33同源蛋白与Orthopoxvirus Abatino、牛痘病毒亲缘关系最近,其次为猴痘病毒(图 2A)。H3L系统进化树结果显示,鼠痘病毒H3L同源蛋白与Orthopoxvirus Abatino亲缘关系最近,虽然与猴痘病毒相对较远,但各病毒种间H3L序列相似性高于A33(图 2B),表明H3L在进化中更保守。

|
图 2 正痘病毒A33(A)、H3L(B)同源基因系统进化树构建 Fig. 2 Phylogenetic tree analysis of orthopoxvirus A33(A) and H3L(B) homologous genes |
以ECTV-Moscow株基因组为模板扩增EVM135和EVM085的胞外区目的基因,琼脂糖凝胶电泳检测分别得到约402和861 bp的目的基因产物(图 3A、B),扩增片段大小与目的片段大小一致,构建到pET30a载体后送单克隆菌落测序,测序结果表明插入片段未发生变异。将构建成功的重组质粒分别命名为pET30a-EVM135(简称pEVM135)、pET30a-EVM085(pEVM085)。将pEVM135和pEVM085重组菌液加入IPTG诱导表达后,收集菌体进行SDS-PAGE鉴定。将成功表达的重组蛋白经镍层析柱进行蛋白纯化,结果表明,pEVM135重组蛋白在咪唑浓度为200 mmol·L-1洗脱,纯度可达90%以上;pEVM085重组蛋白在咪唑浓度为200~400 mmol·L-1洗脱,纯度可达95%以上(图 3C、D)。
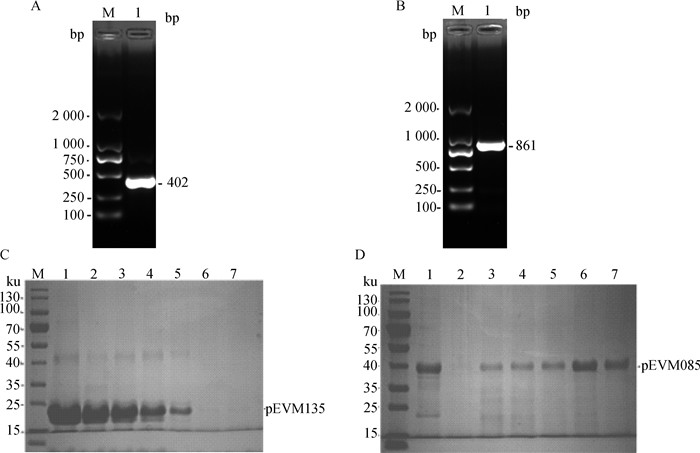
|
A、B. EVM135、EVM085 PCR扩增(M. DL2000 DNA相对分子质量标准;1. PCR产物);C、D. EVM135、EVM085重组蛋白表达及纯化(M. 170 ku蛋白质相对分子质量标准;1. 重组蛋白过Ni柱后的流穿液;2~7. 重组蛋白经含20、50、100、200、300、400 mmol·L-1咪唑的Washing Buffer过Ni柱后的洗脱液) A, B. PCR amplification of EVM135, EVM085 PCR(M. DL2000 DNA marker; 1. PCR product); C, D. Expression and purification of recombinant protein EVM135, EVM085(M. 170 ku protein marker; 1. Flow through of the recombinant protein; 2-7. Washing buffer contain of 20, 50, 100, 200, 300, 400 mmol·L-1 imidazole through Ni-chelating affinity chromatography) 图 3 EVM135(A、C)和EVM085(B、D)目的基因扩增及重组蛋白纯化 Fig. 3 PCR amplification and recombinant protein purification of EVM135(A, C) and EVM085(B, D) |
间接ELISA测定结果显示,制备的抗EVM135抗体效价可达到1∶120 000,而抗EVM085抗体效价则高达1∶360 000。表明制备的这两种重组蛋白具有良好的免疫原性,免疫动物能产生高效价的抗体。
2.5 抗EVM135、EVM085多克隆抗体的免疫印迹检测用重组蛋白免疫血清与纯化后的蛋白反应,在目的大小附件均出现特异性条带(图 4A、B)。感染ECTV后的细胞裂解液上清蛋白进行SDS-PAGE后,用制备的抗EVM135多克隆抗体作为一抗,Western blot结果显示,虽然出现目的条带,但还有其他多条带(图 4C),根据文献资料,推测可能与形成的二聚体或多聚体有关;而用抗EVM085多克隆抗体作为一抗时,在预期大小位置出现单一的特异性条带(图 4D),说明抗EVM085多克隆抗体反应性好、特异性高。
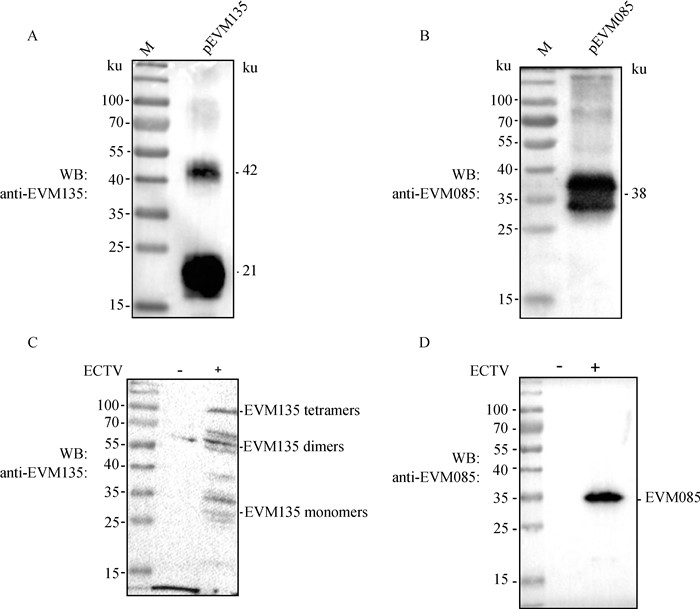
|
A. Western blot鉴定抗EVM135多克隆抗体与重组EVM135蛋白的反应性;B. Western blot鉴定抗EVM085多克隆抗体与重组EVM085蛋白的反应性;C. 抗EVM135多克隆抗体鉴定感染ECTV后细胞裂解液上清中EVM135的表达;D. 抗EVM085多克隆抗体鉴定感染ECTV后细胞裂解液上清中EVM085的表达 A, B. Identification of reactivity of the polyclonal antibodies with the recombinant EVM135 and EVM085 protein by Western-blot; C, D. Identification of the expression of EVM135 and EVM085 following ECTV infection with EM135 and EVM085 polyclonal antibody 图 4 多克隆抗体的免疫印迹鉴定 Fig. 4 Identification of the polyclonal antibody by Western-blot |
用IFA检测ECTV分别感染24、48 h后的BSR细胞,结果显示,不论用抗EVM135多克隆抗体检测,还是用抗EVM085多克隆抗体检测,随着感染时间的延长,荧光强度都相应增加(图 5),说明这两种抗体都可以识别ECTV感染后表达的天然蛋白A33和H3L。图 5A显示,用抗EVM135多克隆抗体进行免疫荧光反应时,产生的绿色荧光部分主要黏附在细胞膜上。用抗EVM085多克隆抗体作为一抗进行免疫荧光反应,产生的绿色荧光主要聚集在细胞核附近,少量分布到胞外(图 5B)。结果与痘病毒A33和H3L的蛋白特征相符,进一步说明制备的这两种多克隆抗体均可识别鼠痘病毒的天然蛋白。

|
A. 抗EVM135多克隆抗体检测不同时间ECTV感染的BSR细胞;B. 抗EVM085多克隆抗体检测不同时间ECTV感染的BSR细胞 A. IFA detection of BSR cells infected with ECTV at different time by using EVM135; B. IFA detection of BSR cells infected with ECTV at different time by using EVM085 图 5 多克隆抗体的间接免疫荧光鉴定 Fig. 5 Identification of the polyclonal antibody by indirect immunofluorescence analysis |
分别将抗EVM135、EVM085多克隆抗体和兔阴性血清进行灭活处理后,抗EVM135多克隆抗体1∶2稀释后进行倍比稀释,共7个梯度,而抗EVM085抗体1∶16稀释后倍比稀释,共7个梯度。结果显示,EVM135的中和效价为1∶16,EVM085的中和效价为1∶128。阴性对照血清没有中和活性。
3 讨论A33和H3L蛋白作为痘病毒高度保守且具有免疫原性的两个主要中和抗体靶标,对研究痘病毒致病机理及预防感染有重要意义。本研究首先通过分析EVM135和EVM085蛋白跨膜结构和抗原表位,选取胞外区构建重组质粒。EVM135同源基因全长为558 bp,编码158个氨基酸,相对分子质量约21 ku,其中胞外区编码129个氨基酸,相对分子质量约15 ku,与His标签融合表达相对分子质量约21 ku。EVM085同源基因全长为975 bp,编码324个氨基酸,相对分子质量约37 ku,其中胞外区编码282个氨基酸,相对分子质量约32 ku,与His标签融合表达相对分子质量约38 ku。本试验的PCR产物及SDS-PAGE结果,均在目的大小处出现相应条带。鉴于本实验室前期已成功构建和表达了羊口疮病毒(ORFV)、牛结节性皮肤病病毒(LSDV)的多种蛋白的原核表达载体,技术条件成熟,直接采用0.5 mmol·L-1 IPTG诱导,在37 ℃、200 r·min-1的条件下培养,成功获得了包涵体形式的目的重组蛋白,复性纯化后免疫兔制备获得了高效价鼠痘病毒A33和H3L同源蛋白多克隆抗体,其能特异性与ECTV感染细胞中的相应天然蛋白反应,且可有效中和ECTV阻止其感染。其中抗EVM135多克隆抗体病毒中和活性效价为1∶16,EVM085免疫血清病毒中和活性效价为1∶128,这进一步证实痘病毒胞内成熟病毒粒子(MV)是中和抗体的主要靶标。根据抗原表位预测结果,EVM085的抗原决定簇基本位于胞外区,可能是其抗体效价及中和活性更高的原因之一。
A33作为由正痘病毒编码的7种特异性胞膜蛋白之一,除禽痘病毒属外存在于脊索动物痘病毒亚科的所有成员中,属于C型凝集素同源的Ⅱ型跨膜糖蛋白,可形成由二硫键连接的同源二聚体或异源多聚体[4]。已有研究将重组A33蛋白用于疫苗接种试验表明,不论A33单体还是多聚体都同样具有免疫原性[14]。VACV A33虽然预测编码21 ku蛋白,但在非还原条件下可以迁移至55 ku,在还原条件下则在23~28 ku大小处呈涂抹样分布,表明A33可形成由二硫键连接的二聚体或多聚体,故大多数抗A33抗体只识别二硫键形式的A33蛋白[14]。在本试验中,用EVM135免疫血清与纯化后的重组蛋白反应,在约21和42 ku附近均出现条带(图 4A);用ECTV感染不同细胞,用Western blot方法检测EVM135免疫血清,如图 4C所示多次出现条带不单一的现象。出现的多条带现象可能是A33的单体、二聚体或多聚体形式,但是否是非特异条带,还有待进一步验证。
H3L同源物存在于痘病毒科的脊索动物痘病毒亚科和昆虫痘病毒亚科[15],在感染后期表达,主要聚集于病毒工厂区。将H3L突变,会导致病毒形成的噬斑减小,病毒复制或病毒在细胞间扩散水平降低,病毒感染性下降[16-17]。虽然H3蛋白在病毒中的作用尚不清楚,但最近对VACV H3的晶体结构解析显示,H3不仅结构类似于糖基转移酶,而且同糖基转移酶一样,也能结合二磷酸尿苷(UDP)-葡萄糖,推测H3与硫酸乙酰肝素的结合及其糖基转移酶活性[18],可能与其在痘病毒的生命周期的作用有关[11]。
正痘病毒在进化过程中表现出两种完全不同的特征,一方面,由于基因的片段化插入或缺失,该属内的不同病毒种类表现出广泛的差异性;另一方面,包括ECTV在内的所有正痘病毒的核心基因组序列几乎没有变异,其约100 kb的核心区域存在超过96%的核苷酸一致性,而来自同一病毒种类的任何两个毒株之间显示至少99%的核苷酸序列一致性[19-20]。本文图 2的系统进化树分析显示,鼠痘病毒与猴痘病毒同源性较高,亲缘关系近,其中A33的核苷酸序列相似性为95.2%,H3L则高达96.8%,这对后续进一步研究A33和H3L蛋白在病毒生物学特性中功能,进而建立有效的猴痘病毒及其他正痘病毒的诊断和防治措施奠定基础。
4 结论成功表达并纯化出鼠痘病毒A33和H3L包涵体形式的同源蛋白,免疫兔获得了两种高效价的鼠痘病毒编码的EEV及IMV膜抗原的多克隆抗体,并能特异性识别鼠痘病毒天然A33和H3L蛋白,且可以有效中和ECTV阻止其感染,这为后续进一步研究这两种蛋白的潜在生物学功能提供了技术和物质基础。
| [1] |
MAVIAN C, LÓPEZ-BUENO A, MARTÍN R, et al. Comparative pathogenesis, genomics and phylogeography of mousepox[J]. Viruses, 2021, 13(6): 1146. DOI:10.3390/v13061146 |
| [2] |
ADNAN N, HAQ Z U, MALIK A, et al. Human monkeypox virus: an updated review[J]. Medicine (Baltimore), 2022, 101(35): e30406. DOI:10.1097/MD.0000000000030406 |
| [3] |
ALAKUNLE E, MOENS U, NCHINDA G, et al. Monkeypox Virus in Nigeria: infection biology, epidemiology, and evolution[J]. Viruses, 2020, 12(11): 1257. DOI:10.3390/v12111257 |
| [4] |
MONTICELLI S R, EARLEY A K, STONE R, et al. Vaccinia virus glycoproteins A33, A34, and B5 form a complex for efficient endoplasmic reticulum to trans-Golgi network transport[J]. J Virol, 2020, 94(7): e02155-19. |
| [5] |
MOSS B. Membrane fusion during poxvirus entry[J]. Semin Cell Dev Biol, 2016, 60: 89-96. DOI:10.1016/j.semcdb.2016.07.015 |
| [6] |
SMITH G L, MURPHY B J, LAW M. Vaccinia virus motility[J]. Annu Rev Microbiol, 2003, 57: 323-342. DOI:10.1146/annurev.micro.57.030502.091037 |
| [7] |
DAVIES D H, MCCAUSLAND M M, VALDEZ C, et al. Vaccinia virus H3L envelope protein is a major target of neutralizing antibodies in humans and elicits protection against lethal challenge in mice[J]. J Virol, 2005, 79(18): 11724-11733. DOI:10.1128/JVI.79.18.11724-11733.2005 |
| [8] |
MENG X Z, ZHONG Y M, EMBRY A, et al. Generation and characterization of a large panel of murine monoclonal antibodies against vaccinia virus[J]. Virology, 2011, 409(2): 271-279. DOI:10.1016/j.virol.2010.10.019 |
| [9] |
CRICKARD L, BABAS T, SETH S, et al. Protection of rabbits and immunodeficient mice against lethal poxvirus infections by human monoclonal antibodies[J]. PLoS One, 2012, 7(11): e48706. DOI:10.1371/journal.pone.0048706 |
| [10] |
FANG M, CHENG H, DAI Z P, et al. Immunization with a single extracellular enveloped virus protein produced in bacteria provides partial protection from a lethal orthopoxvirus infection in a natural host[J]. Virology, 2006, 345(1): 231-243. DOI:10.1016/j.virol.2005.09.056 |
| [11] |
SINGH K, GITTIS A G, GITTI R K, et al. The vaccinia virus H3 envelope protein, a major target of neutralizing antibodies, exhibits a glycosyltransferase fold and binds UDP-glucose[J]. J Virol, 2016, 90(10): 5020-5030. DOI:10.1128/JVI.02933-15 |
| [12] |
裴晓方, 于学杰. 病毒学检验[M]. 北京: 人民卫生出版社, 2005. PEI X F, YU X J. Experimental virology[M]. Beijing: People's Medical Publishing House, 2005. (in Chinese) |
| [13] |
REED L L, MUENCH H. A simple method of estimating fifty per cent endpoints[J]. Am J Epidemiol, 1938, 27(3): 493-497. DOI:10.1093/oxfordjournals.aje.a118408 |
| [14] |
CHAN W M, KALKANOGLU A E, WARD B M. The inability of vaccinia virus A33R protein to form intermolecular disulfide-bonded homodimers does not affect the production of infectious extracellular virus[J]. Virology, 2010, 408(1): 109-118. DOI:10.1016/j.virol.2010.09.021 |
| [15] |
THÉZÉ J, TAKATSUKA J, LI Z, et al. New insights into the evolution of Entomopoxvirinae from the complete genome sequences of four entomopoxviruses infecting Adoxophyes honmai, Choristoneura biennis, Choristoneura rosaceana, and Mythimna separata[J]. J Virol, 2013, 87(14): 7992-8003. DOI:10.1128/JVI.00453-13 |
| [16] |
DA FONSECA F G, WOLFFE E J, WEISBERG A, et al. Effects of deletion or stringent repression of the H3L envelope gene on vaccinia virus replication[J]. J Virol, 2000, 74(16): 7518-7528. DOI:10.1128/JVI.74.16.7518-7528.2000 |
| [17] |
DA FONSECA F G, WOLFFE E J, WEISBERG A, et al. Characterization of the vaccinia virus H3L envelope protein: topology and posttranslational membrane insertion via the C-terminal hydrophobic tail[J]. J Virol, 2000, 74(16): 7508-7517. DOI:10.1128/JVI.74.16.7508-7517.2000 |
| [18] |
LIN C L, CHUNG C S, HEINE H G, et al. Vaccinia virus envelope H3L protein binds to cell surface Heparan sulfate and is important for intracellular mature virion morphogenesis and virus infection in vitro and in vivo[J]. J Virol, 2000, 74(7): 3353-3365. DOI:10.1128/JVI.74.7.3353-3365.2000 |
| [19] |
HENDRICKSON R C, WANG C L, HATCHER E L, et al. Orthopoxvirus genome evolution: the role of gene loss[J]. Viruses, 2010, 2(9): 1933-1967. DOI:10.3390/v2091933 |
| [20] |
BABKIN I V, BABKINA I N, TIKUNOVA N V. An update of orthopoxvirus molecular evolution[J]. Viruses, 2022, 14(2): 388. DOI:10.3390/v14020388 |
(编辑 白永平)



