2. 甘肃省牛羊胚胎工程技术研究中心, 兰州 730070
2. Technology and Research Center of Gansu Province for Embryonic Engineering of Bovine and Sheep, Lanzhou 730070, China
自噬(autophagy)是一种细胞内成分自我清除和自我更新的过程。根据底物识别和作用方式不同分为分子伴侣介导的自噬(chaperone-mediated autophagy, CMA)、微自噬(microautophagy)和巨自噬(macroautophagy)。自噬发生时,细胞内衰老或损伤的成分被具有双层膜结构的自噬体包裹,进而与溶酶体结合并降解,完成细胞内的自我清除和自我更新[1]。微管相关蛋白1轻链3(microtubule associated protein 1 light chain 3, LC3)蛋白是自噬发生过程中表达的重要蛋白之一,在胞浆内以LC3-Ⅰ的形式存在,自噬发生时LC3-Ⅰ与磷脂酰乙醇胺结合形成LC3-Ⅱ并定位于自噬体膜上。当自噬体与溶酶体结合时,自噬体内膜上的LC3-Ⅱ蛋白被降解,外膜上的LC3-Ⅱ蛋白被切割修饰后变为LC3-Ⅰ蛋白[2]。LC3蛋白分为A、B、C三种亚型[3],其中LC3B在自噬过程中发挥双重作用,既作为吞噬细胞形成的重要细胞因子,又作为快速mRNA降解的RNA结合蛋白[4]。LC3B蛋白作为自噬体膜上的标记蛋白,与自噬体的发育和成熟有关,常用来监测自噬水平[5]。
在哺乳动物的繁殖过程中自噬参与配子的分化、生成及早期胚胎发育[6-9]。在雄性动物生殖系统中,支持细胞在生精细胞生成过程中起保护和营养作用[10]。据报道,自噬缺陷会影响支持细胞的骨架结构,破坏支持细胞与生精细胞联系,进而抑制精子的生成[11]。此外,自噬参与顶体反应,对精卵融合起着重要作用[12]。在雌性动物生殖系统中,自噬促进黄体细胞分泌孕酮,维持妊娠[13]。在子宫内膜粘连的小鼠中,子宫内膜自噬水平低,并且以子宫内膜纤维化为特征[14]。子宫内膜发生自噬,对胚胎植入至关重要,并且在妊娠早期发挥着重要作用[15]。有试验证据表明,自噬相关基因Atg16L是小鼠子宫内膜蜕膜化的必需基因[16]。研究发现,自噬缺陷型小鼠表现为原发性卵巢功能不全,导致生育力低下[17]。通过低氧诱导颗粒细胞发生自噬,可以促进颗粒细胞发生分化和黄体形成[18]。颗粒细胞敲除Beclin1构建的自噬缺陷型模型中,小鼠分泌孕酮的量显著减少,从而导致流产[13]。研究表明,自噬完全缺陷型胚胎停滞在4细胞到8细胞阶段,最终导致胚胎死亡,且自噬缺陷型胚胎蛋白合成率也降低了30%[19]。LC3B蛋白作为自噬发生的标识蛋白,在相关研究中被用来检测自噬的发生和评估自噬通量。
牦牛(Bos grunniens)是我国青藏高原重要的动物资源,也是牧民经济收入的主要来源之一。由于自然条件恶劣,饲养水平低下,牦牛的自然繁殖率较低,如何提高牦牛的繁殖率越来越受到重视。目前有关LC3B蛋白在牦牛生殖活动中作用机理的研究较少,且未见商业化的牦牛LC3B蛋白抗体。为了进一步研究自噬在牦牛生殖活动中的作用,本研究通过基因克隆、原核表达和动物免疫的方法制备牦牛特异性LC3B蛋白多克隆抗体,并应用于牦牛生殖器官中LC3B蛋白表达检测,以期为牦牛体内LC3B蛋白和繁殖过程中自噬的研究提供依据。
1 材料与方法 1.1 试验动物与样品采集1.1.1 试验动物 日本大耳白兔购自中国农业科学院兰州兽医研究所,10月龄,室内饲养,饮水充足,健康状况良好。
1.1.2 样品采集 本试验中所用牦牛睾丸、卵巢、子宫、输卵管等样品来自于青海省某屠宰场。健康成年牦牛经颈动脉放血屠宰后,30 min内采集组织样,修剪周围结缔组织后用生理盐水冲洗干净,分别储存于液氮和4% 多聚甲醛溶液中运回实验室备用。牦牛输卵管上皮细胞样品由甘肃省牛羊胚胎工程技术研究中心提供。
1.2 主要仪器与试剂PCR仪购自德国艾本德公司,超声波细胞破碎仪购自宁波新芝生物公司,酶标仪购自美国Thermo公司,显微拍照仪购自日本Olympus公司,Taq PCR Master Mix、Evo M-MLV反转录预混型试剂盒购自湖南艾科瑞生物公司,Trizol试剂盒、RIPA裂解液、通用型DNA纯化回收试剂盒购自北京全式金公司,pMDTM19-T Vector Cloning Kit、JM109感受态细胞均购自日本TaKaRa公司,pET-32a载体质粒购自美国Thermo公司,6×蛋白上样缓冲液、氨苄青霉素(ampicillin, Amp)、5-溴-4-氯-3-吲哚-β-D-半乳糖苷(5-bromo-4-chloro-3-indolyl-beta-D-galactopyranoside, X-gal),异丙基-β-D-硫代半乳糖苷IPTG(isopropyl-β-D-thiogal-actopyranoside, IPTG)均购自北京Solarbio公司,Western blot所用试剂均购自武汉博士德公司,GoatAnti-Rabbit IgG/HRP antibody、SP试剂盒及DAB试剂盒购自北京Bioss公司,Protein marker购自加拿大Fermentas公司,亲和层析柱料购自美国GE Healthcare公司,佐剂购自上海Sigma Aldrich公司,感受态细胞BL21(DE3)、PMSF购自北京碧云天公司。
1.3 牦牛LC3B基因克隆1.3.1 引物设计 参照GenBank公布的牛(Bos taurus)LC3B基因序列(NM_001 001 169.1), 利用Primer 5进行引物设计,由上海生工进行引物合成,引物序列为LC3B-F:CACGAGCCAACTCGC,LC3B-R:ATCGGTGATTAGATGAACT,产物长度为519 bp,退火温度为54 ℃,用于克隆牦牛LC3B基因。
1.3.2 总RNA的提取及反转录 以体外培养的牦牛输卵管上皮细胞为材料,参照Trizol试剂盒说明书提取牦牛输卵管上皮细胞总RNA,并进行反转录合成cDNA,-20 ℃保存。
1.3.3 LC3B基因的扩增与克隆 以cDNA为模板对LC3B基因进行扩增。反应体系为20 μL:2×Exp Taq HS PCR Master Mix 10 μL,cDNA 2 μL,上、下游引物各0.5 μL,dd H2O 7 μL;反应条件:95 ℃ 5 min;95 ℃ 45 s,54 ℃ 30 s,72 ℃ 2 min;4 ℃保存。反应结束后用1% 琼脂糖凝胶进行电泳验证。将胶回收产物与pMD-19 T vector连接转化入DH5α感受态细胞(Escherichia coli)并涂布于LB(Luria-Bertani) 固体培养基(Amp,X-gal,IPTG),过夜培养,挑取阳性单克隆菌落接种于LB液体培养基(Amp) 摇菌16 h,吸取100 μL菌液并送往北京擎科生物科技有限公司测序。
1.3.4 牦牛LC3B基因生物信息学分析 用NCBI-BLAST(https://blast.ncbi.nlm.nih.gov/Blast.cgi)对牦牛LC3B基因进行同源性比对;利用MEGA7.0绘制进化树;用NCBI在线软件进行开放阅读框分析(https://www.ncbi.nlm.nih.gov/orffinder);用在线软件预测LC3B蛋白的二级结构(http:bioinf.cs.ucl.ac.uk/psipred)、三级结构(https://swissmodel.Expasy.org),分析LC3B蛋白的理化性质(https://web.expasy.org/protparam),用在线软件分析LC3B蛋白亲疏水性(https://web.expasy.org/protscale),用在线软件TMHMMServerV2.0预测跨膜结构域(http:www.cbs.dtu.dk/services/TMHMM-2.0/)和磷酸化位点(http:www.cbs.dtu.dk/services/NetPhos)。
1.4 LC3B重组质粒的构建与原核表达测序比对正确的LC3B基因由武汉戴安生物技术有限公司合成,与表达载体pET-32a(该载体含有Trx和His标签蛋白,分子量约为20 ku)连接。将构建好的阳性质粒转化到BL21(DE3)感受态细胞,接种氨苄抗性LB培养基,过夜;挑选转化平板的4个单克隆,分别接种3 mL抗性液体培养基;37 ℃,220 r·min-1培养至OD600 nm为0.5~0.6,加入0.5 mmol·L-1 IPTG 20 ℃诱导表达3.5 h;离心收集菌体,超声破碎,SDS-PAGE检测表达情况。
1.5 LC3B重组蛋白的纯化选择原核表达良好的60 μL菌株接种至200 mL抗性液体培养基,37 ℃,220 r·min-1培养过夜。加入新鲜抗性培养基至800 mL,培养2 h至OD600 nm为0.5~0.6。加入200 μL的1 mol·L-1 IPTG 37 ℃诱导表达3.5 h。4 ℃离心收集菌体(66 r·s-1,15 min),弃上清,加入30 mL PBST悬浮菌体,加入终浓度1 mmol·L-1 PMSF,超声波200 W破碎6 min之后摇床4 ℃孵育1 h。4 ℃高速离心(133 r·s-1,15 min),取上清,加入400 μL于镍柱中,4 ℃过夜。收集镍柱(33 r·s-1,5 min),用20 mmol·L-1咪唑洗脱液洗涤磁珠,洗去杂蛋白(1 mL,3次)。加入300 μL 300 mmol·L-1咪唑洗脱液与磁珠充分结合1 h,离心收集上清。再次向磁珠加入300 μL的洗脱液,洗脱1 h,离心收集上清。两次洗脱液合为一管,对PBS缓冲液透析换液。进行SDS-PAGE鉴定蛋白质。
1.6 多克隆抗体的制备及效价检测用纯化后的400 μg LC3B重组蛋白与弗氏完全佐剂1∶1融合乳化,背部多点注射免疫日本大耳白兔,分别在第一次注射后的28、42、47、54 d进行4次加强免疫,每次150 μg。第四次加强免疫10 d后采集兔子血液,置于4 ℃冰箱,次日离心收集血清。10 mL抗血清与Sepharose4B亲和纯化柱过夜孵育,pH为5.0 HCl洗去杂抗体,pH为2.5,0.15 mol·L-1甘氨酸缓冲液洗脱,10×PBS缓冲液中和,制备亲和纯化抗体。将牦牛重组LC3B蛋白包被液稀释至1 μg·mL-1作为抗原加至96孔板(100 μL·孔-1)于4 ℃冰箱中过夜,次日弃去孔内液体,洗涤3次,每孔加200 μL封闭液,室温静置1 h。兔抗LC3B蛋白抗体按1∶10 000稀释后作为一抗,未注射任何免疫原的兔子血清作为阴性对照,HRP标记的羊抗兔IgG作为二抗,一抗、二抗皆于37 ℃孵育1 h,孵育抗体前后PBST洗涤5次。每孔加50 μL显色液,室温显色20 min后用50 μL终止液终止显色。以OD450 nm阳性血清/OD450 nm阴性血清>2.1的最大稀释倍数为抗体效价。
1.7 Western blot鉴定牦牛LC3B多克隆抗体1.7.1 蛋白变性 经液氮快速冷冻后的组织样品充分研磨,每100 mg组织样加入1 mL高效RIPA裂解液和10 μL PSMF,冰浴反应3 h,4 ℃,1 500 r·min-1离心15 min,取上清液,与6×蛋白上样缓冲液3∶1混合,100 ℃变性10 min后冷却至室温,-20 ℃保存。
1.7.2 Western blot检测牦牛LC3B蛋白抗体特异性 制备12% 的分离胶与5% 的浓缩胶,进行SDS-PAGE,电泳后转膜至PVDF上,用5%脱脂奶粉封闭3 h。弃去封闭液,分别以所得的兔血清和牦牛LC3B抗体为一抗(1∶1 000), 4 ℃孵育12 h,PBST清洗5次,10 min·次-1,HRP标记的羊抗兔抗体为二抗(1∶7 000), 室温摇床孵育1 h,PBST清洗4次,10 min·次-1。之后在PVDF膜上滴加电化学发光液,使用化学发光仪进行检测。
1.8 LC3B蛋白在牦牛生殖器官中的表达定位经4%多聚甲醛固定的睾丸、卵巢、输卵管、子宫样品进行脱水后,制作石蜡切片,用柠檬酸盐缓冲液进行抗原修复,滴加3% H2O2溶液37 ℃作用10 min,PBS洗涤3次,3 min·次-1,后滴加封闭液,室温封闭15 min,滴加牦牛LC3B抗体(1∶500),阴性对照滴加PBS,4 ℃孵育12 h。PBS洗涤3次(3 min·次-1),滴加二抗,37 ℃作用15 min后PBS洗涤3次,3 min·次-1,滴加三抗,37 ℃作用15 min,PBS洗涤3次。滴加DAB工作液显色,蒸馏水终止,苏木精复染,脱水,透明,树脂封片,观察拍照。
1.9 免疫荧光鉴定0.25%胰酶消化原代输卵管上皮细胞,用PBS清洗输卵管上皮细胞3次,制成细胞悬液,将4×105个·mL-1接种至有盖玻片的六孔板中,温箱培养24 h,进行细胞贴壁,取出爬片,用PBS洗涤3次,3 min·次-1。2%多聚甲醛进行固定,洗涤后加入含有0.1%Trition-X 100室温透化20 min后,PBS洗涤3次,5 min·次-1,用牛血清白蛋白(BSA)室温封闭2 h,弃去封闭液,加入牦牛LC3B抗体(1∶500),4 ℃过夜孵育,PBS洗涤3次,5 min·次-1,加入FITC标记的二抗(1∶1 000)室温孵育1 h,PBS洗涤后,用DAPI染色液染核4 min,用抗荧光淬灭剂封片后,在荧光显微镜下观察并拍照。
2 结果 2.1 牦牛LC3B基因克隆PCR扩增结果显示,目的条带单一且特异性良好,大小为519 bp,与预期产物大小一致(图 1A)。将纯化后的牦牛LC3B片段连接至PMD-19T载体后挑取单克隆进行菌液PCR验证(图 1B),目的条带大小与普通PCR结果一致。后使用菌液进行测序,结果进一步提示所得序列为牦牛LC3B序列。测序结果已提交至GenBank,登录号为:OP572227。

|
A. LC3B基因PCR扩增电泳:M. DNA相对分子质量标准,1~4. 牦牛LC3B基因扩增产物。B. 单克隆菌液PCR扩增电泳:1~6. 菌液PCR扩增产物 A. LC3B gene PCR amplification electrophoresis: M. DNA marker; 1-4. Yak LC3B gene amplification products. B. Single colony PCR amplification electrophoresis: 1-6. Bacteria liquid PCR amplification products 图 1 牦牛LC3B基因PCR扩增电泳与菌液PCR扩增电泳 Fig. 1 Yak LC3B gene PCR amplification electrophoresis and bacteria liquid PCR amplification electrophoresis |
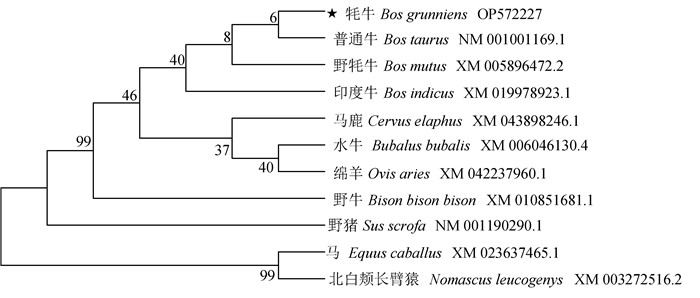
2.2.1 牦牛LC3B基因开放阅读框分析和进化树构建 结果表明牦牛LC3B的开放阅读框全长378 bp,总共编码125个氨基酸。系统进化树结果显示(图 2),牦牛LC3B基因与普通牛(Bos taurus)、野牦牛(Bos mutus)、印度牛(Bos indicus)亲缘性最高。
|
图 2 牦牛LC3B基因的系统进化树 Fig. 2 Phylogenetic tree of yak LC3B gene |
2.2.2 牦牛LC3B蛋白理化性质分析和高级结构预测 牦牛LC3B蛋白分子式为C659H1057N179O189S6,原子总数为2 090,理论等电点(PI)为8.71,不稳定指数60.93,是一种不稳定蛋白。LC3B蛋白预测分子量大小为14.7 ku,共编码19种氨基酸。牦牛LC3B基因编码的氨基酸中带正电的氨基酸总数为(Arg+Lys)19个,带负电的氨基酸总数为(Asp+Glu)17个,该蛋白带正电。
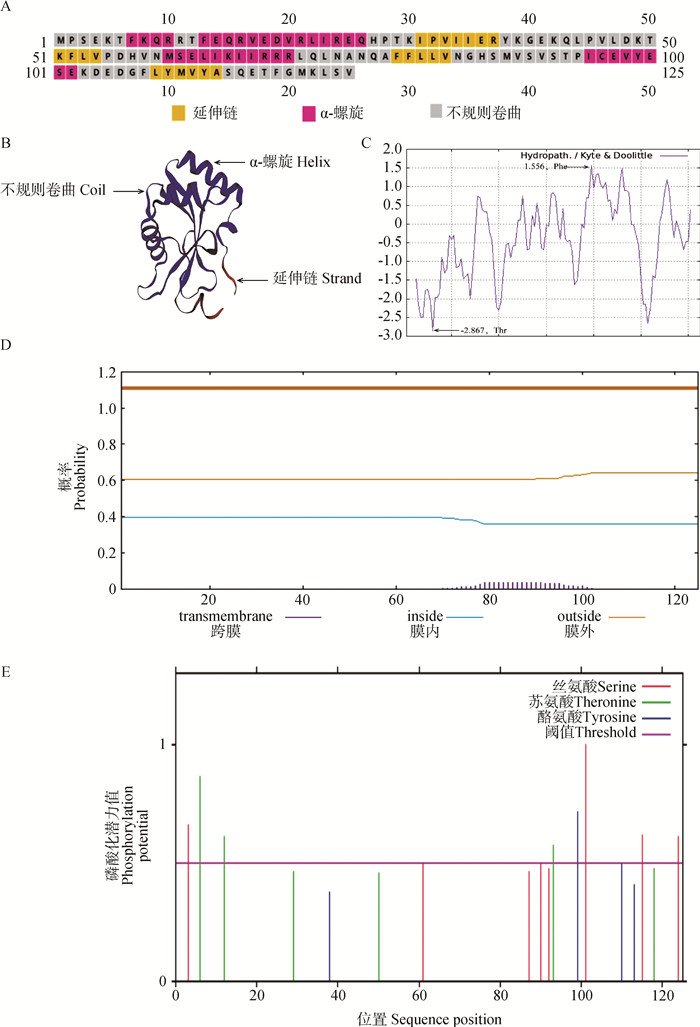
牦牛LC3B基因编码的蛋白中α-螺旋共有37个氨基酸,占总数的29.6%,延伸链结构有22个氨基酸,占17.6%;无规则卷曲结构有66个氨基酸,占52.8%。牦牛LC3B蛋白的二级及三级结构结果如图 3A、3B所示。
|
A.牦牛LC3B蛋白二级结构预测;B.牦牛LC3B蛋白的三级结构;C.牦牛LC3B蛋白亲疏水性分析;D.牦牛LC3B蛋白跨膜结构域分析;E.牦牛LC3B蛋白磷酸化位点分析 A.Secondary structure prediction of yak LC3B protein; B.The tertiary structure protein of yak LC3B protein; C. Hydrophobicity analysis of yak LC3B protein; D. Analysis of transmembrane domains of yak LC3B protein; E. Phosphorylation sites analysis of LC3B protein in yak 图 3 牦牛LC3B蛋白生物学信息分析 Fig. 3 Bioinformatics analysis of yak LC3B protein |
2.2.3 牦牛LC3B基因编码蛋白亲疏水性、跨膜结构域和磷酸化位点分析 牦牛LC3B蛋白为亲水性蛋白(图 3C)。疏水性最强的为第79位的苯丙氨酸(Phe),其分值为1.556,亲水性最强的为第12位的苏氨酸(Thr),其分值为-2.867;LC3B蛋白不含跨膜区域,是非跨膜蛋白(图 3D)。有4个丝氨酸(Ser)、3个苏氨酸(Thr)和1个酪氨酸(Tyr)的磷酸化位点大于阈值,有成为蛋白质激酶磷酸化位点的可能(图 3E)。
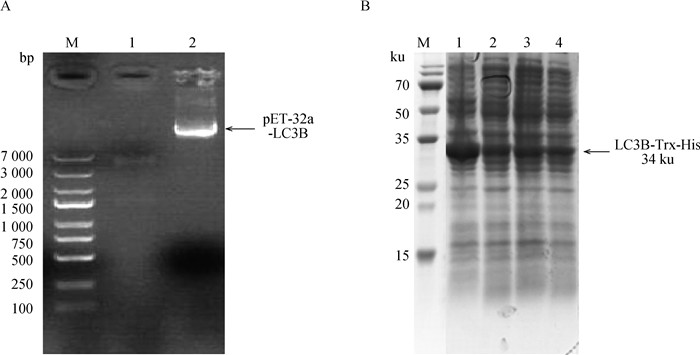
2.3 重组质粒的构建及重组蛋白表达对重组质粒用Bam HⅠ和PstⅠ进行双酶切验证,结果显示成功构建了pET32a-LC3B重组质粒(图 4A)。诱导蛋白表达结果如图 4B所示,上清液和包涵体中都有牦牛LC3B重组蛋白的表达,大小为34 ku,其中Trx标签蛋白大小约为20 ku。
|
A. 重组质粒双酶切验证:M.DNA相对分子质量标准;1.双酶切产物;2.pET32a-LC3B重组质粒。B. 重组质粒诱导表达:M. 蛋白质量分子标准;1~4.全菌液诱导表达 A. Double enzyme digestion verification of recombinant plasmid: M.5000 DNA Marker; 1. Double digestion product; 2. pET32a-LC3B recombinant plasmid. B. Recombinant plasmid induced expression: M. Protein mass molecular standard; 1-4. Whole cell induced expression 图 4 重组质粒双酶切验证与诱导表达 Fig. 4 Verification and induced expression of recombinant plasmid by double digestion |
使用亲和层析法纯化牦牛LC3B重组蛋白,咪唑洗脱液洗脱镍柱中的蛋白,SDS-PAGE检测结果显示(图 5A),大约在34 ku处出现较为单一的条带,表明纯化后的蛋白为牦牛LC3B重组蛋白,与预期结果一致。透析牦牛LC3B重组蛋白后经SDS-PAGE分析,获得3 mg纯化蛋白(图 5B)。

|
A.上清诱导纯化蛋白SDS-PAGE:M. 蛋白质量分子标准;1. 300 mmol·L-1咪唑洗脱液一;2. 300 mmol·L-1咪唑洗脱液二;3. Beads样。B. 透析后蛋白SDS-PAGE:M. 蛋白质量分子标准;1. BSA上样;2. 透析后蛋白 A. The supernatant induced purified protein SDS-PAGE: M. Protein mass molecular standard; 1. 300 mmol·L-1 imidazole eluent one; 2. 300 mmol·L-1 imidazole eluent two; 3. Beads. B. Post-dialysis protein SDS-PAGE: M. Protein mass molecular standard; 1. BSA loading; 2. Protein after dialysis 图 5 牦牛LC3B重组蛋白纯化 Fig. 5 Purification of yak LC3B recombinant protein |
根据OD450 nm阳性血清/OD450 nm阴性血清>2.1的最大稀释倍数为抗体效价,本试验制备的抗体效价为1∶640 000、1∶320 000(表 1,图 6A)。制备的血清(含Trx和His标签)能与牦牛LC3B蛋白发生特异性反应(图 6B),并且能识别LC3B-Ⅰ(36 ku)和脂化的后的LC3B-Ⅱ(34 ku)蛋白,表明该蛋白多克隆抗体特异性良好,可用于后续试验。
|
|
表 1 不同稀释度OD450 nm值 Table 1 OD450 nm values of different dilutions |

|
A.不同稀释度的OD450 nm值;B.免疫后血清特异性验证:1.卵巢;2.输卵管;3.子宫 A.OD450 nm values of different dilutions; B.Verification of serum specificity after immunization: 1.Ovary; 2.Oviduct; 3.Uterus 图 6 多克隆抗体效价及特异性检测 Fig. 6 Polyclonal antibody titer and specificity detection |
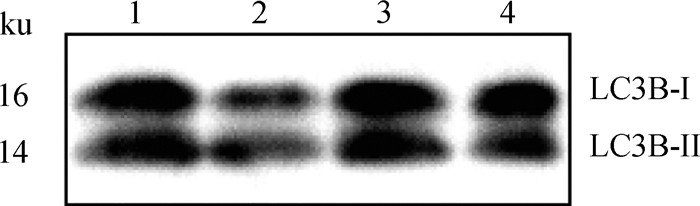
2.6.1 Western blot检测LC3B在牦牛睾丸、卵巢、输卵管和子宫中的表达 牦牛LC3B纯化抗体能与牦牛蛋白发生特异性反应,并且能够识别LC3B蛋白,包括LC3B-I(16 ku)和脂化后的LC3B-II(14 ku),与预测的牦牛LC3B蛋白大小一致(图 7)。
|
1. 睾丸;2. 卵巢;3. 输卵管;4. 子宫 1. Testis; 2. Ovary; 3. Oviduct; 4. Uterus 图 7 Western blot检测LC3B蛋白在牦牛生殖器官中的表达 Fig. 7 Expression of LC3B protein in yak reproductive organs detected by Western blot |
2.6.2 免疫组织化学和免疫荧光染色检测LC3B蛋白在牦牛生殖器官中的分布 LC3B蛋白在牦牛睾丸、卵巢、输卵管、子宫均有阳性表达。在睾丸中,主要表达于精子细胞(SP)、间质细胞(IC)、支持细胞(SC);在卵巢中,主要表达于黄体细胞(CL)、颗粒层(SG)和卵泡膜(TF);在输卵管中,主要表达于黏膜上皮(EM);在子宫中,主要表达于子宫腺(UG)和子宫内膜(EN)(图 8)。免疫荧光显示,LC3B蛋白主要表达于牦牛输卵管上皮细胞的细胞核周和细胞质中(图 9)。

|
a、b、c. 睾丸;d、e、f. 卵巢;g、h、i. 输卵管;j、k、l. 子宫。a、b、d、e、g、h、j、k为阳性表达;c、i、l为阴性对照。SP. 精子细胞; SC. 支持细胞; IC. 间质细胞; ST. 生精小管; SG. 颗粒层;TF. 卵泡膜;CL. 黄体细胞;EM. 黏膜上皮;UG. 子宫腺;EN. 子宫内膜 a, b, c. Testis; d, e, f. Ovary; j, h, i. Fallopian tube; j, k, l. Uterus. a, b, d, e, g, h, j, k are positive expression; c, i, l are negative control. SP. Sperm cells; SC. Sertoli cells; IC. Interstitial cells; ST. Seminiferous tubules; SG. Granular layer; TF. Theca follicle; CL. Luteal cell; EM. Epithelium mucosae; UG. Uterine glands; EN. Endometrium 图 8 LC3B蛋白在牦牛生殖器官中的分布 Fig. 8 Distribution of LC3B protein in yak reproductive organs |
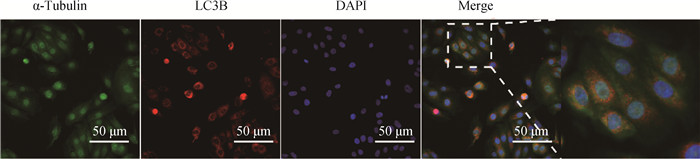
|
图 9 LC3B蛋白在牦牛输卵管上皮细胞中的分布 Fig. 9 Distribution of LC3B protein in oviduct epithelial cells of yak |
本试验通过基因克隆,获得了大小为519 bp的牦牛LC3B基因,该序列已提交至GenBank,登录号为:OP572227。对牦牛LC3B基因序列在线比对后发现,与普通牛、印度牛、野牦牛的LC3B基因序列高度一致,体现了LC3B基因的高度保守性,这与Baeken等[20]的研究结果一致。在前人的研究中提出, LC3B蛋白可发生脂化,表现为LC3B-Ⅰ和脂化后的LC3B-Ⅱ两种形式[21]。本研究通过理化性质分析后发现, 牦牛LC3B共编码125个氨基酸,牦牛LC3B蛋白是非跨膜性的不稳定蛋白,提示牦牛LC3B蛋白也可发生脂化。该蛋白有4个丝氨酸、3个苏氨酸和1个酪氨酸成为磷酸化位点的可能。Nieto-Torres等[22]认为,LC3B蛋白发生磷酸化对自噬体与细胞核周围的溶酶体结合有重要意义。
本试验成功构建了pET-32a-LC3B重组质粒,经原核诱导表达后进行动物免疫,获得了免疫原性良好的抗牦牛LC3B血清,经纯化后制得了牦牛LC3B多克隆抗体。PET-32a载体广泛应用于自噬相关蛋白表达,是较为稳定的原核表达载体[23-24]。但因pET-32a标签蛋白分子量小,不利于小分子蛋白的诱导表达,因此,添加了Trx和His标签,以优化诱导表达条件。硫氧还蛋白(Trx)增强蛋白的可溶性表达,减少蛋白的浪费。牦牛LC3B重组蛋白的成功制备和高水平的表达是成功制备牦牛LC3B多克隆抗体的关键。对该蛋白进行纯化后,制得牦牛LC3B多克隆抗体效价达到1∶320 000和1∶640 000,而余振兴等[25]制备的紫贻贝LC3B抗体效价仅为1∶256 00,表明本研究所制备的兔抗牦牛LC3B多克隆抗体具有较高的灵敏性。通过Western blot检测,本试验制备的牦牛LC3B多克隆抗体能正常识别LC3B蛋白,并且能够识别LC3B-Ⅰ和脂化后的LC3B-Ⅱ,证明本试验成功制备了特异性较好的牦牛LC3B蛋白抗体。
将本试验制备的纯化抗体应用于LC3B蛋白的表达定位检测。Western blot结果显示, LC3B在牦牛睾丸、卵巢、输卵管和子宫中均有表达,并且能够检测到LC3B-Ⅰ和脂化后的LC3B-Ⅱ蛋白。目前,LC3B-Ⅱ/LC3B-Ⅰ的比值常用来评估自噬[26]。因此,本研究结果提示所制备的兔抗牦牛LC3B多克隆抗体可用于牦牛自噬流的评估。免疫组织化学结果显示,LC3B蛋白在牦牛睾丸的精子细胞和支持细胞中表达。睾丸支持细胞在生殖细胞的存活和精子的生成中起着重要作用,与性腺的发育也有着紧密的联系[27]。Yin等[28]已证实, 自噬可抑制精母细胞凋亡,进而促进精子生成,说明牦牛LC3B蛋白也可能参与精子的生成过程。LC3B蛋白在山羊卵巢黄体类固醇生成细胞中表达[29],Ullah等[30]检测LC3B蛋白表达,发现增强自噬可改变黄体类固醇细胞的亚细胞结构,有助于黄体功能的维持。本研究发现, LC3B蛋白在牦牛黄体细胞中表达,提示该蛋白可能参与牦牛孕酮的产生,与牦牛维持妊娠和调节发情和排卵有关。研究发现,促卵泡素(FSH)在促进卵泡发育的同时,伴有自噬的发生,在有腔卵泡中检测到LC3蛋白[31]。牦牛LC3B蛋白在颗粒细胞和卵泡膜中表达,说明LC3B蛋白参与牦牛卵泡的生长和发育。这与Zheng等[32]的报道一致。输卵管和子宫作为受精、早期胚胎的发育和妊娠的场所,在动物繁殖过程中起着重要作用。Su等[15]通过检测子宫内膜上LC3蛋白的表达,发现子宫内膜发生的自噬影响胚胎的着床。本研究发现, 在牦牛输卵管上皮黏膜和子宫内膜中检测到了LC3B蛋白的表达,表明LC3B蛋白在卵子的输送过程、胚胎着床和妊娠中发挥着作用。总之,本研究所制备的牦牛LC3B多克隆抗体能识别牦牛LC3B蛋白,抗体特异性良好,可用于以牦牛为模型的分子试验;免疫组化和免疫荧光结果显示, LC3B在牦牛生殖器官中的表达部位与其他动物一致,提示LC3B蛋白在牦牛繁殖活动中发挥着重要作用,同时也进一步加深了对自噬在牦牛生殖生理中作用的理解。
4 结论本研究成功克隆了牦牛LC3B基因(GenBank登录号:OP572227),构建了重组质粒pET-32a-LC3B,成功制备了特异性良好的牦牛LC3B多克隆抗体,该抗体可特异性识别牦牛LC3B蛋白。牦牛LC3B蛋白在睾丸、卵巢、输卵管和子宫中均有表达,且主要表达于细胞核周和细胞质中。研究结果提示,所制备的牦牛LC3B抗体可用于以牦牛为模型的分子试验,且发现LC3B蛋白参与牦牛生殖生理过程,为进一步研究牦牛LC3B蛋白和细胞自噬提供了基础资料。
| [1] |
DERETIC V. Autophagy in inflammation, infection, and immunometabolism[J]. Immunity, 2021, 54(3): 437-453. DOI:10.1016/j.immuni.2021.01.018 |
| [2] |
KUMA A, KOMATSU M, MIZUSHIMA N. Autophagy-monitoring and autophagy-deficient mice[J]. Autophagy, 2017, 13(10): 1619-1628. DOI:10.1080/15548627.2017.1343770 |
| [3] |
MARUYAMA T, NODA N N. Autophagy-regulating protease Atg4: structure, function, regulation and inhibition[J]. J Antibiot, 2018, 71(1): 72-78. DOI:10.1038/ja.2017.104 |
| [4] |
HWANG H J, HA H, LEE B S, et al. LC3B is an RNA-binding protein to trigger rapid mRNA degradation during autophagy[J]. Nat Commun, 2022, 13(1): 1436. DOI:10.1038/s41467-022-29139-1 |
| [5] |
YOSHⅡ S R, MIZUSHIMA N. Monitoring and measuring autophagy[J]. Int J Mol Sci, 2017, 18(9): 1865. DOI:10.3390/ijms18091865 |
| [6] |
GAO H, KHAWAR M B, LI W. Essential role of autophagy in resource allocation during sexual reproduction[J]. Autophagy, 2020, 16(1): 18-27. DOI:10.1080/15548627.2019.1628543 |
| [7] |
GAO F Y, LI G P, LIU C, et al. Autophagy regulates testosterone synthesis by facilitating cholesterol uptake in Leydig cells[J]. J Cell Biol, 2018, 217(6): 2103-2119. DOI:10.1083/jcb.201710078 |
| [8] |
SUN Y C, WANG Y Y, SUN X F, et al. The role of autophagy during murine primordial follicle assembly[J]. Aging (Albany NY), 2018, 10(2): 197-211. |
| [9] |
MA L Z, TANG X R, GUO S, et al. miRNA-21-3p targeting of FGF2 suppresses autophagy of bovine ovarian granulosa cells through AKT/mTOR pathway[J]. Theriogenology, 2020, 157: 226-237. DOI:10.1016/j.theriogenology.2020.06.021 |
| [10] |
O'DONNELL L, SMITH L B, REBOURCET D. Sertoli cells as key drivers of testis function[J]. Semin Cell Dev Biol, 2022, 121: 2-9. DOI:10.1016/j.semcdb.2021.06.016 |
| [11] |
LIU C, WANG H N, SHANG Y L, et al. Autophagy is required for ectoplasmic specialization assembly in sertoli cells[J]. Autophagy, 2016, 12(5): 814-832. DOI:10.1080/15548627.2016.1159377 |
| [12] |
WANG H N, WAN H F, LI X X, et al. Atg7 is required for acrosome biogenesis during spermatogenesis in mice[J]. Cell Res, 2014, 24(7): 852-869. DOI:10.1038/cr.2014.70 |
| [13] |
GAWRILUK T R, KO C M, HONG X M, et al. Beclin-1 deficiency in the murine ovary results in the reduction of progesterone production to promote preterm labor[J]. Proc Natl Acad Sci U S A, 2014, 111(40): E4194-E4203. |
| [14] |
ZHOU Z H, WANG H Y, ZHANG X W, et al. Defective autophagy contributes to endometrial epithelial-mesenchymal transition in intrauterine adhesions[J]. Autophagy, 2022, 18(10): 2427-2442. DOI:10.1080/15548627.2022.2038994 |
| [15] |
SU Y, ZHANG J J, HE J L, et al. Endometrial autophagy is essential for embryo implantation during early pregnancy[J]. J Mol Med, 2020, 98(4): 555-567. DOI:10.1007/s00109-019-01849-y |
| [16] |
OESTREICH A K, CHADCHAN S B, POPLI P, et al. The autophagy gene Atg16L1 is necessary for endometrial decidualization[J]. Endocrinology, 2020, 161(1): bqz039. DOI:10.1210/endocr/bqz039 |
| [17] |
LIU W W, CHEN M, LIU C, et al. Epg5 deficiency leads to primary ovarian insufficiency due to WT1 accumulation in mouse granulosa cells[J]. Autophagy, 2023, 19(2): 644-659. DOI:10.1080/15548627.2022.2094671 |
| [18] |
TANG Z H, ZHANG Z H, LIN Q Q, et al. HIF-1α/BNIP3-mediated autophagy contributes to the luteinization of granulosa cells during the formation of corpus luteum[J]. Front Cell Dev Biol, 2021, 8: 619924. DOI:10.3389/fcell.2020.619924 |
| [19] |
TSUKAMOTO S, KUMA A, MURAKAMI M, et al. Autophagy is essential for preimplantation development of mouse embryos[J]. Science, 2008, 321(5885): 117-120. DOI:10.1126/science.1154822 |
| [20] |
BAEKEN M W, WECKMANN K, DIEFENTHÄLER P, et al. Novel insights into the cellular localization and regulation of the autophagosomal proteins LC3A, LC3B and LC3C[J]. Cells, 2020, 9(10): 2315. DOI:10.3390/cells9102315 |
| [21] |
WANG W, CHEN Z X, BILLIAR T R, et al. The carboxyl-terminal amino acids render pro-human LC3B migration similar to lipidated LC3B in SDS-PAGE[J]. PLoS One, 2013, 8(9): e74222. DOI:10.1371/journal.pone.0074222 |
| [22] |
NIETO-TORRES J L, ENCALADA S E, HANSEN M. LC3B phosphorylation: autophagosome's ticket for a ride toward the cell nucleus[J]. Autophagy, 2021, 17(10): 3266-3268. DOI:10.1080/15548627.2021.1961073 |
| [23] |
于慧敏, 吴鹏杰, 李南南, 等. 中华蜜蜂GABARAP基因克隆、生物信息学分析及原核表达载体的构建[J]. 中国畜牧兽医, 2022, 49(1): 60-69. YU H M, WU P J, LI N N, et al. Cloning, bioinformatics analysis and prokaryotic expression of GABARAP gene in Apis cerana cerana[J]. China Animal Husbandry & Veterinary Medicine, 2022, 49(1): 60-69. (in Chinese) |
| [24] |
张加姿, 李开心, 于宝佳, 等. 小麦自噬相关因子ATG5的原核表达和抗血清制备[J]. 生物技术通报, 2017, 33(7): 69-74. ZHANG J Z, LI K X, YU B J, et al. Prokaryotic expression of wheat autophagy-related factor ATG5 and preparation of its antiserum in rabbits[J]. Biotechnology Bulletin, 2017, 33(7): 69-74. (in Chinese) |
| [25] |
余振兴, 朱倩, 姚翠鸾. 紫贻贝LC3B蛋白的原核表达及抗血清制备[J]. 水产学报, 2017, 41(4): 498-505. YU Z X, ZHU Q, YAO C L. Recombinant expression and polyclonal antibody preparation of Mytilus galloprovincialis LC3B[J]. Journal of Fisheries of China, 2017, 41(4): 498-505. (in Chinese) |
| [26] |
崔海英. DGAT1调控自噬流影响前列腺癌生长的作用及机制研究[D]. 长春: 吉林大学, 2022. CUI H Y. The effects and mechanisms of DGAT1 on the growth of prostate cancer by regulating autophagy flux[D]. Changchun: Jilin University, 2022. (in Chinese) |
| [27] |
LUCAS-HERALD A K, MITCHELL R T. Testicular sertoli cell hormones in differences in sex development[J]. Front Endocrinol, 2022, 13: 919670. DOI:10.3389/fendo.2022.919670 |
| [28] |
YIN J, NI B, YANG Y D, et al. Elevation of autophagy rescues spermatogenesis by inhibiting apoptosis of mouse spermatocytes[J]. Reproduction, 2018, 156(6): 545-558. |
| [29] |
梁丙坤, 肖婷婷, 陈美洁, 等. LC3B和JAK2/STAT3通路分子在山羊卵巢黄体中的表达研究[J]. 畜牧与兽医, 2022, 54(5): 14-18. LING B K, XIAO T T, CHEN M J, et al. Expression of LC3B and JAK2/STAT3 pathway molecules in the ovarian corpus luteum of goats[J]. Animal Husbandry & Veterinary Medicine, 2022, 54(5): 14-18. (in Chinese) |
| [30] |
ULLAH S, ZHANG M D, YU H, et al. Heat exposure affected the reproductive performance of pregnant mice: Enhancement of autophagy and alteration of subcellular structure in the corpus luteum[J]. Reprod Biol, 2019, 19(3): 261-269. DOI:10.1016/j.repbio.2019.06.006 |
| [31] |
周吉隆. let-7g调控卵泡颗粒细胞凋亡与自噬及卵泡发育过程中自噬的机制研究[D]. 南京: 南京农业大学, 2017. ZHOU J L. The regulation of let-7g in ovarian granulosa cell apoptosis and autophagy and regulatory mechanisms during follicular development[D]. Nanjing: Nanjing Agricultural University, 2017. (in Chinese) |
| [32] |
ZHENG Y X, MA L Z, LIU N, et al. Autophagy and apoptosis of porcine ovarian granulosa cells during follicular development[J]. Animals, 2019, 9(12): 1111. DOI:10.3390/ani9121111 |
(编辑 孟培)



