2. 广东省农业科学院动物科学研究所, 畜禽育种国家重点实验室, 广东省畜禽育种与营养研究重点实验室, 广州 510640;
3. 华南农业大学 畜禽育种国家地方联合工程研究中心, 广州 510642;
4. 华南农业大学, 广东省农业动物基因组学与分子育种重点实验室, 广州 510642
2. Guangdong Key Laboratory of Animal Breeding and Nutrition, State Key Laboratory of Livestock and Poultry Breeding, Institute of Animal Science, Guangdong Academy of Agricultural Sciences, Guangzhou 510640, China;
3. National Engineering Research Center for Livestock and Poultry Breeding, South China Agricultural University, Guangzhou 510642, China;
4. Guangdong Key Laboratory of Agricultural Animal Genomics and Molecular Breeding, South China Agricultural University, Guangzhou 510642, China
产羔数是能繁母羊繁殖性状的重要体现,受品种、营养和环境等因素的影响,而影响母羊产羔数的一个重要指标就是排卵数,排卵的数量直接决定了母羊的产羔数[1]。卵泡是卵巢的基本组成单位,主要由颗粒细胞、卵泡膜细胞和卵母细胞构成,研究发现在一个发情周期内,单胎动物通常只有一个原始卵泡发育到成熟卵泡并完成排卵,而多胎动物可达到数十个原始卵泡发育到成熟卵泡并排卵[2-3]。据报道,卵巢中99.9%的卵泡会在不同阶段发生闭锁[4-6],从而限制了排卵的数量。卵泡发育过程极大的影响了卵子的排出数量以及质量,对山羊受胎率及产羔数等繁殖性能产生重大影响,所以研究卵泡发育对提高母畜繁殖力具有重要意义。
微小RNA是一种长度约为22 nt的内源性非编码小分子RNA,通过碱基互补配对原则与目标基因的3′UTR特异性位点互补结合[7],从而诱导目标基因降解或翻译受阻。已有研究表明,miRNA在雌性动物的卵泡发育、卵母细胞成熟、GCs增殖和分化以及相关生殖器官功能中发挥着重要调节作用[8-13]。miR-144的成熟序列在人、牛、马、小鼠、斑马鱼等物种中保守性较高,可编码miR-144-5p。目前研究表明,miR-144-5p在多种癌症中发挥抑癌作用,但是与山羊繁殖相关的研究鲜有报道,其功能在很大程度上是未知的。Lee等[14]试验结果表明,利用FSHR siRNA转染至KGN,与对照组相比,发现miR-144-5p在GCs中差异表达,并确定其参与GCs中卵泡刺激素(follicle stimulating hormone, FSH)信号传导的分子调控途径。过表达miR-144-5p能够靶向PTEN阻碍大鼠卵巢GCs凋亡,阻止卵巢卵泡的闭锁,表明miR-144-5p与卵泡发育密切相关[15]。Wong等[16]的转录组数据表明,斑马鱼卵泡中的miR-144-5p可能对卵泡发育过程中的卵泡活化起作用。韦唯[17]研究发现miR-144促进GCs凋亡。另外与正常卵巢组织相比,卵巢早衰的动物模型组织中miR-144-5p表达量呈现下调趋势[18]。
WNT5a是调控多个信号网络的关键分子,在干细胞分化以及生殖细胞发生过程中发挥关键调控作用[19-22]。小鼠WNT5a基因在卵泡发育过程中呈现差异性表达,其在闭锁卵泡中可显著抑制类固醇的生成,对卵泡发育有显著影响,在卵巢GCs中特异性的敲除WNT5a,则会引起与雌性不孕不育相关的卵泡黄体化增加以及排卵率降低[23]。上述研究表明,WNT5a可在卵泡发育中起重要作用,但是其对山羊GCs的影响未有报道。
Wnt/β-Catenin通路的功能最常见于胚胎发育和癌症,但随着研究的深入,发现Wnt/β-Catenin在调控整个卵巢发育、性激素分泌、卵母细胞成熟和排卵过程中存在潜在作用。Wnt信号调节卵巢功能的关键机制之一是调节类固醇合成[24]。有趣的是,典型的Wnt信号是支持卵母细胞生长的重要步骤,在没有Wnt信号传导的情况下,小鼠卵巢中的pre-GCs向GCs的转变受到抑制,生长卵泡的数量也会减少[25]。另外,RSPO2激活的Wnt/CTNNB1信号也促进了小鼠早期发育卵泡中颗粒细胞增殖[26]。
GCs是卵巢的重要体细胞之一,其生长发育受错综复杂的细胞信号系统调控,对卵泡的发育有重要影响,因此,探究GCs生长和发育的调控机理,对雌性动物繁殖性能的提高有很重要的意义。本研究为进一步揭示在GCs中miR-144-5p和WNT5a的潜在功能研究提供理论和试验依据,进而为提高山羊繁殖性能提供指导。
1 材料与方法 1.1 试验动物选用来自广东同一羊场的空怀健康雷州山羊作为试验动物,试验羊只年龄为2岁,经产胎次为3胎,经发情鉴定,确定试验羊只发情后的24 h内将发情羊只屠宰。屠宰后立即采集卵巢,分离正常健康表面富有血管的大卵泡(卵泡直径>6 mm)和表面可观察到血管的小卵泡(3 mm>卵泡直径>1 mm)[27]。
1.2 试验主要试剂TRIzol试剂(中国,碧云天),PrimeScriptTM RT reagent Kit(Perfect Real Time)(日本,TaKaRa),miRNA 1st Strand cDNA Synthesis Kit (by stem-loop)(南京,诺唯赞),大肠杆菌菌株DH5α(美国,Invitrogen),HB-infusionTM无缝克隆试剂盒(上海,汉恒生物),RIPA蛋白裂解液(中国,碧云天),BCA蛋白浓度测定试剂盒、羊抗兔二抗、ECL化学发光试剂盒(中国,碧云天),Opti-MEM(美国,Thermo),CCK-8细胞增殖试剂盒(上海,东仁),胎牛血清、DEME/F12细胞培养基(美国,Thermo),Lipofetamine 3000(美国,Invitrogen),Premix TaqTM Hot Start Version、限制性内切酶(日本,TaKaRa)。
1.3 引物的设计与合成在NCBI中下载山羊WNT5a基因的3′UTR序列和WNT5a mRNA全序列(Gene ID:102170921)并用NCBI中的Prime-BLAST在线设计引物,引物序列见表 1。
|
|
表 1 WNT5a基因及反转录引物序列 Table 1 Primer sequence of WNT5a gene and reverse transcription |
采用TRIzol法提取雷州山羊大、小卵泡颗粒细胞的RNA,用PrimeScriptTM RT reagent Kit(Perfect Real Time)进行mRNA的反转录。反应体系:5× PrimeScript Buffer(for Real Time)2 μL,PrimeScript RT Enzyme Mix I 0.5 μL,Oligo dT Primer(50 μmol·L-1)0.5 μL,Random 6 mers(100 μmol·L-1)0.5 μL,Total RNA 1 μL,RNase Free dH2O 5.5 μL。反应条件:37 ℃ 15 min,85 ℃ 5 s,4 ℃保存。根据miRNA 1st Strand cDNA Synthesis Kit(by stem-loop)试剂说明书用茎环法进行miRNA反转录。所需引物均委托生工生物工程有限公司合成,合成引物及序列见表 1。
1.5 原代山羊颗粒细胞培养山羊卵巢GCs分离培养:采集健康卵巢,浸泡在无菌并含有双抗(100 IU·mL-1青霉素和50 IU·mL-1链霉素)的磷酸盐缓冲液(phosphate buffered saline, PBS)中带回实验室后,75%的酒精冲洗卵巢表面,然后用无菌的含有PS的PBS冲洗3遍,去除多余的酒精。用剪刀在保证不损伤卵泡的情况下将卵巢剪成小块,用含PS的DMEM/F-12培养液清洗组织块3次,选取1~3 mm左右的卵泡在5 mL含有10% 胎牛血清、PS的DMEM/F-12培养液中用10 mL注射器的针头将卵泡扎破释放GCs。完成后将培养液吸入15 mL离心管中,静置10 min,然后吸取上清液到离心管中,800 r·min-1离心10 min,弃上清,用含10% FBS、PS的DMEM/F-12培养液重悬细胞后再次离心,重复清洗2次。在37 ℃,5% CO2条件下培养细胞,进行后续试验。
1.6 载体构建及miRNA合成通过TargetScan(www.targetsscan.org/)生物信息学软件对miR-144-5p和其靶基因进行靶基因结合位点预测。根据结合位点设计引物(表 1)。以山羊卵巢cDNA为模板,采用高保真酶PCR扩增获得含有miR-144-5p结合位点的野生型片段,反应体系:2×Phanta Max Master Mix(Dye Plus)25 μL,上游引物(10 μmol·L-1)2 μL,下游引物(10 μmol·L-1)2 μL,cDNA 1 μL,ddH2O 20 μL。反应程序为:95 ℃ 1 min;95 ℃ 30 s,60 ℃ 30 s,72 ℃ 1 min,35个循环;4 ℃保存。PCR产物琼脂糖凝胶电泳检测后,使用DNA回收试剂盒纯化回收PCR扩增产物,突变型目的片段委托生工生物工程有限公司合成。将psiCHECK-2载体用NotⅠ和XhoⅠ进行双酶切,载体酶切完成后胶回收,将处理好的目的片段与载体根据汉恒HB-infusionTM无缝克隆试剂盒说明书进行连接。连接好的载体转化到DH5α感受态细胞中,加入1 mL无抗生素的LB培养基置于摇床上37 ℃,220 r·min-1培养1 h,离心后倒掉上清吸取离心管底部约100 μL含菌培养基涂布到含相应抗生素的固体培养基上过夜培养。第2天挑取单克隆摇菌后进行菌液PCR鉴定,将阳性菌液进行测序,测序正确后使用无内毒素质粒小提中量试剂盒提取质粒。将最终鉴定正确的质粒命名为WNT5a-3′UTR-wt-pSI-Check2和WNT5a-3′UTR-mu-pSI-Check2。
WNT5a的过表达载体以XhoⅠ和XbaⅠ双酶切的pcDNA3.1为骨架与扩增出的WNT5a的CDS区采用无缝克隆法连接,具体方法同上。将最终鉴定正确的质粒命名为pcn-WNT5a。
根据miRbase数据库(http://www.miRbase.org/)提供的山羊成熟miR-144-5p序列,交由广州锐博生物技术有限公司设计和合成。相关信息如下:miR-144-5p:UGGGAUAUCAUCAUAUACUGU;miR-144-5p inhibitor: ACAGUAUAUGAUGAUAUCCCA;miR-144-5p mimic NC产品编号:miR1N0000001-1-5(锐博公司)。
1.7 双荧光素酶报告基因将HEK-293 T细胞进行细胞计数后传至96孔板,每组3个复孔,待细胞密度达到50% ~70% 时,根据Lipofetamine 3000步骤进行转染,37 ℃,5% CO2培养。采用Dual-Luciferase system检测系统测定荧光素酶活性。首先每孔加入100 μL 1×PLB溶液,吹打细胞后摇床上放置15 min,将细胞裂解液吸至1.5 mL离心管,4 ℃,12 000 r·min-1离心10 min,取上清至新的管子;然后加入100 μL Luciferase Assay Reagent II工作液,然后加入20 μL细胞裂解液,吹打混匀2~3次,测定记录Firefly Luciferase值,即内参值。最后加入100 μL Stop & GloⓇ Reagent,吹打混匀,测定记录Renilla Luciferase值,即报告基因发光值。
1.8 CCK-8检测将2×104个GCs铺至96孔细胞培养板上,待细胞密度达到50%~70%时转染miR-144-5p mimics,每孔终浓度为100 nmol·L-1;miR-144-5p inhibitor,每孔终浓度为200 nmol·L-1和pcn-WNT5a,每孔100 ng。每组3个复孔。转染24 h或48 h后,向每个处理组的细胞悬液中滴加10 μL CCK-8溶液,在37 ℃环境下孵育2 h,最后用酶标仪检测450 nm波长处的OD值。
1.9 实时荧光定量PCR以cDNA为模板,按照实时荧光定量的体系进行RT-qPCR扩增。相关引物序列见表 2。反应体系:2×ΜLtra SYBR Green qPCR Mix 10 μL,上游引物(10 μmol·L-1)1 μL,下游引物(10 μmol·L-1)1 μL,cDNA 1 μL,ddH2O 7 μL。应用程序为:95 ℃ 1 min;95 ℃ 30 s,60 ℃ 30 s,72 ℃ 1 min,35个循环;4 ℃保存。分别以U6和β-actin为内参,用2-ΔΔCt法分析基因的相对表达量。
|
|
表 2 实时定量引物 Table 2 Real-time quantitative primers |
PBS冲洗2遍细胞,加入200 μL RIPA裂解液。冰上放置30 min,收集细胞,4 ℃,12 000 r·min-1离心15 min,吸上清,-80 ℃冻存备用。用BCA试剂盒进行浓度测定。根据蛋白浓度,加入蛋白上样液,99 ℃煮沸5 min,使蛋白变性。加入20 ng蛋白在5% 浓缩胶和10% 的分离胶中220 V电泳。用90 V电压1 h将蛋白转印到PVDF膜上。5%的脱脂奶粉摇床上封闭1 h。吸去封闭液,用一抗4 ℃孵育过夜。第2天回收一抗,TBST洗3次,5 min·次-1。用与一抗来源相同的二抗室温摇床孵育1 h。TBST洗3次,10 min·次-1,最后用ECL化学发光液在化学发光成像系统下进行检测。
1.11 统计学分析利用SPSS 17.0软件t-test或者one-way ANOVA多重比较对实时定量结果、双荧光素酶结果和CCK-8结果进行方差分析和显著性检验,所有数据用“平均数±标准差(mean±SEM)”的形式表示。P < 0.05代表数据差异显著,P < 0.01代表数据差异极显著。
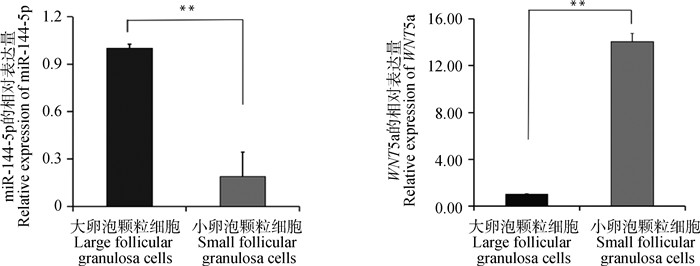
2 结果 2.1 miR-144-5p和WNT5a在山羊大、小卵泡颗粒细胞中的差异表达RT-qPCR结果显示,与大卵泡颗粒细胞相比,miR-144-5p的表达量在小卵泡颗粒细胞中极显著下调(P < 0.01);与大卵泡颗粒细胞相比,WNT5a的表达量在小卵泡颗粒细胞中极显著上调(P < 0.01)(图 1)。
|
ns. P>0.05, *.P < 0.05,**.P < 0.01,***.P < 0.001,****.P < 0.000 1,下同 ns. P>0.05, *.P < 0.05, **. P < 0.01, ***. P < 0.001, ****. P < 0.000 1, the same as below 图 1 miR-144-5p与WNT5a在大小卵泡颗粒细胞的表达水平 Fig. 1 Expression level of miR-144-5p and WNT5a in small and large follicular granulosa cells |
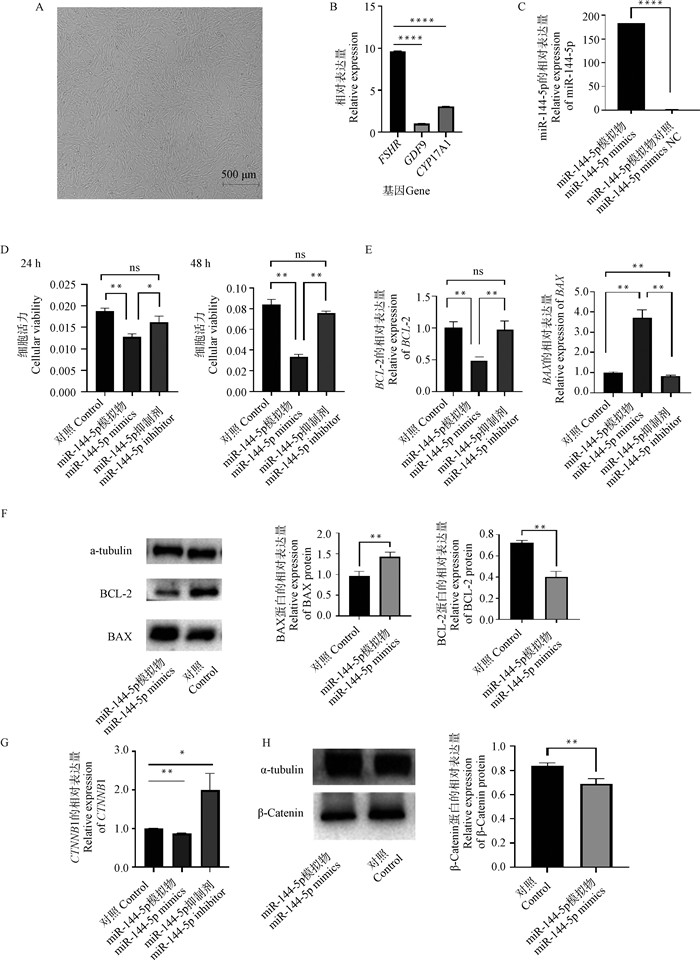
卵泡中主要有颗粒细胞、卵母细胞、卵泡膜细胞,标志基因分别为FSHR、GDF9、CYP17A1, 对分离的颗粒细胞进行qPCR分析,结果显示FSHR极显著高表达,而GDF9和CYP17A1表达量极低(图 2B), 所以分离的颗粒细胞符合后续试验的要求。以从卵巢中分离出的生长状况良好的GCs为研究对象(图 2A),转染miR-144-5p mimics后,与对照组相比其表达量显著上调(图 2C)。CCK-8试验结果表明,转染24 h后,与Control相比,miR-144-5p mimics组GCs的活力极显著降低(P < 0.01),而miR-144-5p inhibitor组GCs活力没有显著变化(P>0.05)。转染48 h后,与Control相比,miR-144-5p mimics组极显著抑制了GCs的活力(P < 0.01),而miR-144-5p inhibitor组GCs活力没有显著变化(P>0.05)(图 2D),表明miR-144-5p可抑制细胞增殖。
|
A.山羊卵巢颗粒细胞; B.卵泡中3种主要细胞标志基因的表达; C.转染miR-144-5p mimics后miR-144-5p表达水平; D. CCK-8检测miR-144-5p对细胞增殖的影响; E. miR-144-5p对凋亡基因mRNA的影响; F. miR-144-5对凋亡基因蛋白水平的影响; G. CTNNB1 mRNA的相对表达量;H. Western blot检测结果及β-Catenin相对表达量 A. Granulosa cells of goat ovary; B. Expression of marker genes of three major cells in the follicle; C. Expression level of miR-144-5p after transfection of miR-144-5p mimics; D. CCK-8 was used to detect the effect of miR-144-5p on cell proliferation; E. Effect of miR-144-5p on apoptotic gene mRNA; F. Effect of miR-144-5p on protein levels of apoptotic genes; G. Relative expression level of CTNNB1 mRNA; H. Western blot test results and β-Catenin relative expression 图 2 miR-144-5p对颗粒细胞凋亡、增殖的影响 Fig. 2 Effect of miR-144-5p on apoptosis and proliferation of granulosa cells |
RT-qPCR结果显示,与Control组相比,miR-144-5p mimics组内BCL-2的表达极显著降低(P < 0.01),miR-144-5p inhibitor组的BCL-2表达量没有显著变化(P>0.05)。miR-144-5p mimics组BAX的表达量极显著升高(P < 0.01),miR-144-5p inhibitor组的BAX表达量极显著降低(P < 0.01)(图 2E)。结果表明,miR-144-5p通过上调促凋亡基因BAX,下调抑凋亡基因BCL-2从而促进了颗粒细胞的凋亡。
Western blot结果表明, 与Control组相比,miR-144-5p mimics组的BCL-2蛋白表达量极显著降低,BAX蛋白表达量极显著升高(P < 0.01)(图 2F),表明miR-144-5p在转录水平抑制了BCL-2的表达,促进BAX的表达。研究结果表明,miR-144-5p在一定程度上促进了颗粒细胞的凋亡,抑制了其增殖。
另外为了研究miR-144-5p对GCs增殖的调控作用是否是通过激活Wnt通路的级联效应引起的,本试验通过RT-qPCR和Western blot的方法分别检测CTNNB 1mRNA和蛋白水平的表达。根据RT-qPCR结果发现, 与Control组相比,过表达miR-144-5p极显著降低了CTNNB1 mRNA表达量(P < 0.01),反之,抑制miR-144-5p表达,CTNNB1 mRNA表达量显著提高(P < 0.05)(图 2G)。Western blot结果显示, 与Control组对比,过表达miR-144-5p极显著降低β-Catenin蛋白表达量(P < 0.01)(图 2H)。
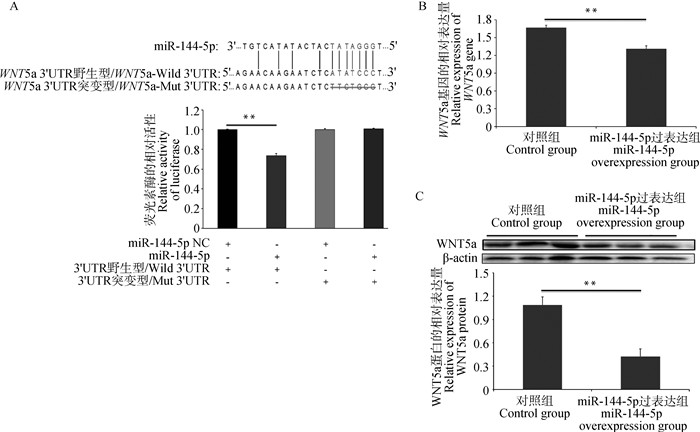
2.3 miR-144-5p与WNT5a的靶向关系验证试验通过Target Scan和Star Base等相关生物信息学数据库,进一步寻找miR-144-5p的下游潜在靶点。生物信息学分析提示, WNT5a可能是miR-144-5p的潜在靶基因,而且功能注释发现,表达差异极为显著的WNT5a基因与机体生长发育、生殖进程、生殖系统发育等生物过程显著相关,而且已经证实WNT5a基因是卵泡发育的重要参与者。此外,为验证miR-144-5p是否可以直接靶向结合WNT5a发挥作用,本研究构建了野生型WNT5a-3′UTR-wt-pSI-Check2荧光素酶报告载体和突变型WNT5a-3′ UTR-mu-pSI-Check2荧光素酶报告载体。经序列比对WNT5a 3′ UTR中与miR-144-5p的结合位点序列为ATATCCC(图 3A)。随后,将荧光素酶报告载体与miR-144-5p共转染至293 T细胞内,结果发现,与NC组相比,miR-144-5p mimic极显著抑制了野生型载体WNT5a-3′ UTR-wt-pSI-Check2的荧光素酶活性(P < 0.01),而突变型载体WNT5a-3′ UTR-mu-pSI-Check2的荧光素酶活性不受miR-144-5p的影响(P>0.05)(图 3A)。因此,将WNT5a初步判定为miR-144-5p的靶基因。此外,通过RT-qPCR和Western blot的方法检测GCs中WNT5a的表达水平。结果表明,与Control组相比,GCs中过表达miR-144-5p后,WNT5a mRNA和蛋白的表达量极显著下调(P < 0.01)(图 3B、C)。以上试验结果说明WNT5a是miR-144-5p的靶基因,并且miR-144-5p在GCs内负调控WNT5a的表达。
|
A. miR-144-5p与WNT5a的靶向关系及双荧光素酶活性检测;B. WNT5a mRNA表达水平检测;C. WNT5a蛋白翻译水平检测 A. Targeting relationship between miR-144-5p and WNT5a and detection of dual luciferase activity; B. Detection of WNT5a mRNA expression level; C. Detection of WNT5a protein translation level 图 3 miR-144-5p靶向WNT5a基因 Fig. 3 miR-144-5p targets WNT5a gene |
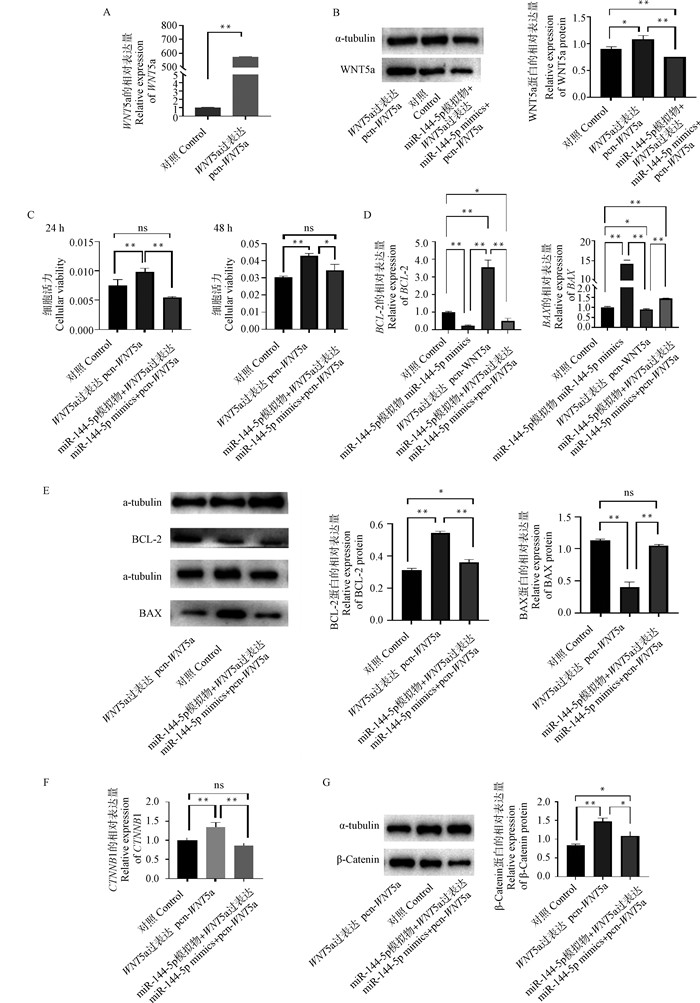
本研究构建pcn-WNT5a过表达载体并转染GCs,提取细胞RNA及蛋白,然后检测WNT5a基因mRNA和蛋白水平。结果显示,pcn-WNT5a过表达载体处理GCs后,极显著增加了WNT5a基因的mRNA表达量(P < 0.01), 显著增加了其蛋白表达量(P < 0.05, 图 4A、B)。因此成功过表达了WNT5a。
|
A. WNT5a mRNA的相对表达量;B. WNT5a的Western blot检测结果;C. WNT5a对细胞增殖的影响D. WNT5a对凋亡基因mRNA水平的影响E. WNT5a对凋亡基因蛋白水平的影响F. CTNNB1 mRNA的相对表达量;G. Western Blot检测结果及β-Catenin的蛋白相对表达量 A. The relative expression of WNT5a mRNA; B. Western blot test results of WNT5a; C. Effects of WNT5a on apoptosis; D. Effects of WNT5a on mRNA levels of apoptotic genes; E. Effects of WNT5a on protein levels of apoptotic genes; F. Relative expression level of CNTTB1 mRNA; G. Protein relative expression level of β-Catenin 图 4 WNT5a对山羊卵巢颗粒细胞的影响 Fig. 4 Effect of WNT5a on granulosa cells of goat ovary |
为了研究WNT5a对GCs的影响,采用CCK-8试验检测不同时间段WNT5a对GCs活力的影响。结果表明,转染24 h后,与Control组相比,pcn-WNT5a组GCs的活力极显著提高(P < 0.01),pcn-WNT5a+miR-144-5p共转组没有显著变化(P>0.05), 转染48 h后,与Control组相比,pcn-WNT5a组GCs的活力极显著提高(P < 0.01),pcn-WNT5a+ miR-144-5p共转组对GCs的活力没有显著影响(P>0.05)(图 4C)。结果表明,WNT5a促进GCs增殖,且证实miR-144-5p能靶向WNT5a抑制其表达从而调控WNT5a在GCs中的作用。
RT-qPCR结果显示,与Control组相比,过表达WNT5a后,BCL-2的mRNA水平极显著提高(P < 0.01),而BAX的表达量显著降低(P < 0.05),反之,抑制WNT5a表达后,BCL-2的mRNA表达量极显著下降(P < 0.01),而BAX的mRNA表达量极显著升高(P < 0.01);miR-144-5p和pcn-WNT5a共转组中BCL-2的mRNA表达量极显著低于pcn-WNT5a组(P < 0.01),极显著高于miR-144-5p mimics组(P < 0.01),BAX的mRNA表达量极显著高于pcn-WNT5a组(P < 0.01),极显著低于miR-144-5p mimics组(P < 0.01)(图 4D)。结果表明,WNT5a在mRNA水平上促进BCL-2基因的表达,抑制BAX基因的表达。Western blot结果显示, 与Control组相比,pcn-WNT5a组的BCL-2蛋白表达量极显著升高(P < 0.01),共转组显著升高(P < 0.05)。pcn-WNT5a组的BAX蛋白表达量极显著降低(P < 0.01),共转组无显著变化(P>0.05)(图 4E)。结果表明,WNT5a在蛋白水平促进抑凋亡BCL-2蛋白的表达,抑制促凋亡BAX蛋白的表达。综上所述WNT5a抑制了颗粒细胞的凋亡,促进了其增殖。
为了研究WNT5a对GCs增殖的调控作用是否是通过激活Wnt通路的级联效应引起的,本试验通过RT-qPCR和Western blot的方法检测CTNNB1 mRNA和β-Catenin蛋白的表达。
RT-qPCR结果发现,与Control组对比,过表达WNT5a极显著提高CTNNB1 mRNA表达量(P < 0.01),而WNT5a和miR-144-5p共转至GCs后对CTNNB1表达量没有显著影响(P>0.05)(图 4F)。Western blot结果发现, 与Control组对比,过表达WNT5a能极显著提高β-Catenin蛋白水平(P < 0.01)。WNT5a和miR-144-5p共转后,β-Catenin蛋白水平显著高于Control组的蛋白水平(P < 0.05),显著低于pcn-WNT5a组的蛋白水平(P < 0.05)(图 4G)。结果表明,WNT5a可能通过调控β-Catenin的表达影响Wnt通路而发挥作用,miR-144-5p可通过抑制WNT5a的表达调控其对β-Catenin的表达。
3 讨论繁殖性状是决定规模化养殖产出的重要经济性状,而研究山羊繁殖性状的调控基因及其作用机制对提高山羊繁殖性能具有重要意义。卵巢是雌性动物重要的繁殖器官,可通过影响卵泡发育和排卵数量决定山羊产羔数,故其在山羊的繁殖调控过程中占据重要地位[28-32]。而大部分卵泡在发育过程中发生闭锁,所以母羊一生的排卵数远远少于卵巢上出现的大卵泡数[33]。研究表明,GCs的增殖和分化导致卵泡成熟和排卵,而GCs的凋亡和变性导致卵泡闭锁[34-36],所以卵巢GCs凋亡被认为是卵泡闭锁的标志[37]。BCL-2蛋白具有促进细胞生存,抗细胞凋亡的作用,而BAX蛋白的作用却与此相反,能够加速诱导GCs的凋亡[38-39]。Ratts等[40]发现,敲除BCL-2基因的小鼠中包含健康卵母细胞的原始卵泡数量显著下降,提示BCL-2对卵泡的发育至关重要,另外在人早期闭锁卵泡GCs中BAX基因大量表达,但是在正常卵泡中表达较少[41]。
miR-144-5p在健康正常雷州山羊大卵泡和小卵泡的GCs中存在显著差异表达,这提示它们可能影响卵泡发育,根据转录组数据发现,WNT5a基因在雷州山羊大卵泡和小卵泡GCs中也存在显著差异表达,进一步功能注释发现WNT5a基因与生长发育(GO: 004 8638, regulation of developmental growth)、典型Wnt信号通路(GO: 006 0828, regulation of canonical Wnt signaling Pathway)、生殖进程(GO: 200 0241, regulation of reproductive Process)、生殖系统发育(GO: 006 1458, reproductive system development)等生物过程显著相关[42],但是WNT5a在山羊卵巢中的表达、调节及功能都鲜有报道。
已有研究表明,miR-144在不同疾病中具有抑制细胞增殖,促进细胞凋亡的作用[43-45]。Fu等[46]发现,miR-144-5p可通过下调ST8SIA4抑制胆管癌细胞的增殖、侵袭和迁移。Song等[47]发现, miR-144-5p通过靶向ATF2增强非小细胞肺癌细胞的放射敏感性。另外, miR-144-5p还靶向RICTOR抑制人脐静脉内皮细胞增殖、迁移和侵袭[48]。本试验通过CCK-8检测方法得出, 过表达miR-144-5p后,GCs的活力极显著降低(P < 0.01),而抑制miR-144-5p表达后,GCs活力没有显著变化。另外, Western blot试验发现, 过表达miR-144-5p后BCL-2蛋白表达量降低,BAX蛋白表达量升高。由此可见, 本试验结果与前人研究报道一致,过表达miR-144-5p可以抑制颗粒细胞的增殖并促进其凋亡。
进一步过表达WNT5a后,CCK-8检测发现山羊卵巢GCs的活力明显提高,且BCL-2蛋白表达量极显著提高,BAX蛋白表达量极显著下降。有文献报道,在小鼠排卵期间,WNT5a在卵巢GCs中的表达量增加,而且WNT5a可通过JNK和AKT信号通路增强KGN细胞中卵丘扩张基因HAS2LH的表达,这表明WNT5a在卵巢排卵中发挥重要作用[49]。另外,促排卵处理可促进卵巢颗粒细胞WNT5a mRNA转录水平升高,WNT5a的表达水平升高又增强了GCs对胰岛素的反应性[50],所以过表达WNT5a后,可能也激活了颗粒细胞内的AKT通路,从而促进了颗粒细胞的增殖,但这还需要进行更深入的研究。
越来越多的研究报道, miRNA可以与mRNA的3′UTR结合从而阻碍mRNA发挥作用,利用生物信息学软件预测出了miR-144-5p可以靶向WNT5a,双荧光素酶报告基因试验证实了miR-144-5p特异性靶向WNT5a,进一步过表达miR-144-5p后WNT5a基因mRNA表达水平显著下降,同时其蛋白表达水平也显著下降,表明miR-144-5p不仅能够在转录水平发挥作用,而且能够抑制靶基因WNT5a的翻译过程,这些成功证实了miR-144-5p和WNT5a的靶向关系。
Wnt/β-Catenin经典信号通路在卵巢发育中起着重要的调控作用。已有研究表明,在鸡卵巢GCs中,细胞因子白血病抑制因子(LIF)和碱性成纤维细胞生长因子(bFGF)通过Wnt/β-Catenin信号传导抑制GCs凋亡并促进其增殖[51]。在猪卵巢GCs中,抑制Wnt/β-Catenin通路后,CCND2基因的表达呈现上调趋势,导致细胞周期阻滞,促进细胞凋亡[52]。在绵羊卵巢GCs中,Wnt信号通路可以促进绵羊卵泡GCs的增殖和雌激素的分泌[53-54]。在水牛卵巢中,Wnt/β-Catenin信号通路可通过调控雌二醇的合成影响孕酮的合成,从而参与水牛卵泡发育的调控[55]。在大鼠卵巢GCs中,Wnt/β-Catenin通路的激活可以上调GCs中的connexin 43[56]。但是在山羊中关于卵巢Wnt/β-Catenin通路调节GCs增殖的研究还非常少。另外,经典/非经典Wnt信号通路的激活在很大程度上依赖于受体,一个单一的WNT5a配体可以根据受体的可用性对细胞产生不同的影响[57-59],因此,细胞环境决定了WNT5a的作用。在牛GCs中,WNT5a发挥作用不是通过Wnt/Ca2+或平面细胞极性途径,而是通过抑制经典Wnt信号通路,阻断FSH和黄体化蛋白功能的发挥,相应的引起β-Catenin结合蛋白和cAMP结合蛋白表达下调,进而对卵泡发育及其对促性腺激素的反应性产生影响[60]。另外,WNT5a能在共表达Fzd5受体的非洲爪猴胚胎中激活β-Catenin依赖通路,诱导次级轴的形成[61-62]。同时,另一项研究发现,WNT5a在表达ROR2的细胞中可抑制典型Wnt/β-Catenin信号,但在表达Fzd4和LRP5的细胞中可诱导典型Wnt/β-Catenin信号通路[63]。
重要的是,WNT5a也是β-Catenin磷酸化的有效抑制剂[64],从而稳定β-Catenin。在牛GCs中,WNT5a可增加LGK-974处理后β-Catenin的丰度,这与WNT5a敲低可抑制HaCaT细胞中β-Catenin的表达是一致的[65-66]。在小鼠胚胎干细胞中,WNT5a信号可以稳定β-Catenin进而激活Wnt/β-Catenin典型信号途径,上调胚胎干细胞细胞中STAT3的mRNA水平并通过LIF/JAK-STAT途径阻止ES细胞分化[67-68], 在肥大细胞中,当用WNT5a处理后,在全细胞裂解物中观察到β-Catenin积累,AXIN2和TCF mRNA的表达量增加,表明WNT5a通过经典的Wnt信号通路促进肥大细胞的成熟[69], 以上研究恰好与本试验WNT5a过表达导致山羊GCs中β-Catenin的增加相类似。
综上所述miR-144-5p通过负调控WNT5a基因的表达来抑制其功能,进而调控Wnt/β-Catenin通路导致卵巢GCs的凋亡,继而上调BAX/BCL-2的比值来调控卵泡的发育,对山羊繁殖性能起到重要作用,但是miR-144-5p和WNT5a基因对GCs的具体调控机制和卵泡发育的影响还需更多的试验探究才能认识清楚。
4 结论本研究结果表明,miR-144-5p通过抑制靶基因WNT5a的表达,上调BAX/BCL-2的比值,调控Wnt/β-Catenin通路来抑制山羊卵巢GCs的增殖并促进其凋亡,从而调控山羊卵泡的发育,这可能会对山羊的排卵数和产羔数产生一定的影响。
| [1] |
王玉琴, 吴至博, 丁鸿祥, 等. 转录组学在绵、山羊繁殖调控机理上的研究应用[J]. 中国草食动物科学, 2020, 40(3): 60-64. WANG Y Q, WU Z B, DING H X, et al. The research and application of transcriptology in the regulating mechanism of sheep and goat reproduction[J]. China Herbivore Science, 2020, 40(3): 60-64. (in Chinese) |
| [2] |
冯光杭, 江声伟, 李耀坤, 等. miRNA调控动物卵泡发育研究进展[J]. 中国畜牧兽医, 2021, 48(11): 4133-4142. FENG G H, JIANG S W, LI Y K, et al. Research advances on regulation of animal follicular development by miRNA[J]. China Animal Husbandry & Veterinary Medicine, 2021, 48(11): 4133-4142. DOI:10.16431/j.cnki.1671-7236.2021.11.023 (in Chinese) |
| [3] |
DE SÁ N A R, FERREIRA A C A, SOUSA F G C, et al. First pregnancy after in vitro culture of early antral follicles in goats: positive effects of anethole on follicle development and steroidogenesis[J]. Mol Reprod Dev, 2020, 87(9): 966-977. DOI:10.1002/mrd.23410 |
| [4] |
叶娜, 董晓英, 李冬华. 卵巢早衰的颗粒细胞凋亡机制研究进展[J]. 首都医科大学学报, 2014, 35(3): 379-383. YE N, DONG X Y, LI D H. The progress in apoptotic mechanism of ovarian granulosa cells involved in premature ovarian failure[J]. Journal of Capital Medical University, 2014, 35(3): 379-383. DOI:10.3969/j.issn.1006-7795.2014.03.023 (in Chinese) |
| [5] |
MANABE N, GOTO Y, MATSUDA-MINEHATA F, et al. Regulation mechanism of selective atresia in porcine follicles: regulation of granulosa cell apoptosis during atresia[J]. J Reprod Dev, 2004, 50(5): 493-514. DOI:10.1262/jrd.50.493 |
| [6] |
HIMELSTEIN-BRAW R, BYSKOV A G, PETERS H, et al. Follicular atresia in the infant human ovary[J]. J Reprod Fertil, 1976, 46(1): 55-59. DOI:10.1530/jrf.0.0460055 |
| [7] |
KILIKEVICIUS A, MEISTER G, COREY D R. Reexamining assumptions about miRNA-guided gene silencing[J]. Nucleic Acids Res, 2022, 50(2): 617-634. DOI:10.1093/nar/gkab1256 |
| [8] |
BARTEL D P. Metazoan MicroRNAs[J]. Cell, 2018, 173(1): 20-51. DOI:10.1016/j.cell.2018.03.006 |
| [9] |
HONG X M, LUENSE L J, MCGINNIS L K, et al. Dicer1 is essential for female fertility and normal development of the female reproductive system[J]. Endocrinology, 2008, 149(12): 6207-6212. DOI:10.1210/en.2008-0294 |
| [10] |
TESFAYE D, GEBREMEDHN S, SALILEW-WONDIM D, et al. MicroRNAs: tiny molecules with a significant role in mammalian follicular and oocyte development[J]. Reproduction, 2018, 155(3): R121-R135. DOI:10.1530/REP-17-0428 |
| [11] |
BERNSTEIN E, KIM S Y, CARMELL M A, et al. Dicer is essential for mouse development[J]. Nat Genet, 2003, 35(3): 215-217. DOI:10.1038/ng1253 |
| [12] |
NAGARAJA A K, ANDREU-VIEYRA C, FRANCO H L, et al. Deletion of Dicer in somatic cells of the female reproductive tract causes sterility[J]. Mol Endocrinol, 2008, 22(10): 2336-2352. DOI:10.1210/me.2008-0142 |
| [13] |
FENG G H, LIU J, LU Z T, et al. miR-450-5p and miR-202-5p synergistically regulate follicle development in black goat[J]. Int J Mol Sci, 2022, 24(1): 401. DOI:10.3390/ijms24010401 |
| [14] |
LEE S Y, KANG Y J, KWON J, et al. miR-4463 regulates aromatase expression and activity for 17β-estradiol synthesis in response to follicle-stimulating hormone[J]. Clin Exp Reprod Med, 2020, 47(3): 194-206. DOI:10.5653/cerm.2019.03412 |
| [15] |
YANG M L, LIN L, SHA C L, et al. Bone marrow mesenchymal stem cell-derived exosomal miR-144-5p improves rat ovarian function after chemotherapy-induced ovarian failure by targeting PTEN[J]. Lab Invest, 2020, 100(3): 342-352. DOI:10.1038/s41374-019-0321-y |
| [16] |
WONG Q W L, SUN M A, LAU S W, et al. Identification and characterization of a specific 13-miRNA expression signature during follicle activation in the zebrafish ovary[J]. Biol Reprod, 2018, 98(1): 42-53. DOI:10.1093/biolre/iox160 |
| [17] |
韦唯. miR-101与miR-144对奶山羊卵巢颗粒细胞调控的研究[D]. 杨凌: 西北农林科技大学, 2017. WEI W. Study of regulation about miR-101 and miR-144 on ovarian granulosa cells in dairy goat[D]. Yangling: Northwest A & F University, 2017. (in Chinese) |
| [18] |
KUANG H X, HAN D W, XIE J M, et al. Profiling of differentially expressed microRNAs in premature ovarian failure in an animal model[J]. Gynecol Endocrinol, 2014, 30(1): 57-61. DOI:10.3109/09513590.2013.850659 |
| [19] |
蒋玉玲. Wnt5a基因下调对C2C12肌原细胞增殖与分化的影响[D]. 大连: 大连医科大学, 2012. JIANG Y L. Down-regulation of Wnt5a gene affects proliferation and differentiation of C2C12 Myogeneic cells[D]. Dalian: Dalian Medical University, 2012. (in Chinese) |
| [20] |
MIKI T, YASUDA S Y, KAHN M. Wnt/β-catenin signaling in embryonic stem cell self-renewal and somatic cell reprogramming[J]. Stem Cell Rev Rep, 2011, 7(4): 836-846. DOI:10.1007/s12015-011-9275-1 |
| [21] |
ZHANG Y F, TU C, ZHANG D W, et al. Wnt/β-catenin and Wnt5a/Ca2+ pathways regulate proliferation and apoptosis of keratinocytes in psoriasis lesions[J]. Cell Physiol Biochem, 2015, 36(5): 1890-1902. DOI:10.1159/000430158 |
| [22] |
NIU Q, SHI J J, GAO Q, et al. WNT5A enhances LH-mediated expression of HAS2 in Granulosa cells[J]. Reprod Sci, 2022, 29(5): 1618-1629. DOI:10.1007/s43032-021-00736-7 |
| [23] |
ABEDINI A, ZAMBERLAM G, BOERBOOM D, et al. Non-canonical WNT5A is a potential regulator of granulosa cell function in cattle[J]. Mol Cell Endocrinol, 2015, 403: 39-45. DOI:10.1016/j.mce.2015.01.017 |
| [24] |
LAPOINTE E, BOERBOOM D. WNT signaling and the regulation of ovarian steroidogenesis[J]. Front Biosci (Schol Ed), 2011, 3(1): 276-285. |
| [25] |
HABARA O, LOGAN C Y, KANAI-AZUMA M, et al. WNT signaling in pre-granulosa cells is required for ovarian folliculogenesis and female fertility[J]. Development, 2021, 148(9): dev198846. DOI:10.1242/dev.198846 |
| [26] |
DE CIAN M C, GREGOIRE E P, LE ROLLE M, et al. R-spondin2 signaling is required for oocyte-driven intercellular communication and follicular growth[J]. Cell Death Differ, 2020, 27(10): 2856-2871. DOI:10.1038/s41418-020-0547-7 |
| [27] |
陆婷婷, 邹娴, 杨镇玮, 等. 基于高通量测序的山羊卵巢基质、卵泡转录组分析[J]. 华南农业大学学报, 2020, 41(2): 23-32. LU T T, ZOU X, YANG Z W, et al. Transcriptome analysis of goat ovaries and follicles based on high-throughput sequencing[J]. Journal of South China Agricultural University, 2020, 41(2): 23-32. (in Chinese) |
| [28] |
李耀坤, 许香萍, 陆婷婷, 等. 影响山羊产羔数lncRNA的筛选及功能分析[J]. 畜牧兽医学报, 2020, 51(8): 1853-1865. LI Y K, XU X P, LU T T, et al. Screening and functional analysis of lncRNA affecting litter size in goats[J]. Acta Veterinaria et Zootechnica Sinica, 2020, 51(8): 1853-1865. (in Chinese) |
| [29] |
MACKLON N S, FAUSER B C J M. Aspects of ovarian follicle development throughout life[J]. Horm Res, 1999, 52(4): 161-170. |
| [30] |
ZHAO Z Q, WANG L J, SUN X W, et al. Transcriptome analysis of the Capra hircus ovary[J]. PLoS One, 2015, 10(3): e0121586. DOI:10.1371/journal.pone.0121586 |
| [31] |
BARNETT K R, SCHILLING C, GREENFELD C R, et al. Ovarian follicle development and transgenic mouse models[J]. Hum Reprod Update, 2006, 12(5): 537-555. DOI:10.1093/humupd/dml022 |
| [32] |
ZHOU J W, PENG X W, MEI S Q. Autophagy in ovarian follicular development and atresia[J]. Int J Biol Sci, 2019, 15(4): 726-737. DOI:10.7150/ijbs.30369 |
| [33] |
董书餐, 侯碧巍, 邹娴, 等. 细胞自噬对动物卵泡发育调控的研究进展[J]. 中国畜牧兽医, 2022, 49(11): 4335-4345. DONG S C, HOU B W, ZOU X, et al. Research progress on regulation of follicle development by autophagy in animals[J]. China Animal Husbandry & Veterinary Medicine, 2022, 49(11): 4335-4345. DOI:10.16431/j.cnki.1671-7236.2022.11.024 (in Chinese) |
| [34] |
TILLY J L, KOWALSKI K I, JOHNSON A L, et al. Involvement of apoptosis in ovarian follicular atresia and postovulatory regression[J]. Endocrinology, 1991, 129(5): 2799-2801. DOI:10.1210/endo-129-5-2799 |
| [35] |
YU Y S, SUI H S, HAN Z B, et al. Apoptosis in granulosa cells during follicular atresia: relationship with steroids and insulin-like growth factors[J]. Cell Res, 2004, 14(4): 341-346. DOI:10.1038/sj.cr.7290234 |
| [36] |
MURDOCH W J. Programmed cell death in preovulatory ovine follicles[J]. Biol Reprod, 1995, 53(1): 8-12. DOI:10.1095/biolreprod53.1.8 |
| [37] |
ZHAO F, ZHAO W M, REN S W, et al. Roles of SIRT1 in granulosa cell apoptosis during the process of follicular atresia in porcine ovary[J]. Anim Reprod Sci, 2014, 151(1-2): 34-41. DOI:10.1016/j.anireprosci.2014.10.002 |
| [38] |
杨阳, 陶仕英, 赵丕文, 等. 卵巢早衰颗粒细胞凋亡调控机制的研究进展[J]. 医学研究杂志, 2018, 47(1): 16-19. YANG Y, TAO S Y, ZHAO P W, et al. Research progress on the regulatory mechanism of granulosa cell apoptosis in premature ovarian failure[J]. Journal of Medical Research, 2018, 47(1): 16-19. (in Chinese) |
| [39] |
SPITZ A Z, GAVATHIOTIS E. Physiological and pharmacological modulation of BAX[J]. Trends Pharmacol Sci, 2022, 43(3): 206-220. DOI:10.1016/j.tips.2021.11.001 |
| [40] |
RATTS V S, FLAWS J A, KOLP R, et al. Ablation of bcl-2 gene expression decreases the numbers of oocytes and primordial follicles established in the post-natal female mouse gonad[J]. Endocrinology, 1995, 136(8): 3665-3668. DOI:10.1210/endo.136.8.7628407 |
| [41] |
KUGU K, RATTS V S, PIQUETTE G N, et al. Analysis of apoptosis and expression of bcl-2 gene family members in the human and baboon ovary[J]. Cell Death Differ, 1998, 5(1): 67-76. DOI:10.1038/sj.cdd.4400316 |
| [42] |
赵智锋, 邹娴, 柳广斌, 等. 川中黑山羊和雷州山羊大小卵泡转录组学分析[J]. 中国畜牧兽医, 2020, 47(5): 1459-1471. ZHAO Z F, ZOU X, LIU G B, et al. Comparative transcriptome analysis between large and small follicles in Chuanzhong black and Leizhou goats[J]. China Animal Husbandry & Veterinary Medicine, 2020, 47(5): 1459-1471. DOI:10.16431/j.cnki.1671-7236.2020.05.020 (in Chinese) |
| [43] |
QING Z, DONGLIU L, XUEDIE G, et al. MiR-144-3p targets STC1 to activate PI3K/AKT pathway to induce cell apoptosis and cell cycle arrest in selenium deficiency broilers[J]. J Inorg Biochem, 2022, 226: 111665. DOI:10.1016/j.jinorgbio.2021.111665 |
| [44] |
SUN N H, ZHANG L, ZHANG C G, et al. miR-144-3p inhibits cell proliferation of colorectal cancer cells by targeting BCL6 via inhibition of Wnt/β-catenin signaling[J]. Cell Mol Biol Lett, 2020, 25: 19. DOI:10.1186/s11658-020-00210-3 |
| [45] |
WANG Z J, ZHANG M, LI K, et al. CircMGA depresses myoblast proliferation and promotes myotube formation through miR-144-5p/FAP signal[J]. Animals (Basel), 2022, 12(7): 873. |
| [46] |
FU W, YU G C, LIANG J N, et al. miR-144-5p and miR-451a inhibit the growth of cholangiocarcinoma cells through decreasing the expression of ST8SIA4[J]. Front Oncol, 2021, 10: 563486. DOI:10.3389/fonc.2020.563486 |
| [47] |
SONG L, PENG L P, HUA S C, et al. miR-144-5p enhances the radiosensitivity of non-small-cell lung cancer cells via targeting ATF2[J]. BioMed Res Int, 2018, 2018: 5109497. |
| [48] |
FU W, LIU Z D, ZHANG J, et al. Effect of miR-144-5p on the proliferation, migration, invasion and apoptosis of human umbilical vein endothelial cells by targeting RICTOR and its related mechanisms[J]. Exp Ther Med, 2020, 19(3): 1817-1823. |
| [49] |
NIU Q, SHI J J, GAO Q, et al. WNT5A enhances LH-mediated expression of HAS2 in Granulosa cells[J]. Reprod Sci, 2022, 29(5): 1618-1629. DOI:10.1007/s43032-021-00736-7 |
| [50] |
牛群, 石婧婧, 符江. WNT5A基因对卵巢颗粒细胞胰岛素反应性和胰岛素抵抗的调控作用[J]. 山东大学学报: 医学版, 2021, 59(6): 57-63. NIU Q, SHI J J, FU J. Effects of WNT5A gene on insulin reactivity and insulin resistance in granulosa cells[J]. Journal of Shandong University: Health Sciences, 2021, 59(6): 57-63. (in Chinese) |
| [51] |
GUO C Q, DONG J, MA Y F, et al. LIF and bFGF enhanced chicken primordial follicle activation by Wnt/β-catenin pathway[J]. Theriogenology, 2021, 176: 1-11. DOI:10.1016/j.theriogenology.2021.09.008 |
| [52] |
杨有福. Wnt/β-catenin协同褪黑素、PI3K信号通路对猪卵巢颗粒细胞发育的影响[D]. 杨凌: 西北农林科技大学, 2018. YANG Y F. Effect of WNT/β-Catenin in cooperation with melatonin、PI3K signaling on development of porcine granulosa cells[D]. Yangling: Northwest A & F University, 2018. (in Chinese) |
| [53] |
GUPTA P S P, FOLGER J K, RAJPUT S K, et al. Regulation and regulatory role of WNT signaling in potentiating FSH action during bovine dominant follicle selection[J]. PLoS One, 2014, 9(6): e100201. DOI:10.1371/journal.pone.0100201 |
| [54] |
赵妙妙. FSH及WNT信号通路对绵羊卵泡颗粒细胞功能的影响[D]. 晋中: 山西农业大学, 2016. ZHAO M M. Effects of FSH and WNT signaling pathways on function of sheep granulosa cells in vitro[D]. Jinzhong: Shanxi Agricultural University, 2016. (in Chinese) |
| [55] |
余庆. Wnt/β-Catenin信号通路的激活或抑制对水牛颗粒细胞雌二醇和孕酮合成的影响[D]. 南宁: 广西大学, 2021. YU Q. Effects of activation or inhibition of Wnt/β-catenin signaling pathway on estradiol and progesterone synthesis in buffalo granulosa cells[D]. Nanning: Guangxi University, 2021. (in Chinese) |
| [56] |
ZHENG X M, JING H, GAO S Q, et al. LH upregulates connexin 43 expression in granulosa cells by activating the Wnt/β-catenin signalling pathway[J]. Reprod Fertil Dev, 2021, 33(3): 239-244. |
| [57] |
KESTLER H A, KVHL M. Generating a Wnt switch: it's all about the right dosage[J]. J Cell Biol, 2011, 193(3): 431-433. DOI:10.1083/jcb.201103167 |
| [58] |
RING L, NETH P, WEBER C, et al. β-Catenin-dependent pathway activation by both promiscuous "canonical" WNT3a-, and specific "noncanonical" WNT4- and WNT5a-FZD receptor combinations with strong differences in LRP5 and LRP6 dependency[J]. Cell Signal, 2014, 26(2): 260-267. DOI:10.1016/j.cellsig.2013.11.021 |
| [59] |
FU H D, WANG B K, WAN Z Q, et al. Wnt5a mediated canonical Wnt signaling pathway activation in orthodontic tooth movement: possible role in the tension force-induced bone formation[J]. J Mol Histol, 2016, 47(5): 455-466. DOI:10.1007/s10735-016-9687-y |
| [60] |
ABEDINI A, ZAMBERLAM G, LAPOINTE E, et al. WNT5a is required for normal ovarian follicle development and antagonizes gonadotropin responsiveness in granulosa cells by suppressing canonical WNT signaling[J]. FASEB J, 2016, 30(4): 1534-1547. DOI:10.1096/fj.15-280313 |
| [61] |
HE X, SAINT-JEANNET J P, WANG Y S, et al. A member of the Frizzled protein family mediating axis induction by Wnt-5A[J]. Science, 1997, 275(5306): 1652-1654. |
| [62] |
ISHIKAWA T, TAMAI Y, ZORN A M, et al. Mouse Wnt receptor gene Fzd5 is essential for yolk sac and placental angiogenesis[J]. Development, 2001, 128(1): 25-33. DOI:10.1242/dev.128.1.25 |
| [63] |
MIKELS A J, NUSSE R. Purified Wnt5a protein activates or inhibits β-catenin-TCF signaling depending on receptor context[J]. PLoS Biol, 2006, 4(4): e115. |
| [64] |
FLORES-HERNÁNDEZ E, VELÁZQUEZ D M, CASTAÑEDA-PATLÁN M C, et al. Canonical and non-canonical Wnt signaling are simultaneously activated by Wnts in colon cancer cells[J]. Cell Signal, 2020, 72: 109636. |
| [65] |
LIU C M, LI Y M, SEMENOV M, et al. Control of β-catenin phosphorylation/degradation by a dual-kinase mechanism[J]. Cell, 2002, 108(6): 837-847. |
| [66] |
ASHRY M, FOLGER J K, RAJPUT S K, et al. FSH stimulated bovine granulosa cell steroidogenesis involves both canonical and noncanonical WNT signaling[J]. Domest Anim Endocrinol, 2022, 78: 106678. |
| [67] |
RAZ R, LEE C K, CANNIZZARO L A, et al. Essential role of STAT3 for embryonic stem cell pluripotency[J]. Proc Natl Acad Sci U S A, 1999, 96(6): 2846-2851. |
| [68] |
HAO J, LI T G, QI X X, et al. WNT/β-catenin pathway up-regulates Stat3 and converges on LIF to prevent differentiation of mouse embryonic stem cells[J]. Dev Biol, 2006, 290(1): 81-91. |
| [69] |
YAMAGUCHI T, NISHIJIMA M, TASHIRO K, et al. Wnt-β-catenin signaling promotes the maturation of mast cells[J]. BioMed Res Int, 2016, 2016: 2048987. |
(编辑 郭云雁)



