皮肤是一个动态且复杂的器官[1],由表皮、真皮和皮下组织构成。羊毛由皮肤内的附属器官毛囊发育而来[2-3]。绵羊皮肤质量主要受羊毛弯曲程度的影响,而羊毛弯曲程度又受毛囊生长发育的调节。毛囊的生长和发育决定了毛发的表型特征[4]。毛囊是皮肤中最显著的产生毛发的微小器官[5],由表皮下陷而形成的,在皮肤上成群分布,控制着毛发的生长。表皮是皮肤的最外层,是人体保护机体免受外界影响的重要物理屏障和免疫屏障[6]。角质形成细胞(keratinocyte)是构成表皮的主要细胞类型,占表皮细胞的90%以上[7]。羊毛卷曲是通过调节毛囊上的大量基因而引起的。一些研究报道,毛囊细胞的不对称分裂导致头发弯曲[8]。不对称的细胞分裂和毛囊底层细胞硬化所施加的压力导致纤维弯曲,弯曲的程度受角质化的调节[9]。
毛发弯曲的调节机制与毛囊形态发育的通路密切相关[10],近年来研究发现,毛发的弯曲与Wnt、外异蛋白A(ectodysplasin-A,EDA)、核转录因子κB(nuclear factor-Kappa B,NF-κB)、SHH、骨形成蛋白(bone mor-phogenetic protein,BMP)等信号通路有着直接或间接的联系[11-14]。SHH是Hedgehog(HH)信号蛋白脊椎动物家族成员,1980年首次在果蝇基因分析中被发现。HH信号传导是毛囊角质形成细胞分化所必需的,可促进表皮发育,皮肤中SHH是由毛囊角质形成细胞产生的[15-16]。在表皮发育早期,SHH表达于发育中的毛囊基板中,发育中的表皮和下面的真皮凝集物都可以接收到SHH信号[17]。表皮SHH的过表达是可以诱导毛囊形态发生的关键胚胎特征[18]。SHH不是毛囊开始发育所必需的,但对于毛囊生长和形态发生的控制非常重要[19]。在对小鼠的研究中发现,SHH在毛基板的表皮部表达且表达是不对称的[18]。近年来,越来越多的证据表明,SHH在各种组织的发育过程中发挥着重要作用,然而,对于SHH在哺乳动物毛囊发育和羊毛弯曲中潜在作用的研究很少。
通过分析本实验室前期数据发现,SHH在美利奴羊和小尾寒羊背部皮肤中的表达存在差异[20]。光密度分析、实时荧光定量PCR、Western blot数据显示,SHH在美利奴羊背部皮肤的表达量高于小尾寒羊,表明SHH可能对羊毛弯曲形成有促进作用。然而,到目前为止SHH在羊毛弯曲中的作用尚未见报道。Krox20和IGFBP5对羊毛弯曲的形成有促进作用[21]。IGFBP5与毛发的发育和分化有关,调节毛干结构和毛囊形态,并被确定为毛发弯曲的第一标记分子[22]。SHH在小鼠皮肤毛囊中的不对称表达与Krox20/IGFBP5引起毛发周期性弯曲的形成密切相关[8, 14],但是详细的调控机理尚不清楚。以前的研究表明Krox20在绵羊成纤维细胞中对下游基因IGFBP5有正向调控作用,但在绵羊角质形成细胞中SHH是否通过Krox20调控IGFBP5来影响羊毛弯曲,目前尚未研究报道。
本研究培养绵羊角质形成细胞,探讨SHH在羊毛弯曲形成过程中的作用以及它的调控机制,研究结果表明在绵羊角质形成细胞中SHH通过Krox20调控IGFBP5来影响羊毛弯曲, 为毛发弯曲性状形成的相关分子调控机制提供理论依据。
1 材料与方法 1.1 试验动物采取妊娠50 d(E50)至70 d(E70)小尾寒羊胎儿3只,胎羊采自山西某屠宰场。
1.2 主要材料0.25%胰蛋白酶-EDTA消化液、1×PBS缓冲液、青链霉素混合液、鼠尾胶原、(索莱宝生物,中国);DispaseⅡ酶(Roche,中国);中提试剂盒(QIAGEN,德国);lipofectamin 2000(invitrogen,美国);成分确定角质形成细胞SFM(Gibco,美国);SHH兔抗多克隆抗体(20697-1-AP)(武汉三鹰,中国);Krox20兔抗多克隆抗体(D162872)、免疫沉淀试剂盒(生工);IGFBP5兔抗多克隆抗体(bs-0406R)(博奥森);抗β-actin鼠单克隆抗体、HRP-山羊抗兔IgG、HRP-山羊抗鼠IgG(康为世纪,中国);TRIzol Reagent(Invitrogen,美国);CCK-8试剂盒、RIPA蛋白裂解液、BCA蛋白浓度测定试剂盒(碧云天,中国)。
1.3 绵羊角质形成细胞的分离培养将子宫浸泡于0.9%生理盐水中迅速带回实验室,剖开子宫,取出胎羊,剥取其皮肤组织后用含1%青霉素-链霉素的PBS缓冲液冲洗干净,将皮肤组织放入DispaseⅡ酶中4 ℃过夜消化。次日,用含1%青霉素-链霉素的PBS缓冲液洗涤组织3次,切成大约1 mm3的组织块,加入0.25%胰蛋白酶-EDTA消化5~8 min,终止液中止消化后用滤网过滤组织碎片,4 ℃,1 000 r·min-1离心10 min,弃上清,将细胞与培养基混合。将含细胞的培养基加入铺有鼠尾胶原的60 mm细胞培养皿内。次日,观察粘附情况和细菌污染,48 h后可换液。
1.4 绵羊角质形成细胞生长曲线的绘制参照CCK-8试剂盒进行细胞检测,按比例将细胞悬液稀释成103、5×103、104三个梯度,并设置空白对照组。将细胞接种于96孔培养板中,每孔100 μL培养基,每个梯度设置5个副孔。细胞贴壁后,每孔加入10 μL CCK-8试剂,分别在0.5、1、2、3和3.5 h时,用酶标仪在450 nm处测量其OD值,并制作标准曲线。选取5×103的细胞密度接种到96孔板中,每隔24 h加入CCK-8试剂并孵育4 h,然后测量其OD值,连续测量7 d。根据制作的标准曲线,将测量7 d的OD值换算成细胞数量,制作细胞生长曲线。
1.5 细胞免疫荧光用4%的多聚甲醛固定30 min,5% BSA封闭液室温封闭1 h(勿洗),滴加anti-CK19(1∶500),4 ℃过夜孵育。次日,复温后滴加山羊抗兔荧光二抗(1∶200),37 ℃避光1 h,滴加抗荧光猝灭剂(含DAPI)封片,在显微镜下选取3个视野观察并拍照。
1.6 质粒构建和细胞转染NCBI中公布的绵羊SHH和Krox20基因的CDS区交由北京华大基因构建pEGFP-N1-SHH和pEGFP-N1-Krox20真核过表达载体。由北京擎科生物公司设计并合成shRNA-SHH。根据QIAKEN中提试剂盒的说明书进行目的质粒和空载质粒的提取,细胞培养至70%时进行转染。按照lip2000说明书,用NC,SHH,Krox20,sh-NC,sh-SHH分别转染绵羊角质形成细胞,每组至少设置3个重复。
1.7 免疫共沉淀试验根据免疫沉淀试剂盒说明书评估SHH和Krox20在角质形成细胞中的相互作用。将真核表达载体转染绵羊角质形成细胞后36 h,用PBS清洗细胞3次,加入700 μL细胞裂解液裂解细胞,离心机4 ℃,12 000×g离心10 min,收集上清液,一部分做Input组对照,另一部分加入SHH一抗,在4 ℃轻摇过夜。提前清洗琼脂糖珠,去除与琼脂糖珠结合的非特异性蛋白。第二天在混合液中加入20 μL protein A琼脂糖珠,在4 ℃摇床孵育2 h进行免疫沉淀。瞬离,去掉上清,加入IP裂解液清洗6次后,加入SDS上样缓冲液,95 ℃变性5 min,用Krox20抗体进行Western blot分析。
1.8 实时荧光定量PCR细胞收样后,根据TRIzol说明书提取总RNA,测浓度后根据反转录试剂盒反转录成cDNA。利用Primer Premier 5.0设计特异性引物,设计完成后交予上海桑尼生物科技有限公司合成(得到引物序列如表 1),使用ChamQTM Universal SYBRⓇ qPCR Master Mix说明书进行实时荧光定量PCR扩增,每个样本进行4次有效重复。利用2-ΔΔCt法计算基因的相对表达量。
1.9 Western blot利用RIPA说明书提取蛋白,BCA法测浓度,进行SDS-PAGE电泳。4 ℃一抗过夜孵育(1∶1 000 SHH兔多克隆抗体;1∶1 000 Krox20兔多克隆抗体;1∶1 000 IGFBP5兔多克隆抗体;1∶2 000抗β-actin鼠单克隆抗体),次日37 ℃孵育二抗1 h(1∶10 000 HRP-山羊抗鼠IgG;1∶12 000 HRP-山羊抗兔IgG),曝光,压片。用Image Lab软件拍照并进行数据分析。
|
|
表 1 实时荧光定量引物序列 Table 1 Primer sequences for qRT-PCR |
采用GraphPad Prism 5.0统计分析软件进行分析,使用单因素方差分析(One-way ANOVA)比较各组之间的差异性。其中*P<0.05,**P<0.01,***P<0.001表示差异显著程度。
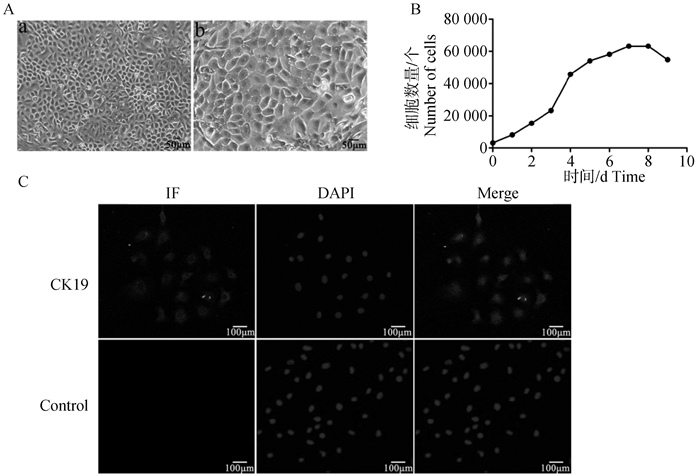
2 结果 2.1 绵羊原代角质形成细胞培养与鉴定在光镜下观察绵羊角质形成细胞呈“铺路石”样,细胞活性较好(图 1A)。由图 1B可见,生长曲线呈“S”型。其中,第1~3天为潜伏期,细胞增殖缓慢,第3天后增殖明显,3~6天为对数增长期,第7~8天细胞生长进入平台期,第8天以后,细胞数量减少。说明绵羊角质形成细胞在体外培养的环境下能够存活、增殖,且生长状况良好。细胞角蛋白19(Cytokeratin 19,CK19,bs-2190R)是上皮类细胞特异性蛋白标志物,在角质层中表达,CK19是呈阳性表达说明所获得的细胞是角质形成上皮细胞。由图 1C可知,CK19在细胞上呈阳性表达,且荧光信号较强。试验结果表明,所培养的是绵羊角质形成细胞且纯度较高,可用于后续试验。
|
A.培养的绵羊角质形成细胞:a.角质形成细胞(40×);b.角质形成细胞(100×)。B.角质形成细胞生长曲线。C.角质形成细胞的鉴定(100×) A.Cultured sheep keratinocytes: a.Keratinocytes(40×); b.Keratinocytes(100×). B.Keratinocyte growth curve. C. Identification of keratinocytes (100×) 图 1 绵羊角质形成细胞的培养与鉴定 Fig. 1 Culture and identification of sheep keratinocytes |
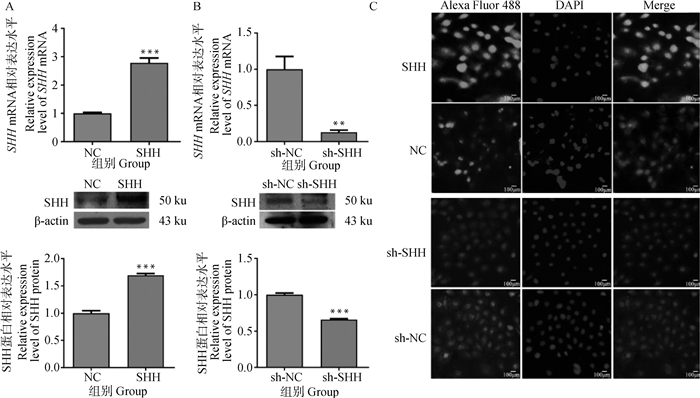
绵羊原代角质形成细胞长到70%至80%时进行转染,分别将pEGFP-N1-SHH和shRNA-SHH质粒转染绵羊角质形成细胞,通过实时荧光定量PCR,Western blot和免疫荧光来确定SHH的表达水平。实时荧光定量PCR和Western blot结果显示(图 2A、B),过表达SHH后,SHH mRNA和蛋白表达水平显著增加,是NC组的2.79和1.69倍(P < 0.001);沉默SHH后,SHH mRNA和蛋白表达水平显著降低,是sh-NC组的0.13和0.66倍(P < 0.01和P < 0.001)。细胞免疫荧光结果显示,SHH转染组的免疫阳性反应显著增强,而sh-SHH转染组免疫阳性反应显著降低(图 2C)。
|
A.过表达SHH后绵羊角质形成细胞中SHH mRNA和蛋白的相对表达量;B.沉默SHH后绵羊角质形成细胞中SHH mRNA和蛋白的相对表达量;C.过表达和沉默SHH后免疫阳性反应。数据表示为“平均值±SEM”。*.P < 0.05; **.P < 0.01;***.P<0.001,下同 A.Relative expression levels of SHH mRNA and protein in sheep keratinocytes after SHH overexpression; B. Relative expression levels of SHH mRNA and protein in sheep keratinocytes after SHH silencing; C. Immunopositive reaction after SHH overexpression and silencing. Data are expressed as "mean±SEM". *.P < 0.05;**.P < 0.01;***.P < 0.001, the same as below 图 2 过表达和沉默SHH对绵羊角质形成细胞中SHH表达水平的影响 Fig. 2 Effects of overexpression or silencing of SHH on the expression level of SHH in sheep keratinocytes |
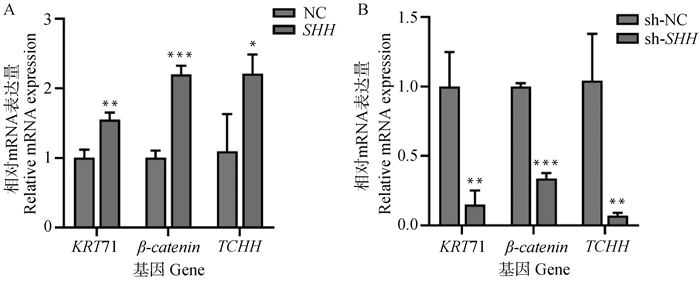
实时荧光定量PCR结果显示,在绵羊角质形成细胞中过表达SHH,显著提高了羊毛弯曲相关基因KRT71、β-catenin和TCHH的mRNA相对表达水平,KRT71、β-catenin和TCHH mRNA的相对表达量是NC组的1.55、2.2、2.02倍(P<0.01、P < 0.001、P < 0.05),差异显著(图 3A);在角质形成细胞中沉默SHH,显著降低了KRT71、β-catenin和TCHH的mRNA相对表达水平,KRT71、β-catenin和TCHH mRNA的相对表达量是sh-NC组的0.15、0.34、0.07倍(P<0.01、P < 0.001、P < 0.01),差异极显著(图 3B)。
|
A.过表达SHH对羊毛弯曲相关基因KRT71、β-catenin、TCHH的影响;B.沉默SHH对羊毛弯曲相关基因KRT71、β-catenin、TCHH的影响。数据表示为“平均值±SEM” A. Effect of overexpression of SHH on fleece fleece-related genes KRT71, β-catenin and TCHH; B. Effects of silencing of SHH on fleece fleece-related genes KRT71, β-catenin and TCHH. Data are expressed as "mean±SEM" 图 3 SHH对羊毛弯曲的影响 Fig. 3 Effect of SHH on wool bending |
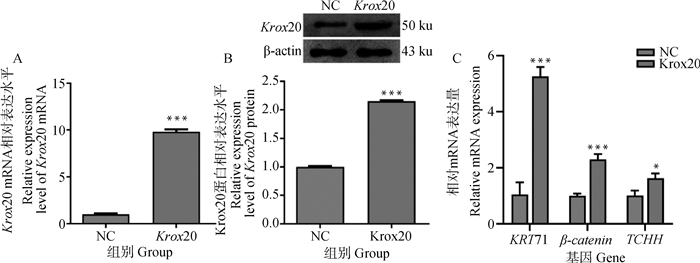
在绵羊角质形成细胞中过表达Krox20,通过实时荧光定量PCR和Western blot检测Krox20和羊毛相关基因的表达水平。实时荧光定量和Western blot结果显示,过表达Krox20的绵羊角质形成细胞中Krox20 mRNA和蛋白表达水平显著增加,是NC组的10、2.15倍(P<0.001,图 4AB)。实时荧光定量结果显示Krox20的过表达上调了这3种相关基因的mRNA表达(p < 0.05,图 4C)。
|
A.过表达Krox20转染角质形成细胞后的Krox20 mRNA表达;B.过表达Krox20转染角质形成细胞后的Krox20蛋白表达;C.过表达对羊毛弯曲相关基因KRT71、β-catenin、TCHH的影响。数据表示为“平均值±SEM” A.Krox20 mRNA expression in keratinocytes transfected with Krox20 overexpression; B. Krox20 protein expression after transfection of keratinocytes with Krox20 overexpression; C. Effect of overexpression on wool bending related genes KRT71, β-catenin and TCHH.Data are expressed as "mean±SEM" 图 4 Krox20对羊毛弯曲的影响 Fig. 4 Effect of Krox20 on wool bending |
免疫共沉淀和Western blot结果表明(图 5A),SHH与Krox20存在互相作用,形成蛋白复合体。qRT-PCR和Western blot证实了SHH正调控krox20。在角质形成细胞中过表达SHH,显著提高了Krox20的mRNA和蛋白相对表达水平(P<0.01,图 5B)。相反,沉默SHH后Krox20 mRNA和蛋白的表达降低(P<0.01,图 5C)。
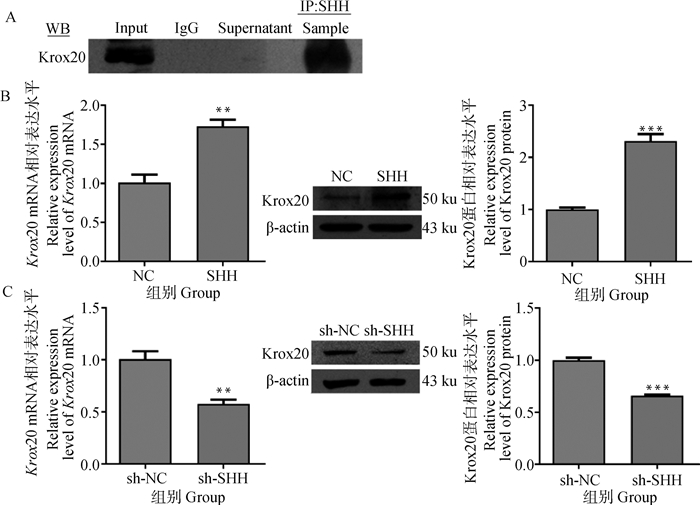
|
A.使用免疫共沉淀和Western blot验证SHH和Krox20的关系;B、C.过表达和抑制SHH后角质形成细胞中Krox20的表达。数据表示为“平均值±SEM” A. Co-immunoprecipitation and Western blot were used to verify the relationship between SHH and Krox20; B, C.Overexpression and inhibition of Krox20 expression in keratinocytes after SHH. Data are expressed as "mean± SEM" 图 5 绵羊角质形成细胞中SHH正调控Krox20 Fig. 5 SHH positively regulates Krox20 in sheep keratinocytes |
在绵羊角质形成细胞中过表达SHH后,显著提高了IGFBP5的mRNA和蛋白相对表达水平,IGFBP5 mRNA和蛋白的相对表达量是NC组的3.12,1.72倍(P<0.01,P<0.001),差异极显著(图 6A);在角质形成细胞中沉默SHH后,IGFBP5 mRNA和蛋白的相对表达量是sh-NC组的0.57,0.4倍(P<0.05和P < 0.001),差异显著(图 6B)。实时荧光定量PCR和Western blot证实了SHH正调控IGFBP5。在绵羊角质形成细胞中过表达Krox20后(图 6C),实时荧光定量PCR结果显示,与对照组相比,IGFBP5 mRNA的相对表达量显著增加了2.45倍(P < 0.01);Western blot结果显示,IGFBP5蛋白的相对表达量显著增加了2.08倍(P < 0.001)。结果表明,krox20正调控IGFBP5。
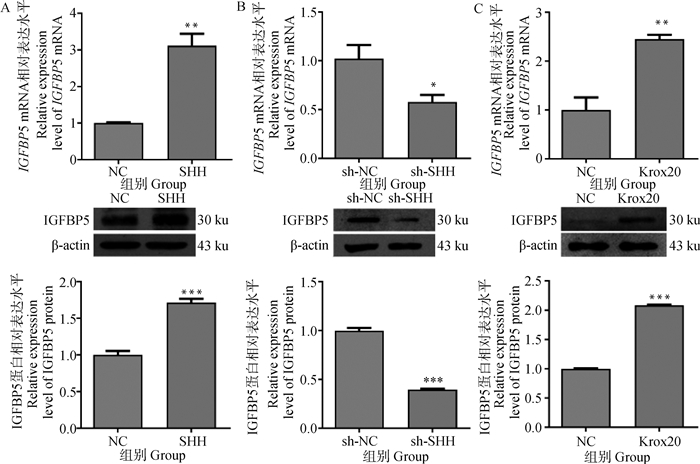
|
A.过表达SHH后角质形成细胞中IGFBP5的表达;B沉默SHH后角质形成细胞中IGFBP5的表达;C过表达Krox20后角质形成细胞中IGFBP5的表达。数据表示为“平均值±SEM” A.IGFBP5 expression in keratinocytes after SHH overexpression; B.IGFBP5 expression in keratinocytes after SHH silencing; C.IGFBP5 expression in keratinocytes after Krox20 overexpression. Data are expressed as "mean±SEM" 图 6 SHH正调控IGFBP5且Krox20正调控IGFBP5的表达 Fig. 6 SHH positively regulates IGFBP5 and Krox20 positively regulates IGFBP5 expression |
皮肤是一个动态而复杂的器官,依赖于不同细胞类型、生物大分子和信号分子之间的相互作用[1]。表皮由角质形成细胞和非角质形成细胞两部分构成,角质形成细胞占主要部分。成年绵羊的角质形成细胞在基底层增殖能力强但数量少,在其他部分角质化较高,所以体外培养的成活率较低。在胚胎50 d左右皮肤结构发育完全,70 d左右初级毛囊开始发育,附属结构齐全,次级毛囊在90 d左右开始发育,仅有皮脂腺,无汗腺和竖毛肌[23]。因此本试验选取胎羊为试验材料,利用无血清培养基成功分离培养出绵羊角质形成细胞,倒置显微镜下观察细胞形态,这与邹剑等[24]培养的猪角质形成细胞的形态类似。CK19是上皮类细胞特异性蛋白标志物,在角质层中表达,本研究通过细胞免疫荧光试验发现,CK19在细胞上呈阳性表达。绵羊角质形成细胞的生长经历了潜伏期、对数增长期和平台期,符合细胞增殖的趋势。
有研究表明,SHH在上皮组织发育中起着至关重要的作用[13]。Lim等[25]对小鼠研究中发现,SHH信号参与毛发过程,且在胚胎和成年毛发发育中也起着重要作用。对小鼠研究中发现SHH损失会选择性的使发育中的毛囊上皮角质形成细胞的增殖降低,使上皮细胞无法向下生长,小鼠的毛囊数量随之减少[15]。用抗SHH的抗体处理成年小鼠会阻断头发生长期的活动期并阻止头发再生[26-27]。本研究发现,过表达SHH的绵羊角质形成细胞中SHH的表达显著增加,免疫阳性反应显著增强。相反,沉默SHH的绵羊角质形成细胞中SHH表达显著降低,免疫阳性反应显著降低。此外,角质形成细胞的分化过程中产生角蛋白。有文献指出,KRT71与人的秃头症有关[28]。在对小鼠及大鼠的研究中发现,KRT71基因突变会导致被毛改变,形成卷曲的毛发[29-30]。牛姝等[31]研究表明,KRT71和β-catenin可能促进绵羊羊毛的弯曲。β-catenin连环蛋白已被证明对毛囊发育至关重要,毛囊的生长一般包括生长期、退行期及休止期3个时期,表皮中在缺乏β-catenin的时候,毛囊形态发生中毛发基板的形成会受到影响[32]。Medland等[33]对人的各种毛发形态进行分析,发现TCHH是影响毛发形态变化的重要基因。有文献指出,通过转录组测序对1和48月龄滩羊皮肤组织进行分析,TCHH在毛发卷曲的萨福克羊中高表达[34]。还有文献发现,随着绵羊的生长,次级毛囊随着自身机能的不断健全,其生长周期和复杂的结构影响羊毛的生长发育和羊毛品质,羊毛次级毛囊中TCHH的不对称表达与毛囊弯曲有关[35]。本研究发现,过表达SHH后,羊毛弯曲相关基因KRT71、β-catenin、TCHH mRNA的相对表达量显著升高;沉默SHH后,KRT71、β-catenin、TCHH mRNA的相对表达量显著降低,这一结果表明SHH会影响羊毛弯曲。
路立里等[8]和Schmidt-Ullrich等[36]在对动物毛发弯曲形成机理进行阐述时推测,在小鼠皮肤毛囊中SHH的不对称表达与Krox20/IGFBP5引起锯齿状毛发弯曲的形成密切相关,但是详细的调控机理尚不清楚。Krox20对3种C2H2型锌指转录因子进行编码,诱导立早基因[37],具有转录激活作用,对于软骨的内骨化和神经系统的发育是必要的[38-39]。IGFBP5是一个保守且关键的IGFBP家族成员,主要介导细胞生长,抑制或诱导细胞增殖,并且涉及卵巢、骨和乳腺等方面,也与毛发的发育和分化有关,调节毛干结构和毛囊形态,并被确定为毛发弯曲的第一标记分子[40]。本试验在绵羊角质形成细胞过表达Krox20,发现绵羊角质形成细胞中Krox20的表达显著增加,免疫阳性反应显著增强。实时荧光定量PCR试验发现过表达Krox20后,羊毛弯曲相关基因KRT71、β-catenin、TCHH mRNA的相对表达量显著升高,这一结果表明Krox20会影响羊毛弯曲。进一步研究表明SHH与Krox20存在相互作用,且过表达SHH后,Krox20相对表达量显著升高;沉默SHH后则降低,提示在绵羊角质形成细胞中SHH正调控Krox20。有文献对美利奴羊和小尾寒羊背部皮肤进行研究,发现美利奴羊的IGFBP5表达量高于小尾寒羊且差异极显著,分析认为IGFBP5是羊毛弯曲的标记基因[41]。分析发现过表达SHH后,IGFBP5相对表达量显著升高;沉默SHH后则降低,提示在绵羊角质形成细胞中SHH正调控IGFBP5。有研究表明,在小鼠毛囊中IGFBP5单独表达时不会产生弯曲,在Krox20的调控下弯曲才会发生[36]。吴晋强[21]分析认为,在绵羊成纤维细胞中Krox20正向调控下游基因IGFBP5,且对羊毛弯曲的形成有一定的促进作用。本研究表明,在绵羊角质形成细胞过表达Krox20后,IGFBP5的相对表达量显著升高,提示绵羊角质形成细胞中Krox20正调控IGFBP5。这些结果表明SHH可能通过Krox20调控IGFBP5来影响羊毛弯曲。当然,SHH通过Krox20调控IGFBP5来影响羊毛弯曲的机制的确定,尚需试验进一步证明。
4 结论本研究体外分离培养了绵羊角质形成细胞且标志物鉴定成功;SHH对羊毛弯曲形成有作用;且SHH可能通过Krox20正调控IGFBP5而促进羊毛弯曲。
| [1] |
FERRONI L, BELLIN G, EMER V, et al. Treatment by Therapeutic Magnetic Resonance (TMRTM) increases fibroblastic activity and keratinocyte differentiation in an in vitro model of 3D artificial skin[J]. J Tissue Eng Regen Med, 2017, 11(5): 1332-1342. DOI:10.1002/term.2031 |
| [2] |
NISSIMOV J N, DAS CHAUDHURI A B. Hair curvature: A natural dialectic and review[J]. Biol Rev, 2014, 89(3): 723-766. DOI:10.1111/brv.12081 |
| [3] |
刘公言, 白莉雅, 李福昌, 等. 毛囊发育与周期性生长的调控信号通路研究进展[J]. 畜牧与兽医, 2021, 53(1): 125-129. LIU G Y, BAI L Y, LI F C, et al. Progress in research on the regulatory signaling pathway of hair follicle development and periodic growth[J]. Animal Husbandry & Veterinary Medicine, 2021, 53(1): 125-129. (in Chinese) |
| [4] |
LI X B, LIU Z F, YE S H, et al. Integrated analysis of lncRNA and mRNA reveals novel insights into wool bending in zhongwei goat[J]. Animals (Basel), 2021, 11(11): 3326. |
| [5] |
YANG P, LU P, LUO J L, et al. Transient stimulation of TRPV4-expressing keratinocytes promotes hair follicle regeneration in mice[J]. Br J Pharmacol, 2020, 177(18): 4181-4192. DOI:10.1111/bph.15161 |
| [6] |
陈教全, 梁碧华, 李华平, 等. 角质层结构及功能的研究进展[J]. 皮肤性病诊疗学杂志, 2020, 27(1): 53-56. CHEN J Q, LIANG B H, LI H P, et al. The research progress in the stratum corneum structure and function[J]. Journal of Diagnosis and Therapy on Dermato-Venereology, 2020, 27(1): 53-56. DOI:10.3969/j.issn.1674-8468.2020.01.016 (in Chinese) |
| [7] |
LI F W, ADASE C A, ZHANG L J. Isolation and culture of primary mouse keratinocytes from neonatal and adult mouse skin[J]. J Vis Exp, 2017(125): 56027. |
| [8] |
路立里, 狄江, 王琼, 等. 羊毛及动物毛发弯曲形成的生物学机理研究进展[J]. 畜牧兽医学报, 2014, 45(5): 679-685. LU L L, DI J, WANG Q, et al. Research advances on the biological formation Mechanism of wool and hair crimps[J]. Acta Veterinaria et Zootechnica Sinica, 2014, 45(5): 679-685. (in Chinese) |
| [9] |
NAY T, JOHNSON H. Follicle curvature and crimp size in some selected Australian Merino groups[J]. Aust J Agr Res, 1967, 18(5): 833-840. DOI:10.1071/AR9670833 |
| [10] |
丁洋洋, 刘占发, 孟详人, 等. 羊毛弯曲及毛囊发育相关生物学机制研究进展[J]. 畜牧兽医学报, 2020, 51(1): 9-17. DING Y Y, LIU Z F, MENG X R, et al. Research progress on biological mechanisms related to wool bending and hair follicle development[J]. Acta Veterinaria et Zootechnica Sinica, 2020, 51(1): 9-17. (in Chinese) |
| [11] |
李晓波, 刘占发, 刘悦, 等. 基于WGCNA与GSEA方法挖掘调控中卫山羊羊毛弯曲相关基因[J]. 畜牧兽医学报, 2022, 53(9): 2930-2943. LI X B, LIU Z F, LIU Y, et al. Mining genes related to wool bending of Zhongwei goat based on WGCNA and GSEA[J]. Acta Veterinaria et Zootechnica Sinica, 2022, 53(9): 2930-2943. (in Chinese) |
| [12] |
LU C P, POLAK L, KEYES B E, et al. Spatiotemporal antagonism in mesenchymal-epithelial signaling in sweat versus hair fate decision[J]. Science, 2016, 354(6319): aah6102. DOI:10.1126/science.aah6102 |
| [13] |
TOMANN P, PAUS R, MILLAR S E, et al. Lhx2 is a direct NF-κB target gene that promotes primary hair follicle placode down-growth[J]. Development, 2016, 143(9): 1512-1522. |
| [14] |
RISHIKAYSH P, DEV K, DIAZ D, et al. Signaling involved in hair follicle morphogenesis and development[J]. Int J Mol Sci, 2014, 15(1): 1647-1670. DOI:10.3390/ijms15011647 |
| [15] |
ABE Y, TANAKA N. Roles of the hedgehog signaling pathway in epidermal and hair follicle development, homeostasis, and cancer[J]. J Dev Biol, 2017, 5(4): 12. DOI:10.3390/jdb5040012 |
| [16] |
ST-JACQUES B, DASSULE H R, KARAVANOVA I, et al. Sonic hedgehog signaling is essential for hair development[J]. Curr Biol, 1998, 8(19): 1058-1069. DOI:10.1016/S0960-9822(98)70443-9 |
| [17] |
VELTRI A, LANG C, LIEN W H. Concise review: Wnt signaling pathways in skin development and epidermal stem cells[J]. Stem Cells, 2018, 36(1): 22-35. DOI:10.1002/stem.2723 |
| [18] |
ZHENG L, RUI C, ZHANG H, et al. Sonic hedgehog signaling in epithelial tissue development[J]. Regen Med Res, 2019, 7: 3. DOI:10.1051/rmr/190004 |
| [19] |
卢光. 牦牛胚胎裙毛毛囊形态发生及其β-catenin和Sonic hedgehog的表达规律[D]. 杨凌: 西北农林科技大学, 2010. LU G. Morphogenesis of macrotrichium and expression pattern of β-catenin and Sonic hedgehog in Bos grunniens embryos[D]. Yangling: Northwest A & F University, 2010. (in Chinese) |
| [20] |
董亚洁, 吴佳豪, 张鹏翔, 等. SHH在美利奴羊与小尾寒羊背部皮肤表达差异的研究[J]. 畜牧与兽医, 2022, 54(2): 85-90. DONG Y J, WU J H, ZHANG P X, et al. Differences in SHH expression in the back skin of Merino sheep and Small-tail Han sheep[J]. Animal Husbandry & Veterinary Medicine, 2022, 54(2): 85-90. (in Chinese) |
| [21] |
吴晋强. Krox20与羊毛弯曲性状的相关性分析[D]. 晋中: 山西农业大学, 2019. WU J Q. Correlation analysis between Krox20 and wool bending traits[D]. Jinzhong: Shanxi Agricultural University, 2019. (in Chinese) |
| [22] |
WANG X J, SU H M, LIANG Y, et al. Stable transfection and identification of a hair follicle-specific expression vector of IGFBP-5 in goat fetal fibroblasts[J]. Genet Mol Res, 2014, 13(1): 1885-1892. DOI:10.4238/2014.March.17.16 |
| [23] |
冯梦雨, 姬凯茜, 伍修锟, 等. 羊毛性状相关蛋白、信号分子及基因的研究进展[J]. 中国畜牧杂志, 2022, 58(10): 114-124. FENG M Y, JI K X, WU X K, et al. Research progresses of the related proteins, signal molecules and genes to wool traits[J]. Chinese Journal of Animal Science, 2022, 58(10): 114-124. (in Chinese) |
| [24] |
邹剑, 张长青, 曾炳芳. 复合角化细胞人工皮肤的实验研究——小香猪角化细胞库的构建[J]. 组织工程与重建外科杂志, 2008, 4(2): 85-88. ZOU J, ZHANG C Q, ZENG B F. The experimental study of artificial skin combined with keratinocytes: keratinocytes bank reconstruction of pig[J]. Journal of Tissue Engineering and Reconstructive Surgery, 2008, 4(2): 85-88. (in Chinese) |
| [25] |
LIM C H, SUN Q, RATTI K, et al. Hedgehog stimulates hair follicle neogenesis by creating inductive dermis during murine skin wound healing[J]. Nat Commun, 2018, 9(1): 4903. |
| [26] |
WANG L C, LIU Z Y, SHAPIRO R, et al. Conditional disruption of hedgehog signaling pathway defines its critical role in hair development and regeneration[J]. J Invest Dermatol, 2000, 114(5): 901-908. |
| [27] |
YANG M, WENG T T, ZHANG W, et al. The roles of non-coding RNA in the development and regeneration of hair follicles: current status and further perspectives[J]. Front Cell Dev Biol, 2021, 9: 720879. |
| [28] |
FUJIMOTO A, FAROOQ M, FUJIKAWA H, et al. A missense mutation within the helix initiation motif of the Keratin K71 gene underlies autosomal dominant woolly hair/hypotrichosis[J]. J Invest Dermatol, 2012, 132(10): 2342-2349. |
| [29] |
KIKKAWA Y, OYAMA A, ISHII R, et al. A small deletion hotspot in the type Ⅱ keratin gene mK6irs1/Krt2-6g on mouse chromosome 15, a candidate for causing the wavy hair of the caracul (Ca) mutation[J]. Genetics, 2003, 165(2): 721-733. |
| [30] |
KURAMOTO T, HIRANO R, KUWAMURA M, et al. Identification of the rat Rex mutation as a 7-bp deletion at splicing acceptor site of the Krt71 gene[J]. J Vet Med Sci, 2010, 72(7): 909-912. |
| [31] |
牛姝, 李淑敏, 何清, 等. 毛发弯曲度相关蛋白KRT71和β-catenin在绵羊毛囊的定位表达[J]. 中国兽医科学, 2017, 47(5): 660-663. NIU S, LI S M, HE Q, et al. Expression and localization of KRT71 and β-catenin in sheep hair follicle[J]. Chinese Veterinary Science, 2017, 47(5): 660-663. (in Chinese) |
| [32] |
ZHANG Y, YU J, SHI C Y, et al. Regulatory effect of β-catenin on proliferation of hair follicle stem cells involves PI3K/Akt pathway[J]. J Appl Biomed, 2013, 11(3): 131-141. |
| [33] |
MEDLAND S E, NYHOLT D R, PAINTER J N, et al. Common variants in the trichohyalin gene are associated with straight hair in Europeans[J]. Am J Hum Genet, 2009, 85(5): 750-755. |
| [34] |
KANG X L, LIU G, LIU Y F, et al. Transcriptome profile at different physiological stages reveals potential mode for curly fleece in Chinese Tan sheep[J]. PLoS One, 2013, 8(8): e71763. |
| [35] |
YU Z D, GORDON S W, NIXON A J, et al. Expression patterns of keratin intermediate filament and keratin associated protein genes in wool follicles[J]. Differentiation, 2009, 77(3): 307-316. |
| [36] |
SCHMIDT-ULLRICH R, TOBIN D J, LENHARD D, et al. NF-κB transmits Eda A1/EdaR signalling to activate Shh and cyclin D1 expression, and controls post-initiation hair placode down growth[J]. Development, 2006, 133(6): 1045-1057. |
| [37] |
SCHLAKE T. Krox20, a novel candidate for the regulatory hierarchy that controls hair shaft bending[J]. Mech Dev, 2006, 123(8): 641-648. |
| [38] |
QUINTES S, BRINKMANN B G, EBERT M, et al. Zeb2 is essential for Schwann cell differentiation, myelination and nerve repair[J]. Nat Neurosc, 2016, 19(8): 1050-1059. |
| [39] |
SABAG E, HALPERIN E, LIRON T, et al. Hormone-independent sexual dimorphism in the regulation of bone resorption by Krox20[J]. J Bone Miner Res, 2019, 34(12): 2277-2286. |
| [40] |
SCHLAKE T. Segmental Igfbp5 expression is specifically associated with the bent structure of zigzag hairs[J]. Mech Dev, 2005, 122(9): 988-997. |
| [41] |
陆娜. DKK1与羊毛弯曲性状的相关性分析[D]. 晋中: 山西农业大学, 2019. LU N. Correlation analysis between DKK1 and wool bending character[D]. Jinzhong: Shanxi Agricultural University, 2019. (in Chinese) |
(编辑 孟培)



