2. 广西壮族自治区兽用生物制品工程研究中心,南宁 530004;
3. 广西畜禽繁育与疾病防控重点实验室,南宁 530004
2. Guangxi Zhuang Autonomous Region Engineering Research Center of Veterinary Biologics, Nanning 530004, China;
3. Guangxi Key Laboratory of Animal Breeding, Disease Control and Prevention, Nanning 530004, China
病毒突破固有免疫防御后,以B、T淋巴细胞为代表的适应性免疫应答会被迅速激活,产生大量的抗体和效应T淋巴细胞,共同抵抗和消灭入侵的病原。启动细胞免疫需要细胞毒性T淋巴细胞(cytotoxic T lymphocyte,CTL)识别感染细胞表面的抗原特异性MHC-Ⅰ分子(major histocompatibility complex class Ⅰ,主要组织相容性复合物Ⅰ类)[1]。MHC-Ⅰ介导的抗原递呈途径不仅存在于抗原递呈细胞(antigen presenting cell,APC),其它有核的细胞类型也能表达MHC-Ⅰ分子[2]。细胞表面的MHC-Ⅰ分子是由多态性的α重链(heavy chain)和β2-微球蛋白(β2-microglobulin)组成的二聚体,抗原肽在胞内经过多个阶段被MHC-Ⅰ分子递呈到细胞表面[2]。首先,泛素化的内源性抗原被细胞核或胞质中的蛋白酶体加工,裂解形成长度为8~11个氨基酸的短肽,通过抗原加工相关转运体(transporter associated with antigen processing,TAP)转运进入内质网。随后,多肽装载复合物(peptide loading complex,PLC)将抗原肽转移至MHC-Ⅰ分子的肽结合槽内。在内质网完成组装后,携带抗原肽的MHC-Ⅰ分子迁移至高尔基体发生糖基化并进行分选。最终,含MHC-Ⅰ分子的囊泡与细胞膜发生融合,将携带抗原肽的MHC-Ⅰ分子呈现在细胞表面[1-2]。当遇到被病毒感染的细胞并识别其表面异常的MHC-Ⅰ分子后,CTL释放的膜穿孔蛋白(perforin)和颗粒酶B(granzyme B)诱导靶细胞凋亡,从而摧毁病毒持续复制所依赖的宿主细胞[1]。然而,在与宿主长期共进化的斗争中,病毒获得了干扰MHC-Ⅰ抗原递呈途径的能力,通过多个关键节点抑制感染细胞表面MHC-Ⅰ分子的表达水平,避免被CTL识别和清除[3]。
疱疹病毒(Herpesviridae)是公认的免疫逃避“高手”,在与宿主长期共进化过程中形成了多种免疫逃避策略,其中最为突出的是干扰MHC-Ⅰ分子抗原递呈[1]。疱疹病毒是大型双链DNA病毒,其基因组在细胞核内复制,长度为125~240 kb,可感染人类和其他脊椎动物、部分软体动物[4-5]。根据基因组结构和病原学特点,可分为α、β和γ三个疱疹病毒亚科(Herpesvirinae)[5]。α亚科病毒DNA基因组较小,复制时间短,主要感染黏膜和上皮细胞;β亚科病毒DNA基因组较大,宿主范围窄,复制时间较长,可形成巨大的融合细胞;γ亚科病毒以感染淋巴细胞、诱发肿瘤为特征[5]。为了维持长期存活,入侵的疱疹病毒与宿主之间发生复杂的相互作用,在不同感染阶段产生多种蛋白或非编码RNA,这些分子不管是病毒还是宿主来源都能调节或干扰免疫系统[1, 6]。在细胞核内,病毒基因组以附着体(episome)的形式结合在染色质上[6],或整合入染色体端粒[7],以维持潜伏感染状态(latency)。当宿主免疫力低下或受外界应激条件刺激后,沉默的病毒基因组可被再次激活,产生的病毒粒子引起新一轮溶细胞感染(cytolytic infection)[6]。周而复始的发作,不仅严重影响患病畜禽的健康和生产性能,还会出现无规律的排毒,对周围环境中的幼龄或免疫力差的动物构成威胁。
在众多动物疱疹病毒中,α亚科疱疹病毒对畜禽生产的危害最为严重[8-11],例如马立克病病毒(Marek′s disease virus,MDV)、伪狂犬病病毒(pseudorabies virus,PRV)、牛疱疹病毒Ⅰ型(bovine herpesvirus type 1,BHV-1)和马疱疹病毒Ⅰ型(equine herpesvirus type 1,EHV-1)等。尽管针对这些畜禽疱疹病毒病的传统疫苗已问世数十年,但不论减毒活疫苗还是灭活疫苗都存在一个共同缺陷,即只能提供部分保护控制临床发病,而不能完全阻止免疫动物被感染和排毒。在免疫选择压的作用下,大范围长期应用这类不完美的疫苗会导致疱疹病毒重组变异株的出现[12],给疫病净化工作带来新的挑战。
本文聚焦畜禽疱疹病毒蛋白干扰细胞MHC-Ⅰ抗原递呈途径的最新研究进展,从抑制TAP转运抗原肽、促进细胞表面MHC-Ⅰ内吞降解、抑制MHC-Ⅰ mRNA表达等方面,系统阐述畜禽疱疹病毒下调MHC-Ⅰ的分子机制。通过分析比较同源蛋白的保守性、结构和功能差异,加深对动物疱疹病毒逃避适应性免疫的认识,为寻找有效的抗病毒靶点、优化动物疱疹病毒疫苗设计和开发提供新的视角。
1 抑制TAP转运抗原肽TAP是一种由TAP1和TAP2蛋白通过非共价结合形成的异二聚体,属于ATP结合盒(ATP binding cassette,ABC)转运蛋白超家族B类,其功能是将蛋白酶体加工过的抗原肽转运至内质网腔,使之与MHC-Ⅰ分子结合[13]。TAP转运抗原肽分为两个主要步骤:首先,位于胞质的抗原肽与TAP发生特异性结合;然后,TAP的构象变化增强ATP(adenosine triphosphate,三磷酸腺苷)的结合,使TAP保持开放状态,促进抗原肽进入内质网[14]。因此,任何一步受阻均可影响MHC-Ⅰ分子的抗原递呈。
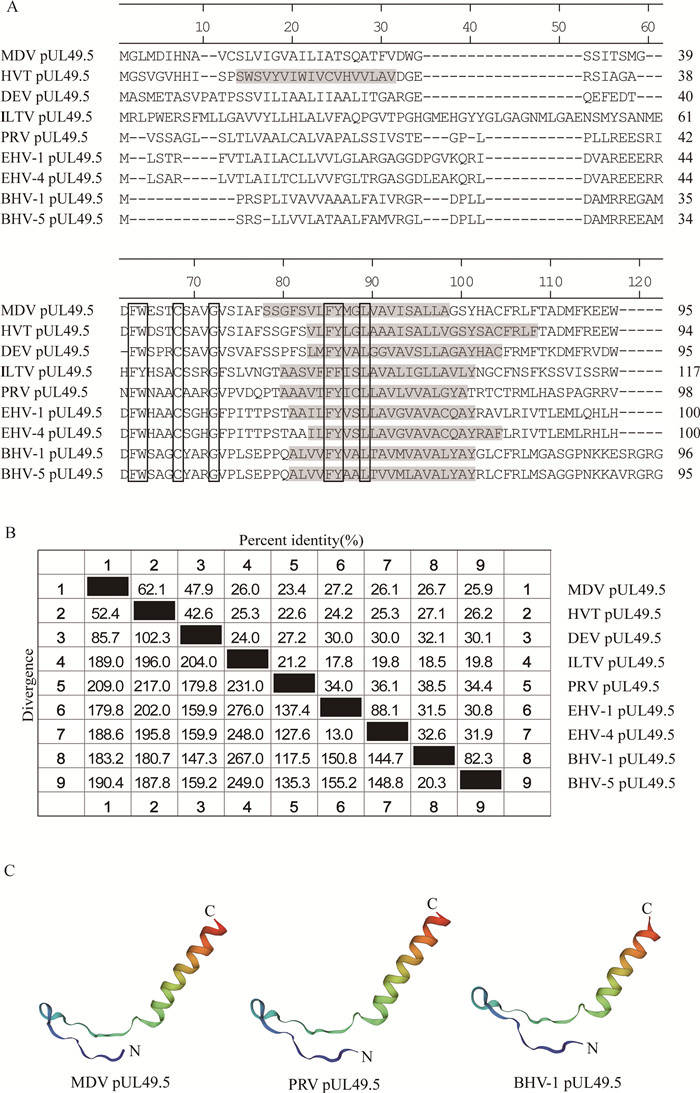
1.1 pUL49.5UL49.5基因在整个α亚科疱疹病毒家族中相当保守,编码Ⅰ型跨膜蛋白pUL49.5,因其N端被糖基化故称为糖蛋白N(glycoprotein N, gN)[15],pUL49.5蛋白在N端有一段亲水性区域,中间有一个跨膜区,C末端为胞质区尾部(图 1A)。不同病毒的pUL49.5氨基酸序列相似度为17.8%~88.1%,亲缘关系近的病毒保守性较高(图 1B)。在结构上,家禽和哺乳动物疱疹病毒的pUL49.5非常保守,跨膜区是一个明显的α螺旋(图 1C)。pUL49.5与糖蛋白M(glycoprotein M, gM)形成异二聚体复合物,参与病毒粒子的成熟和细胞间传播[16-18]。在MDV和部分水痘病毒属(Varicellovirus)成员中,pUL49.5是第一个被证明能抑制细胞表面MHC-Ⅰ分子表达的病毒蛋白[19-20]。
|
A. pUL49.5氨基酸序列多重比对;B. pUL49.5保守性的比较;C. MDV、PRV和BHV-1 pUL49.5结构的同源建模。“□”表示保守的氨基酸位点,灰色阴影区域为跨膜域 A. Multiple amino acid sequence alignment of pUL49.5 homologues; B. Identity comparison between pUL49.5 homologues; C. Homology modeling of MDV, PRV, and BHV-1 pUL49.5 structures. "□" indicates the conserved amino acid residues, and the gray shadow highlights the transmembrane domain 图 1 pUL49.5蛋白的保守性及结构特征 Fig. 1 Conservation and structural characteristics of pUL49.5 homologues |
MDV pUL49.5的胞质区尾部在下调细胞表面MHC-Ⅰ分子的过程中发挥关键作用。Jarosinski等[21]发现鸡B细胞系(RP9)表达完整的pUL49.5后表面MHC-Ⅰ分子水平显著下降,但缺失pUL49.5胞质区尾部的病毒突变体和过表达载体都不能引起表面MHC-Ⅰ分子表达降低。另外,在人黑色素瘤细胞系(MJS)[15]、鸡成纤维细胞系(DF1)和鸡肝癌细胞系(LMH)单独表达pUL49.5后,MHC-Ⅰ分子水平没有发生明显变化[22],表明在某些细胞条件下MDV pUL49.5可能需要其它病毒蛋白辅助,才能抑制细胞表面MHC-Ⅰ分子。
EHV-1和EHV-4的pUL49.5作用机制相同,都是通过抑制ATP与TAP结合,阻断抗原肽转运进入内质网[23]。根据pUL49.5蛋白的保守结构,有学者推测其细胞质尾部可能存在影响ATP与TAP结合的关键氨基酸位点[23]。然而,试验结果显示切除pUL49.5细胞质尾部后,EHV-1病毒突变体仍干扰ATP与TAP的结合[23],提示pUL49.5的其它部分也发挥抑制作用。
PRV pUL49.5通过干扰TAP介导的抗原肽转运,抑制MHC-Ⅰ分子的抗原递呈[23]。感染PRV野毒后,猪肾细胞系(PK-15)表面MHC-Ⅰ分子的表达量明显下降;而感染缺失UL49.5的病毒突变体后,表面MHC-Ⅰ分子水平出现部分恢复[24],提示pUL49.5并非是下调MHC-Ⅰ分子的唯一因素,可能存在其它病毒蛋白共同参与此过程。另外,无论是野毒还是突变体感染猪睾丸细胞系(ST)和原代肺泡巨噬细胞(PAM)后,均未观察到MHC-Ⅰ分子下调的现象[24],表明PRV pUL49.5引起的表面MHC-Ⅰ分子下调具有细胞依赖性。
BHV-1 pUL49.5也能特异地抑制TAP对抗原肽的转运,但该过程受病毒糖蛋白gM的负调控。在共表达pUL49.5和gM的细胞中,pUL49.5的产生早于gM,此时TAP的降解抑制了抗原肽的转运。随着gM表达量逐渐增加,在后期两者表达水平趋于一致时,pUL49.5对TAP的降解和抑制作用显著降低,细胞表面MHC-Ⅰ分子的表达水平明显恢复[18]。这是由于pUL49.5跨膜域和gM发生相互作用,为gM成熟提供关键位点,pUL49.5-gM复合物的形成及在胞内的扩散减缓了pUL49.5对TAP的抑制作用[18]。BHV-5 pUL49.5的作用机制也是类似[15]。
虽然不同病毒pUL49.5氨基酸序列总体差异较大,但在N端和跨膜区仍存在多个相同的氨基酸位点(图 1A),特别是N端的苯丙氨酸(F)、色氨酸(W)和半光氨酸(C),它们是否直接决定MHC-Ⅰ表达的下调仍需进一步研究。与其它病毒相比,火鸡疱疹病毒(herpesvirus of turkey,HVT)pUL49.5的N端还有一个另外的跨膜域(图 1A),这种结构上的差异是否意味着HVT pUL49.5的功能有所不同,值得研究。以HVT为载体的商品化疫苗已在家禽生产中广泛应用[25],但仍需要试验证明HVT pUL49.5是否影响MHC-Ⅰ表达。在此基础上,缺失UL49.5基因或将其作为外源基因插入位点,可以更好地开发和利用HVT。
1.2 PRV gD和US3PRV基因组编码的囊膜糖蛋白D(glycoprotein D, gD)识别宿主细胞受体nectin-1,两者结合诱导细胞膜发生融合,是PRV入侵靶细胞的关键糖蛋白之一[26]。马宁宁[27]结合生物信息学分析工具,证实gD能引起PK-15细胞表面MHC-Ⅰ分子下调,通过ATP-琼脂糖珠凝胶试验发现gD能阻止ATP与TAP1结合,抑制抗原肽向内质网转运。
US3基因位于PRV基因组独特短区,在α疱疹病毒中高度保守,属于复制非必需基因,其编码产物US3蛋白是一种丝氨酸/苏氨酸蛋白激酶。US3能使病毒或宿主靶蛋白发生磷酸化,从而影响病毒基因表达和病毒粒子的形态发生,改变细胞骨架并协助病毒逃避Ⅰ型干扰素(type Ⅰ interferon,IFN-Ⅰ)介导的固有免疫[28]。在调节适应性免疫应答方面,Deruelle等[24]发现PRV US3在其蛋白激酶活性作用下,降低感染的ST细胞表面MHC-Ⅰ分子表达。然而,这种下调过程具有明显的细胞类型依赖性,且过表达US3蛋白不会影响PK-15和PAM细胞表面MHC-Ⅰ分子的稳定,提示存在其它病毒蛋白或细胞成分参与PRV US3介导的MHC-Ⅰ分子下调。
需要指出的是,US3只能引起细胞表面MHC-Ⅰ分子下调,而并不影响MHC-Ⅰ蛋白的表达总量[24]。虽然US3的蛋白激酶活性在此过程中发挥重要作用,但具体机制尚不明确,有可能是通过引起TAP或MHC-Ⅰ分子的异常磷酸化,阻止抗原肽转运至细胞表面。此外,维持细胞膜受体的稳定性需要依赖于ZAP-70/Syk和PI-3K激酶复合物的形成,也不排除US3可能干扰该复合物的正常功能。
1.3 MDV012MDV012是禽类疱疹病毒独有的基因,也是动物疱疹病毒中少数存在内含子的基因。MDV012基因的两个外显子之间有一个83 bp的内含子间隔[22],产生的剪接转录本编码一种磷酸化蛋白,可穿梭于细胞核与胞质,对病毒的增殖至关重要[22, 29]。
全长的MDV012和无内含子的MDV012s相比,后者抑制MHC-Ⅰ分子表达的效果更明显[22]。R10V肽段(REVDEQLLSV)能与鸡B21单倍型MHC-Ⅰ分子结合[30]。在表达MDV012s后,如果R10V肽段滞留在内质网,则DF1细胞表面MHC-Ⅰ分子不会出现下调。相反,当R10V与泛素融合表达进入胞质后,MDV012s仍然能抑制表面MHC-Ⅰ分子表达,这说明MDV012通过阻断TAP转运抗原多肽,干扰MHC-Ⅰ分子向表面运输[22]。
MDV012同源蛋白也存在于α疱疹病毒亚科、Mardivirus属的其它成员,如鸡疱疹病毒3型(Gallid alphaherpesvirus 3,GaHV-3)、HVT和鸭肠炎病毒(duck enteritis virus,DEV)[22],它们的N端氨基酸序列高度相似,推测家禽疱疹病毒的MDV012功能可能比较保守。
2 促进细胞表面MHC-Ⅰ内吞降解在正常条件下,到达细胞表面的MHC-Ⅰ分子并非静止不变,那些与抗原肽结合不够强的MHC-Ⅰ分子被内吞后再循环回到细胞表面,确保有新的更稳定的MHC-Ⅰ分子不断补充,维持总量动态平衡[31]。MHC-Ⅰ分子被细胞内吞主要通过依赖网格蛋白(clathrin)或发动蛋白(dynamin)的方式,但也存在其它途径[32]。然而,疱疹病毒利用宿主细胞内吞机制的缺陷,促使大量表面MHC-Ⅰ分子进入内体(endosome),并最终在溶酶体(lysosome)发生降解。
2.1 pUL56UL56基因为α亚科疱疹病毒所特有,其编码产物pUL56是一种Ⅱ型跨膜蛋白[33],由N端长亲水区、C端跨膜区及胞质区构成。N端有1~4个数量不等的PPxY(Pro-Pro-x-Tyr,x为任意氨基酸)基序,PPxY基序和跨膜域共同决定pUL56的细胞定位[34],胞质区很短, 只有几个氨基酸构成,具体功能尚不清楚。缺失UL56基因不会影响病毒在培养细胞中的增殖,但会减弱病毒对宿主的致病力[35-36],如神经入侵性降低[37]、排毒量减少等[38]。EHV-1和EHV-4的ORF1基因与UL56基因同源,两者编码的pUL56蛋白都能引起感染细胞表面MHC-Ⅰ分子下调[39-40]。pUL56通过依赖Dynamin介导的内吞途径促进细胞表面MHC-Ⅰ分子下调并被溶酶体降解,该过程与泛素化修饰密切相关[41]。虽然pUL56自身不被泛素化和降解,但作为接头蛋白pUL56可以促进宿主神经前体细胞表达发育下调蛋白4(neural precursor cell expressed developmentally down-regulated protein 4, Nedd4)发生泛素化[42],导致其在蛋白酶体(proteasome)内发生降解,目前尚不清楚Nedd4是否帮助pUL56加速MHC-Ⅰ分子的内吞和降解,或还有其它囊泡转运相关蛋白共同发挥作用。此外,EHV-1 pUL56不仅针对MHC-Ⅰ,还能引起其它免疫相关分子下调,如CD46和CD63[41],提示pUL56可能具有广泛的免疫调节能力。
最新研究发现,PRV pUL56靶向下调细胞内MHC-Ⅰ分子重链。Zhao等[36]利用CRISPR/Cas9技术敲除PRV UL56基因获得病毒突变体PRV-ΔUL56。与亲本毒株和回复突变体相比,感染PRV-ΔUL56的PK-15细胞内MHC-Ⅰ分子重链表达水平明显上升[36]。与EHV-1 pUL56类似,PRV pUL56的PPxY基序在下调MHC-Ⅰ分子重链的过程中发挥关键作用,并与溶酶体途径降解有关[36]。上述哺乳动物疱疹病毒的例子表明,pUL56的功能和作用机制相当保守,都是通过内吞途径和诱导MHC-Ⅰ分子发生异常泛素化,干扰MHC-Ⅰ分子对抗原肽的有效递呈。
不同于哺乳动物疱疹病毒,MDV作为禽类疱疹病毒的代表,其pUL56是否引起细胞表面MHC-Ⅰ分子下调未见报道。MDV pUL56与鸡Nedd4没有直接相互作用,也不会导致其降解[34],提示MDV和哺乳动物疱疹病毒的pUL56功能可能有差异。近期,张金城等[43]将带有荧光蛋白标记的MDV pUL56表达质粒转染DF1细胞,经流式分选后用于mRNA转录组测序,基因富集分析发现pUL56显著上调Ⅰ型干扰素信号通路相关基因的表达;相反,促进抗原递呈和B细胞活化的磷脂酰肌醇3-激酶(PI3K)基因表达则显著下调,提示pUL56可能精准干预先天性免疫和适应性免疫,以促进MDV在宿主的潜伏感染。
2.2 pUL43UL43基因在α、γ亚科疱疹病毒中高度保守,其编码的蛋白产物pUL43属Ⅲ型多次跨膜蛋白,有9~11个跨膜域,集中分布在N端和C端,具有极强的疏水性,但在中间有一段长80~100个氨基酸的亲水环[44]。在部分疱疹病毒, 如单纯疱疹病毒1型(herpes simplex virus type 1,HSV-1)和PRV中,pUL43蛋白可参与囊泡运输并抑制细胞膜融合[44-45]。考虑到可能存在未知病毒蛋白干扰MHC-Ⅰ通路,有研究人员通过筛选EHV-1单基因缺失突变体库,发现pUL43能下调细胞表面MHC-Ⅰ水平,且N端亲水段在此过程中发挥重要作用[46]。在感染后期,pUL43在溶酶体内降解[46],恰好与MHC-Ⅰ降解的时间和场所吻合。有意思的是,pUL43本身并不能引起表面MHC-Ⅰ分子表达下降,需要pUL56协同才能限制MHC-Ⅰ分子在细胞表面停留[46]。
与哺乳动物疱疹病毒不同,MDV pUL43的表达出现在感染晚期[47],且单独表达pUL43就能降低鸡DF1细胞表面MHC-Ⅰ分子水平[48],此过程依赖于蛋白酶体和溶酶体途径。MDV pUL43定位于高尔基体,只删除N端或C端跨膜域不影响其定位和下调MHC-Ⅰ分子的功能[48],推测其它区域如N端短亲水区或中间亲水环,可能发挥重要作用。总之,畜禽疱疹病毒pUL43的作用机制还有待深入研究,首先要解决的问题是pUL43与MHC-Ⅰ是否存在共定位并发生直接相互作用,同时还应探究在pUL43表达时MHC-Ⅰ可能发生的蛋白翻译后修饰,如磷酸化、泛素化等。
3 抑制胞内MHC-Ⅰ的mRNA产生MHC-Ⅰ分子的表达广泛存在于畜禽动物有核细胞[49]。在疱疹病毒入侵的早期阶段,固有免疫系统的激活会产生大量IFN-Ⅰ[50]。在IFN-Ⅰ及其下游效应分子的作用下,MHC-Ⅰ基因的mRNA表达明显上调,为适应性免疫特别是细胞免疫的启动作准备[51]。然而,MHC-Ⅰ分子的存在与否并不影响细胞的生长和活力[52],这种缺陷可被疱疹病毒充分利用以更好地逃避宿主免疫。
3.1 VHS病毒宿主关闭(virion host shutoff,VHS)蛋白仅存在于α疱疹病毒,因其与RNase A有相似的底物特异性,VHS能有效切割宿主和病毒mRNA,快速关闭宿主的蛋白合成途径,避免感染细胞被免疫系统识别和清除,帮助病毒建立潜伏感染[53-54]。BHV-1 pUL41为VHS同源蛋白,Koppers-Lalic等[55]报道感染野生型BHV-1的牛肾细胞(Madin-Darby bovine kidney, MDBK)最早在3 h内蛋白合成受到抑制,包括MHC-Ⅰ分子重链、蛋白酶体亚基和内质网驻留蛋白ERp57等。相反,缺失UL41基因的病毒突变体丧失抑制功能,表明pUL41在感染早期参与阻止宿主蛋白的合成。免疫沉淀试验发现,MHC-Ⅰ分子表达减少是由于pUL41抑制MHC-Ⅰ分子的产生,而非干扰MHC-Ⅰ重链-β2微球蛋白-肽三聚体复合物的形成。另外,Hinkley等[56]利用Northern印迹也观察到BHV-1 pUL41引起MHC-Ⅰ分子的mRNA水平下降。这些研究都证明了pUL41通过广泛降解宿主mRNA,破坏宿主蛋白合成机制,实现从mRNA源头抑制MHC-Ⅰ分子的表达。此外,有研究表明MDV pUL41与其他已知α疱疹病毒pUL41蛋白同源物同属晚期蛋白[57],但MDV pUL41是否利用与BHV-1 pUL41相似的蛋白互作网络,从而下调细胞表面MHC-Ⅰ分子仍有待研究。
3.2 囊膜糖蛋白gC和gDPRV UL44属复制非必需基因,在感染初期其编码产物囊膜糖蛋白C(glycoprotein C,gC)与硫酸乙酰肝素发生特异性相互作用,介导病毒与细胞初次结合[58]。瞬时表达PRV gC的PK-15细胞,其MHC-Ⅰ的转录水平和翻译水平均有明显降低[27]。其它囊膜糖蛋白,如gD也能抑制MHC-Ⅰ、TAP和Tapasin基因的mRNA转录本产生,引起PK-15细胞表面MHC-Ⅰ分子下调[27]。目前尚不清楚这两个结构糖蛋白为何能影响MHC-Ⅰ通路的重要基因表达,在内质网新生成的gC或gD经囊泡转运至高尔基体才能完成糖基化[59],并不具备直接参与胞质mRNA降解的能力。可能的解释是糖蛋白在合成或转运过程中干扰了某些转录因子进入细胞核,从而阻碍MHC-Ⅰ通路相关基因的表达。上述研究也进一步表明,作为动物疱疹病毒粒子囊膜的保守成分,糖蛋白(至少是gC和gD)还具有功能多样性,参与逃避宿主免疫。
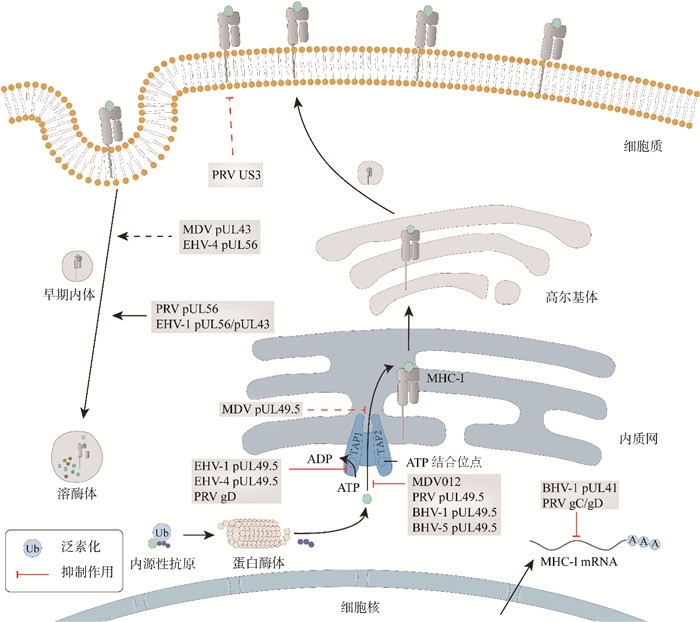
4 结语与展望疱疹病毒入侵宿主细胞后,启动病毒自身编码的各种免疫逃避蛋白,以对抗机体免疫系统。本文介绍的常见畜禽动物疱疹病毒,主要通过抑制抗原肽转运、促进细胞膜蛋白内吞降解、抑制mRNA产生等机制,干扰MHC-Ⅰ分子稳定表达,从而避免感染细胞被CTL识别和清除(图 2)。在过去二十多年,国内外研究人员已报道多种阻碍MHC-Ⅰ抗原递呈途径的畜禽疱疹病毒蛋白,但这些研究结果大多数来自体外非免疫细胞试验,且极少在本体动物模型上验证。与大动物的疱疹病毒相比,家禽疱疹病毒[MDV、传染性喉气管炎病毒(infectious laryngotracheitis virus,ILTV)和DEV等]的动物试验研究成本相对较低、操作简便,有的物种还有抗性品系,如抗MD商品鸡[60]。充分利用这些实验材料优势,可以在临床背景下验证病毒蛋白能否真正参与抑制动物个体的细胞免疫,更能展现这一研究领域未来的应用前景。
|
图 2 畜禽疱疹病毒免疫逃避蛋白抑制MHC-Ⅰ分子抗原递呈途径 Fig. 2 Inhibition of MHC Class Ⅰ antigen presentation pathway mediated by immune evasion proteins of livestock herpesviruses |
值得注意的是,一种疱疹病毒通常会存在多个不同作用靶点的MHC-Ⅰ分子调节蛋白,有的可以独立发挥作用,而有的需要相互配合,阐明它们在溶细胞感染和潜伏阶段中的各自作用将是今后的重要研究方向之一。由于疱疹病毒基因组具有很强的编码蛋白能力,不排除存在其它未知蛋白影响MHC-Ⅰ抗原递呈的可能性。挖掘这些蛋白的传统策略是根据疏水性、跨膜域、二级结构、信号肽、亚细胞定位和翻译后修饰等特征,有针对性地选择可能参与内吞、内体分选、膜泡运输、内质网相关蛋白降解等细胞过程的病毒蛋白进行研究。随着新兴基因编辑技术的应用领域不断扩展,也可以利用CRISPR/Cas9构建疱疹病毒随机突变体库,提高靶蛋白的筛选效率。
许多疱疹病毒编码的小RNA(miRNA)能调节宿主细胞的基因表达,影响机体稳态以利于免疫逃避。例如,prv-miR-LLT11a能抑制PK-15细胞TAP1基因的表达,从而阻碍TAP介导的抗原肽转运[61]。因此,未来可以从畜禽疱疹病毒非编码RNA的角度出发,结合多组学和单细胞技术,探究疱疹病毒基因组转录本及蛋白对宿主细胞MHC-Ⅰ分子的综合调控作用。总之,深入理解畜禽疱疹病毒逃避MHC-Ⅰ途径的分子机制,将有助于筛选增强抗原递呈能力的小分子药物,以及优化活病毒载体设计,提高疫苗免疫效果。
| [1] |
KOYANAGI N, KAWAGUCHI Y. Evasion of the cell-mediated immune response by alphaherpesviruses[J]. Viruses, 2020, 12(12): 1354. DOI:10.3390/v12121354 |
| [2] |
WIECZOREK M, ABUALROUS E T, STICHT J, et al. Major histocompatibility complex (MHC) Class Ⅰ and MHC class Ⅱ proteins: conformational plasticity in antigen presentation[J]. Front Immunol, 2017, 8: 292. |
| [3] |
HANSEN T H, BOUVIER M. MHC Class Ⅰ antigen presentation: learning from viral evasion strategies[J]. Nat Rev Immunol, 2009, 9(7): 503-513. DOI:10.1038/nri2575 |
| [4] |
GRIFFIN B D, VERWEIJ M C, WIERTZ E J H J. Herpesviruses and immunity: the art of evasion[J]. Vet Microbiol, 2010, 143(1): 89-100. DOI:10.1016/j.vetmic.2010.02.017 |
| [5] |
马宁宁, 刘占, 邓梦梦, 等. 疱疹病毒免疫逃逸相关蛋白及其作用机制研究进展[J]. 中国人兽共患病学报, 2021, 37(5): 462-466. MA N N, LIU Z, DENG M M, et al. Research advances in herpesvirus immune escape proteins and their mechanisms[J]. Chinese Journal of Zoonoses, 2021, 37(5): 462-466. (in Chinese) |
| [6] |
COHEN J I. Herpesvirus latency[J]. J Clin Invest, 2020, 130(7): 3361-3369. DOI:10.1172/JCI136225 |
| [7] |
KAUFER B B, JAROSINSKI K W, OSTERRIEDER N. Herpesvirus telomeric repeats facilitate genomic integration into host telomeres and mobilization of viral DNA during reactivation[J]. J Exp Med, 2011, 208(3): 605-615. DOI:10.1084/jem.20101402 |
| [8] |
BO Z Y, LI X D. A review of pseudorabies virus variants: genomics, vaccination, transmission, and zoonotic potential[J]. Viruses, 2022, 14(5): 1003. DOI:10.3390/v14051003 |
| [9] |
FAROOQ S, KUMAR A, CHAUDHARY S, et al. Bovine herpesvirus 1 (BoHV-1): a review on latency and persistence of infection in cattle[J]. J Pharmacogn Phytochem, 2019, 8(6): 875-879. |
| [10] |
OLADUNNI F S, HOROHOV D W, CHAMBERS T M. EHV-1:a constant threat to the horse industry[J]. Front Microbiol, 2019, 10: 2668. DOI:10.3389/fmicb.2019.02668 |
| [11] |
BOODHOO N, GURUNG A, SHARIF S, et al. Marek's disease in chickens: a review with focus on immunology[J]. Vet Res, 2016, 47(1): 119. DOI:10.1186/s13567-016-0404-3 |
| [12] |
LEE S W, MARKHAM P F, COPPO M J C, et al. Attenuated vaccines can recombine to form virulent field viruses[J]. Science, 2012, 337(6091): 188. DOI:10.1126/science.1217134 |
| [13] |
VAL M D, ANTÓN L C, RAMOS M, et al. Endogenous TAP-independent MHC-Ⅰ antigen presentation: not just the ER lumen[J]. Curr Opin Immunol, 2020, 64: 9-14. DOI:10.1016/j.coi.2019.12.003 |
| [14] |
MARIJT K A, VAN HALL T. To TAP or not to TAP: alternative peptides for immunotherapy of cancer[J]. Curr Opin Immunol, 2020, 64: 15-19. DOI:10.1016/j.coi.2019.12.004 |
| [15] |
VERWEIJ M C, LIPIN?SKA A D, KOPPERS-LALIC D, et al. The capacity of UL49.5 proteins to inhibit TAP is widely distributed among members of the genus Varicellovirus[J]. J Virol, 2011, 85(5): 2351-2363. DOI:10.1128/JVI.01621-10 |
| [16] |
FUCHS W, METTENLEITER T C. The nonessential UL49.5 gene of infectious laryngotracheitis virus encodes an O-glycosylated protein which forms a complex with the non-glycosylated UL10 gene product[J]. Virus Res, 2005, 112(1-2): 108-114. DOI:10.1016/j.virusres.2005.03.002 |
| [17] |
OSTERRIEDER N, NEUBAUER A, BRANDMULLER C, et al. The equine herpesvirus 1 glycoprotein gp21/22a, the herpes simplex virus type 1 gM homolog, is involved in virus penetration and cell-to-cell spread of virions[J]. J Virol, 1996, 70(6): 4110-4115. DOI:10.1128/jvi.70.6.4110-4115.1996 |
| [18] |
LIPINSKA A D, KOPPERS-LALIC D, RYCHLOWSKI M, et al. Bovine herpesvirus 1 UL49.5 protein inhibits the transporter associated with antigen processing despite complex formation with glycoprotein M[J]. J Virol, 2006, 80(12): 5822-5832. DOI:10.1128/JVI.02707-05 |
| [19] |
KOPPERS-LALIC D, REITS E A J, RESSING M E, et al. Varicelloviruses avoid T cell recognition by UL49.5-mediated inactivation of the transporter associated with antigen processing[J]. Proc Natl Acad Sci U S A, 2005, 102(14): 5144-5149. DOI:10.1073/pnas.0501463102 |
| [20] |
HUNT H D, LUPIANI B, MILLER M M, et al. Marek's disease virus down-regulates surface expression of MHC (B Complex) Class Ⅰ (BF) glycoproteins during active but not latent infection of chicken cells[J]. Virology, 2001, 282(1): 198-205. DOI:10.1006/viro.2000.0797 |
| [21] |
JAROSINSKI K W, HUNT H D, OSTERRIEDER N. Down-regulation of MHC Class Ⅰ by the Marek's disease virus (MDV) UL49.5 gene product mildly affects virulence in a haplotype-specific fashion[J]. Virology, 2010, 405(2): 457-463. DOI:10.1016/j.virol.2010.06.041 |
| [22] |
HEARN C, PREEYANON L, HUNT H D, et al. An MHC Class Ⅰ immune evasion gene of Marek's disease virus[J]. Virology, 2015, 475: 88-95. DOI:10.1016/j.virol.2014.11.008 |
| [23] |
KOPPERS-LALIC D, VERWEIJ M C, LIPINSKA A D, et al. Varicellovirus UL49.5 proteins differentially affect the function of the transporter associated with antigen processing, TAP[J]. PLoS Pathog, 2008, 4(5): e1000080. DOI:10.1371/journal.ppat.1000080 |
| [24] |
DERUELLE M J, VAN DEN BROEKE C, NAUWYNCK H J, et al. Pseudorabies virus US3- and UL49.5-dependent and-independent downregulation of MHC Ⅰ cell surface expression in different cell types[J]. Virology, 2009, 395(2): 172-181. DOI:10.1016/j.virol.2009.09.019 |
| [25] |
ZAI X S, SHI B, SHAO H X, et al. Identification of a novel insertion site HVT-005/006 for the generation of recombinant turkey herpesvirus vector[J]. Front Microbiol, 2022, 13: 886873. DOI:10.3389/fmicb.2022.886873 |
| [26] |
LI A, LU G W, QI J X, et al. Structural basis of nectin-1 recognition by pseudorabies virus glycoprotein D[J]. PLoS Pathog, 2017, 13(5): e1006314. DOI:10.1371/journal.ppat.1006314 |
| [27] |
马宁宁. 影响TAP肽转运的PRV蛋白筛选及功能鉴定[D]. 郑州: 河南农业大学, 2021. MA N N. Screening and functional identification of PRV proteins affecting TAP peptide transport[D]. Zhengzhou: Henan Agricultural University, 2021. (in Chinese) |
| [28] |
DERUELLE M J, FAVOREEL H W. Keep it in the subfamily: the conserved alphaherpesvirus US3 protein kinase[J]. J Gen Virol, 2011, 92(Pt 1): 18-30. |
| [29] |
SCHIPPERS T, JAROSINSKI K, OSTERRIEDER N. The ORF012 gene of Marek's disease virus type 1 produces a spliced transcript and encodes a novel nuclear phosphoprotein essential for virus growth[J]. J Virol, 2015, 89(2): 1348-1363. DOI:10.1128/JVI.02687-14 |
| [30] |
KOCH M, CAMP S, COLLEN T, et al. Structures of an MHC Class Ⅰ molecule from B21 chickens illustrate promiscuous peptide binding[J]. Immunity, 2007, 27(6): 885-899. DOI:10.1016/j.immuni.2007.11.007 |
| [31] |
SU R C, MILLER R G. Stability of surface H-2Kb, H-2Db, and peptide-receptive H-2Kb on splenocytes[J]. J Immunol, 2001, 167(9): 4869-4877. DOI:10.4049/jimmunol.167.9.4869 |
| [32] |
NASLAVSKY N, WEIGERT R, DONALDSON J G. Characterization of a nonclathrin endocytic pathway: membrane cargo and lipid requirements[J]. Mol Biol Cell, 2004, 15(8): 3542-3552. DOI:10.1091/mbc.e04-02-0151 |
| [33] |
KOSHIZUKA T, GOSHIMA F, TAKAKUWA H, et al. Identification and characterization of the UL56 gene product of herpes simplex virus type 2[J]. J Virol, 2002, 76(13): 6718-6728. DOI:10.1128/JVI.76.13.6718-6728.2002 |
| [34] |
ZHANG J C, XU B B, MA D Q, et al. Identification of Marek's disease virus pUL56 homologue and analysis of critical amino acid stretches indispensable for its intracellular localization[J]. Virus Res, 2022, 313: 198741. DOI:10.1016/j.virusres.2022.198741 |
| [35] |
SOH T K, DAVIES C T R, MUENZNER J, et al. Temporal proteomic analysis of herpes simplex virus 1 infection reveals cell-surface remodeling via pUL56-mediated GOPC degradation[J]. Cell Rep, 2020, 33(1): 108235. DOI:10.1016/j.celrep.2020.108235 |
| [36] |
ZHAO H Y, WANG S J, LIU C, et al. The pUL56 of pseudorabies virus variant induces downregulation of swine leukocyte antigen Class Ⅰ molecules through the lysosome pathway[J]. Virus Res, 2018, 251: 56-67. DOI:10.1016/j.virusres.2018.04.007 |
| [37] |
BERKOWITZ C, MOYAL M, RÖSEN-WOLFF A, et al. Herpes simplex virus type 1 (HSV-1) UL56 gene is involved in viral intraperitoneal pathogenicity to immunocompetent mice[J]. Arch Virol, 1994, 134(1-2): 73-83. DOI:10.1007/BF01379108 |
| [38] |
HUSSEY G S, HUSSEY S B, WAGNER B, et al. Evaluation of immune responses following infection of ponies with an EHV-1 ORF1/2 deletion mutant[J]. Vet Res, 2011, 42: 23. DOI:10.1186/1297-9716-42-23 |
| [39] |
MA G G, FEINEIS S, OSTERRIEDER N, et al. Identification and characterization of equine herpesvirus type 1 pUL56 and its role in virus-induced downregulation of major histocompatibility complex Class Ⅰ[J]. J Virol, 2012, 86(7): 3554-3563. DOI:10.1128/JVI.06994-11 |
| [40] |
SAID A, AZAB W, DAMIANI A, et al. Equine herpesvirus type 4 UL56 and UL49.5 proteins downregulate cell surface major histocompatibility complex Class Ⅰ expression independently of each other[J]. J Virol, 2012, 86(15): 8059-8071. DOI:10.1128/JVI.00891-12 |
| [41] |
HUANG T, LEHMANN M J, SAID A, et al. Major histocompatibility complex Class Ⅰ downregulation induced by equine herpesvirus type 1 pUL56 is through dynamin-dependent endocytosis[J]. J Virol, 2014, 88(21): 12802-12815. DOI:10.1128/JVI.02079-14 |
| [42] |
USHIJIMA Y, KOSHIZUKA T, GOSHIMA F, et al. Herpes simplex virus type 2 UL56 interacts with the ubiquitin ligase Nedd4 and increases its ubiquitination[J]. J Virol, 2008, 82(11): 5220-5233. DOI:10.1128/JVI.02515-07 |
| [43] |
张金城, 马德青, 徐贝贝, 等. 马立克病病毒pUL56蛋白对DF-1细胞免疫通路相关基因的转录调控研究[J]. 病毒学报, 2022, 38(3): 684-693. ZHANG J C, MA D Q, XU B B, et al. Transcriptomic profiling of DF-1 cells with transient expression of the pUL56 protein of the Marek's disease virus[J]. Chinese Journal of Virology, 2022, 38(3): 684-693. DOI:10.13242/j.cnki.bingduxuebao.004147 (in Chinese) |
| [44] |
KLUPP B G, ALTENSCHMIDT J, GRANZOW H, et al. Identification and characterization of the pseudorabies virus UL43 protein[J]. Virology, 2005, 334(2): 224-233. DOI:10.1016/j.virol.2005.01.032 |
| [45] |
LIU Z B, HUANG J L, DING Q, et al. Analysis of contributions of herpes simplex virus type 1 UL43 protein to induction of cell-cell fusion[J]. Trop J Pharm Res, 2016, 15(6): 1137-1144. DOI:10.4314/tjpr.v15i6.4 |
| [46] |
HUANG T, MA G G, OSTERRIEDER N. Equine herpesvirus 1 multiply inserted transmembrane protein pUL43 cooperates with pUL56 in downregulation of cell surface major histocompatibility complex Class Ⅰ[J]. J Virol, 2015, 89(12): 6251-6263. DOI:10.1128/JVI.00032-15 |
| [47] |
刘潇, 宋佳玲, 张金城, 等. 马立克氏病病毒多次跨膜蛋白pUL43多克隆抗体的制备及其体外表达分析[J]. 中国家禽, 2021, 43(7): 37-43. LIU X, SONG J L, ZHANG J C, et al. Generation of a polyclonal antibody targeting the multiple membrane-spanning protein pUL43 of Marek's disease virus and its expression profile in cultured cells[J]. China Poultry, 2021, 43(7): 37-43. DOI:10.16372/j.issn.1004-6364.2021.07.005 (in Chinese) |
| [48] |
刘潇. 马立克氏病病毒pUL43蛋白表达特征分析及对细胞表面MHC-Ⅰ分子稳定性的影响[D]. 南宁: 广西大学, 2021. LIU X. The expression profiling of pUL43 protein from Marek's disease virus and its effect on the stability of cell surface MHC Class Ⅰ[D]. Nanning: Guangxi University, 2021. (in Chinese) |
| [49] |
KAUFMAN J. From chickens to humans: the importance of peptide repertoires for MHC Class Ⅰ alleles[J]. Front Immunol, 2020, 11: 601089. DOI:10.3389/fimmu.2020.601089 |
| [50] |
DENG L S, XU Z W, LI F Q, et al. Insights on the cGAS-STING signaling pathway during herpesvirus infections[J]. Front Immunol, 2022, 13: 931885. DOI:10.3389/fimmu.2022.931885 |
| [51] |
DE BRACHÈNE A C, DOS SANTOS R S, MARROQUI L, et al. IFN-α induces a preferential long-lasting expression of MHC Class Ⅰ in human pancreatic beta cells[J]. Diabetologia, 2018, 61(3): 636-640. DOI:10.1007/s00125-017-4536-4 |
| [52] |
DHATCHINAMOORTHY K, COLBERT J D, ROCK K L. Cancer immune evasion through loss of MHC Class Ⅰ antigen presentation[J]. Front Immunol, 2021, 12: 636568. DOI:10.3389/fimmu.2021.636568 |
| [53] |
HE T Q, WANG M S, CHENG A C, et al. Host shutoff activity of VHS and SOX-like proteins: role in viral survival and immune evasion[J]. Virol J, 2020, 17(1): 68. DOI:10.1186/s12985-020-01336-8 |
| [54] |
FRIEDEL C C, WHISNANT A W, DJAKOVIC L, et al. Dissecting herpes simplex virus 1-induced host shutoff at the RNA level[J]. J Virol, 2021, 95(3): e01399-20. |
| [55] |
KOPPERS-LALIC D, RIJSEWIJK F A M, VERSCHUREN S B E, et al. The UL41-encoded virion host shutoff (vhs) protein and vhs-independent mechanisms are responsible for down-regulation of MHC Class Ⅰ molecules by bovine herpesvirus 1[J]. J Gen Virol, 2001, 82(Pt 9): 2071-2081. |
| [56] |
HINKLEY S, AMBAGALA A P N, JONES C J, et al. A vhs-like activity of bovine herpesvirus-1[J]. Arch Virol, 2000, 145(10): 2027-2046. DOI:10.1007/s007050070038 |
| [57] |
徐贝贝, 张金城, 马德青, 等. 马立克病病毒宿主关闭蛋白pUL41多克隆抗体的制备及应用[J]. 中国兽医科学, 2022, 52(10): 1294-1301. XU B B, ZAHNG J C, MA D Q, et al. Preparation and application of a polyclonal antibody against virion host shutoff protein pUL41 of Marek's disease virus[J]. Chinese Veterinary Science, 2022, 52(10): 1294-1301. (in Chinese) |
| [58] |
HE W T, AUCLERT L Z, ZHAI X F, et al. Interspecies transmission, genetic diversity, and evolutionary dynamics of pseudorabies virus[J]. J Infect Dis, 2019, 219(11): 1705-1715. DOI:10.1093/infdis/jiy731 |
| [59] |
METTENLEITER T C. Aujeszky's disease (pseudorabies) virus: the virus and molecular pathogenesis-state of the art, June 1999[J]. Vet Res, 2000, 31(1): 99-115. |
| [60] |
金元昌, 李玉峰, 张艳. 不同马立克氏病抗性鸡攻毒后IL-18基因的差异表达[J]. 中国兽医学报, 2015, 35(3): 355-358, 366. JIN Y C, LI Y F, ZHANG Y. Differential expression of IL-18 gene in chickens with different resistance to Marek's disease virus infection[J]. Chinese Journal of Veterinary Science, 2015, 35(3): 355-358, 366. (in Chinese) |
| [61] |
杨利. PRV编码prv-miR-LLT11a靶基因鉴定及初步功能研究[D]. 郑州: 河南农业大学, 2017. YANG L. Identification of targeted gene and preliminary function of PRV-encoded prv-miR-LLT11a[D]. Zhengzhou: Henan Agricultural University, 2017. (in Chinese) |
(编辑 白永平)



