2. 广西大学动物科学技术学院,南宁 530003;
3. 广西动物疫病预防控制中心,南宁 530004;
4. 长春市动物疫病预防控制中心,长春 130061
2. College of Animal Science and Technology, Guangxi University, Nanning 530003, China;
3. Guangxi Center for Animal Disease Prevention and Control, Nanning 530004, China;
4. Changchun Center for Animal Disease Control and Prevention, Changchun 130061, China
猪传染性胃肠炎病毒(transmissible gastroenteritis virus,TGEV)是冠状病毒科α冠状病毒属的成员,为不分节段的单股正链RNA病毒,可引起猪传染性胃肠炎(transmissible gastroenteritis,TGE)。猪传染性胃肠炎是以食欲减退、脱水、持续性呕吐与水样腹泻为主要临床症状的一种急性、高度接触性肠道传染病[1]。不同生长阶段和品种的猪均易感,2周龄内的仔猪病死率高达100%[2],随着日龄增加,感染死亡率逐渐降低,5周龄以上的猪感染后多可存活,但其后续生长发育受到严重影响且长期携带病毒[3]。TGE于1946年在美国首次被发现[4],而后迅速蔓延至美洲、亚洲和欧洲多个国家,现已成为世界性的猪病,给养猪业造成了巨大的经济损失,世界动物卫生组织将TGE列为B类必检传染性疾病。20世纪50年代,TGE在我国广东省出现首例报道[5],随后在全国大部分地区出现流行[6]。目前,随着免疫接种的推广,TGEV在我国的发病率逐年下降且呈现稳定趋势,但在全国各省市的猪群中TGEV仍存在广泛的传播。因此,建立快速、灵敏和适用于现场检测的TGEV诊断方法仍具有重要意义。
由于与其它猪腹泻病毒在临床表现、病理学变化上的相似性以及常见的混合感染及隐性感染,TGEV的鉴别诊断通常需要借助于实验室诊断技术[7]。传统的TGEV检测方法主要有病毒的分离鉴定、ELISA、电镜观察法、病毒中和试验、核酸探针杂交技术等[8-9],但在实际应用中不难发现其存在操作繁琐、对仪器设备要求高、周期长等缺点。重组酶介导核酸等温扩增(recombinase-aid amplification,RAA)技术[10]是一种新型的核酸检测方法,能够在恒温条件下(37~42 ℃)快速完成扩增,该方法目前在病毒、细菌等病原体的检测中均得到成功应用。本研究针对TGEV N基因高度保守区设计探针及多对引物,成功建立TGEV的荧光RT-RAA检测方法,并通过敏感性、特异性等试验以及临床样品的检测对该方法进行初步评价。
1 材料与方法 1.1 病毒及临床样品猪传染性胃肠炎病毒(TGEV)以及猪流行性腹泻病毒(porcine epidemic diarrhea virus,PEDV)、猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)、猪丁型冠状病毒(porcine deltacoronavirus,PDCoV)、猪肠道α冠状病毒(porcine enteric alphacoronavirus,PEAV)等猪源病毒保存于广西动物疫病预防控制中心;50份猪源临床样品(包括粪便拭子、肠组织及内容物,采集自腹泻仔猪)由广西动物疫病预防控制中心搜集并提供,保存于-80 ℃备用。
1.2 主要试剂与仪器Axy Prep DNA凝胶回收试剂盒、Axy Prep质粒小量提取试剂盒购自康宁生命科学(吴江)有限公司;2×Taq DNA Master Mix购自北京生物科技有限公司;UNIQ-10柱式TRIzol总RNA抽提试剂盒购自生工生物工程(上海)股份有限公司;大肠杆菌Trans T1感受态细胞购自北京全式金生物技术有限公司;pMD18-T载体购自宝日医生物(北京)有限公司;RT-RAA核酸扩增试剂(荧光型)购自南宁壮博生物科技有限公司;F1620恒温核酸扩增检测仪为江苏奇天基因生物科技有限公司产品。
1.3 方法1.3.1 引物、探针设计与合成 从GenBank数据库下载多株TGEV病毒N基因序列(AF104420.1、AY587884.1、DQ443743.1、EU074218.1、FJ755618.2、GQ374566.1),利用DNAMAN软件进行分析比对,选择高同源性的保守区域,根据RAA引物、探针设计原则,利用Primer Premier 5.0软件设计多条引物及探针(表 1)。引物、探针由生工生物工程(上海)股份有限公司合成。
|
|
表 1 引物和探针 Table 1 Primers and probes |
1.3.2 病毒核酸的提取 按照核酸抽提试剂盒说明书提取TGEV、PEDV、PRRSV、PDCoV、PEAV等猪源病毒的RNA,保存于-80 ℃备用。
1.3.3 质粒标准品构建与鉴定 以TGEV RNA反转录得到的cDNA为模板,进行RT-PCR扩增,扩增的目的片段经纯化后克隆至pMD18-T载体,并由生工生物工程(上海)股份有限公司测序鉴定。经测序正确的重组质粒作为质粒标准品。通过Nanodrop 2000分光光度计测定浓度并经公式(拷贝数(拷贝·μL-1)=6.02×1023×浓度(ng·μL-1)×10-9/片段长度×660)计算得出拷贝数。
1.3.4 反应体系 反应体系根据RAA核酸扩增试剂(荧光型)使用说明书建立。单管反应体系总50 μL,其中,A Buffer 25.0 μL,上下游引物各2.0 μL,探针0.6 μL,模板1.0 μL,无核酸酶水16.9 μL,B Buffer 2.5 μL最后加至每个反应管的管盖内侧;充分混匀后,将反应管置于F1620恒温核酸扩增检测仪扩增并收集荧光,反应时间为20 min。
1.3.5 引物筛选与反应条件优化 将设计并合成的多条引物,上、下游引物两两随机组合,均以质粒标准品作为模板进行荧光RT-RAA扩增,综合比较扩增曲线的起峰时间以及试验中荧光信号强度选择最佳的引物组合;确定最佳引物对后,均以质粒标准品作为模板,在不同试验温度(37、39、42 ℃)下反应20 min,根据起峰时间与荧光强度,确定最适反应温度。
1.3.6 特异性试验 利用建立的TGEV荧光RT-RAA方法对TGEV、PEAV、PDCoV、PEDV、PRRSV病毒核酸同时进行检测,以无核酸酶水为阴性对照,评价该方法的特异性。
1.3.7 敏感性试验 将TGEV质粒标准品依次稀释为109~100拷贝·μL-1,以100~106拷贝·μL-1的质粒标准品分别作为模板,采用本研究建立TGEV荧光RT-RAA方法进行扩增,以无核酸酶水为阴性对照,评价该方法的敏感性。
1.3.8 临床样品的检测 猪粪便拭子、猪肠组织及内容物经无菌PBS浸泡并研磨,5 000 r·min-1离心10 min,取200 μL上清按照核酸抽提试剂盒提取病毒RNA,反转录得到cDNA。采用本研究建立的荧光RT-RAA方法和李莎莎等[11]建立的RT-PCR方法对上述样品进行扩增,比较两者的检测结果。
2 结果 2.1 重组质粒的鉴定结果重组质粒经测序鉴定正确后,作为质粒标准品并命名为TGEV-N,经测定与计算,质粒标准品原始浓度为6.62×1010拷贝·μL-1。
2.2 最佳引物对与最适反应温度将上下游引物两两随机组合,均以TGEV-N作为模板,同时进行实时荧光RT-RAA扩增。结果显示(图 1),TGEV F2/R3引物组合(简称F2/R3)起峰最快,且荧光信号最强,因此,选择F2/R3引物对为本试验最佳引物组合;通过对比不同温度发现(图 2),当试验温度为42 ℃时,扩增曲线起峰最早,且荧光信号最强,因此,42 ℃为本试验最适反应温度。
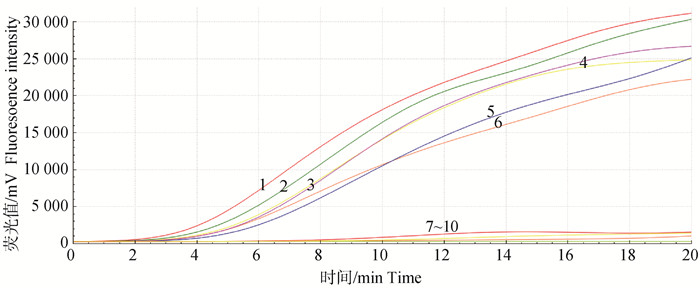
|
1. F2/R3;2. F2/R1;3. F1/R1;4. F1/R3;5. F2/R2;6. F1/R2;7~10:F3/R1、F3/R2、F3/R1、阴性对照 1. F2/R3; 2. F2/R1; 3. F1/R1; 4. F1/R3; 5. F2/R2; 6. F1/R2; 7-10. F3/R1, F3/R2, F3/R1, negative control 图 1 实时荧光RT-RAA引物筛选 Fig. 1 The selection of real-time RT-RAA primers |
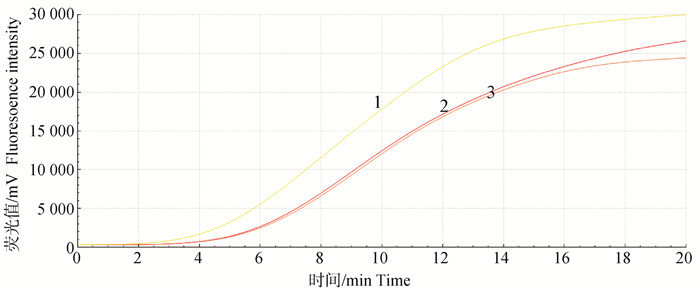
|
1~3. 42、39和37 ℃ 1-3. Represent 42, 39 and 37 ℃, respectively 图 2 荧光RT-RAA反应温度的筛选 Fig. 2 The selection of real-time RT-RAA reaction temperatures |
同时检测TGEV以及PEAV、PDCoV、PEDV、PRRSV等在临床上引起猪腹泻常见的病毒核酸,利用建立的荧光TGEV RT-RAA方法进行扩增,结果显示(图 3),仅TGEV产生显著的扩增曲线,判定为阳性,而PEAV、PDCoV、PEDV、PRRSV和阴性对照均无扩增曲线,判定为阴性,表明该方法对TGEV具有良好的特异性。
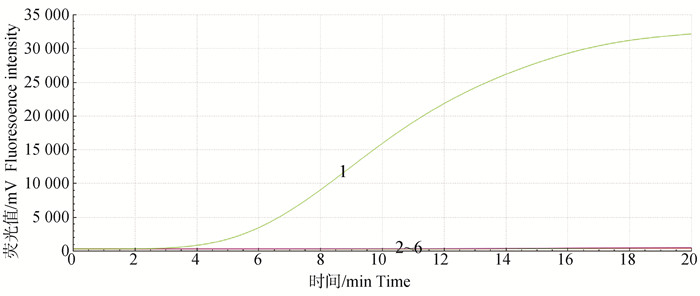
|
1. TGEV;2~6. PEDV、PRRSV、PDCoV、PEAV、阴性对照 1. TGEV; 2-6. Represent PEDV, PRRSV, PDCoV, PEAV, negative control, respectively 图 3 荧光RT-RAA特异性试验 Fig. 3 Specificity test of real-time RT-RAA assay |
以6.62×100~6.62×106拷贝·μL-1TGEV-N作为模板进行扩增,结果显示(图 4),随着质粒标准品拷贝数的降低,扩增曲线的起峰时间逐渐延长,荧光强度也相应地降低,最低检出限为6.62×101拷贝·μL-1,表明本研究所建立的TGEV荧光RT-RAA方法具有较高的敏感性。
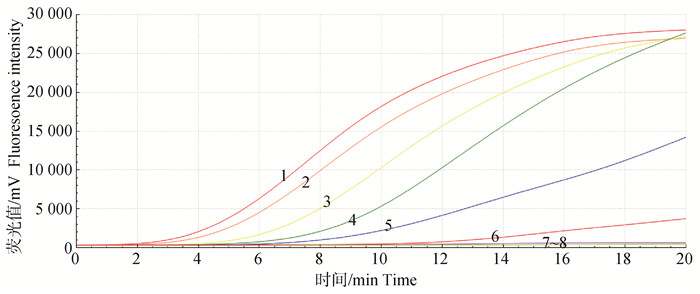
|
1~7. TGEV-N依次为106~100拷贝·μL-1;8. 阴性对照 1-7. TGEV-N concentretion were successively 106-100 copies·μL-1; 8. Negative control 图 4 实时荧光RT-RAA敏感性试验 Fig. 4 Sensitivity test of real time RT-RAA assay |
临床样品检测结果显示,本研究所建立的TGEV荧光RT-RAA方法阳性率为6%,与常规RT-PCR方法一致,表明本研究所建立的荧光RT-RAA在TGEV的临床检测中具有可行性。
3 讨论近年来,随着我国养猪业规模的扩大化、经营的集约化,猪病毒性腹泻由于其高致病性在猪场的综合防控中日益重要。TGEV是引起猪病毒性腹泻主要的病原之一,多发于初春和冬季[12],潜伏期短,传播迅速,对仔猪具有高致死率[13],因此在TGEV的防治中,早期快速、准确的诊断对于疫病的控制至关重要。传统的病毒分离培养法在病毒检测中准确、可靠,但由于过程耗时,操作繁琐,无法实现临床的快速检测。近年来,在传统的实验室诊断方法不断完善的同时,一系列的分子生物学诊断技术也被应用于TGEV的检测中。杜雅楠等[13]建立了TGEV RT-PCR检测方法,可检测出最低浓度为0.713 ng·μL-1的cDNA,对来自内蒙古自治区7个盟市的猪腹泻样品进行检测,TGEV阳性率为11.76%。Luo等[14]基于功能化磁珠富集和特异性纳米技术扩增建立了同时检测和区分PEDV、TEGV的二重超敏感纳米颗粒探针PCR检测方法,其对两种病毒的检测限为25拷贝·g-1,较已有的RT-PCR敏感400倍。Chen等[15]针对TGEV N基因保守区域设计并建立了环介导等温扩增(LAMP)检测方法,灵敏度优于RT-PCR而接近巢式PCR。Huang等[16]建立了基于TaqMan探针的多重荧光定量RT-PCR检测方法,可同时检测包括TGEV在内的4种猪肠道冠状病毒,敏感性试验显示, TGEV的检测下限为1.1×102拷贝·μL-1,猪腹泻样品检测结果显示,PDCoV(34.2%)和TGEV(20.3%)是主要的病原体并伴有混合感染。
作为一种新兴的检测方法,RAA利用重组酶-引物复合体、单链结合蛋白以及DNA聚合酶替代了传统PCR的高温变性解链过程,通过引入逆转录酶,该技术还可以应用于RNA病毒的检测。目前,基于RAA技术已建立了新型冠状病毒[17]、非洲猪瘟病毒[18]、弓形虫[19]等多种病原的检测方法,且评价性试验均显示出高敏感性和良好的特异性。RAA引物、探针在设计上区别于荧光定量PCR且目前尚无专门的设计程序,引物长度通常为30~35 nt,探针长度为46~52 nt,探针中间位置标记四氢呋喃(THF),并对其上下游的T碱基分别标记荧光基团和淬灭基团,在3′末端连接一个阻断基团(常用C3-spacer)[20]。引物、探针的选择在很大程度上影响了检测的敏感性、特异性等重要指标,因此在方法建立之初,对于引物、探针组合的筛选很有必要。此外,在RAA检测体系的优化中,反应温度也是一个重要因素,本研究中,将温度提高至42 ℃后,扩增曲线起峰更快,荧光信号也更强。
本研究成功建立了基于TGEV N基因的荧光RT-RAA检测方法,检测限可以达到6.62×101拷贝·μL-1,5 min内便可以观察到显著的扩增曲线。特异性试验中,荧光RT-RAA方法与PEDV、PDCoV等常见的猪源病毒均未出现交叉反应,证实了该方法用于TGEV临床检测的可行性。采用荧光RT-RAA方法对50份临床样品进行检测,其中,3份显示为阳性,检测结果与RT-PCR方法一致。综上,TGEV荧光RT-RAA方法具有特异、灵敏等优点,实现了病原检测的简便、高效,尤其对现场与基层实验室的检测具有广泛的应用前景。本研究为TGEV快速检测提供了有效方法。
4 结论本研究首次建立了TGEV的荧光RT-RAA检测方法,评估性试验及临床检测结果表明该方法具有实际应用价值,为临床上TGEV的检测提供了一种新的手段。
| [1] |
吴梓琦, 吴少佳, 吕华达, 等. 猪冠状病毒的起源与遗传演化[J]. 中国兽医学报, 2022, 42(2): 376-383. WU Z Q, WU S J, LYU H D, et al. Origin and evolution of coronaviruses in pigs[J]. Chinese Journal of Veterinary Science, 2022, 42(2): 376-383. (in Chinese) |
| [2] |
MAN C L, YU X L. Cloning and sequence analysis of N gene of transmissible gastroenteritis virus HYM-09 Isolated from dog in China[J]. Indian J Virol, 2012, 23(3): 364-367. DOI:10.1007/s13337-012-0072-5 |
| [3] |
XIA L, YANG Y H, WANG J L, et al. Impact of TGEV infection on the pig small intestine[J]. Virol J, 2018, 15(1): 1020. |
| [4] |
LIU Q, WANG H Y. Porcine enteric coronaviruses: an updated overview of the pathogenesis, prevalence, and diagnosis[J]. Vet Res Commun, 2021, 45(2-3): 75-86. DOI:10.1007/s11259-021-09808-0 |
| [5] |
佟有恩, 刘芳萍. 猪传染性胃肠炎诊断技术的研究进展[J]. 畜牧兽医科技信息, 2011(4): 19-22. TONG Y E, LIU F P. Progress on the diagnostic methods of porcine transmissible gastroenteritis[J]. Chinese Journal of Animal Husbandry and Veterinary Medicine, 2011(4): 19-22. DOI:10.3969/J.ISSN.1671-6027.2011.04.011 (in Chinese) |
| [6] |
WANG C B, FENG L, CHEN J F, et al. Analysis of the gene 3 region sequences of Chinese field strains of transmissible gastroenteritis virus[J]. Acta Virol, 2010, 54(1): 61-73. DOI:10.4149/av_2010_01_61 |
| [7] |
VEMULAPALLI R, GULANI J, SANTRICH C, et al. A real-time TaqMan Ⓡ RT-PCR assay with an internal amplification control for rapid detection of transmissible gastroenteritis virus in swine fecal samples[J]. J Virol Methods, 2009, 162(1-2): 231-235. DOI:10.1016/j.jviromet.2009.08.016 |
| [8] |
白兴华, 冯力, 陈建飞, 等. 猪传染性胃肠炎病毒TaqMan荧光定量RT-PCR检测方法的建立[J]. 畜牧兽医学报, 2007, 38(5): 476-481. BAI X H, FENG L, CHEN J F, et al. Development of TaqMan fluorescence quantitative RT-PCR assay for detection of transmissible gastroenteritis virus of swine[J]. Acta Veterinaria et Zootechnica Sinica, 2007, 38(5): 476-481. DOI:10.3321/j.issn:0366-6964.2007.05.011 (in Chinese) |
| [9] |
KIM S H, KIM I J, PYO H M, et al. Multiplex real-time RT-PCR for the simultaneous detection and quantification of transmissible gastroenteritis virus and porcine epidemic diarrhea virus[J]. J Virol Methods, 2007, 146(1-2): 172-177. DOI:10.1016/j.jviromet.2007.06.021 |
| [10] |
吕蓓, 程海荣, 严庆丰, 等. 用重组酶介导扩增技术快速扩增核酸[J]. 中国科学: 生命科学, 2010, 40(10): 983-988. LÜ B, CHENG H R, YAN Q F, et al. Recombinase-aid amplification: a novel technology of in vitro rapid nucleic acid amplification[J]. Scientia Sinica Vitae, 2010, 40(10): 983-988. (in Chinese) |
| [11] |
李莎莎, 纪立凯, 王中华, 等. 猪Delta冠状病毒、猪流行性腹泻病毒、猪传染性胃肠炎病毒、猪轮状病毒多重PCR检测方法的建立和应用[J]. 畜牧与兽医, 2020, 52(9): 74-79. LI S S, JI L K, WANG Z H, et al. Establishment and application of the multiplex PCR method for detection of PDCoV, PEDV, TGEV and PRoV[J]. Animal Husbandry & Veterinary Medicine, 2020, 52(9): 74-79. (in Chinese) |
| [12] |
YUAN D W, YAN Z H, LI M Y, et al. Isolation and characterization of a porcine transmissible gastroenteritis coronavirus in northeast China[J]. Front Vet Sci, 2021, 8: 611721. DOI:10.3389/fvets.2021.611721 |
| [13] |
杜雅楠, 李静, 刘艳成, 等. 猪传染性胃肠炎病毒RT-PCR检测方法的建立及应用[J]. 动物医学进展, 2019, 40(9): 29-33. DU Y N, LI J, LIU Y C, et al. Establishment of RT-PCR method for detecting transmissible gastroenteritis virus and its application[J]. Progress in Veterinary Medicine, 2019, 40(9): 29-33. (in Chinese) |
| [14] |
LUO L, CHEN J, LI X M, et al. Establishment of method for dual simultaneous detection of PEDV and TGEV by combination of magnetic micro-particles and nanoparticles[J]. J Infect Chemother, 2020, 26(5): 523-526. DOI:10.1016/j.jiac.2020.01.008 |
| [15] |
CHEN Q, LI J, FANG X E, et al. Detection of swine transmissible gastroenteritis coronavirus using loop-mediated isothermal amplification[J]. Virol J, 2010, 7(1): 206. DOI:10.1186/1743-422X-7-206 |
| [16] |
HUANG X, CHEN J N, YAO G, et al. A TaqMan-probe-based multiplex real-time RT-qPCR for simultaneous detection of porcine enteric coronaviruses[J]. Appl Microbiol Biotechnol, 2019, 103(12): 4943-4952. DOI:10.1007/s00253-019-09835-7 |
| [17] |
XUE G H, LI S L, ZHANG W W, et al. Reverse-transcription recombinase-aided amplification assay for rapid detection of the 2019 novel coronavirus (SARS-CoV-2)[J]. Anal Chem, 2020, 92(14): 9699-9705. |
| [18] |
FAN X X, LI L, ZHAO Y G, et al. Clinical validation of two recombinase-based isothermal amplification assays (RPA/RAA) for the rapid detection of African swine fever virus[J]. Front Microbiol, 2020, 11: 1696. |
| [19] |
WANG Z H, ZHANG W, ZHANG X Z, et al. Development of a real-time recombinase-aided amplification (RT-RAA) molecular diagnosis assay for sensitive and rapid detection of Toxoplasma gondii[J]. Vet Parasitol, 2021, 298: 109489. |
| [20] |
LI X Y, WANG C G, ZHANG Z S, et al. Fast detection of duck circovirus by real-time fluorescence-based recombinase-aided amplification[J]. Poult Sci, 2022, 101(3): 101707. |
(编辑 范子娟)



