伪狂犬病(pseudorabies, PR)是由伪狂犬病病毒(pseudorabies virus, PRV)引起的多种家畜和野生动物共患的一种急性传染病。PRV属于疱疹病毒科,α-疱疹病毒亚科,病毒粒子呈球形,直径为180~300 nm,基因组为线性双链DNA,全长大约143 kb,其中,编码的gB、gC、gD、gE及TK等蛋白共同决定病毒毒力。
自2011年以后,PRV发生了变异,导致免疫过Bartha-K61疫苗的猪场仍暴发了伪狂犬病,给养猪业造成了严重的经济损失。近几年,有研究对我国部分地区PRV感染情况进行流行病学调查,对主要糖蛋白(gB、gC、gD和gE)进行遗传进化分析,结果显示大多数阳性样本为国内变异株[1]。同时还有研究发现,部分变异株是由国内野毒株与国外流行株(疫苗株)发生重组而产生的[2-3]。因此,需持续监测PRV变异株分子流行病学情况,并针对性地制定有效的防控措施。
本试验从广东省佛山市某个已免疫过Bartha-K61疫苗的发病猪场的血液样本中分离到1株PRV变异株,命名为GDFS2020,并对家兔的致病性进行研究,旨在为PRV病原学研究及分子流行病学研究提供参考数据。
1 材料与方法 1.1 病料、细胞及实验动物1份疑似PRV感染的病猪血液样本来自广东省佛山市某发病猪场;PRV FS2015株和PK-15细胞均为本实验室保存;6只新西兰白兔购自广东省医学实验动物中心。
1.2 主要试剂4%多聚甲醛固定液购自Biosharp公司;Alexa Fluor-488羊抗兔IgG购自碧云天生物技术有限公司;兔抗PRV多克隆抗体由本实验室制备并保存。
1.3 病毒的间接免疫荧光(IFA)取经空斑纯化后的病毒悬液(1×103 TCID50·mL-1) 接种PK-15细胞,进行IFA试验,具体步骤详见参考文献[4],本试验中一抗为PRV多克隆抗体,稀释倍数为1 ∶100;二抗为Alexa Fluor-488羊抗兔IgG,稀释倍数为1 ∶500。
1.4 病毒的电镜观察将病毒接种PK-15细胞,当出现CPE现象后,弃掉上清液,加入电镜固定液,用细胞刮轻轻刮下细胞收集到离心管内,3 000 r·min-1离心5 min,弃上清后,再加入新的电镜固定液,于4 ℃保存;或反复冻融PK-15细胞2次,5 000 r·min-1离心15 min,取上清液,运用病毒浓缩试剂盒(碧云天,C2901S)浓缩病毒,于4 ℃保存送至赛维尔生物科技有限公司进行电镜观察。
1.5 病毒生长曲线的测定取第6代病毒悬液,接种PK-15细胞后12、24、36、48、60和72 h分别收集细胞上清液,根据Reed-Muench法计算每个时间点上清液的病毒滴度(TCID50),测定病毒的生长曲线。
1.6 分离株主要毒力基因序列分析利用DNASTAR中的Megalign等软件将获得的序列与GenBank已登录的PRV gB、gC、gD、gE和TK基因编码氨基酸序列进行同源性及分子特征分析;并利用MEGA X软件,采用Neighbor-Joining(NJ)法构建gB、gC、gD、gE和TK基因遗传进化树,分析PRV分离株的遗传进化关系。
1.7 家兔感染试验取1×102 TCID50·mL-1的病毒悬液,经皮下注射接种3只新西兰白兔,另外3只皮下接种DMEM培养基作为阴性对照组。每天观察家兔临床症状,组织器官病变情况,并将家兔病变组织用4%多聚甲醛固定后,由赛维尔生物科技有限公司制作病理切片并观察组织病变情况。
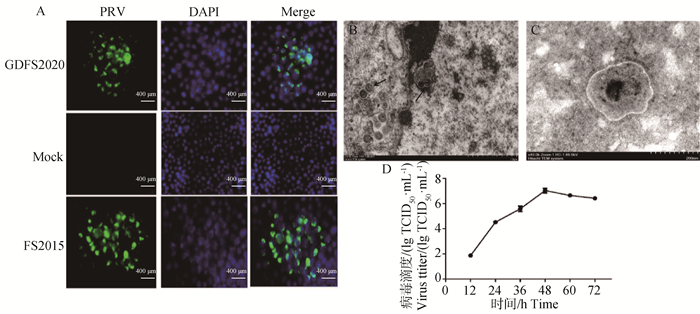
2 结果 2.1 病毒的分离鉴定及生长曲线的测定将GDFS2020株运用IFA和电镜试验进行鉴定,结果显示,接种GDFS2020株的PK-15细胞可见明显的绿色荧光,而阴性对照无荧光,并以FS2015株作为阳性对照(图 1A)。电镜结果显示,靠近核膜的细胞核内及胞质中有多个直径约80 nm的不成熟病毒粒子(图 1B)。负染后电镜下观察,可见成熟病毒粒子直径约170 nm,呈球形,有囊膜,表面有放射状排列的纤突(图 1C)。生长曲线结果显示,在感染48 h后,TCID50达到最高(107.25 TCID50·mL-1)(图 1D)。
|
A.IFA鉴定结果;B、C.电镜观察结果;D.病毒粒子一步法生长曲线测定结果 A. IFA identification results; B, C. Electron microscopic observation; D. One-step growth curve of virus particles 图 1 GDFS2020株分离鉴定 Fig. 1 Isolation and identification of GDFS2020 stain |
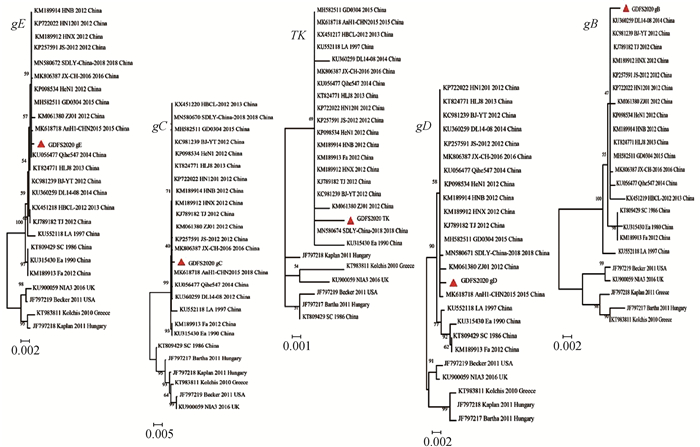
对GDFS2020株的gE、TK、gB、gC及gD基因氨基酸序列分别与欧美株、国内经典株及国内变异株进行同源性分析。结果显示,该毒株主要毒力基因与国内变异株同源性最高。并且gE氨基酸序列在aa48和aa496各有一个天冬氨酸的插入;gB氨基酸序列在aa75―77连续缺失SPG,aa94插入了G;gC氨基酸序列在aa63―69有连续7个氨基酸插入(AAASTPA)。这些分子特征与国内变异株分子变异特征相似,但仍与国内变异株存在个别氨基酸位点的差异。比如该毒株gE氨基酸序列V123A;TK氨基酸序列的V151A和V276D;gB氨基酸序列F464S、V757E;gC氨基酸序列H103R、A336V;gD氨基酸序列R276G等。进化树结果也显示,这5个毒力基因编码氨基酸序列均与国内变异株亲缘关系最近,位于同一分支(图 2)。
|
图 2 PRV GDFS2020株gE、TK、gB、gC和gD基因编码的氨基酸进化树 Fig. 2 Amino acid evolution trees of gE, TK, gB, gC and gD genes of PRV GDFS2020 strain |
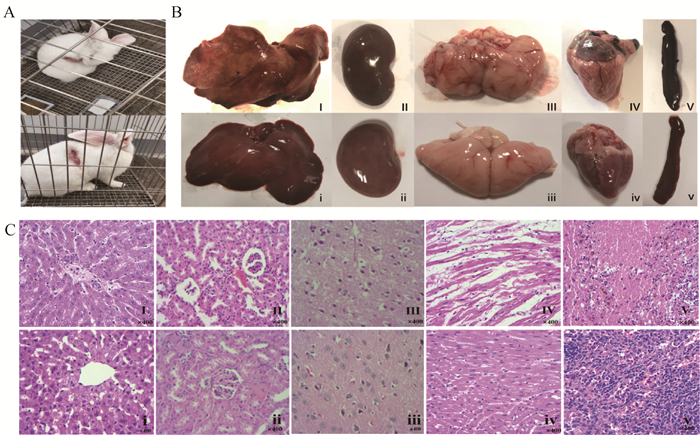
感染GDFS2020株的家兔出现精神萎靡,食欲不振,啃咬接种处等临床症状(图 3A),并在感染3~4 d后全部死亡。剖检接种组家兔各组织器官,结果显示,肝边缘有梗死,心、脾、肾和脑组织有充血出血等现象(图 3B Ⅰ~Ⅴ),对照组家兔组织器官未见明显病变(图 3B ⅰ~ⅴ)。组织病理切片结果显示,肝细胞肿胀变性,淋巴细胞增多;肾小管上皮细胞肿胀崩解脱落,间质局灶性出血;脑部的神经元变性萎缩,核略微皱缩,空隙增多变大,染色变深轻微水肿;心肌纤维肿胀透明变性,心肌纤维断裂;脾白髓红髓间隙红细胞增多,淋巴细胞减少(图 3C Ⅰ~Ⅴ);对照组组织切片未见明显病变(图 3C ⅰ~ⅴ)。以上结果表明,GDFS2020株对家兔具有较强致病性,并能致其死亡。
|
A. 接种组家兔的临床症状;B. 家兔组织剖检变化(Ⅰ~Ⅴ.接种组家兔肝、肾、脑、心、脾;ⅰ~ⅴ. 对应的阴性组家兔组织);C. 家兔组织病理切片观察(Ⅰ~Ⅴ.接种组家兔肝、肾、脑、心、脾的病理切片,ⅰ~ⅴ. 对应的阴性组家兔组织切片)(400×) A. Clinical symptom of rabbits infected with GDFS2020; B. Results of tissue dissection of rabbits (Ⅰ-Ⅴ. Liver, kidney, brain, heart and spleen of rabbits infected with GDFS2020; ⅰ-ⅴ. Corresponding negative tissue); C. Results of pathological section of rabbit tissue (Ⅰ-Ⅴ. Positive pathological section of liver, kidney, brain, heart and spleen of rabbits infected with GDFS2020; ⅰ-ⅴ. Corresponding negative control section)(400×) 图 3 PRV GDFS2020株感染家兔对其致病性结果 Fig. 3 Pathogenicity of PRV GDFS2020 strain in rabbits |
目前,研究表明PRV变异株主要毒力基因存在部分氨基酸位点突变、缺失或插入,这可能是导致PRV毒力及抗原性发生改变的原因,从而导致Bartha-K61疫苗对变异株的保护率降低[5-6]。本研究分离的GDFS2020株gE、gB及gC编码氨基酸序列的分子特征与国内变异株相似[7],表明该毒株为国内变异株。但该毒株gE、gB、gC和gD基因编码氨基酸序列上有多个位点发生了突变,然而这些氨基酸位点的突变是否影响GDFS2020株的毒力及抗原性等问题有待进一步研究。
家兔作为PRV易感动物常被用于评价PRV的致病性和毒力。因此,本研究运用家兔评价GDFS2020株的致病性。结果显示,该毒株感染家兔1 d后出现明显的临床症状;感染3~4 d后接种组家兔全部死亡,剖检后发现肝边缘有梗死,肾、心、脾和脑组织有充血出血等现象,这与前期报道的强毒株对家兔的致病性相一致[8],表明GDFS2020株对家兔具有较强致病性。本研究数据为丰富广东省PRV分子流行病学特征及新流行毒株的疫苗研发提供参考数据。
4 结论本试验成功分离了1株PRV变异株(GDFS2020),对家兔具有较强致病性。
| [1] |
ZHAI X F, ZHAO W, LI K M, et al. Genome characteristics and evolution of pseudorabies virus strains in eastern China from 2017 to 2019[J]. Virol Sin, 2019, 34(6): 601-609. DOI:10.1007/s12250-019-00140-1 |
| [2] |
BO Z Y, MIAO Y R, XI R, et al. Emergence of a novel pathogenic recombinant virus from Bartha vaccine and variant pseudorabies virus in China[J]. Transbound Emerg Dis, 2021, 68(3): 1454-1464. DOI:10.1111/tbed.13813 |
| [3] |
HE W T, AUCLERT L Z, ZHAI X F, et al. Interspecies transmission, genetic diversity, and evolutionary dynamics of pseudorabies virus[J]. J Infect Dis, 2019, 219(11): 1705-1715. DOI:10.1093/infdis/jiy731 |
| [4] |
HUAN C C, ZHOU Z Y, YAO J T, et al. The antiviral effect of Panax notoginseng polysaccharides by inhibiting PRV adsorption and replication in vitro[J]. Molecules, 2022, 27(4): 1254. DOI:10.3390/molecules27041254 |
| [5] |
LUO Y Z, LI N, CONG X, et al. Pathogenicity and genomic characterization of a pseudorabies virus variant isolated from Bartha-K61-vaccinated swine population in China[J]. Vet Microbiol, 2014, 174(1-2): 107-115. DOI:10.1016/j.vetmic.2014.09.003 |
| [6] |
ZHOU M M, WU X J, JIANG D D, et al. Characterization of a moderately pathogenic pseudorabies virus variant isolated in China, 2014[J]. Infect Genet Evol, 2019, 68: 161-171. DOI:10.1016/j.meegid.2018.12.016 |
| [7] |
孙颖, 王雪莹, 梁婉, 等. 2018年伪狂犬病病毒的流行特征及其遗传变异分析[J]. 畜牧兽医学报, 2020, 51(3): 584-593. SUN Y, WANG X Y, LIANG W, et al. Epidemiological and evolutionary characteristics of pseudorabies virus in China in 2018[J]. Acta Veterinaria et Zootechnica Sinica, 2020, 51(3): 584-593. (in Chinese) |
| [8] |
孙雅鑫, 韩剑锋, 荣先锋. 猪伪狂犬病病毒JSSQ2013株的分离鉴定及重要功能基因序列分析[J]. 中国兽药杂志, 2020, 54(4): 1-10. SUN Y X, HAN J F, RONG X F. Isolation and identification of porcine pseudorabies virus (PRV) strain JSSQ2013 and sequence analysis of important functional genes[J]. Chinese Journal of Veterinary Drug, 2020, 54(4): 1-10. (in Chinese) |
(编辑 白永平)



