2. 渭南市动物疫病预防控制中心,渭南 715400;
3. 江苏省动物重要疫病与人兽共患病防控协同创新中心,扬州 225009
2. Weinan Animal Disease Prevent and Control Center, Weinan 715400, China;
3. Jiangsu Co-Innovation Center for the Prevention and Control of Important Animal Infectious Disease and Zoonosis, Yangzhou University, Yangzhou 225009, China
非洲猪瘟(African swine fever,ASF) 是由非洲猪瘟病毒(African swine fever virus,ASFV) 感染猪引起的一种急性、高度接触性传染病。家猪、野猪和蜱是ASFV的主要宿主。临床上通常表现为发热、皮肤发绀,淋巴结、肾、胃肠黏膜明显出血,发病过程短,致死率高达100%[1]。ASF是世界动物卫生组织(WOAH)法定需报告的动物疫病之一,我国农业农村部将其列为一类疫病[2]。该病自1921年首次在肯尼亚发现报道以来,随着疫情发展在东非和南非等地区呈地方流行状态。2007年以来,ASF在全球多个国家发生、扩散和流行,特别是在俄罗斯及其周边地区[3]。2018年8月,我国发生首例ASF疫情,很快蔓延至全国各地,给生猪产业造成很大影响[4]。
ASFV属于非洲猪瘟病毒科非洲猪瘟病毒属,基因组为双股线状DNA,大小170~190 kb,病毒粒子直径为175~215 nm,有囊膜,呈二十面体对称。整个基因组包含150~167个开放阅读框,编码150~200种蛋白,目前,已知有68种结构蛋白和100多种非结构蛋白,表明ASFV具有复杂的结构和增殖过程[5-6]。同时ASFV也表现出了明显的遗传多样性,基因组变异频繁,目前常用B646L进行基因分型研究,根据该基因C端序列可将其分为24个基因型[7]。我国主要以基因Ⅱ型的流行为主,最近也存在基因Ⅰ型的报道[8]。
一直以来,疫苗免疫被认为是防控传染病的重要手段,由于ASFV多数蛋白功能尚未得到解析,对该病有效的防控增加困难。研究者们也对疫苗的研发做出尝试,但目前仍尚无商品化的疫苗。同时常规的抗病毒治疗也不能有效防治,随着病原研究的深入及技术的日趋成熟,对疫苗及药物的研究也会更进一步。目前,对ASF的研究主要集中于结构蛋白,多种诊断方法都是围绕结构蛋白进行研发的,如P72、P30、P54、P62等[9-13]。作为ASFV编码蛋白的重要组成部分,非结构蛋白在病毒复制、宿主细胞代谢调控和免疫逃逸等过程中发挥重要作用[14]。pD205R蛋白是由D205R基因编码的一种非结构蛋白,对其研究鲜见报道。比较基因组研究发现,pD205R蛋白的羧基端部分序列与真核生物RNA聚合酶Ⅱ亚基5 (RPB5)相似,并含有该蛋白超家族的特征结构域,而且RPB5属于真核生物3种RNA聚合酶中的共有亚基,可与起始前复合物中的DNA启动子紧密相连,已被证明与基础转录因子TFIIB相互作用,是潜在的转录激活因子相互作用靶点。同时ASFV也编码类似于TFIIB因子的蛋白质,与RPB5相似基因的存在是该类病毒的基本特征之一,因此推测pD205R参与ASFV转录相关过程[15]。本研究拟利用生物信息学方法对GenBank中的不同ASFV毒株的RNA聚合酶亚基D205R基因序列进行分析,并对pD205R蛋白的理化性质及结构进行了预测,然后构建原核表达质粒对其进行表达,纯化后免疫新西兰大白兔制备抗pD205R的多克隆抗体,为pD205R蛋白的生物学功能研究奠定基础。
1 材料与方法 1.1 主要生物试剂ASFV-CN/SC/2019毒株、ASFV阳性血清、阴性血清由国家非洲猪瘟区域实验室(兰州)保存。限制性内切酶NheⅠ、XhoⅠ,Taq DNA聚合酶、T4DNA连接酶、DNA Marker、蛋白Marker均购自宝生物工程(大连)有限公司;质粒提取试剂盒、PCR产物纯化试剂盒购自OMEGA公司;异丙基硫代-β-D-半乳糖苷(IPTG)购自生工生物工程(上海)股份有限公司;pET-28a(+)载体、Rosetta(DE3)感受态细胞由本实验室保存;辣根过氧化物酶(HRP)标记山羊抗兔IgG、HRP标记山羊抗猪IgG均购自Sigma公司。
1.2 D205R基因的生物信息学分析从GenBank数据库中下载不同基因型ASFV毒株的D205R基因序列,利用DNAStar进行基因序列比对、MEGA7.0构建系统进化树,并利用ExPASy、GOR4、AlphaFold分别对pD205R蛋白理化性质及二级、三级结构预测分析[16]。
1.3 引物的设计及合成参考GenBank中公布的ASFV毒株D205R基因序列,利用Primer 5.0软件设计特异性引物,扩增D205R基因,下划线部分为NheⅠ和XhoⅠ酶切位点,P1: 5′-CTAGCTAGCATGGCCATGCAAAAGTTATTTACGTATATTTACG-3′;P2: 5′-CCGCTCGAGTCAAATTTTGGA CTTGGTGAT- AAAGCGG-3′,引物合成及测序服务由生工生物工程有限公司(上海)完成。
1.4 ASFV D205R基因的扩增及重组质粒构建以ASFV-CN/SC/2019基因组为模板进行目的基因扩增,50 μL PCR反应体系:2× Mix Buffer 25 μL,模板2 μL,上、下游引物各1 μL,ddH2O 21 μL。PCR反应程序: 95 ℃ 5 min;95 ℃ 30 s,56 ℃ 30 s,72 ℃ 40 s,35个循环;72 ℃10 min。扩增产物用1% 琼脂糖凝胶电泳检测。将D205R基因PCR产物与pET-28a双酶切产物纯化后,利用T4 DNA连接酶将两种酶切产物4 ℃连接过夜,随后转化至Rosetta(DE3)感受态细胞,挑取单克隆进行菌液PCR、双酶切和测序鉴定。
1.5 重组蛋白pD205R的诱导表达及可溶性分析将鉴定正确的重组表达菌液按照1∶100的量接种到含有卡那霉素抗性的2 ×YT培养基中,37 ℃,220 r·min-1培养至OD600 nm为0.6~0.8,加入终浓度为1.0 mmol·L-1 IPTG进行诱导表达,每隔2 h收集菌液,直至14 h,筛选最佳诱导时间。将菌液按照最佳表达时间诱导表达后离心收集菌体,加适量PBS重悬,-80 ℃反复冻融3次,超声破碎后离心分别收集上清和沉淀(包涵体),通过SDS-PAGE电泳进行可溶性分析。
1.6 重组蛋白的纯化和鉴定采用镍柱亲和层析方法纯化pD205R重组蛋白。纯化后的pD205R经SDS-PAGE电泳后转印至PVDF膜,在室温条件下用5%的脱脂乳封闭1 h,TBST洗涤3次,将ASFV阳性血清和阴性血清分别1∶300稀释后作为一抗,4 ℃孵育过夜,TBST洗涤3次,以HRP标记的山羊抗猪IgG作为为二抗,按1∶5 000稀释后室温孵育1 h,TBST洗涤3次,利用Bio-RAD Chemi Doc XRS凝胶成像系统进行分析。
1.7 多克隆抗体的制备与鉴定将纯化的pD205R重组蛋白(300 μg·只-1)与等体积的弗氏完全佐剂乳化后采用背部皮下分点注射的方式免疫新西兰大白兔,同时免疫前耳缘静脉采集阴性血清。首次免疫后每间隔2周,采用重组蛋白(150 μg·只-1)与等体积的弗氏不完全佐剂乳化后加强免疫,三免后1周采集血液,分离兔血清。
1.8 多克隆抗体效价测定采用间接酶联免疫吸附试验(ELISA)测定制备的抗pD205R蛋白的多克隆抗体的效价。按照0.5 μg·孔-1重组蛋白包被ELISA酶标板,4 ℃过夜;PBST洗涤3次;用2% BSA 200 μL·孔-1于37 ℃封闭1 h,PBST洗涤3次;将采集的免疫血清按要求稀释后100 μL·孔-1加入酶标板,同时以免疫前阴性血清为对照,37 ℃孵育1 h,PBST洗涤3次;HRP标记山羊抗兔IgG抗体1∶5 000稀释,100 μL·孔-1加入酶标板,37 ℃孵育1 h,PBST洗涤3次;按100 μL·孔-1加入TMB显色液避光显色10 min,用等量的H2SO4(0.3 mol·L-1)终止反应,测定OD450 nm值,并根据P/N≥2.1判定效价。
1.9 多克隆抗体反应性分析1.9.1 Western blot鉴定多克隆抗体与天然蛋白的反应性 将PAMs铺至6孔板,过夜培养后加入ASFV(MOI=0.2),分别在感染12和24 h收集细胞,用PBS轻洗后,加入500 μL RIPA裂解液于冰上裂解30 min,12 000 g 4 ℃离心30 min,吸取上清至新的离心管,SDS-PAGE电泳后,转印至PVDF膜,5% 脱脂乳室温封闭1 h,制备的多克隆抗体1∶100稀释后作为一抗4 ℃过夜孵育,以HRP标记的山羊抗兔的IgG抗体作为二抗,室温孵育1 h后,加入显色液曝光分析多克隆抗体的反应性。
1.9.2 间接免疫荧光试验(IFA)鉴定多克隆抗体与天然蛋白的反应性 将PAMs平铺于激光共聚焦显微镜专用平皿,培养12 h,待细胞贴壁后,加入ASFV感染24 h,弃上清,PBS轻洗3次,4%的多聚甲醛室温固定10 min,PBS轻洗3次,加入0.5% Triton-100室温静置10 min,PBS轻洗3次,加入3%的BSA室温封闭30 min,PBS轻洗后加入1∶100稀释的多克隆抗体4 ℃过夜孵育,PBS轻洗,加入荧光二抗室温孵育1 h,PBS轻洗,加入1∶2 000稀释DAPI,避光染色3 min,弃去DAPI,PBS轻洗后观察荧光反应。
2 结果 2.1 ASFV D205R基因生物信息学分析2.1.1 D205R基因序列比较分析 利用DNAStar对GenBank数据库中不同毒株不同基因型的ASFV D205R基因比较分析,结果显示普遍流行的基因Ⅰ型和Ⅱ型,相似性高达99%以上,其他基因型的同源性也较高。尽管不同基因型核苷酸序列同源性略有差异,但多数基因型该蛋白相似性高达100%。同时通过MEGA7.0构建系统进化树,结果显示,各基因型分布与同源性分析基本一致。其中,基因Ⅰ型和Ⅱ型属同一分支,在遗传演化过程中的亲缘关系较近,相似性明显高于其他基因型,说明在基因进化中存在一定的关联性。其他基因型形成较为独立的分支,亲缘关系相对较远。
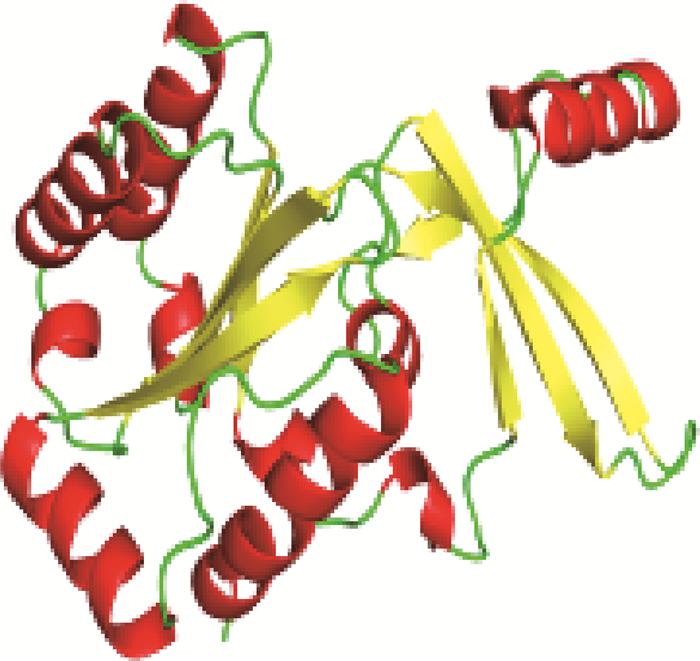
2.1.2 pD205R蛋白理化性质分析及结构预测 利用ExPASy在线软件分析pD205R蛋白理化性质显示:蛋白的分子式为C1088H1712N278O295S8,分子量约为23.66 ku;共编码205个氨基酸,含量较高的氨基酸主要是Ile(I)10.7%,Leu (L)8.8%;无跨膜区,无信号肽,理论等电点(PI)为7.84。其稳定系数为40.07,总平均亲水性为-0.019(正值表明为疏水蛋白,负值为亲水蛋白),说明该蛋白为亲水蛋白且稳定性差。二级结构经GOR4在线软件预测,显示α螺旋占35.12%,无规卷曲占27.80%,扩展链占25.85%,β折叠占11.22%,说明α螺旋是该蛋白二级结构的主要结构形式(表 1)。同时利用AlphaFold在线软件预测其三级结构模型,显示α螺旋是高级结构的主要形式(图 1)。
|
|
表 1 pD205R蛋白二级结构预测 Table 1 Prediction of pD205R protein secondary structure |
|
红色代表α-螺旋,黄色表示β-转角,绿色代表不规则卷曲 Red represents α-helix, yellow represents β-turn, and green represents irregular coils 图 1 pD205R蛋白三级结构预测 Fig. 1 Prediction of tertiary structure of pD205R protein |
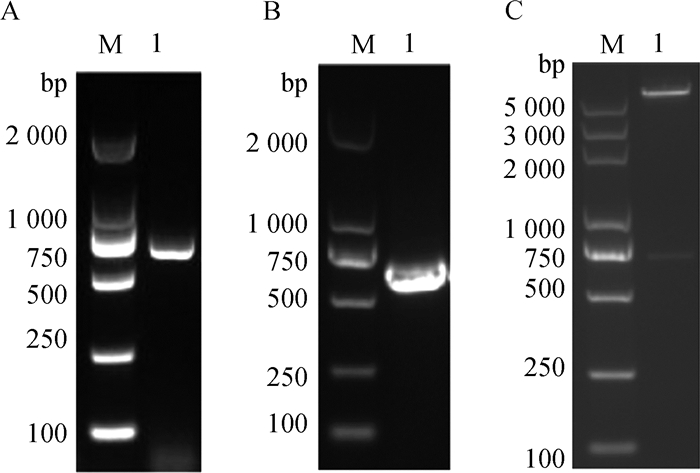
用P1/P2特异性引物对D205R基因进行PCR扩增,产物经1%琼脂糖凝胶电泳检测得到约618 bp的目的条带,与预期结果相符(图 2A)。将其PCR产物及pET-28a(+)双酶切后连接,构建pET-28a-D205R重组原核表达载体,重组表达载体转化至Rosetta(DE3)感受态细胞,通过菌液PCR筛选阳性克隆(图 2B),重组质粒经NheⅠ和XhoⅠ双酶切及测序鉴定,结果显示, pET-28a-D205R重组质粒构建成功(图 2C)。
|
A. D205R基因PCR产物电泳鉴定;B. pET-28a-D205R菌液PCR电泳鉴定;C. pET-28a-D205R双酶切电泳鉴定 A. Electrophoretic identification of D205R gene PCR product; B. Electrophoretic identification of PCR product of pET-28a-D205R bacteria solution; C. Electrophoretic identification of pET-28a-D205R by double digestion 图 2 pET-28a-D205R重组质粒构建与鉴定 Fig. 2 Construction and analysis of recombinant plasmid pET-28a-D205R |
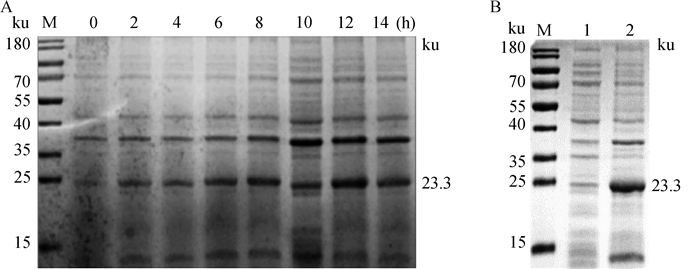
将筛选鉴定正确的阳性重组菌,经终浓度为1 mmol·L-1 IPTG诱导表达,SDS-PAGE分析重组蛋白pD205R表达情况,结果显示蛋白大小约为23.3 ku,与理论分析值相符合,诱导表达的蛋白在12 h时表达量较高(图 3A)。收集菌体离心后经超声裂解进行可溶性分析,重组蛋白主要存在于包涵体(图 3B)。
|
A.不同诱导时间(0~14 h)的表达分析(M.蛋白质相对分子质量标准);B.重组蛋白的可溶性分析(M.蛋白质相对分子质量标准; 1.上清; 2.沉淀) A. Expression analysis of different induction time (0-14 h); B. Soluble analysis of recombinant protein (M. Protein marker; 1. Supernatant; 2. Sedimentation) 图 3 pD205R重组蛋白表达分析 Fig. 3 Expression analysis of recombinant pD205R protein |
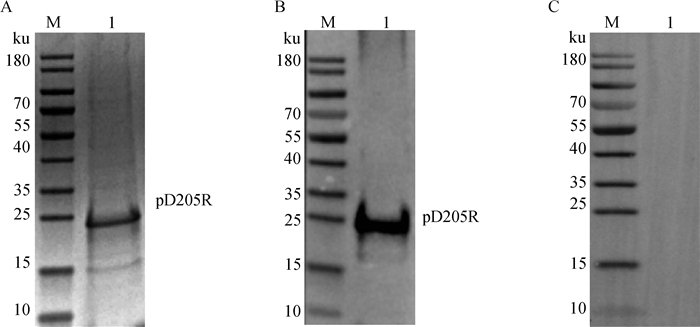
将超声裂解后收集的包涵体,通过镍柱亲和层析方法纯化后SDS-PAGE检测显示重组蛋白条带单一、大小与目的蛋白一致(图 4A),表明得到纯度较好的pD205R蛋白。纯化后的pD205R重组蛋白经SDS-PAGE电泳,然后转印至PVDF膜进行蛋白反应原性鉴定。Western blot结果显示,获得的重组蛋白与ASFV阳性血清发生特异性反应(图 4B),不与阴性血清反应(图 4C),表明重组蛋白具有良好的反应原性。
|
A. SDS-PAGE鉴定纯化效果; B、C. Western blot鉴定反应原性(B.阳性血清;C.阴性血清); 1. pD205R A. Identification of purification effect by SDS-PAGE; B, C. Western blot identification of the reactivity (B. Positive serum; C. Negative serum); 1. pD205R 图 4 pD205R重组蛋白纯化与反应原性鉴定 Fig. 4 Purification and reactivity identification of recombinant pD205R protein |
将纯化和鉴定的pD205R重组蛋白免疫新西兰大白兔制备多克隆抗体,3次免疫后收集家兔血清,采用间接ELISA方法测定抗体效价。结果显示抗pD205R蛋白的多克隆抗体的效价达到1∶51 200,说明经纯化后的pD205R重组蛋白免疫后能够诱导动物机体产生较高水平的抗体。
2.6 多克隆抗体的反应性鉴定Western blot分析结果显示(图 5A),免疫家兔后制备的抗pD205R重组蛋白的多克隆抗体能够很好地识别ASFV感染的PAMs中表达的天然pD205R蛋白。同时IFA结果显示(图 5B):在ASFV感染24 h后的细胞内能够观察到明显的绿色荧光,说明制备多克隆抗体能够识别ASFV感染PAMs细胞后表达的pD205R蛋白,表明制备的多克隆抗体具有良好的反应性。
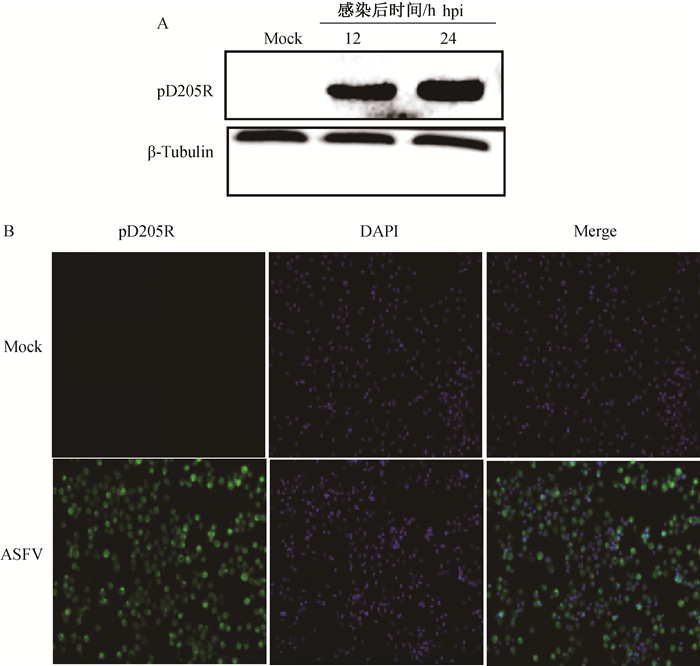
|
A. Western blot鉴定;B. IFA鉴定 A. Western blot identification; B.IFA identification 图 5 多克隆抗体与天然蛋白的反应性鉴定 Fig. 5 Reactivity identification of polyclonal antibody against native protein |
ASF是一种高度接触性传染病,已给全球生猪养殖产业带来严重的经济损失。ASFV主要感染单核巨噬细胞等免疫细胞,通过抑制细胞凋亡、宿主免疫应答等策略逃逸宿主免疫系统[17-18]。ASFV是目前唯一已知的虫媒DNA病毒,属于核质大DNA病毒,编码的蛋白种类繁多,其中非结构蛋白100多种,主要参与病毒自身复制、宿主细胞代谢及免疫逃逸等[14]。同时研究发现ASFV具有与痘病毒和真核生物相似的基因转录过程,其编码的RNA聚合酶具有与真核生物RNA聚合酶Ⅱ相似的组成结构[15, 19]。主要表现为ASFV编码的pNP1450L、pH359L、pD205R、pC147L、pD339L和pCP80R六种非结构蛋白分别与宿主RNA聚合酶RPB1、RPB3、RPB5、RPB6、RPB7和RPB10的6个亚基相似,参与ASFV基因转录及mRNA加工[20]。pD205R蛋白与真核生物RNA聚合酶Ⅱ亚基5 (RPB5)相似,且RPB5属于真核生物3种RNA聚合酶中的共有亚基[21]。同时,通过对国内外不同毒株、不同基因型的D205R基因序列比对结果分析发现该基因高度保守,遗传变异小,这与先前报道的ASFV基因组中存在高度保守的基因结果一致[16]。但目前关于pD205R的功能研究报道较少,相关作用机制也暂不清楚,鉴于pD205R与真核生物中RNA聚合酶Ⅱ的主要亚基RPB5相似,推测该蛋白在ASFV转录过程中可能发挥重要作用。
本研究运用生物信息学方法对GenBank中公布的不同毒株ASFV RNA聚合酶亚基D205R基因进行序列分析,发现该基因同源性较高,且高度保守,蛋白理化性质及结构预测显示,其属于不稳定的亲水性蛋白,α螺旋是构成其高级结构的主要形式。同时对国家非洲猪瘟区域实验室(兰州)保存的ASFV基因组中D205R基因进行了扩增,并选择在常用的原核表达系统中诱导表达pD205R蛋白,通过纯化、SDS-PAGE及Western blot鉴定,获得纯度较高的pD205R蛋白,具有良好的反应原性。同时免疫新西兰大白兔制备多克隆抗体,能够很好地识别ASFV感染细胞中表达的天然pD205R蛋白,这为后期研究该蛋白的诊断方法及功能奠定了一定的基础。
4 结论ASFV D205R基因在不同基因型的不同毒株之间高度保守,在田间猪群流行的基因Ⅰ型和Ⅱ型之间的相似性高达100%。α螺旋是该蛋白二级结构和三级结构的主要结构形式。纯化的重组蛋白与ASFV阳性血清反应性较好,制备的多克隆抗体能够特异性地识别天然pD205R蛋白;IFA结果表明,D205R主要分布于细胞质中,推测主要参与ASFV在细胞质中的基因转录。本研究获得的数据可为进一步研究D205R在病毒感染中的作用提供依据。
| [1] |
ARABYAN E, KOTSYNYAN A, HAKOBYAN A, et al. Antiviral agents against African swine fever virus[J]. Virus Res, 2019, 270: 197669. DOI:10.1016/j.virusres.2019.197669 |
| [2] |
中华人民共和国农业农村部. 中华人民共和国农业农村部公告第573号[EB/OL]. (2022-08-30)[2023-03-21]. http://www.moa.gov.cn/nybgb/2022/202208/202208/t20220830_6408131.htm. Ministry of Agriculture and Rural Affairs, PRC. Announcement No. 573 of the Ministry of Agriculture and Rural Affairs of the People's Republic of China[EB/OL]. (2022-08-30)[2023-03-21]. http://www.moa.gov.cn/nybgb/2022/202208/202208/t20220830_6408131.htm. (in Chinese) |
| [3] |
欧云文, 马小元, 王俊, 等. 非洲猪瘟分子病原学及分子流行病学研究进展[J]. 中国兽医学报, 2018, 38(2): 416-420. OU Y W, MA X Y, WANG J, et al. Advances in studies of molecular etiology and molecular epidemiology for African swine fever[J]. Chinese Journal of Veterinary Science, 2018, 38(2): 416-420. DOI:10.16303/j.cnki.1005-4545.2018.02.32 (in Chinese) |
| [4] |
王清华, 任炜杰, 包静月, 等. 我国首例非洲猪瘟的确诊[J]. 中国动物检疫, 2018, 35(9): 1-4. WANG Q H, REN W J, BAO J Y, et al. The first outbreak of African swine fever was confirmed in China[J]. China Animal Health Inspection, 2018, 35(9): 1-4. DOI:10.3969/j.issn.1005-944X.2018.09.001 (in Chinese) |
| [5] |
CHAPMAN D A G, TCHEREPANOV V, UPTON C, et al. Comparison of the genome sequences of non-pathogenic and pathogenic African swine fever virus isolates[J]. J Gen Virol, 2008, 89(2): 397-408. DOI:10.1099/vir.0.83343-0 |
| [6] |
ALEJO A, MATAMOROS T, GUERRA M, et al. A proteomic atlas of the African swine fever virus particle[J]. J Virol, 2018, 92(23): e01293-18. |
| [7] |
朱利敏, 邹兴启, 赵启祖. 非洲猪瘟病毒多样性[J]. 病毒学报, 2021, 37(3): 719-725. ZHU L M, ZOU X Q, ZHAO Q Z. Diversity of African swine fever virus[J]. Chinese Journal of Virology, 2021, 37(3): 719-725. (in Chinese) |
| [8] |
SUN E C, HUANG L Y, ZHANG X F, et al. Genotype I African swine fever viruses emerged in domestic pigs in China and caused chronic infection[J]. Emerg Microbes Infect, 2021, 10(1): 2183-2193. DOI:10.1080/22221751.2021.1999779 |
| [9] |
王晓丽, 孙蕾, 刘文军, 等. 非洲猪瘟病毒编码蛋白功能研究进展[J]. 微生物学通报, 2019, 46(7): 1827-1836. WANG X L, SUN L, LIU W J, et al. Advances in the functions of African swine fever virus-encoded proteins[J]. Microbiology China, 2019, 46(7): 1827-1836. (in Chinese) |
| [10] |
张锦, 陈艳, 邹剑文, 等. 非洲猪瘟病毒p30蛋白的原核表达及间接ELISA抗体检测方法的建立与应用[J]. 畜牧与兽医, 2022, 54(3): 83-90. ZHANG J, CHEN Y, ZOU J W, et al. Prokaryotic expression of p30 protein and establishment and application of an indirect ELISA antibody detection method for ASFV[J]. Animal Husbandry & Veterinary Medicine, 2022, 54(3): 83-90. (in Chinese) |
| [11] |
戴建华, 王豪伟, 张紫菡. 基于p54的非洲猪瘟抗体胶体金检测方法建立[J]. 中国动物传染病学报, 2021, 29(6): 50-54. DAI J H, WANG H W, ZHANG Z H. Development of p54 based colloidal gold detection method for detection of African swine fever antibodies[J]. Chinese Journal of Animal Infectious Diseases, 2021, 29(6): 50-54. (in Chinese) |
| [12] |
刘靖. 非洲猪瘟病毒CD2v、p30和pK205R蛋白的表达纯化与p30、pK205R蛋白单克隆抗体的制备[D]. 北京: 中国农业科学院, 2021. LIU J. Expression and purification of CD2v, p30 and pK205R proteins of African swine fever virus and preparation of monoclonal antibodies against p30 and pK205R proteins[D]. Beijing: Chinese Academy of Agricultural Sciences, 2021. (in Chinese) |
| [13] |
杨文兵, 邹亚文, 蒋一凡, 等. 非洲猪瘟血清学诊断靶点的研究进展[J]. 畜牧兽医学报, 2021, 52(5): 1208-1217. YANG W B, ZOU Y W, JIANG Y F, et al. Advances research on African swine fever serological diagnostic targets[J]. Acta Veterinaria et Zootechnica Sinica, 2021, 52(5): 1208-1217. (in Chinese) |
| [14] |
欧云文, 刘俐君, 贾宁, 等. 非结构蛋白在非洲猪瘟病毒感染中作用[J]. 病毒学报, 2021, 37(4): 910-921. OU Y W, LIU L J, JIA N, et al. Roles of African swine fever virus nonstructural proteins in viral infection[J]. Chinese Journal of Virology, 2021, 37(4): 910-921. (in Chinese) |
| [15] |
RODRÍGUEZ J M, SALAS M L. African swine fever virus transcription[J]. Virus Res, 2013, 173(1): 15-28. |
| [16] |
侯景, 申超超, 张大俊, 等. 非洲猪瘟病毒解旋酶D1133L基因序列分析、蛋白结构预测及亚细胞定位[J]. 畜牧兽医学报, 2021, 52(7): 1953-1962. HOU J, SHEN C C, ZHANG D J, et al. Gene sequence analysis, protein structure prediction and subcellular localization of African swine fever virus helicase D1133L[J]. Acta Veterinaria et Zootechnica Sinica, 2021, 52(7): 1953-1962. (in Chinese) |
| [17] |
刘弘知, 熊丹, 潘志明, 等. 非洲猪瘟病毒逃逸天然免疫的研究进展[J]. 中国兽医科学, 2022, 52(10): 1323-1327. LIU H Z, XIONG D, PAN Z M, et al. Research progresson in innate immune evasion of African swine fever virus[J]. Chinese Veterinary Science, 2022, 52(10): 1323-1327. (in Chinese) |
| [18] |
赵旭阳, 靳家鑫, 路闻龙, 等. 非洲猪瘟病毒免疫逃逸分子机制研究进展[J]. 畜牧兽医学报, 2022, 53(7): 2074-2082. ZHAO X Y, JIN J X, LU W L, et al. Advances in the molecular mechanism of immune escape of african swine fever virus[J]. Acta Veterinaria et Zootechnica Sinica, 2022, 53(7): 2074-2082. (in Chinese) |
| [19] |
ZHANG D W, RODRÍGUEZ-MOLINA J B, TIETJEN J R, et al. Emerging views on the CTD code[J]. Genet Res Int, 2012, 2012: 347214. |
| [20] |
IYER L M, BALAJI S, KOONIN E V, et al. Evolutionary genomics of nucleo-cytoplasmic large DNA viruses[J]. Virus Res, 2006, 117(1): 156-184. |
| [21] |
钱虹萍, 陈博, 林金星, 等. RNA聚合酶Ⅱ动态调控及其成像技术的研究进展[J]. 生物技术通报, 2021, 37(4): 293-302. QIAN H P, CHEN B, LIN J X, et al. Recent advances on dynamic regulation and imaging techniques of RNA polymerase Ⅱ[J]. Biotechnology Bulletin, 2021, 37(4): 293-302. (in Chinese) |
(编辑 白永平)



