2. 新疆农业大学动物科学学院, 乌鲁木齐 830052;
3. 瓦赫宁根大学与研究中心, P. O. Box 338, 6700 AH 瓦赫宁根, 荷兰;
4. 北京首农畜牧发展有限公司, 北京 100029;
5. 拉萨市城关区农业农村局, 拉萨 850000;
6. 西藏自治区农牧科学院畜牧兽医研究所, 拉萨 850000;
7. 北京交通大学生命科学与生物工程研究院, 北京 100044;
8. 山南市畜牧兽医总站, 山南 856000
2. College of Animal Science, Xinjiang Agricultural University, Urumqi 830052, China;
3. Wageningen University and Research Center, P. O. Box 338, 6700 AH Wageningen, Netherlands;
4. Beijing Sunlon Livestock Development Co. Ltd., Beijing 100029, China;
5. Agricultural and Rural Bureau of Chengguan District of Lhasa, Lhasa 850000, China;
6. Institute of Animal Husbandry and Veterinary Medicine, Academy of Agriculture and Animal Husbandry of Tibet Autonomous Region, Lhasa 850000, China;
7. Institute of Life Science and Bioengineering, Beijing Jiaotong University, Beijing 100044, China;
8. Shannan Animal Husbandry and Veterinary General Station, Shannan 856000, China
西藏地区高寒、低氧,基础物资十分匮乏,牦牛和本地黄牛泌乳性能不足,长期无法满足人们对奶制品的迫切需求[1]。自21世纪初,西藏自治区开始进行本地黄牛改良和奶牛的引进工作[2-4],然而综合疾病发生率、生产性能发挥等情况可认为引进奶牛未表现出对高原环境较强的适应性[5],且杂交牛随着级进杂交代次增加也开始出现不适应高原的症状[3]。高原的低氧应激会导致全身心血管系统、器官、组织和细胞供氧不足[6],奶牛为适应低氧环境常表现出不同程度的生理性反应,包括呼吸心跳加快、肺动脉压升高等,同时伴随红细胞数目、动脉氧分压等血液指标的变化[7]。
血液参数被认为是衡量动物适应高原的重要指标,直接反映动物体能否适应低氧环境[8]。其中,血常规指标主要通过检测血液中细胞数量和形态的变化直接反映机体生理状态的改变,分为参与机体免疫应答的白细胞系统,负责氧气和二氧化碳运输的红细胞系统,和起到止血和凝血的作用的血小板系统[9]。血气生化分析已广泛应用于人类临床医学领域,能够快速完成血气、电解质和生化指标的检测,客观反映机体的酸碱平衡状态、呼吸和代谢功能[10]。但是由于条件的限制和测试成本等因素,血气指标的测定在动物医学临床实践中应用很少,尤其对于高原奶牛的血气指标缺乏必要的了解。
本研究对拉萨市城关区两个规模化奶牛场展开大规模血液指标测定,并分析了月龄、荷斯坦牛血统比例、泌乳阶段和测定时间等因素对血液指标的影响,旨在为高原奶牛部分血液指标群体参数提供参考,为奶牛饲养管理、健康监测和和群体改良方案的完善提供理论依据。
1 材料与方法 1.1 试验动物试验群体来自西藏自治区拉萨市城关地区海拔3 700 m的高标准奶牛养殖中心和嘎巴生态牧场2个规模化牛场,包括435头不同纯度的健康荷斯坦牛,其中428头进行了血常规测定,260头进行了血气、电解质和生化指标测定。牧场每天上料时间为9 ∶30、15 ∶00和20 ∶00,挤奶时间为8 ∶00-10 ∶30和18 ∶45-21 ∶15。
1.2 样品采集与测定1.2.1 血常规指标测定 使用一次性采血针和抗凝真空采血管于2021年7月采集试验牛尾根静脉血样5 mL,于24 h内送至幸运宠物医院(拉萨),利用BC-2800Vet全自动动物血液细胞分析仪(迈瑞,深圳)进行指标测定。共检测18项血常规指标,分别为白细胞计数(white blood cell count,WBC)、淋巴细胞计数(lymphocyte cell count,LymphC)、单核细胞计数(mononuclear cell count,MonC)、粒细胞计数(granulocyte cell count,GranC)、淋巴细胞百分比(lymphocyte cell ratio,LymphR)、单核细胞百分比(mononuclear cell ratio,MonR)、粒细胞百分比(granulocyte cell ratio,GranR)、红细胞计数(red blood cells,RBC)、血红蛋白浓度(hemoglobin,HGB)、红细胞压积(hematocrit,HCT)、平均红细胞体积(mean corpuscular volume,MCV)、平均红细胞血红蛋白含量(mean corpuscular hemoglobin,MCH)、平均红细胞血红蛋白浓度(mean corpuscular hemoglobin concentration,MCHC)、红细胞分布宽度(red blood cell distribution width,RDW)、血小板计数(platelet count,PLT)、平均血小板体积(mean platelet volume,MPV)、血小板分布宽度(platelet distribution width,PDW)和血小板压积(plateletcrit,PCT),并按照血液细胞类型分为3类。
1.2.2 血气、电解质、生化指标测定 使用一次性人体动脉血样采集器(天地和协,北京)于2021年7月采集试验牛尾根动脉血样3 mL,于1 h内利用PL2000Plus血气生化分析仪(普朗医疗,南京)测定。检测10项指标,其中血气指标包括氧分压(partial pressure of oxygen,PO2)、二氧化碳分压(partial pressure of carbon dioxide,PCO2)和酸碱度(pH),电解质指标包括钾离子浓度(K+)、钠离子浓度(Na+)、钙离子浓度(Ca2+)和氯离子浓度(Cl-),生化指标包括葡萄糖浓度(glucose,GLU)和乳酸浓度(lactic acid,LAC),此外,还包括1项血常规指标HCT。
1.2.3 奶牛个体信息收集 试验奶牛的月龄和泌乳天数(days in milk,DIM)均通过牧场阿菲金系统记录获得。血统比例通过GGP-150K芯片测定由纽勤中国实验室评估获得荷斯坦牛血统所占比例。评定人员通过目测和触摸奶牛隐窝、臀角及腰角等部位,结合整体印象及经验进行体况评分(body condition scoring,BCS)。采用5分制评定系统[11],0.25分为一间隔。评定时牛体应自然站立。
1.3 统计分析1.3.1 描述性统计 利用R语言软件(v.4.1.2)计算各指标平均值、标准差、变异系数、最小值、最大值、上四分位数和下四分位数。
1.3.2 相关性分析 利用R语言软件(v.4.1.2)corrplot包和ggcorrplot包计算血常规各指标之间及血气、电解质和生化指标之间的Pearson相关系数和显著性,以P < 0.05为显著相关。
1.3.3 方差分析 利用SAS 9.2软件的GLM过程进行方差分析,计算每个影响因素下各水平的最小二乘均值和标准误,利用Bonferroni t检验进行多重比较,P < 0.05表示差异显著。方差分析采用以下固定模型:
| $ \begin{gathered} Y_{i j k l m}=\mu+ { herd }_i+D I M_j+B_{k S_k}+ { test }_l+ \\ \alpha a \mathrm{ge}+\beta { breed }+e_{i j k l m} \end{gathered} $ | (1) |
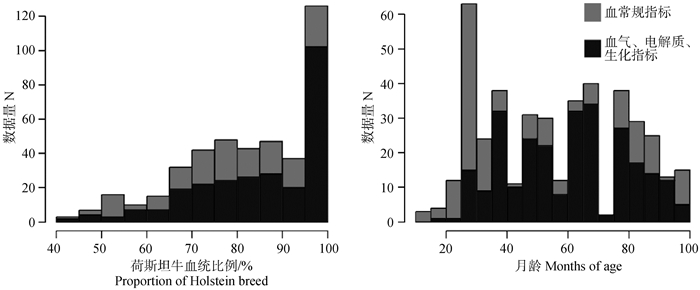
式中,Yijklmn表示血常规、血气、电解质、生化指标;μ表示总体平均数;herd表示牛场效应(i=1,2);DIM表示泌乳阶段效应(j=1,2,3,4,5,6);BCS表示体况评分效应(k=1,2,3,4,5,6);test在Yijklmn为血常规指标时表示测定间隔效应(l=1,2),test在Yijklmn为血气、电解质、生化指标的测定时间效应(l=1,2,3,4,5);age为月龄协变量;breed为荷斯坦牛血统比例协变量;α、β分别为协变量回归系数;eijklmn表示随机残差。各效应不同水平数据量如表 1和图 1所示。
|
|
表 1 方差分析各效应不同水平数据量 Table 1 The amount of data at different levels for each effect of ANOVA |
|
图 1 方差分析中不同荷斯坦牛血统比例和不同月龄的数据量分布直方图 Fig. 1 Histograms of data volume distribution for different proportion of Holstein breed and different months of age in ANOVA |
428头试验牛的18项血常规指标的描述性统计结果如表 2所示。其中,RBC远多于WBC和PLT,而PLT变异系数为18血常规指标中最大的55.33%,远高于WBC(27.92%)和RBC(10.7%)。3种白细胞中,MonC的数量最少,占白细胞总数的8.68%,其次为LymphC (35.8%)和GranC(55.21%)。虽然细胞比例指标(LymphR、MonR和GranR)的变异系数均小于对应的细胞计数指标(LymphC、MonC和GranC),但LymphR和GranR极差可高达50.2%和54.7%。与白细胞系统和血小板系统相比,红细胞系统的各指标变异程度小,其变异系数范围为2.75% ~ 10.70%。两体积指标中,MCV的均值为47.99 fL,约为MPV均值的8倍;两压积指标中,HCT的均值为33.11%,约为PCT均值的144倍。
|
|
表 2 高原地区奶牛血常规指标的描述性统计 Table 2 Descriptive statistics of routine blood hematological parameters in dairy cows at high-altitude area |
本研究对260头试验牛的血气、电解质、生化指标进行了描述性统计分析,结果见表 3。动脉血中,PO2的均值为11.28 kPa,约为PCO2均值的3倍。动脉血pH的均值为7.51,最大值7.593,最小值为7.396,表明动脉血呈弱碱性。Na+和Cl-的浓度均大于100 mmol ·L-1,远高于K+(4.08 mmol ·L-1)和Ca2+(1.01 mmol ·L-1)。在动脉血生化指标中,GLU的均值为3.16 mmol ·L-1,而LAC的均值小于1 mmol ·L-1。此外,动脉血HCT的均值为40.42%,比静脉血HCT(表 2)的检测结果高了7.31%。所测的血气、电解质、生化指标中,LAC和HCT的变异系数较大,分别为26.26%和18.43%,其余指标的变异系数均小于15%,其中pH的变异系数最小,仅为0.45%。
|
|
表 3 高原地区奶牛血气、电解质、生化指标的描述性统计 Table 3 Descriptive statistics of blood gas indexes, electrolyte indexes, and biochemical parameters in dairy cows at high-altitude area |
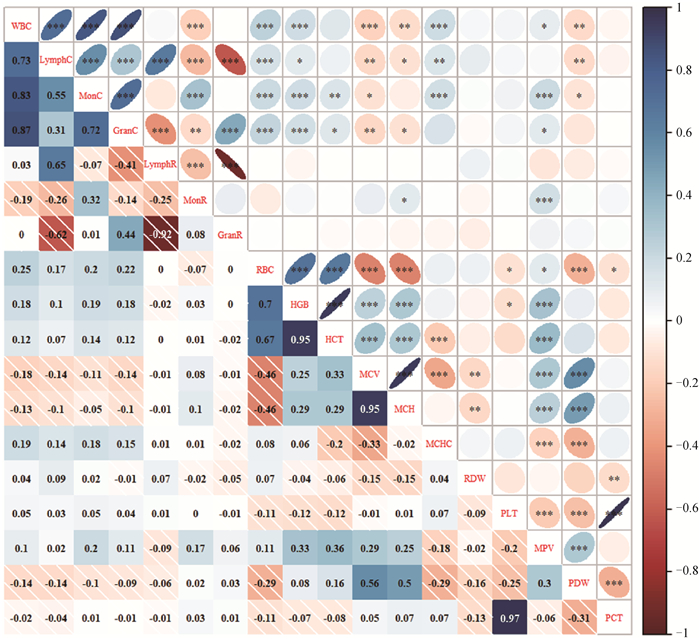
血常规指标之间的相关分析结果显示(图 2),同一系统内指标之间相关性普遍高于不同系统指标之间的相关性,此外,红细胞系统与血小板系统之间具有较高的相关性。白细胞系统的细胞数目类指标(WBC、LymphC、MonC和GranC)之间均呈极显著(P < 0.001)正相关关系,其中WBC与GranC之间的相关系数最高,数值为0.87。白细胞系统的细胞比例指标(LymphR、MonR和GranR)中LymphR与GranR呈高度负相关(P < 0.001),相关系数为-0.92。红细胞系统中,RBC与HGB、HCT呈中等正相关关系(P < 0.001),与MCV、MCH呈中等负相关关系(P < 0.001)。此外,HGB和HCT之间,以及MCV和MCH之间具有高度的正相关关系(P < 0.001),相关系数均为0.95。血小板系统4项指标中,PLT和PCT具有显著的相关关系(P < 0.001),相关系数为0.97,其余指标间相关程度较低。
|
*、**、***分别表示显著性P < 0.05、P < 0.01和P < 0.001。下图同 *, **, *** indicate significance at P < 0.05, P < 0.01, and P < 0.001 levels, respectively. The same as below 图 2 高原地区奶牛血常规指标相关分析结果 Fig. 2 Results of the correlation analysis among blood hematological parameters in dairy cows at high-altitude area |
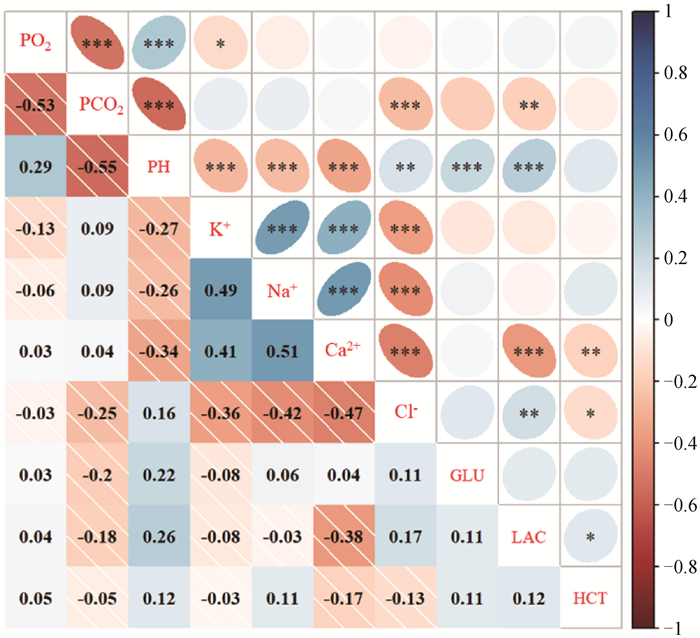
在血气、电解质和生化指标的相关分析结果中(图 3),除HCT外,pH与其余指标均有极显著的相关关系(P < 0.01),其中与PCO2的相关程度最高,相关系数为-0.55。PO2与PCO2之间呈极显著的负相关关系(P < 0.001),相关系数为-0.53。4种电解质指标(K+、Na+、Ca2+和Cl-)之间均有中高度的相关关系(P < 0.001),其中阳离子之间呈正相关(0.41 ~ 0.53),阴阳离子之间呈负相关(-0.36 ~ -0.47)。Ca2+与LAC也有中度负相关关系(P < 0.001;r = -0.38)。HCT与其他指标关系较弱或相关不显著(P>0.05)。
|
图 3 高原地区奶牛血气、电解质、生化指标相关分析结果 Fig. 3 Results of the correlation analysis among blood gas indexes, electrolyte indexes, and biochemical parameters in dairy cows at high-altitude area |
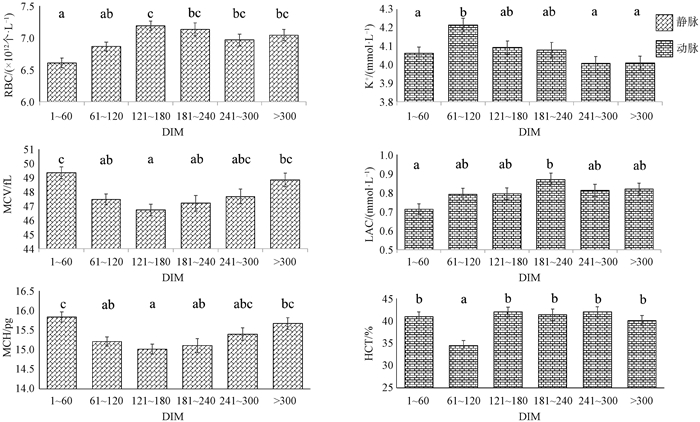
利用固定效应模型对血常规各指标进行方差分析(表 4),结果表明月龄对于除HGB、HCT和PCT以外的血常规指标均有显著影响(P < 0.05),WBC、RBC和PLT均随试验牛月龄增大而减小,而MCV和MPV随月龄增大而增大。红细胞系统中的HGB、HCT、MCV、MCH和白细胞系统中的GranR与荷斯坦牛血统比例有显著的回归关系(P < 0.05),荷斯坦牛血统比例更少的杂种牛倾向于拥有更高的HGB、HCT、MCV和MCH。白细胞系统指标在不同泌乳阶段间无显著差异(P>0.05),表明其数值不受泌乳阶段的显著影响。红细胞系统中的RBC、MCV和MCH随泌乳阶段变化如图 4,RBC的数值在DIM为121 ~ 180 d时达到最高,而MCV和MCH的数值却最低(图 4)。泌乳初期(DIM < 61 d)的PLT为(544.34 ± 25.09)×109个·L-1、PCT为(0.29 ± 0.01)%,均极显著(P < 0.01)高于其他泌乳阶段。体况评分更高的试验牛其HGB、HCT、MCV和MCH更高。RBC、HGB和HCT在牛场之间差异极显著(P < 0.01),差值分别为0.42×1012个·L-1、7.59 g ·L-1和2.02%。放置超过12 h测定的样品具有更高的GranC、GranR和更低的LymphR,差值分别为0.58× 109个·L-1、3.20%和4.03%。
|
|
表 4 各因素对高原奶牛血常规指标的影响 Table 4 The impacts of different factors on blood hematological parameters in dairy cows at high-altitude area |
|
误差线表示标准误,相同字母表示差异不显著(P>0.05)。下图同 Error line indicates standard error, the same letter means the difference is not significant (P > 0.05). The same as below 图 4 不同泌乳阶段各指标的最小二乘均值 Fig. 4 Least square means for each indicator at different lactation stages |
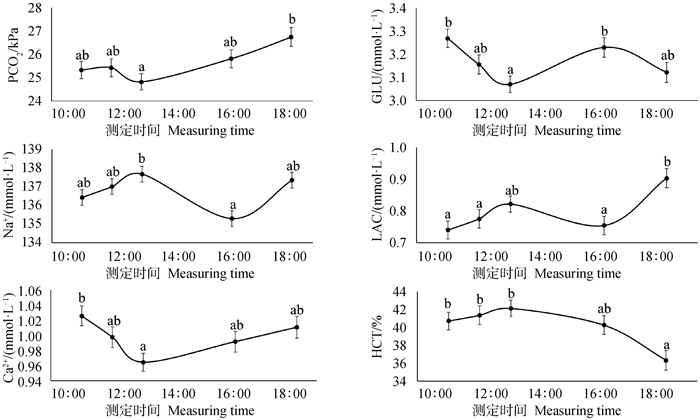
血气、电解质、生化指标的方差分析结果显示(表 5),各影响因素对PO2和Cl-均无显著影响(P> 0.05),血统比例对各指标均无显著影响(P > 0.05)。动脉血气、电解质、生化指标多受到测定时间的影响(图 5),其中PCO2、Na+、Ca2+、GLU和HCT均在12 ∶41~14 ∶10出现极值。结合牧场的饲喂时间为9 ∶30和15 ∶00,GLU、LAC和Na+的变化趋势可能与试验牛的采食和反刍行为有关。受泌乳阶段显著影响(P < 0.05)的指标中,PCO2随DIM增大而减小,与pH呈相反的变化趋势,GLU从泌乳初期(DIM为1 ~ 60 d)上升至泌乳中期(DIM为121 ~ 180 d)后趋于平稳。K+、LAC和HCT随泌乳阶段变化如图 4所示,泌乳高峰期(DIM为61 ~ 120 d)动脉血HCT仅为34.48%,极显著低于(P < 0.001)其他时期,而K+达到最高的4.21 mmol ·L-1,LAC的最大值出现在泌乳中后期(DIM为181 ~ 240 d)。4个动脉血指标在牧场之间存在显著差异(P < 0.05),Ca2+和GLU更高的牧场拥有更低的PCO2和LAC。电解质指标中K+和Ca2+随月龄增大而减小,Na+随体况评分升高而增大。
|
|
表 5 各因素对高原地区奶牛血气、电解质、生化指标的影响 Table 5 The impacts of different factors on blood gas indexes, electrolyte indexes, and biochemical parameters in dairy cows at high-altitude area |
|
图 5 不同测定时间血气、电解质、生化指标的最小二乘均值 Fig. 5 Least square mean of blood gas indexes, electrolyte indexes, and biochemical parameters at different measuing times |
与北京地区荷斯坦牛群体的血常规相比[12],饲养在高原地区奶牛群体的WBC和LymphC更少、RBC更多、HGB和HCT更高,与高原本地黄牛的血液指标有更好的一致性[13];血小板系统中PLT和MPV均低于北京地区荷斯坦牛群体。荷斯坦牛引入高原后会出现RBC和HGB显著升高、WBC显著降低的情况[5],在对猪[14]和鸡[15]的研究中也观察到RBC、HGB和HCT随海拔升高而增大的现象。红细胞和血红蛋白在生物体内负责运输氧气,低氧适应中RBC、HGB和HCT的增加能够满足机体对氧气的需要[8, 16]。与此同时,红细胞体积由北京地区[12]的48.95 fL减小到本研究中的47.99 fL,能够缓解因红细胞数增加而造成的血液动力学的改变,使血液粘滞度降低,进而不影响血液的流动速度,保证机体氧气的运输[8, 17]。白细胞是一类具有防御和免疫功能的细胞,3种白细胞百分比指标中,高原奶牛的GranR最高(54.88%),在北京地区群体中LymphR最高(52.29%)[12],推测该差异与拉萨两个试验牛场奶牛乳房炎发病率较高有关,研究表明嗜中性粒细胞是宿主防御微生物反应阶段的主要参与者[18],在奶牛乳腺免疫中发挥着关键作用[19]。
本研究中,PO2和PCO2的平均值分别为11.28 kPa和3.39 kPa,均低于Naito和Murakami[20](14.29 kPa和5.21 kPa)以及Tvedten等[21](14.40 kPa和4.89 kPa)在平原地区的研究结果,pH为7.51高于平原地区的7.465[20]和7.46[21]。血气是外界环境影响的敏感指标,低压低氧会导致pH升高、PO2和PCO2降低[22],在对安格斯牛[23]、人[24]、绵羊[25]和鸡[15]的研究中也观察到了相同趋势。大气氧分压随海拔升高下降,机体吸入后引起肺泡气氧分压和动脉血氧分压降低[24]。PCO2可以衡量肺脏对二氧化碳气体的排除能力,是对肺脏功能的检验[26]。低氧会使肺通气量增加,呼吸深度加强,动脉和肺泡中二氧化碳的排出增加,导致血液中氢离子的浓度下降,进而使pH增高、PCO2下降[27]。
研究发现,高海拔应激能使奶牛血液中Ca2+、K+、Na+、Cl-含量明显下降,这些离子的下降可能会导致奶牛代谢、内分泌功能的紊乱而产生疾病[28]。由于血液电解质指标的测定值在血气生化仪、生化仪和电解质分析仪之间有显著差异[29],故无法将不同方法的测定结果进行直接比较,因此有必要在其他奶牛群体中积累更多血气生化仪的测定结果。有研究表明,不同仪器测定的GLU具有可比性[30]。本研究群体所测GLU与平原地区荷斯坦牛[31]和西藏其他地区荷斯坦牛[32]相比均偏低。GLU受饲料、采食时间、应激、饮水等环境因素影响较大,不同研究中GLU随海拔的变化也呈现出不同趋势[32-34]。低氧时组织细胞糖酵解增强会导致血液LAC增高[35],但在不同的研究中观察到LAC随海拔变化不一致[32, 36],不同仪器测定血液LAC是否存在差异仍待探究。
3.2 其他因素对血液指标的影响本研究中,泌乳阶段对白细胞系统中各项指标的影响均不显著,与杨桐桐等[12]的研究结果一致。WBC随月龄增加而减少,与在北京奶牛群体中的研究结果一致[12, 37],但在白若雨等[38]的研究中WBC随胎次增加而升高,在李毅冉[9]的研究中WBC随胎次和年龄增加无明显变化规律。GranR随月龄和胎次的增加而升高,可能与高胎次的奶牛感染细菌的概率增加有关[39]。此外,本研究发现测定间隔超过12 h会对GranC、GranR和LymphR的测定结果产生显著影响,因此建议严格控制测定间隔。
在红细胞系统指标中,产后120 d内的RBC、HGB和HCT均显著低于产后120 ~ 180 d,并伴随着低血糖状态,这与奶牛产后启动泌乳、达到泌乳高峰的过程中干物质摄入量不能满足需求量而产生的能量负平衡有关[12, 40]。奶牛产后血糖浓度降低,提示奶牛可能有分娩应激性厌食、瘤网胃消化功能紊乱、酮病、脂肪肝、低钙血症的风险[41]。奶牛通常在泌乳高峰期有最低的BCS[42],而红细胞系统指标随BCS下降有降低趋势,表明在泌乳高峰期BCS低的牛更易发生贫血,应给予更多关注。RBC随月龄和胎次的升高而降低的规律已被大量研究证实[9, 12, 37, 43-44],表明随年龄增加奶牛的造血功能有一定的下降。MCV和MCH与RBC呈负相关,它们随日龄和胎次增加而升高[37],研究表明红细胞直径与总表面积随着年龄的增加而增大[44]。HGB、HCT、MCV和MCH均与荷斯坦牛血统比例呈负相关,能够更好适应高原环境的本地牛与荷斯坦牛的杂交后代拥有更高的HGB、HCT、MCV和MCH,推测这4个红细胞系统指标对高原适应情况有较好的指示性。
本研究中, PCO2在中午达到最低、在晚间达到最高,研究发现PCO2会随昼夜在一定范围内发生的波动,而PO2更加稳定[45]。动脉血pH随DIM升高,血液pH主要取决于HCO3-/H2CO3的比值,饲料、前胃疾病及其他代谢疾病、呼吸系统或肾功能障碍都会影响奶牛体内酸碱平衡[46],该变化趋势及原因有待后续探究。GLU随时间的变化主要与采食时间有关[47],本研究中LAC、Na+与GLU变换趋势相反,说明LAC和Na+也会受到奶牛采食等行为的影响,因此应尽量保证每次采样与采食的间隔时间一致。此外,与血常规指标相比,血气和电解质指标极易受到血样存放时间的影响,在采样后15 min内进行测定才能更准确地反映血液电解质指标随时间的变化趋势[48]。PO2和Cl-均未受到本研究涉及的因素影响,有待后续探究。
4 结论本研究对在高原饲养的奶牛血液中的18项血常规、3项血气、4项电解质和2项生化指标进行了测定和分析,发现月龄对除血红蛋白浓度、红细胞压积、血小板压积外的其它血常规指标有显著影响。血红蛋白浓度、红细胞压积、平均红细胞体积和平均红细胞血红蛋白含量与荷斯坦牛血统比例呈负相关关系,可作为遗传水平的高原适应性指标进行后续探索和验证。泌乳初期体况评分低的牛易发生贫血和低血糖症状,泌乳高峰期动脉血红细胞压积降低,应给予关注。血气生化仪测定的血液指标容易受到采食行为和自然时间的影响,宜严格限制采样时间。综上,利用血液指标开展高原牧场奶牛健康检测具有重要意义并应考虑以上因素的影响。
| [1] |
郎宇, 王桂霞, 吴佩蓉. 我国奶业发展的困境及对策[J]. 黑龙江畜牧兽医, 2020(4): 12-16, 147. LANG Y, WANG G X, WU P R. The dilemma and countermeasures of milk industry development in China[J]. Heilongjiang Animal Science and Veterinary Medicine, 2020(4): 12-16, 147. DOI:10.13881/j.cnki.hljxmsy.2019.01.0128 (in Chinese) |
| [2] |
曹步凯, 徐向明. 拉萨市奶牛引进与奶业发展情况的思考[J]. 畜牧兽医杂志, 2007, 26(6): 50-51, 53. CAO B K, XU X M. Reflections on the introduction of dairy cattle and the development of dairy industry in Lhasa[J]. Journal of Animal Science and Veterinary Medicine, 2007, 26(6): 50-51, 53. (in Chinese) |
| [3] |
胡雄贵, 强久卓玛, 张国庆, 等. 西藏山南市黄牛横交固定育种现状与实施规划[J]. 湖南畜牧兽医, 2017(1): 10-11. HU X G, QIANGJIU Z M, ZHANG G Q, et al. Status and implementation plan of fixed breeding of crossbred yellow cattle in Shannan, Tibet[J]. Hunan Journal of Animal Science & Veterinary Medicine, 2017(1): 10-11. (in Chinese) |
| [4] |
巴桑珠扎, 旦增洛桑, 赵丽, 等. 荷斯坦牛冻精改良西藏黄牛的效果分析[J]. 中国畜牧杂志, 2023, 59(1): 149-153. BASANG Z Z, DANZENG L S, ZHAO L, et al. Effect analysis of improving Tibetan yellow cattle by Holstein frozen semen[J]. Chinese Journal of Animal Science, 2023, 59(1): 149-153. DOI:10.19556/j.0258-7033.20210816-06 (in Chinese) |
| [5] |
索朗曲吉, 巴桑珠扎, 赵丽, 等. 西藏引进良种奶牛高原适应性观察与研究[J]. 中国饲料, 2019(2): 11-15. SUOLANG Q J, BASANG Z Z, ZHAO L, et al. Observation and research on plateau adaptability of introduced breeding cows in Tibet[J]. China Feed, 2019(2): 11-15. DOI:10.15906/j.cnki.cn11-2975/s.20190203 (in Chinese) |
| [6] |
吕永达, 孙苑. 急性高原病的发病机制[J]. 旅行医学科学, 1998, 4(4): 30-36. LÜ Y D, SUN Y. Pathogenesis of acute plateau disease[J]. Science of Travel Medicine, 1998, 4(4): 30-36. DOI:10.3969/j.issn.1006-7159.1998.04.008 (in Chinese) |
| [7] |
唐骏, 格桑加措, 陈景瑞, 等. 西藏山南地区高海拔应激对引进奶牛的影响[J]. 中国奶牛, 2015(1): 53-55. TANG J, GESANG J C, CHEN J R, et al. The effect of high altitude stress on introduced cows in Shannan district of Tibet[J]. China Dairy Cattle, 2015(1): 53-55. DOI:10.3969/j.issn.1004-4264.2015.01.016 (in Chinese) |
| [8] |
江炎庭, 苟潇, 李明丽, 等. 高原民族和动物低氧适应血液生理特征及相关基因研究进展[J]. 中国畜牧兽医, 2012, 39(10): 149-153. JIANG Y T, GOU X, LI M L, et al. Physiological characteristics of blood and research progress on hypoxia candidate genes in plateau nation and animals[J]. China Animal Husbandry & Veterinary Medicine, 2012, 39(10): 149-153. (in Chinese) |
| [9] |
李毅冉. 中国荷斯坦奶牛血液生化成分的全基因组关联分析[D]. 福州: 福建农林大学, 2020. LI Y R. Genome-wide association analysis of blood biochemical components in Chinese Holstein cows[D]. Fuzhou: Fujian Agriculture and Forestry University, 2020. (in Chinese) |
| [10] |
王新丽, 孙田新. 动脉血气分析结果准确性的影响因素[J]. 河北联合大学学报: 医学版, 2013, 15(2): 198-199. WANG X L, SUN T X. Factors influencing the accuracy of arterial blood gas analysis results[J]. Journal of Hebei United University: Health Sciences, 2013, 15(2): 198-199. (in Chinese) |
| [11] |
WILDMAN E E, JONES G M, WAGNER P E, et al. A dairy cow body condition scoring system and its relationship to selected production characteristics[J]. J Dairy Sci, 1982, 65(3): 495-501. DOI:10.3168/jds.S0022-0302(82)82223-6 |
| [12] |
杨桐桐, 陈紫薇, 张海亮, 等. 生理阶段对健康中国荷斯坦泌乳牛血常规指标影响的研究[J]. 黑龙江畜牧兽医, 2021(23): 18-24. YANG T T, CHEN Z W, ZHANG H L, et al. Study on effects of physiological stages on blood routine indexes in healthy Holstein cattle[J]. Heilongjiang Animal Science and Veterinary Medicine, 2021(23): 18-24. (in Chinese) |
| [13] |
袁午舟. 黄牛高原适应性分子机制的研究[D]. 北京: 中国科学院大学, 2018. YUAN W Z. Analysis of molecular mechanisms of high-altitude adaptation in cattle[D]. Beijing: University of Chinese Academy of Sciences, 2018. (in Chinese) |
| [14] |
孔小艳, 苟潇, 马腾, 等. 藏猪低氧适应的血液生理指标研究[J]. 云南农业大学学报, 2014, 29(2): 297-300. KONG X Y, GOU X, MA T, et al. Study on blood physiological indicators of adaptation to hypoxia in Tibet pig[J]. Journal of Yunnan Agricultural University, 2014, 29(2): 297-300. DOI:10.3969/j.issn.1004-390X(n).2014.02.026 (in Chinese) |
| [15] |
张浩, 强巴央宗, 凌遥. 藏鸡对高海拔适应的血液生理机制[C]//中国畜牧兽医学会2006学术年会论文集(上册). 北京: 中国畜牧兽医学会, 2006: 69-72. ZHANG H, QIANGBA Y Z, LING Y. Blood physiological mechanisms of high altitude adaptation in Tibetan chickens[C]// Proceedings of the 2006 Annual Academic Conference of the Chinese Society of Animal Husbandry and Veterinary Medicine (Previous Volume). Beijing: Chinese Association of Animal Science and Veterinary Medicine, 2006: 69-72. (in Chinese) |
| [16] |
MORTOLA J P, WILFONG D. Hematocrit and hemoglobin levels of nonhuman apes at moderate altitudes: a comparison with humans[J]. High Alt Med Biol, 2016, 17(4): 323-335. DOI:10.1089/ham.2016.0069 |
| [17] |
佘永新, 吴德宽, 王建林. 西藏高原藏鸡血液生化指标的测定及其对低氧环境适应机理的探讨[J]. 中国兽医科技, 1995, 25(7): 47-48. SHE Y X, WU D K, WANG J L. Determination of blood biochemical indexes in Tibetan chickens on the Tibetan plateau and the mechanism of their adaptation to low oxygen environment[J]. Chinese Journal of Veterinary Science and Technology, 1995, 25(7): 47-48. (in Chinese) |
| [18] |
MORTAZ E, ALIPOOR S D, ADCOCK I M, et al. Update on neutrophil function in severe inflammation[J]. Front Immunol, 2018, 9: 2171. |
| [19] |
PAAPE M J, BANNERMAN D D, ZHAO X, et al. The bovine neutrophil: structure and function in blood and milk[J]. Vet Res, 2003, 34(5): 597-627. |
| [20] |
NAITO Y, MURAKAMI D. Blood gas and acid-base values in the coccygeal artery of holstein-friesian cows[J]. Nihon Juigaku Zasshi, 1982, 44(5): 777-780. |
| [21] |
TVEDTEN H, KOPCIA M, HAINES C. Mixed venous and arterial blood in bovine coccygeal vessel samples for blood gas analysis[J]. Vet Clin Pathol, 2000, 29(1): 4-6. |
| [22] |
KUWAHIRA I, MOUE Y, OHTA Y, et al. Pulmonary blood flow distribution during acute hypoxia in conscious resting rats[J]. Respir Physiol, 1995, 100(2): 151-157. |
| [23] |
GULICK A K, GARRY F B, HOLT T N, et al. Angus calves born and raised at high altitude adapt to hypobaric hypoxia by increasing alveolar ventilation rate but not hematocrit[J]. J Anim Sci, 2016, 94(10): 4167-4171. |
| [24] |
陈斌, 郭志坚. 高原地区血气变化的研究[J]. 高原医学杂志, 2007, 17(2): 60-64. CHEN B, GUO Z J. Study of blood gas changes in high altitudes areas[J]. Journal of High Altitude Medicine, 2007, 17(2): 60-64. (in Chinese) |
| [25] |
刘凤云, 陈秋红. 急性低氧对高原土生动物藏系绵羊血气的影响[J]. 动物学杂志, 2006, 41(1): 48-52. LIU F Y, CHEN Q H. Effect of acute hypoxia on the parameters of blood gas in Tibetan Plateau sheep[J]. Chinese Journal of Zoology, 2006, 41(1): 48-52. (in Chinese) |
| [26] |
梁小军, 李颖康, 王建东, 等. 应用血气和血液生化指标量化评判不同生理状态下高产奶牛群体健康状况[J]. 安徽农业科学, 2012, 40(27): 13385-13387, 13422. LIANG X J, LI Y K, WANG J D, et al. Study on the health status of high producing dairy cows population in different physiological states by blood-gas and biochemical index[J]. Journal of Anhui Agricultural Sciences, 2012, 40(27): 13385-13387, 13422. (in Chinese) |
| [27] |
杜继曾, 李庆芬. 模拟高原低氧对高原鼠兔和大鼠器官与血液若干指标的影响[J]. 兽类学报, 1982, 2(1): 35-42. DU J Z, LI Q F. Effects of simulated hypoxic acclimation on organism, organ and hematology in Ochotona curzoniae and rats[J]. Acta Theriologica Sinica, 1982, 2(1): 35-42. (in Chinese) |
| [28] |
张寿, 李耀云, 崔海龙, 等. 高海拔应激对奶牛血清中K+、Na+、Ca++、Cl-、P5+的影响[J]. 中国牛业科学, 2012, 38(4): 26-27. ZHANG S, LI Y Y, CUI H L, et al. Effect of high altitude stress on serum K+, Na+, Ca++, Cl-, P5+ in dairy cow[J]. China Cattle Science, 2012, 38(4): 26-27. (in Chinese) |
| [29] |
李志越. 全自动血气生化仪在急诊生化检验中的应用[J]. 中国医疗器械信息, 2021, 27(20): 19-21. LI Z Y. Application of Automatic blood gas biochemical instrument in emergency biochemistry test[J]. China Medical Device Information, 2021, 27(20): 19-21. (in Chinese) |
| [30] |
刘慧玲, 马永能, 张鹏, 等. 三种仪器检测血糖的对比分析[J]. 检验医学与临床, 2012, 9(4): 407, 410. LIU H L, MA Y N, ZHANG P, et al. Comparison of determination of blood glucose by blood gas analyzer, portable blood glucose meter and automated biochemical analyzer[J]. Laboratory Medicine and Clinic, 2012, 9(4): 407, 410. (in Chinese) |
| [31] |
黄丽瑾, 陆颖, 于讳茹, 等. 手持血糖仪检测奶牛血糖及预测酮病的探讨[J]. 中国兽医杂志, 2018, 54(1): 50-52. HUANG L J, LU Y, YU H R, et al. Exploration of hand-held blood glucose meter to detect blood glucose and predict ketosis in dairy cattle[J]. Chinese Journal of Veterinary Medicine, 2018, 54(1): 50-52. (in Chinese) |
| [32] |
田发益, 梁桂荣, 袁雷, 等. 不同海拔梯度中荷斯坦牛血液中乳酸和血糖含量分析[J]. 畜牧与兽医, 2013, 45(9): 70-74. TIAN F Y, LIANG G R, YUAN L, et al. Analysis of lactate and blood glucose levels in the blood of Holstein cattle at different altitude gradients[J]. Animal Husbandry & Veterinary Medicine, 2013, 45(9): 70-74. (in Chinese) |
| [33] |
仇燕, 关国跃, 许柏青, 等. 不同海拔地区体检人群空腹血糖水平的比较分析[J]. 上海预防医学, 2019, 31(11): 936-940. QIU Y, GUAN G Y, XU B Q, et al. Comparison and analysis of fasting blood glucose at different altitude areas in physical examination population[J]. Shanghai Journal of Preventive Medicine, 2019, 31(11): 936-940. (in Chinese) |
| [34] |
贺迎春. 高原环境对机体主要生理和代谢指标影响的研究[D]. 成都: 成都中医药大学, 2019. HE Y C. The Study on the influence of plateau environment on main physiological and metabolic indicators of the body[D]. Chengdu: Chengdu University of Traditional Chinese Medicine, 2019. (in Chinese) |
| [35] |
孙正娟. 血气检测血乳酸与其他参数的相关性及临床意义[J]. 当代临床医刊, 2016, 29(4): 2453. SUN Z J. Correlation and clinical significance of blood lactate with other parameters in blood gas testing[J]. The Medical Journal of the Present Clinical, 2016, 29(4): 2453. (in Chinese) |
| [36] |
HAYS F L, BIANCA W, NÄF F. Effects of exercise on young and adult cattle at low and high altitude[J]. Int J Biometeorol, 1978, 22(2): 147-158. |
| [37] |
陈紫薇, 王凯, 赵琦琪, 等. 荷斯坦奶牛血常规指标随胎次变化规律研究[J]. 中国畜牧杂志, 2019, 55(12): 132-135. CHEN Z W, WANG K, ZHAO Q Q, et al. Study on the variation of blood indexes with parity in Holstein cows[J]. Chinese Journal of Animal Science, 2019, 55(12): 132-135. (in Chinese) |
| [38] |
白若雨, 黄启震, 王瑞, 等. 不同胎次奶牛血液生理生化指标分析[J]. 中国农学通报, 2019, 35(5): 150-153. BAI R Y, HUANG Q Z, WANG R, et al. Physiological and biochemical indexes of blood of different-parity dairy cows[J]. Chinese Agricultural Science Bulletin, 2019, 35(5): 150-153. (in Chinese) |
| [39] |
金亚东, 李艳艳, 徐晓锋. 胎次和泌乳阶段对奶牛体细胞数和乳损失量的影响[J]. 乳业科学与技术, 2016, 39(3): 9-13. JIN Y D, LI Y Y, XU X F. Effects of parity and lactation stage on somatic cell score and milk production loss in dairy cows[J]. Journal of Dairy Science and Technology, 2016, 39(3): 9-13. (in Chinese) |
| [40] |
夏成, 王洪斌, 张洪友, 等. 能量负平衡对泌乳早期奶牛生产性能、繁殖性能和机体代谢的影响[J]. 中国畜牧杂志, 2009, 45(21): 32-35. XIA C, WANG H B, ZHANG H Y, et al. Effect of negative energy balance on productive performance, reproductive performance and body metabolism of cows in early lactation[J]. Chinese Journal of Animal Science, 2009, 45(21): 32-35. (in Chinese) |
| [41] |
黄丽瑾. 医用血糖仪用于奶牛的评价及奶牛产后血糖异常情况研究[D]. 南宁: 广西大学, 2019. HUANG L J. Medical blood glucometer for evaluation of dairy cows and investigation of postpartum blood glucose abnormalities in dairy cows[D]. Nanning: Guangxi University, 2019. (in Chinese) |
| [42] |
陈佩琪, 刘念锐, 司永. 成年母牛体况评分及其影响因素分析[J]. 乳业科学与技术, 2010, 33(1): 42-45. CHEN P Q, LIU N R, SI Y. The analysis of body condition score of Holstein cow and its effect factors[J]. Journal of Dairy Science and Technology, 2010, 33(1): 42-45. (in Chinese) |
| [43] |
VALLEJO-TIMARÁN D, MONTOYA-ZULUAGA J, CASTILLO-VANEGAS V, et al. Parity and season affect hematological, biochemical, and milk parameters during the early postpartum period in grazing dairy cows from high-tropics herds[J]. Heliyon, 2020, 6(5): e04049. |
| [44] |
王贞照, 陈以楠, 张楹, 等. 奶牛血液细胞正常值测定的研究[J]. 上海农业科技, 1982(4): 30-31. WANG Z Z, CHEN Y N, ZHANG Y, et al. Study on the determination of normal values of blood cells in dairy cattle[J]. Shanghai Agricultural Science and Technology, 1982(4): 30-31. (in Chinese) |
| [45] |
PICCIONE G, CAOLA G, MORTOLA J P. Day/night pattern of arterial blood gases in the cow[J]. Respir Physiol Neurobiol, 2004, 140(1): 33-41. |
| [46] |
房少新. 高原地区黑白花奶牛的血气分析[J]. 中兽医医药杂志, 2008, 27(2): 34-36. FANG S X. Blood gas analysis of black and white dairy cattle in high altitude area[J]. Journal of Traditional Chinese Veterinary Medicine, 2008, 27(2): 34-36. (in Chinese) |
| [47] |
JENNY B F, POLAN C E. Postprandial blood glucose and insulin in cows fed high grain[J]. J Dairy Sci, 1975, 58(4): 512-514. |
| [48] |
SRISAN P, UDOMSRI T, JETANACHAI P, et al. Effects of temperature and time delay on arterial blood gas and electrolyte measurements[J]. J Med Assoc Thai, 2011, 94(Suppl 3): S9-S14. |
(编辑 郭云雁)



