2. 重庆市兽医科学工程研究中心, 重庆 402460
2. Chongqing Veterinary Science Engineering Research Center, Chongqing 402460, China
酒糟是酒业生产的主要固体副产品,其产量巨大,价格低廉。酒糟干物质含量高,富含蛋白质[1-3]、维生素B族、高能量物质[4]和可消化纤维[5-6],还含有丰富的矿物元素、未知的生长因子等,在瘤胃内的降解率可达53%[7],是一种适合山羊的物美价廉的饲料原料[8]。现有的资料记载[9],我国不少地区牛羊养殖场使用鲜酒糟十分普遍;其中,酒糟代替44%~67%日粮饲喂的动物数占总调查动物数的42.51%,酒糟代替60%~80%日粮饲喂的动物数占总调查动物数的12.57%~14.49%。然而,鲜白酒糟酸度高,含有乙醇、甲醇、杂醇油、醛类、酸类、霉菌毒素[10]等不良成分,长期大量饲喂很容易导致羊发生慢性酒糟中毒病。
慢性酒糟中毒的羊群可表现为消化机能紊乱[11],后逐渐出现缺钙、骨质软化、母畜生殖道疾病[12]等。在疾病初期的症状极易与消化道疾病相混淆,临床难以依据目前仅有的关于本病症状的记载进行早期诊断和确诊。且慢性酒糟中毒诱导的血液化学指标及乙醇中毒机制方面的研究尚未见报道。
因此,本研究根据山羊饲喂酒糟史、临床症状及血液生化指标检测结果所反映的山羊肝肾损伤、钙磷代谢紊乱初步确定山羊慢性酒糟中毒造模成功。利用非靶向代谢组学技术探究慢性酒糟中毒山羊血液内源性代谢物的变化,筛选慢性酒糟中毒潜在性生物标志物及显著性差异代谢通路,用qRT-PCR方法研究乙醇中毒通路上关键基因的表达变化,为探索该病新的诊断性生物标志物及其诱导神经症状的分子机制提供参考。
1 材料与方法 1.1 山羊慢性酒糟中毒模型的建立1.1.1 试验设计与饲养管理 试验使用的酒糟采自重庆市荣昌区某高粱型白酒生产企业,酒糟以高粱渣为主(约97%),糠壳及发酵菌残体少量(约3%),新鲜全糟水分约70%。鲜糟每3 d从该酒厂购置一次,购回后将其摊晾1 h,再密封于塑料袋内阴凉处保存,勿使霉败、酸败,供试验使用。
选取15只4月龄健康大足黑山羊与波尔山羊的杂交后代羊,已接种口蹄疫、三联四防、羊痘、传染性胸膜肺炎、小反刍兽疫等疫苗。参试山羊随机分为3组,每组5只。参考《肉羊饲养标准》(NY/T816—2004),分别使用鲜白酒糟替代山羊每日生长所需的65%、75%的蛋白质和能量。Ⅰ组(65%的鲜白酒糟组)、Ⅱ组(75%鲜白酒糟组)、Ⅲ组(基础日粮组),每只单笼舍饲养,半漏缝式地板,每天9:00与18:00分别饲喂1次草料,自由饮水。白酒糟预饲期14 d,正式饲喂90 d,共104 d。每日观察山羊的精神、采食与饮水、排便等情况。
|
|
表 1 试验日粮组成及营养水平 Table 1 Experimental diet composition and nutrient levels |
1.1.2 山羊慢性酒糟中毒的判断 每日观察试验山羊,依据资料[9]判断是否出现酒糟中毒临床症状;每隔15 d(15、30、45、60、75、90 d),无菌采集一次血样,用全自动血液生化分析仪及试剂盒法检测肝肾、钙磷及蛋白质代谢指标(肌酐CREA、尿素UREA、磷P、钙Ca、总蛋白TP、白蛋白ALB、球蛋白GLB、谷氨酰基转移酶GGT、碱性磷酸酶ALP、谷丙转氨酶ALT、天门冬氨酸氨基转移酶AST),直到山羊慢性酒糟中毒病临床症状显现,血液结果显示肝肾损伤、钙磷代谢紊乱,确定山羊慢性酒糟中毒病造模成功。
1.2 样品采集与处理每隔15 d采集试验Ⅰ、Ⅱ、Ⅲ组山羊颈静脉血液,分离血清后,-20 ℃保存。
试验结束前1 h采集最后一次血样,制备血清,保存于-80 ℃待进行代谢组学检测。随后,Ⅱ、Ⅲ组山羊放血处死,无菌采集肝组织,液氮速冻后保存在-80 ℃待测。
1.3 代谢组学分析采用UHPLC-QTOFMS平台对慢性酒糟中毒山羊血清进行代谢组分检测,用主成分分析(PCA)、正交偏最小二乘判别分析(OPLS-DA)查看样本间的分离情况,将质谱数据与数据库比对,筛选出差异代谢物(P-value < 0.05且VIP≥1);通过KEGG数据库中代谢通路的富集分析,得到显著性代谢通路后,筛选出共有富集的通路。
1.4 乙醇代谢通路差异基因检测使用RNAiso Plus提取山羊肝总RNA,用超微量核酸分析仪测定OD260 mm/OD280 mm比值计算其浓度。适当稀释后,按照PrimeScriptTM RT reagent Kit with gDNA Eraser(Perfect Real Time)(TaKaRa,日本)试剂盒说明书进行反转录。按照SYBRⓇPremix Ex TaqTM Ⅱ试剂盒说明书进行qRT-PCR。20 μL反应体系优化方案:2×TB Green Premix 10 μL,Template cDNA 2 μL, PCR上下游引物各1 μL,灭菌水6 μL。反应条件:95 ℃ 30 s;95 ℃ 10 s,60 ℃ 30 s,40个循环。采用2-ΔΔCt定量分析法对数据进行处理。引物信息详见表 2。
|
|
表 2 引物序列 Table 2 Primer sequences |
试验所得数据均以“x±s”形式表示,试验结果使用SPSS 26.0软件进行统计学分析,两组样本采用独立样本t检验, 多组间比较采用单因素方差分析(One-way ANOVA),P < 0.05表示差异显著,P < 0.01表示差异极显著。组织基因的相对表达水平采用2-ΔΔCt法进行分析, 使用GraphPad Prism 8完成数据可视化作图。
2 结果 2.1 山羊慢性酒糟中毒临床观察发现,Ⅱ组山羊在试验65 d,出现精神轻度兴奋,采食减少,粪便不成形或粥状,(图 1B),呕吐,口周黏附大量白色泡沫(图 1A),瘤胃蠕动音减弱,2 min 1~2次,腹围膨大,触诊瘤胃内容物凝硬,Ⅰ组山羊症状较轻微;Ⅰ组和Ⅱ组均有1~2只羊出现行走无力、跛行。Ⅲ组羊无任何异常现象。试验组山羊表现的临床症状与文献[9]中动物慢性酒糟中毒记载基本一致。

|
图 1 口周黏附大量白色泡沫(A)、腹泻、粪便不成形(B) Fig. 1 A large amount of white foam adhered around the mouth(A); Diarrhea, unformed stool (B) |
如表 3所示,Ⅰ、Ⅱ组ALB含量在15 d时显著高于Ⅲ组(P < 0.05)。Ⅱ组GGT含量在15 d时显著高于Ⅲ组(P < 0.05)。Ⅰ、Ⅱ组Ca含量在15、30、60、75 d时均显著低于Ⅲ组(P < 0.05);45、90 d时,Ⅱ组显著低于Ⅰ组(P < 0.05),极显著低于Ⅲ组(P < 0.01)。Ⅰ、Ⅱ组中UREA含量在15、30、45、60 d时均显著高于Ⅲ组(P < 0.05);75 d时,Ⅰ组显著高于Ⅱ组(P < 0.05),极显著高于Ⅲ组(P < 0.01);30、75、90 d时,Ⅱ组极显著高于Ⅲ组(P < 0.01)。Ⅱ组P含量在90 d时显著高于Ⅲ组(P < 0.05)。血清生化指标显示,90 d时,山羊出现肝肾损伤及钙磷代谢紊乱。因此,确定山羊慢性酒糟中毒病建模成功。
|
|
表 3 山羊血清生化指标检测结果(x±s) Table 3 Detection of goat serum biochemical indicators (x±s) |
所有山羊血清样品上机检测,代谢物在正负离子模式下得到较好的分离,TIC峰形状完整(图 2),说明测试结果的正确性和稳定性,数据质量可靠。共获得正离子代谢物315个,负离子代谢物112个,正离子代谢物数多于负离子代谢物数。

|
QC样本为同一个样本,它们TIC的重叠图可以用于初步判断仪器状态,重叠程度越高说明仪器越稳定 The QC samples are the same sample, and the overlapping graph of their TICs can be used to preliminarily judge the status of the instrument. The higher the degree of overlap, the more stable the instrument is 图 2 QC样品在正离子(A)、负离子(B)模式下TIC重叠图 Fig. 2 TIC overlay of QC samples in positive ion (A) and negative ion (B) modes |
对样本进行主成分分析(PCA),PCA得分图中的每一个点分别代表一个样本,各个样本的代谢特点确定了这些代谢物位置,由图 3所示,各组组内的聚集良好,说明组内的差异较小。两组之间出现较好的分离。Ⅰ、Ⅱ、Ⅲ组间的样本分开,证明组间存在差异。当前PCA模型能够较可靠地解释组间样本的代谢差异。

|
绿色圆形分别代表Ⅰ、Ⅱ组样本,红色圆形则代表Ⅲ组样本 The green circles represent the samples of group Ⅰ and Ⅱ, respectively, and the red circles represent the samples of group Ⅲ 图 3 Ⅰ组和Ⅲ组(A)、Ⅱ组和Ⅲ组(B)主成分分析得分图 Fig. 3 Principal component analysis scores of group Ⅰ vs groupⅢ(A), group Ⅱ vs group Ⅲ(B) |
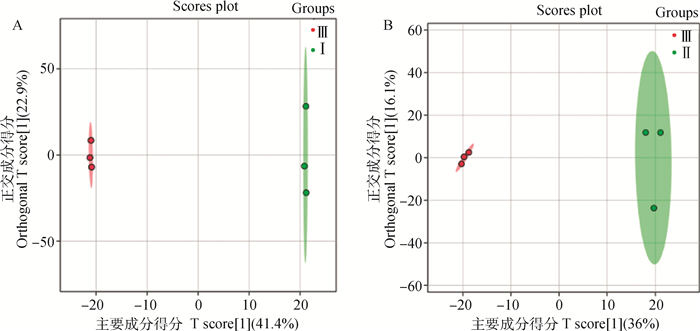
采用OPLS-DA得分图(图 4A、B)进行分析,两组样本得分差异非常显著,样本全部处于95%置信区间(Hotelling’s T-squaredellipse)内,组间的聚集良好,组内的差异较小。Ⅰ及Ⅱ组分别可以和Ⅲ组的样本良好的区分开,证明组间存在差异。另外,Ⅲ组的聚集性均比Ⅰ、Ⅱ组好,提示饲喂不同剂量鲜白酒糟对样本代谢结果的组内差异有一定影响。
|
图 4 Ⅰ组和Ⅲ组(A)、Ⅱ组和Ⅲ组(B)OPLS-DA分析得分图 Fig. 4 OPLS-DA analysis scores of group Ⅰ vs group Ⅲ(A), groupⅡ vs groupⅢ(B) |
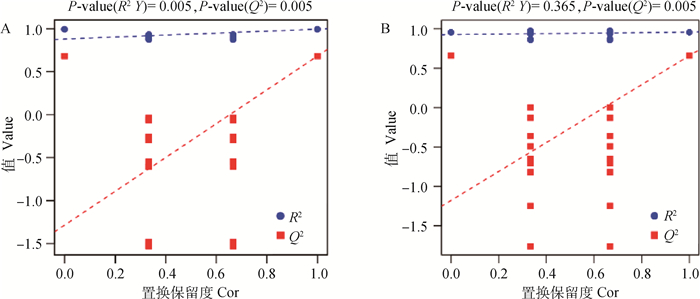
图 5A中R2X(cum)=0.617,R2Y(cum)=1,Q2(cum)=0.841,图 5B中R2X(cum)=0.678,R2Y(cum)=0.959,Q2(cum)=0.659。通常情况下,R2、Q2高于0.5较好,说明本数据均具有可靠性。
|
本模型中R2为模型解释率,Q2为模型的预测能力。横坐标表示置换检验的置换保留度(与原模型Y变量顺序一致的比例,置换保留度等于1处的点即为原模型的R2和Q2值),纵坐标表示R2和Q2的取值,蓝色圆点表示置换检验得到的R2值,红色方点表示置换检验得到的Q2值,两条虚线分别表示R2和Q2的回归线 In this model, R2 is the model interpretation rate, and Q2 is the predictive ability of the model. The abscissa represents the permutation retention of the permutation test (the proportion that is consistent with the order of the Y variable of the original model, the point where the permutation retention is equal to 1 is the R2 and Q2 values of the original model), the ordinate represents the values of R2 and Q2, the blue The colored dots represent the R2 value obtained by the permutation test, the red square point represents the Q2 value obtained by the permutation test, and the two dashed lines represent the regression lines of R2 and Q2, respectively 图 5 Ⅰ和Ⅲ组(A)、Ⅱ和Ⅲ组(B)OPLS-DA模型验证图 Fig. 5 OPLS-DA model validation diagram of group Ⅰ and group Ⅲ (A), group Ⅱ and group Ⅲ (B) |
与Ⅲ组相比,Ⅰ组筛选出340个差异代谢物,其中,186个代谢物上调,154个代谢物下调(图 6A);Ⅱ组筛选出278个差异代谢物,其中,136个代谢物上调,142个代谢物下调(图 6B)。

|
火山图中每个点代表一个代谢物,横坐标代表该组对比各物质的倍数变化(取以2为底的对数),纵坐标表示学生t检验的P-value(取以10为底的对数)。散点颜色代表最终的筛选结果,显著差异上调的代谢物以红色表示,显著差异下调的代谢物以绿色表示,非显著差异的代谢物为灰色 Each point in the volcano plot represents a metabolite, the abscissa represents the fold change of each substance in the group compared to each other (take the logarithm with the base 2), and the ordinate represents the P-value of the Student's t test (take 10 as the logarithm of the base). Scattered colors represent the final screening results, significantly differently up-regulated metabolites are represented in red, significantly differently down-regulated metabolites are represented in green, and non-significantly differential metabolites are represented in grey 图 6 Ⅰ和Ⅲ组(A)、Ⅱ和Ⅲ组(B)差异代谢物筛选火山图 Fig. 6 Volcano plot for screening differential metabolites in groups Ⅰ and Ⅲ(A), groups Ⅱ and Ⅲ(B) |
在排除药物等无关物质的鉴定后,按P值从小到大原则,分别均筛选出20个差异代谢物作为潜在的生物标志物。与Ⅲ组相比,Ⅰ组有13个代谢物上调,7个代谢物下调(表 4);Ⅱ组有12个代谢物上调,8个代谢物下调(表 5);试验Ⅰ、Ⅱ组羊血清代谢物均表现出了前列腺素I2的下调,多巴胺、2-呋喃酰甘氨酸上调。
|
|
表 4 Ⅰ和Ⅲ组差异代谢物筛选结果 Table 4 Screening of differential metabolites in group Ⅰ and group Ⅲ |
|
|
表 5 Ⅱ和Ⅲ组差异代谢物筛选 Table 5 Screening of differential metabolites in group Ⅱ and group Ⅲ |
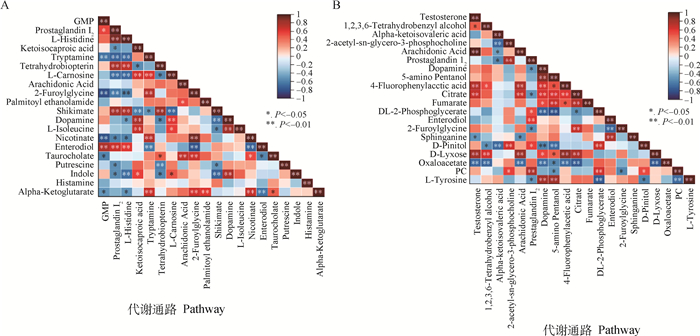
为更清楚了解试验组(Ⅰ、Ⅱ组)与对照组(Ⅲ组)间前20种主要差异代谢物的丰度变化及物质间的相关性,分别绘制了组间差异代谢物相关性热图(图 7A、7B)。由图 7A可知,Ⅰ组与Ⅲ组间,前列腺素I2与花生四烯酸(P>0.05)、2-呋喃甘氨酸(P < 0.01)、多巴胺呈负相关(P>0.05),与肠二醇呈正相关(P < 0.01);2-呋喃甘氨酸与前列腺素I2(P < 0.01)、多巴胺(P>0.05)、肠二醇(P < 0.01)呈负相关,与花生四烯酸呈正相关(P>0.05);多巴胺与前列腺素I2呈负相关(P>0.05),与花生四烯酸、2-呋喃甘氨酸、肠二醇呈正相关(P>0.05)。图 7B显示,Ⅱ组与Ⅲ组间,前列腺素I2与花生四烯酸(P>0.05)、2-呋喃甘氨酸(P < 0.05)、多巴胺呈负相关(P < 0.05),与肠二醇呈正相关(P < 0.01);2-呋喃甘氨酸与前列腺素I2呈负相关(P>0.05)、肠二醇(P < 0.01)呈负相关,与多巴胺、花生四烯酸呈正相关(P>0.05);多巴胺与前列腺素I2呈负相关(P < 0.05),与花生四烯酸、2-呋喃甘氨酸、肠二醇呈正相关(P < 0.05)。两个试验组与对照组比较,主要差异代谢物丰度间相关性表现最相似的是前列腺素I2和多巴胺。
|
图 7 Ⅰ和Ⅲ组(A)、Ⅱ和Ⅲ组(B)差异代谢物相关性热图 Fig. 7 Correlation heat map of differential metabolites in groups Ⅰ and Ⅲ(A), groups Ⅱ and Ⅲ(B) |
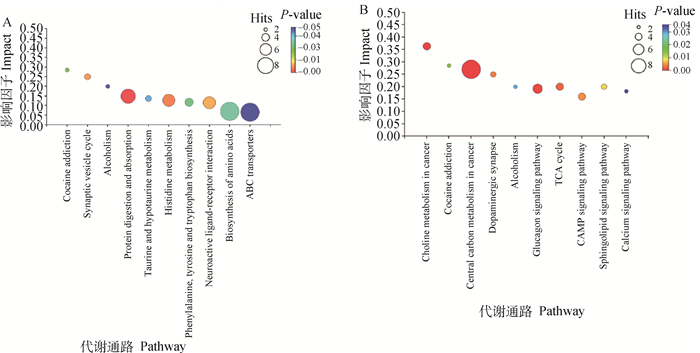
与Ⅲ组相比,Ⅰ组中影响因子前十的代谢通路见图 8A,其中,对蛋白质消化、组氨酸代谢等途径影响最显著(P < 0.01),对乙醇中毒、可卡因成瘾途径也有显著的影响(P < 0.05);Ⅱ组中影响因子前十的代谢通路见图 8B,其中,对癌症的胆碱代谢、癌症的中心碳代谢、乙醇中毒、胰高血糖素信号通路影响最显著(P < 0.01)。乙醇中毒代谢途径在三组两两比较中均变化显著,且影响因子>0.2;慢性酒糟中毒组山羊在此通路上均表现L-酪氨酸(Tyr)、多巴胺(DA)的上调,见图 9。
|
横坐标表示富集到的不同的代谢通路(pathway);Hits表示差异代谢物命中该通路的个数;纵坐标表示通路拓扑分析得到的影响因子(pathway impact),即命中通路代谢物个数与该通路中所有代谢物个数的比值;不同颜色表示富集分析得到的P值大小。以上代谢通路在不同组别中均有显著性差异(P < 0.05) Legend: the abscissa represents the enriched different metabolic pathways (pathways); Hits represents the number of differential metabolites hitting the pathway; the ordinate represents the impact factor (pathway impact) obtained by the pathway topology analysis, that is, the hit pathway metabolites. The ratio of the number of metabolites to the number of all metabolites in the pathway; different colors indicate the P value obtained by the enrichment analysis. The above metabolic pathways were significantly different in different groups (P < 0.05) 图 8 Ⅰ和Ⅲ组(A)、Ⅱ和Ⅲ组(B)KEGG富集气泡图 Fig. 8 KEGG enrichment bubble diagram of groups Ⅰ and Ⅲ(A), groups Ⅱ and Ⅲ(B) |
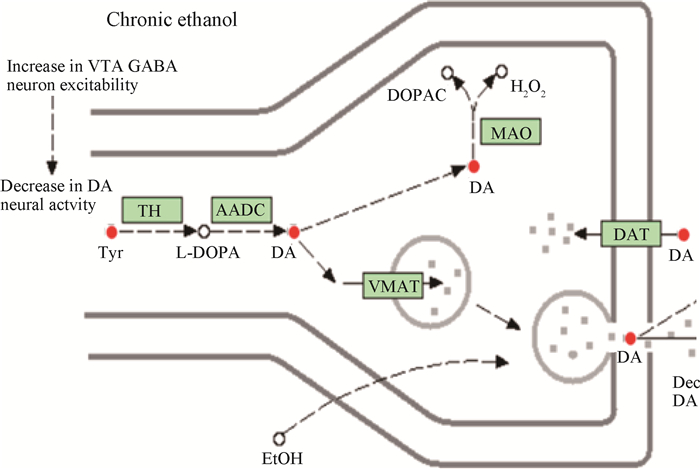
|
圆点表示代谢物名称,方框表示调控代谢物的基因或酶。红色圆点代表上调,绿色圆点代表下调。图中表示为Ⅱ组相较于Ⅲ组部分代谢物上调 Dots indicate metabolite names, and boxes indicate genes or enzymes that regulate metabolites. Red dots represent up-regulation, green dots represent down-regulation. The figure shows that some metabolites in group Ⅱ are up-regulated compared to group Ⅲ 图 9 乙醇中毒(alcoholism)Ⅱ组与Ⅲ组KEGG代谢通路图 Fig. 9 KEGG metabolic pathway in group Ⅱ vs group Ⅲ of alcoholism |
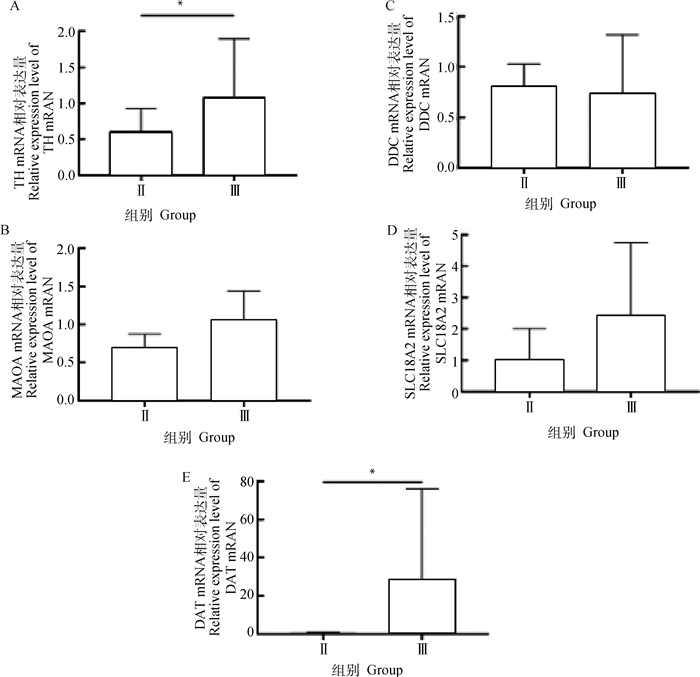
由图 10可知,TH、DAT在Ⅱ组的mRNA相对表达量显著低于Ⅲ组(P < 0.05)。DDC、MAOA、SLC18A2在Ⅱ组的表达量均低于Ⅲ组,但无显著性差异。
|
*.P < 0.05 图 10 Ⅱ和Ⅲ组TH(A)、MAOA(B)、DDC(C)、SLC18A2 (D)、DAT(E) mRNA相对表达量 Fig. 10 Relative expression of TH(A), MAOA(B), DDC(C), SLC18A2(D), DAT(E) mRNA in groups Ⅱ and Ⅲ |
山羊饲喂鲜白酒糟90 d后,出现以下临床症状:精神不振,采食减少,粪不成形或粥状,呕吐,口周黏附大量白色泡沫,行走无力,跛行等,与已有的动物慢性酒糟中毒病记载一致。除此以外,血清生化指标检测结果显示,山羊长期采食大量鲜白酒糟会导致血清GGT、ALB、UREA、P均显著增高,Ca发生显著下降。血清GGT已被广泛用作肝功能障碍的指标和酒精摄入量的标志物[13],ALB[14]为临床上评估肝损伤严重程度的指标,试验组GGT、ALB的升高,尤其是饲喂15 d时组间差异显著,提示长期大量饲喂鲜白酒糟后山羊发生肝损伤。UREA在临床中用于评估肾疾病的进展[15],此指标的升高提示长期大量饲喂鲜白酒糟后山羊肾功能下降;90 d,Ⅱ组血清钙为1.60 mmol·L-1,极显著低于正常值(2.40~2.76 mmol·L-1),血清P为3.30 mmol·L-1,极显著高于正常值(1.35~2.94 mmol·L-1),钙磷比为0.5,明显低于正常范围(1.5~2.0)。资料记载[9],酒糟长期饲喂可促进钙的排泄,血清钙水平下降,导致机体钙磷代谢紊乱。本试验数据提示的试验组山羊发生钙磷代谢紊乱与资料记载基本一致。这些临床症状及血液生化检测所表明的肝肾损伤、钙磷代谢紊乱可判断本研究试验组山羊已发生慢性酒糟中毒。
代谢组学差异代谢物结果分析表明,饲喂75%鲜白酒糟比65%更容易富集到更多且更具有统计意义的差异代谢物,Ⅰ、Ⅱ组均出现了多巴胺(DA)和2-呋喃酰甘氨酸(2-FG)上调,前列腺素I2(PGI2)下调;共同富集通路为乙醇中毒通路。这说明慢性酒糟中毒状态下,山羊血液代谢物已发生明显的改变,多巴胺、2-呋喃酰甘氨酸、前列腺素I2可为山羊慢性酒糟中毒的新型潜在性诊断用指标,乙醇中毒可能为该病的重要发病机制之一。DA代谢异常与神经精神疾病的病理生理学有关,如成瘾性疾病失调[16]、帕金森病、精神分裂症和一些发育障碍[17]。呋喃衍生物或其前体是外源性的[18],2-FG来源于食物,作为特征性食物来源物质,可以作为鲜白酒糟饲喂的特征性生物标志物。PGI2是大血管内皮中环氧化酶(COX)催化花生四烯酸代谢的主要产物[19],具有扩张血管的作用,对血小板聚集、白细胞黏附和血管平滑肌细胞增殖呈抑制表现,还有抗有丝分裂和抑制血管平滑肌细胞DNA合成的作用[20]。Norlander等[21]研究发现,内源性PGI2信号传导在过敏性炎症环境引起的免疫耐受中发挥重要作用,PGI2可能是增强或恢复免疫耐受的治疗策略。在本试验中PGI2表达量下调,这表明鲜白酒糟长期饲喂山羊,有可能导致山羊出现心血管疾病、机体的免疫调节受到影响。
在乙醇中毒通路中,乙醇可延长DA在伏隔核中的作用,或者通过刺激神经元以促进DA的释放。已有的文献显示[22-24],乙醇可以激活中脑边缘DA系统,导致主要投射区域伏隔核(nAc) 的细胞外DA水平增加。轴突末端DA释放后,可通过激活纹状体轴突末端D2自身受体来降低PKA介导的TH磷酸化,降低囊泡中DA的合成和包装[25]。Kleppe等[26]的研究表明,未磷酸化的TH会比磷酸化的TH更易受到DA抑制,使其表达量暂时下降。本试验中慢性酒糟中毒山羊血液中DA的量表现显著升高,组织中TH mRNA的表达显著下降(P < 0.05),这一结果与上述报道结果一致。DDC基因为合成多巴脱羧酶(AADC)提供指令,在大脑和神经系统中很重要,是儿茶酚胺生物合成途径重要的酶之一[27]。Tyr通过YH作用生成L-多巴(L-DOPA),经过AADC生成DA。本研究中慢性酒糟中毒山羊组织中DDC的表达量与对照组比较无显著差异(P>0.05)。上述结果表明,山羊慢性酒糟中毒时,Tyr产量增加、TH表达下降、DA产量增加,导致DA蓄积,可使山羊发生神经系统紊乱。TH在DA的形成过程中表现了明显的抑制DA产生作用。
膜内DA一部分通过溶质载体家族18个成员A2(SLC18A2)作用进入突触小泡中储存,之后运输释放至膜外,膜外的DA又可通过溶质载体家族6成员3(DAT)竞争性摄取,再转运回膜内生成其它神经递质。试验中SLC18A2的表达量未发生明显变化,表明酒精对DA从膜内至膜外的转运路径未产生不利影响。DAT是抑制DA再摄取并导致多巴胺能神经传递升高的精神兴奋剂和治疗药物的靶点[28]。慢性连续乙醇蒸汽暴露会诱导kappa阿片受体功能上调[29],从而抑制降低伏隔核中的DAT表达[30],这与本试验中慢性酒糟中毒山羊组织DAT mRNA相对表达量显著降低的结果是一致的。另一部分DA通过含黄素的胺氧化酶(MAO)转化成3, 4-二羟基苯乙酸酯(DOPAC)和过氧化氢(H2O2)。单胺氧化酶-A(MAOA)具有分解多巴胺、肾上腺素和去甲肾上腺素等单胺物质的重要功能。本研究中慢性酒糟中毒山羊组织MAOA的表达量呈降低趋势(P>0.05),可能提示长期大量饲喂鲜白酒糟引起DA降解效率下降,导致DA累积。
4 结论血液代谢物差异分析表明慢性酒糟中毒山羊出现了能量、脂类、氨基酸代谢的改变及神经功能紊乱,DA、2-FG、PGI2可作为慢性酒糟中毒病的潜在诊断性生物标志物;差异代谢物富集显示,慢性酒糟中毒对乙醇中毒代谢通路影响最为显著,通路中DAT、TH mRNA表达下降,使机体DA浓度升高,进而引起中毒山羊的神经功能紊乱。
| [1] |
DEROSE K, LIU F, DAVIS R W, et al. Conversion of Distiller's grains to renewable fuels and high value protein: integrated techno-economic and life cycle assessment[J]. Environ Sci Technol, 2019, 53(17): 10525-10533. DOI:10.1021/acs.est.9b03273 |
| [2] |
IRAM A, CEKMECELIOGLU D, DEMIRCI A. Distillers' dried grains with solubles (DDGS) and its potential as fermentation feedstock[J]. Appl Microbiol Biotechnol, 2020, 104(14): 6115-6128. DOI:10.1007/s00253-020-10682-0 |
| [3] |
LIU Y Z, LIU S P, HUANG C H, et al. Chinese Baijiu distiller's grains resourcing: Current progress and future prospects[J]. Resour, Conserv Recycl, 2022, 176: 105900. DOI:10.1016/j.resconrec.2021.105900 |
| [4] |
POL K J V, LUEBBE M K, CRAWFORD G I, et al. Performance and digestibility characteristics of finishing diets containing distillers grains, composites of corn processing coproducts, or supplemental corn oil[J]. J Anim Sci, 2009, 87(2): 639-652. DOI:10.2527/jas.2008-1036 |
| [5] |
PANCINI S, SIMEONE A, BENTANCUR O, et al. Evaluation of sorghum dried distillers' grains plus solubles as a replacement of a portion of sorghum grain and soybean meal in growing diets for steers[J]. Livest Sci, 2021, 250: 104564. DOI:10.1016/j.livsci.2021.104564 |
| [6] |
FLODMAN H R, BOYER E J, MUTHUKUMARAPPAN A, et al. Extraction of soluble fiber from Distillers' grains[J]. Appl Biochem Biotechnol, 2012, 166(4): 1070-1081. DOI:10.1007/s12010-011-9495-5 |
| [7] |
冀建军, 王俊萍, 赵书臣, 等. 白酒糟添加量对肉羊增重效果的影响[J]. 黑龙江畜牧兽医, 2016(12): 83-84. JI J J, WANG J P, ZHAO S C, et al. Influence of the addition amount of liquor lees on the weight gain of mutton sheep[J]. Heilongjiang Animal Science and Veterinary Medicine, 2016(12): 83-84. (in Chinese) |
| [8] |
王丽. 日粮白酒糟水平对山羊生产性能和营养物质表观消化率影响[D]. 保定: 河北农业大学, 2014. WANG L. Effects of white Distillers' grains diets on performance and nutrient apparent digestibility of goats[D]. Baoding: Hebei Agricultural University, 2014. (in Chinese) |
| [9] |
王建华. 兽医内科学[M]. 4版. 北京: 中国农业出版社, 2010: 12. WANG J H. Veterinary internal medicine[M]. 4th ed. Beijing: China Agricultural Press, 2010: 12. (in Chinese) |
| [10] |
LIU K S. Chemical composition of distillers grains, a review[J]. Journal of Agricultural and Food Chemistry, 2011, 59(5): 1508-1526. DOI:10.1021/jf103512z |
| [11] |
冀建军, 王俊萍, 段新安, 等. 一例育肥羊白酒糟中毒的诊断与治疗[J]. 畜牧与兽医, 2016, 48(5): 144. JI J J, WANG J P, DUAN X A, et al. Diagnosis and treatment of a case of fattening sheep poisoning with vinasses[J]. Animal Husbandry & Veterinary Medicine, 2016, 48(5): 144. (in Chinese) |
| [12] |
李丽. 浅析牛酒糟中毒的防治[J]. 山东畜牧兽医, 2018, 39(4): 82. LI L. Analysis on the prevention and treatment of cattle distiller's grains poisoning[J]. Shandong Journal of Animal Science and Veterinary Medicine, 2018, 39(4): 82. (in Chinese) |
| [13] |
WHITFIELD J B. Gamma glutamyl transferase[J]. Crit Rev Clin Lab Sci, 2001, 38(4): 263-355. DOI:10.1080/20014091084227 |
| [14] |
刘琼, 杨歆, 唐简, 等. 慢性乙型肝炎患者外周血单个核细胞Tim-3和血清IL-33表达及临床意义[J]. 中华医院感染学杂志, 2020, 30(13): 2014-2017. LIU Q, YANG X, TANG J, et al. Clinical significance of expression of Tim-3 on peripheral blood mononuclear cells and serum IL-33 in diagnosis of patients with chronic hepatitis B[J]. Chinese Journal of Nosocomiology, 2020, 30(13): 2014-2017. (in Chinese) |
| [15] |
ZHANG G M, GUO X X, ZHANG G M. Limiting the testing of urea: urea along with every plasma creatinine test?[J]. J Clin Lab Anal, 2017, 31(5): e22103. DOI:10.1002/jcla.22103 |
| [16] |
SOLINAS M, BELUJON P, FERNAGUT P O, et al. Dopamine and addiction: what have we learned from 40 years of research[J]. J Neural Transm (Vienna), 2019, 126(4): 481-516. DOI:10.1007/s00702-018-1957-2 |
| [17] |
MIYAJIMA K, KAWAMOTO C, HARA S, et al. Tyrosine hydroxylase conditional KO mice reveal peripheral tissue-dependent differences in dopamine biosynthetic pathways[J]. J Biol Chem, 2021, 296: 100544. DOI:10.1016/j.jbc.2021.100544 |
| [18] |
PETTERSEN J E, JELLUM E. The identification and metabolic origin of 2-furoylglycine and 2, 5-furandicarboxylic acid in human urine[J]. Clin Chim Acta, 1972, 41: 199-207. DOI:10.1016/0009-8981(72)90512-8 |
| [19] |
CHENG Y, AUSTIN S C, ROCCA B, et al. Role of prostacyclin in the cardiovascular, response to thromboxane A2[J]. Faseb J, 2003, 17(5): A1054-A. |
| [20] |
RICCIOTTI E, FITZGERALD G A. Prostaglandins and inflammation[J]. Arterioscler, Thromb, Vasc Biol, 2011, 31(5): 986-1000. |
| [21] |
NORLANDER A E, BLOODWORTH M H, TOKI S, et al. Prostaglandin I2 signaling licenses Treg suppressive function and prevents pathogenic reprogramming[J]. J Clin Invest, 2021, 131(7): e140690. |
| [22] |
ERICSON M, BLOMQVIST O, ENGEL J A, et al. Voluntary ethanol intake in the rat and the associated accumbal dopamine overflow are blocked by ventral tegmental mecamylamine[J]. Eur J Pharmacol, 1998, 358(3): 189-196. |
| [23] |
BLOMQVIST O, ERICSON M, ENGEL J A, et al. Accumbal dopamine overflow after ethanol: localization of the antagonizing effect of mecamylamine[J]. Eur J Pharmacol, 1997, 334(2-3): 149-156. |
| [24] |
ERICSON M, CHAU P, CLARKE R B, et al. Rising taurine and ethanol concentrations in nucleus accumbens interact to produce dopamine release after ethanol administration[J]. Addict Biol, 2011, 16(3): 377-385. |
| [25] |
FORD C P. The role of D2-autoreceptors in regulating dopamine neuron activity and transmission[J]. Neuroscience, 2014, 282: 13-22. |
| [26] |
KLEPPE R, WAHEED Q, RUOFF P. DOPA homeostasis by dopamine: a control-theoretic view[J]. Int J Mol Sci, 2021, 22(23): 12862. |
| [27] |
ELKOUZI A, VEDAM-MAI V, EISINGER R S, et al. Emerging therapies in Parkinson disease - repurposed drugs and new approaches[J]. Nat Rev Neurol, 2019, 15(4): 204-223. |
| [28] |
RASTEDT D E, VAUGHAN R A, FOSTER J D. Palmitoylation mechanisms in dopamine transporter regulation[J]. J Chem Neuroanat, 2017, 83-84: 3-9. |
| [29] |
MELCHIOR J R, JONES S R. Chronic ethanol exposure increases inhibition of optically targeted phasic dopamine release in the nucleus accumbens core and medial shell ex vivo[J]. Mol Cell Neurosci, 2017, 85: 93-104. |
| [30] |
HEALEY J C, WINDER D G, KASH T L. Chronic ethanol exposure leads to divergent control of dopaminergic synapses in distinct target regions[J]. Alcohol, 2008, 42(3): 179-190. |
(编辑 白永平)



