2. 重庆市畜牧科学院, 重庆 402460
2. Chongqing Academy of Animal Sciences, Chongqing 402460, China
在哺乳动物的生殖周期中,黄体(corpus luteum,CL)是排卵后由卵泡迅速转变成的富含血管的腺体样结构[1-3],其主要功能是合成类固醇激素孕酮(progesterone,P4),以调节子宫内膜的变化来适应受精卵着床和妊娠维持[4]。在正常的发情周期中,如果受精卵未完成着床或在妊娠末期黄体发生退化,则会开启新的发情周期;如果黄体功能发生异常,P4分泌水平下降,则会导致受精卵着床失败或妊娠终止[5]。可见,黄体在哺乳动物早期妊娠的维持和生殖周期的更替过程中发挥着重要作用。
目前,普遍认为前列腺素(prostaglandin,PG)是哺乳动物黄体维持与退化调控的关键因素[6]。早在1930年,Raphael Kurzruk和Charles Lieb已发现在底层的宫内液中存在某种能够刺激子宫平滑肌收缩的物质;而后Ulf Von Euler于1936年从精液中分离出了这种物质并将其命名为PG,从而开启了PG在诸多领域的研究[7-8]。随后,越来越多的研究证实PG具有丰富的家族成员,而且依据其分子式结构不同可将其分为A2、D2、E2、F2、I2及J2等不同类型。不过,在上述诸多类型中,目前主要以PG家族成员E2(PGE2)和F2α(PGF2α)两种类型研究最为普遍,并证实在生殖方面发挥着重要作用[9-10]。例如,PGF2α成员被广泛认为是反刍动物中促黄体退化的关键因子,而PGE2成员则被认为是母体妊娠时黄体维持的重要介质[11-12]。相比之下,PG家族的其他成员(如PGD2、PGI2等)关于黄体维持与退化的研究却鲜有报道。不过,有研究显示将不同类型的PG成员灌注至母体子宫腔后,相较于PG家族其他成员(如PGF2α),PGD2更能够有效地促进母畜子宫与卵巢之间的血管丛系统(vascular utero-ovarian plexus,UOP)中血流量的增加,从而改变母体子宫源PGF2α向卵巢黄体端的注入量,间接地影响黄体功能性和结构性退化进程[13]。然而,PGD2成员对黄体退化的进程是否具有直接作用机制尚不清楚。为此,本研究对山羊黄体细胞进行原代培养,选择处于离体培养时最适活性的黄体细胞添加适宜浓度的PGD2激素,进行单一环境下黄体细胞功能性和结构性退化的研究;旨在探析PG家族生殖领域研究的新成员PGD2对黄体退化的作用效应及影响,为后续全面解析雌性动物的发情周期调节机理、完善PG优化方案应用提供新的理论依据。
1 材料与方法 1.1 主要试验材料PGD2购自于英国Abcam公司;PrimeScriptTMRT Master Mix和TB Green Premix Ex Taq Ⅱ购自日本TaKaRa公司;前列腺素D2 ELISA试剂盒购自江苏晶美生物科技有限公司;SYP抗体购自北京博奥森生物技术有限公司;BCL-2(AF4700)和Cleaved-Caspase-3(AF7022,以下简写Caspase-3)抗体均购自美国Affinity Biosciences公司;3SDS-PAGE、PVDF膜、ECL化学发光试剂盒等购自索莱宝生物科技有限公司。
1.2 原代黄体细胞分离培养及鉴定1.2.1 原代黄体细胞分离、纯化及培养 从屠宰场收集处于黄体中期的周期性黄体组织,置于加有5倍青链霉素(双抗)的PBS溶液中带回实验室,在生物安全柜内将新鲜的卵巢(黄体)转移至无菌平皿,加75%酒精浸泡1 min;用预热的PBS冲洗3遍,使用眼科剪剪去黄体周围组织,剥离黄体外层薄膜后,将剩余黄体组织在PBS中再冲洗3遍,转移到无菌平皿;置于1 mL无血清的DMEM-F12培养基中,用眼科剪剪成1 mm左右的组织块,按照1∶3体积比加入胶原酶Ⅱ,37 ℃水浴锅内消化约1 h,每隔15 min用1 mL移液枪吹打消化酶,直到没有肉眼可见组织块;200目滤网过滤消化完成后的悬液,1 000 r·min-1离心5 min,弃上清,完全培养基重悬细胞,置于37 ℃、5% CO2的细胞培养箱中培养。之后每隔12 h在显微镜观察下,并拍摄照片记录细胞生长情况,及时换细胞培养液,保证细胞生长环境的良好。黄体细胞贴壁后,采用胰酶差速消化法纯化;待原代细胞在培养皿生长至80%~90%时,吸去旧培养液,并用PBS清洗3次,然后用2.5 g·L-1胰蛋白酶消化,在倒置显微镜下观察,当视野内20%左右的细胞收缩呈圆形时,立即加入培养液终止消化,轻轻吹打2次,吸出细胞悬液,以1 000 r·min-1离心10 min,细胞沉淀用不含血清的培养液洗1次,置另一培养皿继续培养。原培养皿中剩下的约80%贴壁细胞用PBS清洗后继续消化,显微镜下观察待60%的细胞收缩呈圆形时,加入培养液终止,吹打、吸出、离心,置另一培养皿内继续培养。原培养皿中细胞加入培养液继续培养,长至单层后可重复此纯化过程。待其大黄体细胞纯度达到90%左右时,将其接种到一次性6孔培养板,加入新鲜培养液放入37 ℃、5% CO2细胞培养箱中继续培养。
1.2.2 卵巢黄体细胞的鉴定 黄体细胞含有弥散性神经内分泌系统广泛存在的共同标记物SYP,可将SYP作为黄体细胞鉴定的重要依据[14]。本试验通过免疫组化法检测细胞SYP阳性表达的方法鉴定上述大黄体细胞,将其制成细胞悬液,调整浓度以每孔3×103个接种到24孔板上,放入37 ℃、5% CO2培养箱中培养;培养5 d后,弃去细胞培养液,用PBS洗3次,每次2 min;采用500 μL 4%的多聚甲醛固定15 min,室温干燥5 min;PBS清洗标本3次后,用200 μL 0.1% Triton-X-100孵育20 min;PBS清洗标本3次,置于3% H2O2(甲醇稀释)孵育15 min,PBS清洗标本3次后,滴加封闭血清(山羊),37 ℃孵育20 min。甩去多余液体(不洗);加入200 μL一抗SYP抗体(1∶50),4 ℃湿盒中过夜;PBS溶液洗3次后,再用生物素化羊抗兔IgG二抗孵育,37 ℃孵育30 min;PBS溶液洗5次,加D液,37 ℃孵育15 min,PBS溶液洗5次,DAB显色试剂盒显色,显微镜下控制反应时间,以抗原染色呈明显的棕黄色而背景尚无颜色为最佳,显微镜观察并拍照。本试验阴性对照用PBS代替一抗孵育,其余操作步骤相同。
1.2.3 黄体细胞形态观察与分泌功能评价 取纯化后的大黄体细胞,置于6孔板培养基中37 ℃、5% CO2细胞培养箱中培养;每隔1 d用倒置显微镜观察细胞形态,并收集培养1、3、5、7和9 d的细胞培养液,低速离心后,将上清液置于-20 ℃保存,待收集完成后进行P4含量测定。依据P4ELISA试剂盒说明书,将标准品按二倍稀释法稀释,在酶标板上设置空白孔、标准孔及待测样品孔后,分别进行试剂和样品的添加;37 ℃水浴锅中孵育30 min后,进行弃液、洗涤及拍干,此步骤重复5次;每孔加入酶标试剂后,孵育30 min,待其洗涤后依次加入显色剂A和B,37 ℃避光显色10 min;最后,每孔加入终止液,以空白孔调零、450 nm波长测定每孔的吸光度(OD值)。
1.2.4 细胞生长曲线测定 将原代黄体细胞密度调整为1×105个·mL-1,接种到6孔板中,置于37 ℃、5% CO2的培养箱中培养。然后,将培养1、3、5、7及9 d的6孔板取出,每孔添加250 μL CCK-8溶液后孵育2 h。使用酶标仪在450 nm处测定吸光度。测量每个孔的OD值,以吸光度为纵坐标,培养时间为横坐标,绘制细胞生长曲线。每组3个重复。
1.3 前列腺素D2对黄体影响的最佳剂量筛选依据上述原代黄体细胞培养情况,选择处于细胞增殖对数期峰值阶段的黄体细胞。将DMEM/F12完全培养基加入6孔板中,待细胞贴壁至80%左右时,更换为无血清的DMEM/F12培养基继续培养。同时,将所有孔分成3组(n=3),分别向其中添加不同剂量的PGD2激素(1、2和3 μg)[15],每组3个重复;培养48 h后,收集每孔中的细胞培养液-20 ℃保存、待用。使用“1.2.3”中ELISA法检测P4含量。
1.4 前列腺素D2对黄体功能性退化的影响依据“1.3”中PGD2最佳剂量筛选结果,将上述峰值期的黄体细胞接种至6孔板中,添加完全培养基。待细胞贴壁80%左右时,更换为无血清培养基培养;同时,添加2 μg·mL-1的PGD2作为试验组,空白对照组不做任何处理,每组3个重复。培养48 h后,收集各组细胞培养液,收集完成后进行P4含量测定。
1.5 前列腺素D2对黄体结构性退化的影响通过流式细胞仪检测黄体细胞的凋亡情况,分析PGD2对黄体结构性退化的影响。收集试验组和空白组培养48 h的细胞,悬浮于结合缓冲液Annexin×V-FITC/PI中,加入5 μL的Annexin×V-FITC染色液,混匀后室温避光孵育15 min,加入10 μL PI染色液,再次混匀避光孵育5 min,上机检测。
1.6 黄体mRNA的提取和实时荧光定量聚合酶链式反应(qRT-PCR)采集黄体细胞样品后加入TRIzol,采用TRIzol法对细胞总RNA进行分离提取,并分别使用Nano PhotometerⓇ分光光度计(IMPLEN,Westlake Village,CA),QubitⓇ RNA Assay Kitin QubitⓇ 2.0 Fluorometer(Life Technologies,Carlsbad,CA)及Bioanalyzer2100系统的RNANano6000检测试剂盒(Agilent Technologies,SantaClara,CA)进行RNA纯度、浓度和完整度的检测。所有样品的OD260nm/OD280nm值均≥1.9,RIN(RNA Integrity Number)值均≥8.0。使用PrimeScript RT reagent Kit with gDNA Eraser试剂盒和荧光定量聚合酶链反应仪(Applied Biosystems,美国)进行体系为10 μL的qRT-PCR反应,具体反应体系:SYBRⓇ Premix Ex TaqTM为5.0 μL,cDNA(50 ng·μL-1)为1.0 μL,上、下游引物(10 μmol·L-1)各为0.2 μL,ROX Reference Dye Ⅱ为0.2 μL,RNase-free ddH2O为3.4 μL。反应程序:95 ℃预变性30 s;95 ℃变性5 s;60 ℃退火30 s,共40个循环。以β-actin作为内参基因,根据GenBank中StAR、3β-HSD、BCL-2、Caspase-3及β-actin序列使用软件Primer Premier 5.0设计,引物信息见表 1。
|
|
表 1 定量PCR引物信息 Table 1 Primer information for quantitative PCR |
收集每组转染48 h的黄体细胞,并使用RIPA强细胞裂解液分层提取总蛋白。使用BCA蛋白质定量试剂盒检测蛋白质浓度,然后一定量的样品和蛋白质Marker进行SDS-PAGE操作,并将目的蛋白切胶转移至PVDF膜上,置于摇床室温清洗封闭,取出PVDF膜加入BCL-2、Caspase-3和β-actin一抗,4 ℃摇床、孵育;最后,PBST摇床洗涤,加入羊抗兔IgG室温孵育。使用ECL化学发光观察蛋白质不同条带,并使用Quantity One软件量化条带强度。
1.8 统计方法Real time PCR结果使用2-ΔΔCt法计算,所得数据结果以“x ±s”表示。P4含量使用SPSS17.0软件进行单因素方差分析,P < 0.05表示显著性差异,P < 0.01表示差异极显著。
2 结果 2.1 黄体细胞的原代培养及鉴定取到合格、理想的黄体样本,是达到原代细胞预期培养目的的前提。羊的黄体细胞缺少脂色素,而呈现肉色;进行黄体细胞培养时,本试验选取空怀母羊处于黄体中期的组织进行原代细胞培养(图 1A)。在倒置显微镜下观察,用胶原酶Ⅱ消化与胰酶差速法纯化后,培养24 h黄体细胞开始贴壁,体积较大、呈多面体,有向外延伸趋势,相邻的细胞间开始建立连接(图 1B)。此时,利用免疫组化法检测细胞SYP阳性表达情况,黄体细胞的阳性率达90%以上,说明分离纯化后得到的原代细胞为靶黄体细胞,可用于后续试验(图 1C、D)。
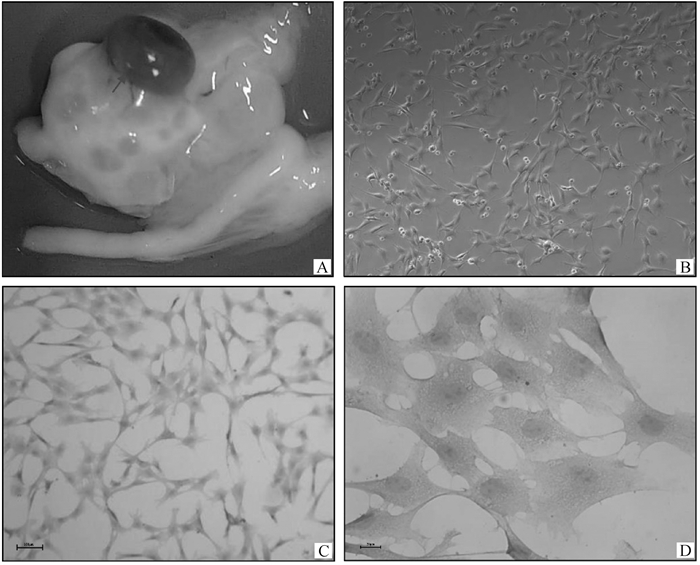
|
图 1 黄体细胞的原代培养及鉴定(B/C为100×,D为400×) Fig. 1 Primary culture and identification of luteal cells(B/C is 100×, D is 400×) |
2.2.1 原代黄体细胞的形态观察 依据上述黄体细胞原代培养方法,经倒置显微镜跟踪观察发现,如图 2所示,培养1 d后的原代黄体细胞,呈细胞体透亮,形状为不规则多角形,临近黄体细胞间出现部分连接(图 2A)。培养3 d后,黄体细胞开始进入对数生长期,细胞完全贴壁,细胞密度明显增加、细胞间连接紧密(图 2B)。培养5 d后,黄体细胞铺满培养皿底部、细胞生长均匀,且细胞外形紧凑、细胞胞质饱满、形态清晰可见,此时细胞呈现最佳状态(图 2C)。培养至7 d时,黄体细胞已出现明显的悬浮现象,培养皿中大部分细胞呈现肥大、边缘模糊、不均匀分布的特点(图 2D)。培养9 d后,培养基中悬浮细胞呈团簇状,出现大量空泡化细胞、细胞间连接消失(图 2E)。

|
A~E. 培养1、3、5、7、9 d细胞形态;F. P4浓度, *.P < 0.05, **.P < 0.01 A-E. Cell morphology after culture for 1, 3, 5, 7 and 9 days; F. P4 concentration, *.P < 0.05, **.P < 0.01 图 2 原代黄体细胞各时间点的形态 Fig. 2 Morphology of primary luteal cells at different time points |
2.2.2 原代黄体细胞分泌功能评价 P4是黄体细胞内分泌功能的重要指征,如图 2F所示。在原代黄体细胞培养过程中,发现随着黄体细胞培养时间的延长,在离体培养5 d时黄体细胞分泌P4浓度达到最高水平。随后,其浓度逐渐呈现递减趋势,具体P4浓度的递进变化关系为:培养5 d>7 d>3 d>9 d>1 d。与原代培养1、3、7和9 d的黄体细胞相比,培养5 d的黄体细胞活性状态最佳,较适合作为细胞试验的素材、用于后续PGD2处理黄体细胞的研究。
2.3 原代黄体细胞的生长曲线由原代黄体细胞的生长曲线可见(图 3),黄体细胞接种培养1 d时生长缓慢;在接种后培养3 d呈现快速生长状态,进入对数生长期;直至培养5 d时,细胞生长到达最高值,进入平台期。在此时期之前,细胞生长曲线呈倒置的“S”形。随后,细胞生长开始减慢,培养7 d时细胞出现死亡,至培养9 d时细胞死亡数量明显增多。
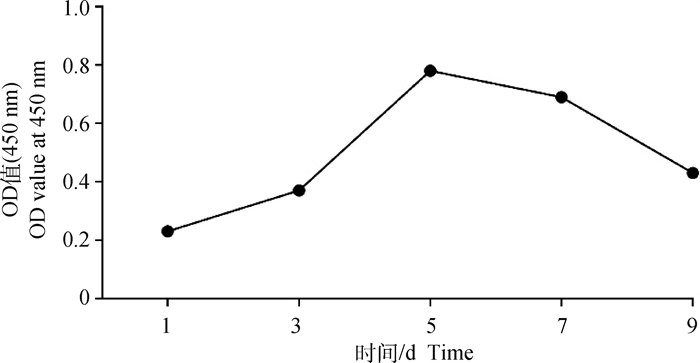
|
图 3 细胞生长曲线 Fig. 3 Growth curve of luteal cells |
接种对数期峰值点细胞后,不同剂量PGD2处理48 h,利用ELISA法检测培养基中黄体细胞的内分泌功能(P4)。结果发现,经PGD2处理48 h后,与对照组相比,2 μg剂量组中P4浓度呈极显著下降(P<0.01),3 μg剂量组中P4浓度呈显著性下降(P<0.05);然而,1 μg剂量组中P4浓度未发生明显下降。此时,P4浓度变化为2 μg组<3 μg组<1 μg组(图 4)。
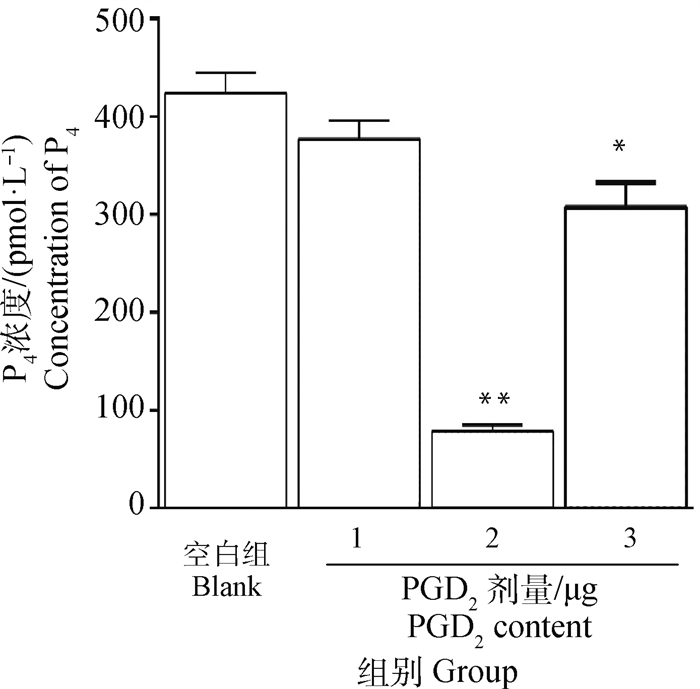
|
均与空白组比较,进行显著性分析。*.P < 0.05, **.P < 0.01 Compared with the blank group, the significance analysis was carried out. *.P < 0.05, **.P < 0.01 图 4 不同剂量PGD2处理后P4浓度 Fig. 4 P4 concentration after treatment with different doses of PGD2 |
为了明确PGD2对黄体细胞的功能和结构的影响,在接种对数期峰值点细胞后,添加最适剂量2 μg PGD2处理48 h。首先,利用ELISA法检测培养基中黄体细胞分泌P4的浓度(如图 5 A所示),与对照组相比,经PGD2处理后的试验组中P4浓度呈极显著性下降(P<0.01)。同时,实时荧光定量PCR检测发现,P4合成的关键酶基因StAR和3β-HSD mRNA表达量也呈显著性降低(P<0.05)(如图 5B、C所示)。
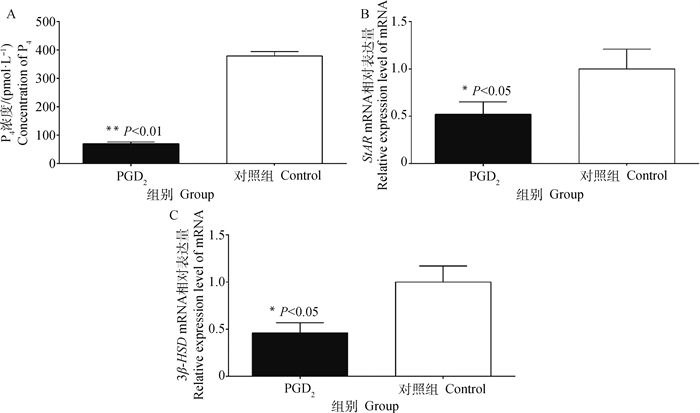
|
图 5 PGD2处理后P4浓度和关键合成酶StAR/3β-HSD基因表达的变化 Fig. 5 Changes of P4 concentration and its key synthase StAR/3β-HSD gene expression after PGD2 treatment |
2.6.1 流式细胞术检测细胞凋亡情况 利用流式细胞仪检测上述PGD2处理组和空白组中黄体细胞的凋亡率,使用Annexin V-FITC和PI染色液进行单染。结果发现,与对照组相比(图 6B),经PGD2处理后的试验组中黄体细胞凋亡率(即UR+LR)明显增加(图 6A)。使用Flow Jo软件进行黄体细胞凋亡率分析后,显示PGD2处理后的黄体细胞凋亡率显著性上调(P<0.05)(图 6C)。
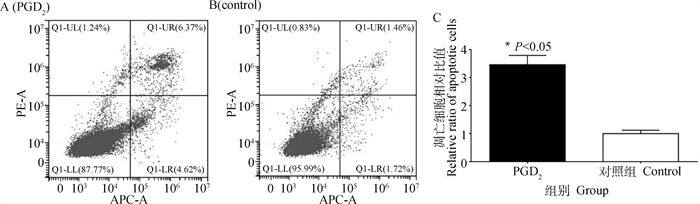
|
图 6 流式细胞仪测PGD2对黄体细胞凋亡的影响 Fig. 6 Effect of PGD2 on apoptosis of luteal cells were detected by flow cytometry |
2.6.2 前列腺素D2对黄体细胞凋亡相关基因的影响 利用qRT-PCR和Western blot检测上述PGD2处理组和空白组中黄体细胞的BCL-2和Caspase-3 mRNA和蛋白表达水平,以β-actin为内参基因,结果如图 7所示。与对照组相比,经PGD2处理后黄体细胞中抗凋亡因子BCL-2 mRNA表达量显著降低(P<0.05)(图 7A),促凋亡因子Caspase-3 mRNA表达量明显增加(P<0.05)(图 7B)。同时,使用Quantity One软件量化蛋白印迹条带强度分析,显示PGD2处理后黄体细胞中抗凋亡因子BCL-2蛋白表达量也呈显著性减少(P<0.05),促凋亡因子Caspase-3蛋白表达量相应的也呈显著性上调(P<0.05)(图 7C、D)。
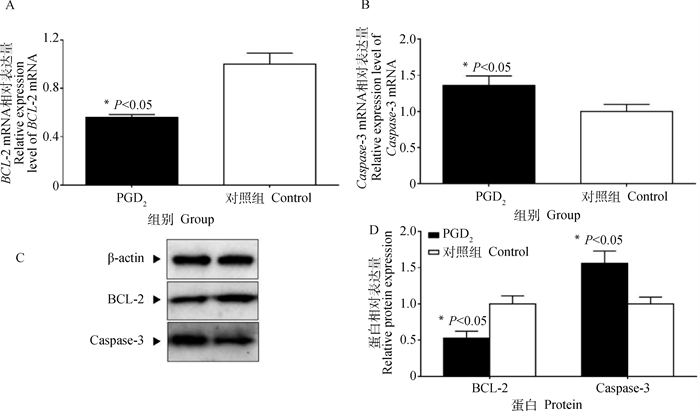
|
A、B. qRT-PCR结果;C、D. Western blot结果 A, B. qRT-PCR results; C, D. Western blot results 图 7 黄体细胞凋亡相关基因的相对表达丰度 Fig. 7 Relative abundance of luteal cell apoptosis related genes |
黄体是雌性哺乳动物卵巢内的暂时性分泌腺体,在哺乳动物的发情、受精卵着床以及妊娠维持中发挥着不可替代作用。但黄体作为下丘脑-垂体-卵巢(黄体)性腺轴中的重要一环,在体内受到诸多因素的影响(如激素、神经、动物应激或个体之间的差异等),很难准确地阐述黄体自体细胞的生理调节机制,研究进展缓慢[16-17]。体外细胞培养技术的建立为黄体细胞的研究提供了新的思路和方法,可对其直接施加激素、药物、细胞影响因子等,因此黄体细胞离体成功培养是体外研究黄体的基础。
黄体组织属于弥散性神经内分泌系统,具有四种神经内分泌标志物:SYP、S100、5-羟色胺(5-hydroxytryptophan,5-HT)和神经元特异性烯醇化酶(neuron-specific enolase,NSE)[14, 18]。其中,有研究显示,SYP几乎存在于所有的神经内分泌细胞中,是一种全面的、新的神经内分泌标记物,比NSE、S100及5-HT更具有特异性,可被用来区分黄体细胞、颗粒细胞和间质细胞[19]。本试验采用SYP活性来鉴定培养的原代黄体细胞显示细胞SYP为阳性,表明分离培养的细胞为黄体细胞。同时,结合阳性细胞体积较大、呈多面体以及细胞核位于中央位置等表型特征,发现上述结果与Rodgers和O’Shea[20]及Wang等[21]研究报道相吻合,符合大黄体细胞的典型特点,说明课题组已成功完成了靶黄体细胞的离体培养及黄体细胞的纯化。与此同时,在离体培养期间,课题组观察发现黄体细胞经24 h培养,开始有少量P4分泌;培养72 h后,黄体细胞合成与分泌P4的能力大幅度增加;培养5 d后,培养液中黄体细胞分泌P4的浓度达到峰值。随后,随着培养时间的延长,培养液中P4的浓度则逐渐减少,提示体外培养的山羊原代黄体细胞在离体培养5 d时呈现最佳内分泌状态。此外,结合离体培养的细胞表型特征和生长曲线的变化趋势,发现培养24 h后培养皿中细胞数量较少;培养72 h后,培养皿中的细胞开始进入对数生长期;直至培养5 d,培养皿中黄体细胞密度到达峰值。结果显示,在这一过程中,黄体细胞生长曲线呈现倒置的“S”形,与Wang等[21]研究结果一致。不难发现与其它时间段相比,在本研究中离体培养5 d的山羊原代黄体细胞更适合作为细胞模型用于开展后续试验。
前列腺素是黄体维持与退化的关键因素,在哺乳动物的黄体结构完整性和内分泌功能维持方面发挥着重要作用[7, 22]。目前,普遍认为PGF2α是PG家族中促进黄体退化的主要因素,而PGE2则是维持黄体存在的重要保护介质。相比之下,PG家族的其他成员在繁殖领域的研究却鲜有报道。PGD2作为PG家族中最有效的促进子宫-卵巢UOP系统血流量的成员,有研究显示PGD2很可能在黄体维持与退化过程中以某种直接或间接的方式发挥着重要的调节作用[23-24]。不过,PG作为一类具有广泛生理活性的激素,其生物学效应总是与其剂量间存在一定的依赖性关系[25-27]。例如,低剂量PGF2α只会引起黄体内分泌功能(P4浓度)的下降,而不引起黄体发生结构性的溶解;但高剂量PGF2α,不仅会引起黄体内分泌功能下降,还会加速黄体的结构性溶解[25, 28]。基于此,本研究将试验设置成了三组不同剂量梯度,即通过添加1、2和3 μg不同剂量的PGD2处理大黄体细胞,结果发现PGD2仅在2 μg剂量时才会呈现出最佳的黄体内分泌功能下调作用,而当其剂量增加或减少时均会表现出弱于前者的现象。产生这一结果的原因很可能与细胞膜上PGD2受体(DP1和CRTH2)表达量的变化有关[29],同时这也造成了PGD2成员对黄体细胞作用存在一定的剂量依赖性,并在黄体细胞退化中可能发挥着“类PGF2α”效应[30-31]。众所周知,黄体的退化主要涉及功能性退化与结构性退化两个方面内容;其中,前者主要表现为P4浓度的下降,而黄体细胞的结构依然保持完整和形态稳定[32-33];随后,随着退化进程的递进,黄体则会开启结构性退化,其结构的完整性便随之被破坏、黄体体积减小,最终完全消融[25, 31, 34]。本研究中,当PGD2剂量为2 μg时,培养基中黄体细胞内分泌P4水平显著下降,提示PGD2确实诱导黄体细胞发生了明显地内分泌功能性退化。同时,StAR和3β-HSD作为催化P4合成与分泌的关键合成酶[35]。实时荧光定量检测结果发现,StAR和3β-HSD基因的相对表达量与上述P4水平结果相一致,进一步证实PGD2在黄体细胞功能性退化中发挥着促进作用;而且,这种促进作用很可能是通过下调P4关键合成酶基因StAR和3β-HSD的表达来实现。不过,相较于功能性退化,黄体细胞的结构性退化则主要表现为黄体细胞凋亡机制启动引起其细胞结构完整性破坏以及细胞生命周期的结束。本研究中,流式细胞仪检测细胞凋亡率发现,经PGD2处理后试验组中黄体细胞的凋亡率明显增加,说明PGD2对黄体细胞退化的作用可能并不仅仅局限于单一的促进黄体细胞的功能性退化;同时,也会引起黄体细胞发生结构性退化,继而开启其对黄体细胞调控的双重促进效应。目前,在众多的细胞凋亡途径中,主要以BCL-2家族中抗凋亡基因BCL-2基因和Caspase家族中促凋亡基因Caspase-3的相关研究最受关注[36-38]。实际上,作为典型的BCL-2家族成员的抗凋亡基因代表,BCL-2在保护细胞内环境稳定中发挥着关键作用[36]。例如,在小鼠、人和牛的黄体组织中,随着黄体腺体“形成-维持-退化”发育进程的递进,其组织内BCL-2的表达量也随之相应的递增转而递减[39-40],这进一步论证了BCL-2在黄体细胞中的作用是保护其结构的完整性,而不是促进其细胞结构的破坏。类似地,在PGD2处理后的试验组中,黄体细胞的BCL-2 mRNA和蛋白的表达量均呈现显著性下调,说明此时黄体细胞中的抗凋亡信号已被削弱,黄体细胞的状态极不稳定;这一结论与上述黄体细胞凋亡率增加、内分泌功能下降结果相吻合。同时,Caspase-3作为细胞凋亡级联反应的关键信号,它在细胞凋亡过程中占据核心地位,是下游凋亡细胞死亡程序的最终执行者[37-38]。目前,诸多研究发现Caspase-3凋亡基因表达与黄体退化有关,且在这些研究中它的表达量均在黄体退化过程中呈现较高表达[38, 41-42]。正如Carambula等[43]的研究所示,Caspase-3缺失的小鼠黄体会在其退化过程中发生细胞凋亡的延迟,说明Caspase-3基因在哺乳动物的黄体退化过程中发挥着促凋亡的调控作用。类似地,在本研究中,经PGD2处理后发现在试验组中Caspase-3 mRNA和蛋白的表达量呈显著性增加,提示在PGD2处理后的黄体细胞中已开启细胞凋亡途径的下游级联反应,诱导其黄体细胞发生了结构性退化。综上,不难发现PGD2对黄体细胞的作用不仅涉及黄体细胞内分泌功能的抑制,还包括细胞结构性的消亡。因此,作者推测PGD2对黄体细胞的效应除了通过舒张血管以增加子宫源主效因子PGF2α向卵巢黄体端的转运,去间接的影响黄体退化的进程外;同时,还可能会通过下调P4关键合成酶活性加速黄体的功能性退化,再通过抑制抗凋亡基因BCL-2表达和激活促凋亡基因Caspase-3基因表达启动黄体细胞凋亡途径,破坏其细胞结构的完整性及细胞内环境的稳定,最终以直接作用的方式参与黄体退化的促进效应。
4 结论在黄体细胞的单一环境下,PGD2对黄体退化的生物学效应主要涉及两个方面。(1)通过下调关键合成酶StAR和3β-HSD基因表达抑制黄体细胞内分泌激素P4的合成诱导其发生功能性退化;(2)通过下调抗凋亡BCL-2基因表达和上调促凋亡Caspase-3基因表达启动黄体细胞凋亡途径加速其发生结构性消亡,最终以直接作用的方式参与其对黄体退化的调控效应,这为全面认识PG家族成员的生物学功能效应及深入探析母畜黄体维持与退化的分子网络调控机制奠定了坚实基础。
| [1] |
WILTBANK M C, SOUZA A H, CARVALHO P D, et al. Physiological and practical effects of progesterone on reproduction in dairy cattle[J]. Animal, 2014, 8(Suppl 1): 70-81. |
| [2] |
MESEN T B, YOUNG S L. Progesterone and the luteal phase: a requisite to reproduction[J]. Obstet Gynecol Clin North Am, 2015, 42(1): 135-151. DOI:10.1016/j.ogc.2014.10.003 |
| [3] |
NAFTOLIN F, KHAFAGA A, NACHTIGALL M. The hypothalamic-pituitary-ovarian axis and regulation of the menstrual cycle[M]//BERGA S L, GENAZZANI A E, NAFTOLIN F, et al. Menstrual Cycle Related Disorders. Cham: Springer, 2019: 1-13.
|
| [4] |
WILTBANK M C, MEZERA M A, TOLEDO M Z, et al. Physiological mechanisms involved in maintaining the corpus luteum during the first two months of pregnancy[J]. Anim Reprod, 2018, 15(Suppl 1): 805-821. |
| [5] |
DE BRUN V, MEIKLE A, FERNÁNDEZ-FOREN A, et al. Failure to establish and maintain a pregnancy in undernourished recipient ewes is associated with a poor endocrine milieu in the early luteal phase[J]. Anim Reprod Sci, 2016, 173: 80-86. DOI:10.1016/j.anireprosci.2016.08.016 |
| [6] |
ZIECIK A J, PRZYGRODZKA E, KACZMAREK M M. Corpus luteum regression and early pregnancy maintenance in pigs[M]//MEIDAN R. The Life Cycle of the Corpus Luteum. Cham: Springer, 2017: 227-248.
|
| [7] |
BERISHA B, SCHAMS D, RODLER D, et al. Changes in the expression of prostaglandin family members in bovine corpus luteum during the estrous cycle and pregnancy[J]. Mol Reprod Dev, 2018, 85(7): 622-634. DOI:10.1002/mrd.22999 |
| [8] |
OCHOA J C, PEÑAGARICANO F, BAEZ G M, et al. Mechanisms for rescue of corpus luteum during pregnancy: gene expression in bovine corpus luteum following intrauterine pulses of prostaglandins E1 and F2α[J]. Biol Reprod, 2018, 98(4): 465-479. DOI:10.1093/biolre/iox183 |
| [9] |
AROSH J A, BANU S K, MCCRACKEN J A. Novel concepts on the role of prostaglandins on luteal maintenance and maternal recognition and establishment of pregnancy in ruminants[J]. J Dairy Sci, 2016, 99(7): 5926-5940. DOI:10.3168/jds.2015-10335 |
| [10] |
WILTBANK M C, MEIDAN R, OCHOA J, et al. Maintenance or regression of the corpus luteum during multiple decisive periods of bovine pregnancy[J]. Anim Reprod, 2016, 13(3): 217-233. DOI:10.21451/1984-3143-AR865 |
| [11] |
ABOELENAIN M, KAWAHARA M, BALBOULA A Z, et al. Status of autophagy, lysosome activity and apoptosis during corpus luteum regression in cattle[J]. J Reprod Dev, 2015, 61(3): 229-236. DOI:10.1262/jrd.2014-135 |
| [12] |
BOWOLAKSONO A, FAUZI M, SUNDARI A M, et al. The effects of luteinizing hormone as a suppression factor for apoptosis in bovine luteal cells in vitro[J]. Reprod Domest Anim, 2021, 56(5): 744-753. DOI:10.1111/rda.13913 |
| [13] |
SCHRAMM W, EINER-JENSEN N, BROWN M B, et al. Effect of four primary prostaglandins and relaxin on blood flow in the ovine endometrium and myometrium[J]. Biol Reprod, 1984, 30(3): 523-531. DOI:10.1095/biolreprod30.3.523 |
| [14] |
王仲慧, 唐彩琰, 莫虹斐, 等. 山羊黄体细胞的原代培养及鉴定[C]//中国畜牧兽医学会动物解剖学及组织胚胎学分会第十七次学术研讨会论文集(下). 太谷: 中国畜牧兽医学会, 2012: 150-157. WANG Z H, TANG C Y, MO H F, et al. Primary culture and biological characteristics of luteal cells from goat[C]//Proceedings of the 17th Academic Symposium of Animal Anatomy and Tissue and Embryology Branch of Chinese Animal Husbandry and Veterinary Society (Volume Ⅱ). Taigu: Chinese Association of Animal Science and Veterinary Medicine, 2012: 150-157. (in Chinese) |
| [15] |
BHUYAN B K, BADINER G J, ADAMS E G, et al. Cytotoxicity of combinations of prostaglandin D2 (PGD2) and antitumor drugs for B16 melanoma cells in culture[J]. Invest New Drugs, 1986, 4(4): 315-323. DOI:10.1007/BF00173504 |
| [16] |
RACHDAOUI N, SARKAR D K. Pathophysiology of the effects of alcohol abuse on the endocrine system[J]. Alcohol Res, 2017, 38(2): 255-276. |
| [17] |
DEWITT N A, WHIRLEDGE S, KALLEN A N. Updates on molecular and environmental determinants of luteal progesterone production[J]. Mol Cell Endocrinol, 2020, 515: 110930. DOI:10.1016/j.mce.2020.110930 |
| [18] |
SQUILLACIOTI C, PELAGALLI A, LIGUORI G, et al. Urocortins in the mammalian endocrine system[J]. Acta Vet Scand, 2019, 61(1): 46. DOI:10.1186/s13028-019-0480-2 |
| [19] |
卢习. 山羊黄体细胞的分离培养和鉴定方法的研究[D]. 杨凌: 西北农林科技大学, 2011. LU X. Isolation, culture and identification of luteal cell from goats[D]. Yangling: Northwest A&F University, 2011. (in Chinese) |
| [20] |
RODGERS R J, O'SHEA J D. Purification, morphology, and progesterone production and content of three cell types isolated from the corpus luteum of the sheep[J]. Aust J Biol Sci, 1982, 35(4): 441-455. DOI:10.1071/BI9820441 |
| [21] |
WANG Z H, CHEN S L, MO H F, et al. A simple and economical method in purifying dairy goat luteal cells[J]. Tissue Cell, 2013, 45(4): 269-274. DOI:10.1016/j.tice.2013.03.004 |
| [22] |
VON VERSEN-HÖYNCK F, NARASIMHAN P, SELAMET TIERNEY E S, et al. Absent or excessive corpus luteum number is associated with altered maternal vascular health in early pregnancy[J]. Hypertension, 2019, 73(3): 680-690. DOI:10.1161/HYPERTENSIONAHA.118.12046 |
| [23] |
WACLAWIK A, BLITEK A, ZIECIK A J. Oxytocin and tumor necrosis factor α stimulate expression of prostaglandin E2 synthase and secretion of prostaglandin E2 by luminal epithelial cells of the porcine endometrium during early pregnancy[J]. Reproduction, 2010, 140(4): 613-622. DOI:10.1530/REP-10-0092 |
| [24] |
MORI A, SAITO M, SAKAMOTO K, et al. Intravenously administered vasodilatory prostaglandins increase retinal and choroidal blood flow in rats[J]. J Pharmacol Sci, 2007, 103(1): 103-112. DOI:10.1254/jphs.FP0061061 |
| [25] |
MEIRA C, PESSOA V M, FERREIRA J C P, et al. Alternative low doses and routes of administering a prostaglandin F2αanalogue to induce luteolysis in Nelore cows[J]. J Vet Sci, 2006, 7(4): 387-390. DOI:10.4142/jvs.2006.7.4.387 |
| [26] |
JUENGEL J L, HAWORTH J D, ROLLYSON M K, et al. Effect of dose of prostaglandin F2α on steroidogenic components and oligo nucleosomes in ovine luteal tissue[J]. Biol Reprod, 2000, 62(4): 1047-1051. DOI:10.1095/biolreprod62.4.1047 |
| [27] |
WATANABE S, SHIRASUNA K, MATSUI M, et al. Effect of intraluteal injection of endothelin type a receptor antagonist on PGF2α-induced luteolysis in the cow[J]. J Reprod Dev, 2006, 54(4): 551-559. |
| [28] |
CUERVO-ARANGO J, NEWCOMBE J R. Cloprostenol in equine reproductive practice: something more than a luteolytic drug[J]. Reprod Domest Anim, 2010, 45(5): e8-e11. |
| [29] |
杨恒, 邵焱焱, 赵宗胜, 等. 前列腺素D2与F2α对绵羊黄体退化的影响及其机理研究[J]. 畜牧兽医学报, 2021, 52(6): 1582-1593. YANG H, SHAO Y Y, ZHAO Z S, et al. Study on the effect and mechanism of prostaglandin D2 and F2α on the corpus luteum regression in sheep[J]. Acta Veterinaria et Zootechnica Sinica, 2021, 52(6): 1582-1593. (in Chinese) |
| [30] |
MIYAMOTO A, SHIRASUNA K. Luteolysis in the cow: a novel concept of vasoactive molecules[J]. Anim Reprod, 2009, 6(1): 47-59. |
| [31] |
SOCHA B M, ŁADA P, JOŃCZYK A W, et al. The role of peroxisome proliferator-activated receptors in PGF2α-induced luteolysis in the bovine corpus luteum[J]. Animals (Basel), 2022, 12(12): 1542. |
| [32] |
ABEDEL-MAJED M A, ROMEREIM S M, DAVIS J S, et al. Perturbations in lineage specification of granulosa and theca cells may alter corpus luteum formation and function[J]. Front Endocrinol (Lausanne), 2019, 10: 832. DOI:10.3389/fendo.2019.00832 |
| [33] |
GRZESIAK M, MICHALIK A, RAK A, et al. The expression of autophagy-related proteins within the corpus luteum lifespan in pigs[J]. Domest Anim Endocrinol, 2018, 64: 9-16. DOI:10.1016/j.domaniend.2018.03.004 |
| [34] |
BERISHA B, THAQI G, RODLER D, et al. Regulatory changes of local produced prostaglandins in corpus luteum after experimentally induced luteolysis in the cow[J]. Anat Histol Embryol, 2022, 51(2): 289-299. DOI:10.1111/ahe.12790 |
| [35] |
REKAWIECKI R, KOWALIK M K, SLONINA D, et al. Regulation of progesterone synthesis and action in bovine corpus luteum[J]. J Physiol Pharmacol, 2008, 59(Suppl 9): 75-89. |
| [36] |
ASHKENAZI A, FAIRBROTHER W J, LEVERSON J D, et al. From basic apoptosis discoveries to advanced selective BCL-2 family inhibitors[J]. Nat Rev Drug Discov, 2017, 16(4): 273-284. DOI:10.1038/nrd.2016.253 |
| [37] |
YADAV V K, LAKSHMI G, MEDHAMURTHY R. Prostaglandin F2α-mediated activation of apoptotic signaling cascades in the corpus luteum during apoptosis: INVOLVEMENT OF CASPASE-ACTIVATED DNase[J]. J Biol Chem, 2005, 280(11): 10357-10367. DOI:10.1074/jbc.M409596200 |
| [38] |
JONCZYK A W, PIOTROWSKA-TOMALA K K, SKARZYNSKI D J. Effects of prostaglandin F2α (PGF2α) on cell-death pathways in the bovine corpus luteum (CL)[J]. BMC Vet Res, 2019, 15(1): 416. DOI:10.1186/s12917-019-2167-3 |
| [39] |
SLOT K A, VOORENDT M, DE BOER-BROUWER M, et al. Estrous cycle dependent changes in expression and distribution of Fas, Fas ligand, Bcl-2, Bax, and pro-and active caspase-3 in the rat ovary[J]. J Endocrinol, 2006, 188(2): 179-192. DOI:10.1677/joe.1.06165 |
| [40] |
SKARZYNSKI D J, FERREIRA-DIAS G, OKUDA K. Regulation of luteal function and corpus luteum regression in cows: hormonal control, immune mechanisms and intercellular communication[J]. Reprod Domest Anim, 2008, 43(Suppl 2): 57-65. |
| [41] |
YANG Y L, REN L R, SUN L F, et al. The role of GPR1 signaling in mice corpus luteum[J]. J Endocrinol, 2016, 230(1): 55-65. DOI:10.1530/JOE-15-0521 |
| [42] |
MEIDAN R, GIRSH E, MAMLUK R, et al. Luteolysis in ruminants: past concepts, new insights, and persisting challenges[M]//MEIDAN R. The Life Cycle of the Corpus Luteum. Cham: Springer, 2017: 159-182.
|
| [43] |
CARAMBULA S F, PRU J K, LYNCH M P, et al. Prostaglandin F2alpha-and FAS-activating antibody-induced regression of the corpus luteum involves caspase-8 and is defective in caspase-3 deficient mice[J]. Reprod Biol Endocrinol, 2003, 1: 15. DOI:10.1186/1477-7827-1-15 |
(编辑 白永平)



