2. 西安交通大学生命科学与技术学院, 西安 710000;
3. 天康生物股份有限公司, 乌鲁木齐 830000
2. College of Life Science and Technology, Xi'an Jiaotong University, Xi'an 710000, China;
3. Tecon Biology Co., Ltd., Urumqi 830000, China
口蹄疫(foot-and-mouth disease, FMD)疫苗是预防口蹄疫传播的有效措施。佐剂常用于增强口蹄疫灭活抗原(inactivated foot-and-mouth disease viral antigen,FMD-Ag)的免疫原性,从而增强其效力[1]。ISA-206油乳剂在FMD疫苗应用广泛,ISA-206油乳剂虽然佐剂效果优良,但易在注射部位产生肉芽肿等[2],因此,开发低毒、免疫增强效果良好的佐剂是提高FMD疫苗效力的关键。
近年来,中药类佐剂、纳米乳剂、细胞因子佐剂、模式识别受体佐剂等被应用于FMD疫苗佐剂的筛选[3]。中药多糖作为FMD疫苗佐剂在提高疫苗效力的同时表现出良好的安全性,如黄芪多糖、白术多糖、川明参多糖、牛膝多糖等能够诱导FMD疫苗特异性IgG抗体、T细胞增殖、细胞因子分泌,并促进树突状细胞成熟[4-5]。研究表明,中药多糖亲水性高、稳定性好,具有良好的乳化和增稠作用,如沙蒿多糖、铁皮石斛多糖、党参多糖等作为乳化剂能降低油-水界面表面张力,提高乳液稳定性[6-7]。因此,中药多糖作为免疫增强剂具有改善FMD疫苗的免疫原性和稳定性的潜力。
新疆一枝蒿(Artemisia rupestris L.)是菊科蒿属中药,多糖、黄酮、一枝蒿酮酸、生物碱等为其主要活性成分并具有多种药理活性,包括免疫增强活性,抗病毒,抗肿瘤的作用[8]。栽培一枝蒿相关制剂已应用于临床,如复方一枝蒿感冒颗粒用于抗流感治疗;一枝蒿酊剂用于治疗过敏性、神经性皮炎等[4, 9]。前期研究发现栽培一枝蒿粗多糖(cultivated A. rupestris L. crude polysaccharides,CARCP)作为卵清白蛋白(ovalbumin, OVA)、流感疫苗和FMD疫苗的佐剂通过提高抗体水平、激活效应和记忆T细胞、增强CTL反应、活化树突状细胞等调控Th1/Th2反应,并具有良好的安全性[10-11]。
现用商品化FMD疫苗由FMD-Ag与ISA-206油乳剂通过乳化制备而成,乳化方法和乳化程度会影响疫苗的免疫效果。常用乳化方法有研磨法、注射器混合法、搅拌法、超声法等,研磨法和注射器混合法使用简便,但易造成抗原浪费;超声乳化方便快捷,但需要专用仪器和冰浴;搅拌乳化简单可控,常用于生产中[12-13]。基于前期的研究,选用CARCP作为FMD疫苗的佐剂,协同ISA-206油乳剂与FMD-Ag制备不同组合的FMD疫苗,皮下免疫小鼠后检测体液免疫和细胞免疫水平,比较不同乳化方法对FMD疫苗免疫效果的影响。由于不同的储存条件也会影响FMD疫苗的效力,为此探讨了不同储存条件下CARCP单独或协同ISA-206油乳剂对FMD疫苗稳定性的影响,为CARCP多糖佐剂作为FMD疫苗佐剂的研究提供参考。
1 材料与方法 1.1 试验材料栽培一枝蒿多糖为实验室制备[11],简述如下:粉末经无水乙醇脱色后,水提醇沉法制备CARCP,Sevag法除蛋白,苯酚/硫酸法测得多糖含量为35.65%。FMD-Ag(146S 9.06 μg·mL-1)、FMD疫苗、ISA-206来自天康生物股份有限公司;羊抗鼠HRP-IgG购自South biotech公司;3, 3′, 5, 5′-四甲基联苯胺(tetramethyl-benzidine, TMB)购自Sigma公司;RPMI 1640培养基购自Gibco公司;Perm/Wash buffer、兔抗鼠PE-CD3、FITC-CD4、FITC-CD8、APC-CD4、PE-CD44购自BD公司;其他试剂为国产分析纯。
1.2 不同乳化方法制备疫苗不同组合的FMD疫苗(水油比为46∶54)中,FMD-Ag和CARCP为水相,ISA-206为油相,采用搅拌和超声方法分别乳化制备FMD-Ag+ISA-206和FMD-Ag+ISA-206+CARCP,操作如下:(1)超声乳化:乳化15 s(20 kHz,200 W),间歇1 min,反复乳化10 min。(2)搅拌乳化:自动混合机中300 r·min-1搅拌10 min。
1.3 动物与免疫分组雌性ICR小鼠(6~8周龄)购自新疆医科大学动物实验中心(合格证号SCXK(新)2016-0003)。在温度24 ℃±1 ℃,湿度50%±10%,12/12 h-光/暗循环下适应1周。动物伦理批件编号为BRGE-AE001。
将制备好的FMD疫苗于0、14 d经皮下途径免疫小鼠(100 μL·只-1,FMD-Ag 0.3 μg·只-1),每组4只。FMD-Ag+ISA-206不同乳化方法试验分4组,包括:0.9% NaCl、商品化FMD疫苗、搅拌乳化FMD-Ag+ISA-206和超声乳化FMD-Ag+ISA-206。FMD-Ag+ISA-206+CARCP不同乳化方法试验分4组,包括:0.9% NaCl组、商品化FMD疫苗、搅拌乳化FMD-Ag+ISA-206+CARCP组和超声乳化FMD-Ag+ISA-206+CARCP组。FMD疫苗稳定性试验分11组,包括:0.9% NaCl、商品化FMD疫苗、FMD-Ag+ISA-206+CARCP,以及搅拌乳化制备的FMD-Ag+ISA-206和FMD-Ag+ISA-206+CARCP分别储存于4、25 ℃条件下放置0、30、180 d的8个试验组。
1.4 IgG抗体水平检测间接ELISA法检测IgG水平[10],简述如下:1 μg·mL-1 FMD-Ag包被过夜,封闭1 h后加入14 d (1∶100) 和28 d (1∶1 000) 稀释血清孵育1 h。加入山羊抗鼠HRP-IgG放置1 h。TMB显色15 min后终止反应,测定OD450 nm。
1.5 T淋巴细胞亚群检测流式细胞术检测初免后28 d的脾T细胞亚群水平[11],简述如下:制备脾单细胞悬液,将1×106单细胞悬液用Perm/Wash buffer洗涤后,PE-CD3、FITC-CD4;PE-CD3、FITC-CD8;APC-CD4、FITC-CD8、PE-CD44分别进行表面分子染色30 min,流式细胞仪检测。
1.6 疫苗稳定性试验将搅拌乳化的FMD不同疫苗组合分别储存于4、25 ℃条件下放置0、30、180 d后免疫小鼠,检测免疫后小鼠的体液和细胞免疫水平。
1.7 统计学分析试验结果采用“ x±s”表示,GraphPad Prism 5.0分析试验数据。数据用单因素方差分析后进行Turkey多重比较,*.P < 0.05表示差异显著。
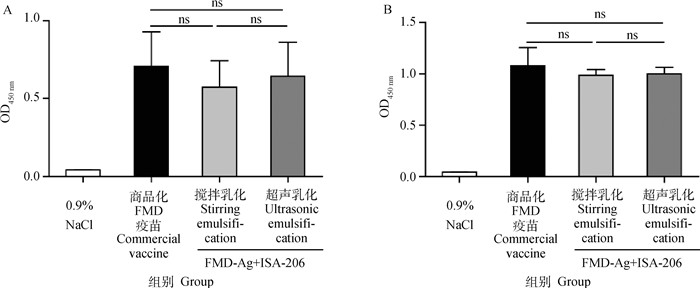
2 结果 2.1 FMD-Ag+ISA-206不同乳化方法对体液免疫反应的影响初免后的IgG水平如图 1所示,与商品化FMD疫苗相比,搅拌乳化和超声乳化的FMD-Ag+ISA-206的IgG水平均无显著差异(P>0.05);且两种乳化方法之间IgG水平也无显著差异(P>0.05)。
|
A. 14 d IgG抗体水平;B. 28 d IgG抗体水平。ns. P>0.05 A. IgG antibody levels at 14 d; B. IgG antibody levels at 28 d. ns. P>0.05 图 1 FMD-Ag+ISA-206不同乳化方法对IgG抗体的影响(n=4) Fig. 1 Effect of different emulsification methods of FMD-Ag+ISA-206 on IgG antibody (n=4) |
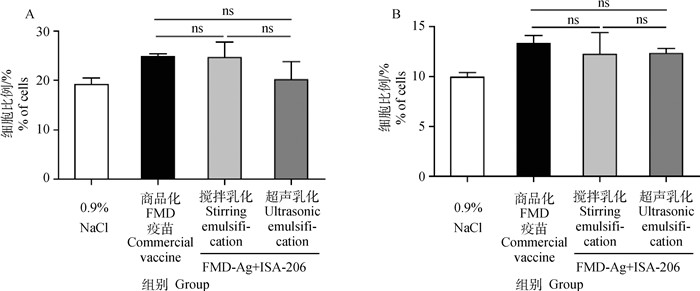
初免后28 d脾T细胞活化状态如图 2所示,与商品化FMD疫苗相比,搅拌乳化FMD-Ag+ISA-206和超声乳化FMD-Ag+ISA-206的CD3+CD4+和CD3+CD8+ T细胞比例无显著差异(P>0.05);两种乳化方法的T细胞比例差异不显著(P>0.05)。
|
A.CD3+CD4+T细胞百分比;B. CD3+CD8+T细胞百分比。ns. P>0.05 A. Percentage of CD3+CD4+ T lymphocyte; B. Percentage of CD3+ CD8+ T lymphocyte. ns. P>0.05 图 2 FMD-Ag+ISA-206不同乳化方法对T细胞亚群的影响(n=4) Fig. 2 Effects of different emulsification methods of FMD-Ag+ISA-206 on T-cell subsets (n=4) |
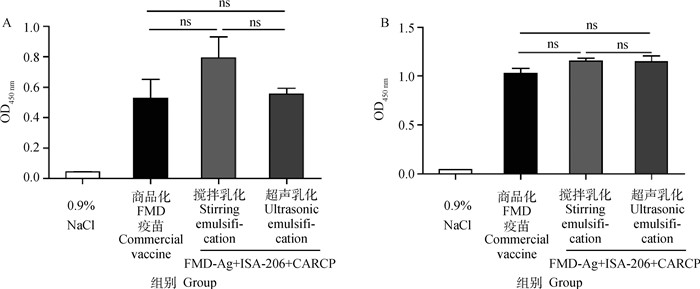
初免后14及28 d,不同乳化方法制备的FMD-Ag+ISA-206+CARCP的IgG水平结果如图 3所示,搅拌乳化FMD-Ag+ISA-206+CARCP、超声乳化FMD-Ag+ISA-206+CARCP的IgG抗体水平与商品化FMD疫苗相比差异不显著(P>0.05);且两种乳化方法所制备的FMD-Ag+ISA-206+CARCP之间的IgG抗体水平差异也不显著(P>0.05)。
|
A. 14 d IgG抗体水平;B. 28 d IgG抗体水平。ns. P>0.05 A. IgG antibody levels at 14 d IgG; B. IgG antibody levels at 28 d IgG. ns. P>0.05 图 3 FMD-Ag+ISA-206+CARCP不同乳化方法对IgG的影响(n=4) Fig. 3 Effects of different emulsification methods of FMD-Ag+ISA-206+CARCP on IgG(n=4) |
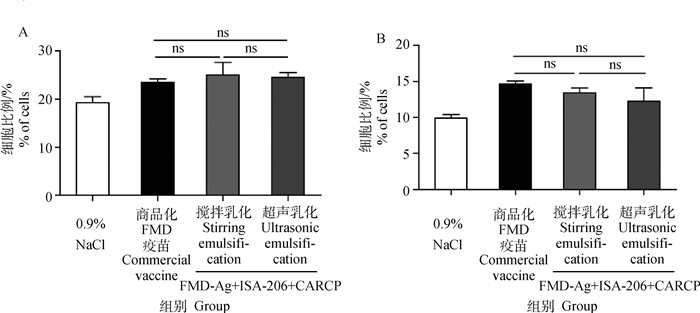
初免后28 d T细胞亚群如图 4所示,搅拌乳化FMD-Ag+ISA-206+CARCP、超声乳化FMD-Ag+ ISA-206+CARCP的CD3+CD4+和CD3+CD8+ T细胞水平与商品化FMD疫苗相比无显著差异(P>0.05);两种乳化方法所制备的FMD-Ag+ISA-206+ CARCP相比T细胞亚群水平差异不显著(P>0.05)。
|
A. CD3+CD4+T细胞百分比;B. CD3+CD8+T细胞百分比。ns. P>0.05 A. Percentage of CD3+CD4+ T lymphocyte; B. Percentage of CD3+ CD8+ T lymphocyte. ns. P>0.05 图 4 FMD-Ag+ISA-206+CARCP不同乳化方法对T细胞亚群影响(n=4) Fig. 4 Effects of different emulsification methods of FMD-Ag+ISA-206+CARCP on T cell subsets (n=4) |
搅拌乳化FMD-Ag+ISA-206和FMD-Ag+ISA-206+CARCP在不同条件储存后免疫小鼠,IgG水平如图 5所示,4和25 ℃储存0 d时,FMD-Ag+ISA-206+CARCP组28 d IgG显著高于商品化FMD疫苗组(P < 0.05)。4和25 ℃储存30和180 d时,FMD-Ag+ISA-206+CARCP组IgG显著高于FMD-Ag+ISA-206组(P < 0.05)。
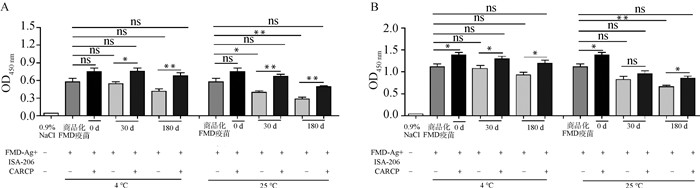
|
A. 14 d IgG抗体水平;B. 28 d IgG抗体水平。*.P < 0.05, **.P < 0.01, ns. P>0.05 A. IgG levels at 14 d; B. IgG levels at 28 d. *.P < 0.05, **.P < 0.01, ns. P>0.05 图 5 不同储存条件下FMD-Ag+ISA-206+CARCP对IgG的影响(n=4) Fig. 5 Effect of FMD-Ag+ISA-206+CARCP on IgG under different storage conditions(n=4) |
搅拌乳化制备的疫苗于不同储存条件下免疫小鼠后,脾T细胞百分含量结果如图 6所示,与商品化FMD疫苗相比:4和25 ℃储存0 d时,FMD-Ag+ ISA-206+CARCP组的CD4+和CD8+ T细胞水平显著高于商品化FMD疫苗组(P < 0.05),CD4+CD44+ T、CD8+CD44+ T细胞百分含量无显著性差异(P>0.05)。4 ℃储存30 d,FMD-Ag+ISA-206+CARCP组的CD4+、CD8+、CD4+CD44+、CD8+CD44+T细胞与FMD-Ag+ISA-206组相比没有显著差异(P>0.05)。4 ℃储存180 d, FMD-Ag+ISA-206+CARCP组CD4+、CD4+CD44+、CD8+CD44+ T细胞水平显著高于FMD-Ag+ISA-206组(P < 0.05)。25 ℃储存30和180 d时,FMD-Ag+ISA-206+CARCP组的T细胞水平显著高于FMD-Ag+ISA-206组(P < 0.05)。
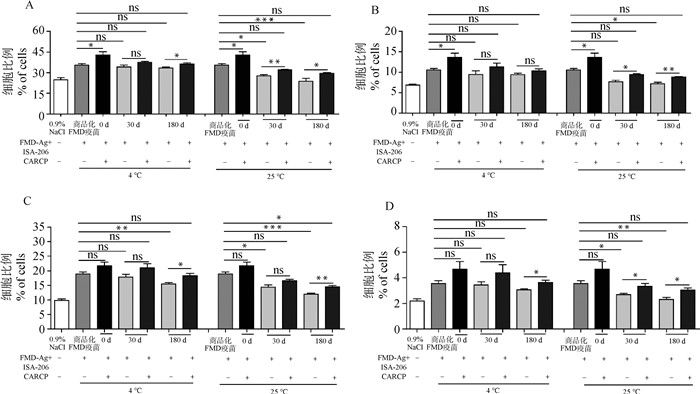
|
A. CD4+ T细胞比例;B. CD8+ T细胞比例;C. CD4+CD44+ T细胞比例;D. CD8+ CD44+ T细胞比例。*.P < 0.05, **.P < 0.01, ***.P < 0.001, ns. P>0.05 A. Percentage of CD4+ T cell; B. Percentage of CD8+ T cell; C. Percentage of CD4+ CD44+ T cell; D. Percentage of CD8+ CD44+ T cell. *.P < 0.05, **.P < 0.01, ***.P < 0.001, ns. P>0.05 图 6 不同储存条件下FMD-Ag+ISA-206+CARCP对T细胞亚群的影响(n=4) Fig. 6 Effect of FMD-Ag+ISA-206+CARCP on T cell subsets under different storage conditions(n=4) |
多糖协同油乳剂作为疫苗佐剂不仅能提高机体特异性免疫应答,还能提高油乳剂疫苗的稳定性,如山药多糖、黄芪多糖、白术多糖等[14]。现用商品化FMD疫苗为包含ISA-206油乳剂的W/O/W剂型,油乳剂与疫苗的乳化方法和储存条件会影响疫苗的效力和稳定性[15]。油乳剂因在体内不易降解而存在毒副作用,中药多糖不仅具有免疫调节活性,也可以增加油乳剂型疫苗水相的黏度,提高油乳剂疫苗的稳定性,是一种具有潜力的新型佐剂候选[6]。搅拌乳化和超声乳化常用于W/O/W油乳剂疫苗的制备,搅拌乳化可避免药物降解、易于实际生产,超声乳化分散粒径均匀,产量较小、工艺放大困难,适用于实验室研究[13]。为此,本研究选用了搅拌和超声乳化方法制备CARCP协同ISA-206的FMD不同疫苗组合,通过特异性抗体和T细胞水平比较不同乳化方法的异同;同时,阐明不同储存条件下CARCP对FMD疫苗稳定性的影响。
选择合适的乳化方法是确保疫苗效果的关键,抗体和T细胞是口蹄疫保护性免疫的重要效应分子和细胞[16]。本研究选用搅拌和超声乳化混合FMD疫苗的不同组合,以商品化FMD疫苗为对照,通过检测免疫后小鼠的体液及细胞免疫水平,比较乳化方法对FMD-Ag+ISA-206免疫效果的影响。结果显示,搅拌和超声乳化制备的FMD-Ag+ISA-206免疫后小鼠血清中的IgG水平和脾中的CD4+和CD8+ T细胞亚群水平没有差异。在此基础上,观察了CARCP协同ISA-206采用搅拌和超声乳化制备FMD疫苗的佐剂效果。结果表明,搅拌和超声乳化制备的FMD-Ag+ISA-206+CARCP的IgG水平及CD4+和CD8+ T细胞亚群没有差异。这些结果初步表明,搅拌及超声乳化方法对FMD疫苗的免疫效果没有差异,同时也说明在实验室建立的搅拌乳化方式与FMD疫苗规模生产的乳化方法没有差异,为CARCP作为FMD疫苗佐剂的理论研究提供重要的试验参考。
W/O/W剂型疫苗的稳定性对于维持机体免疫反应至关重要。多糖高亲水性、高黏度等特性,可以改善疫苗体系的稳定性[6, 17]。为了探究CARCP协同ISA-206对FMD疫苗稳定性的影响,本试验选用搅拌乳化制备疫苗FMD+ISA-206和FMD-Ag+ ISA-206+CARCP,放置在不同温度(4和25 ℃)和不同储存时间(0、30和180 d)后免疫小鼠,检测免疫后的抗体水平和T细胞水平[16]。试验结果表明,在4和25 ℃放置30和180 d后,与没有添加CARCP组相比,CARCP的添加促进了IgG抗体的持续产生,CD4+、CD8+、CD4+CD44+、CD8+CD44+ T细胞也表现出相同的趋势。这些结果显示W/O/W型疫苗储存超过一定温度和时间会导致疫苗免疫原性和稳定性下降[15],同时表明添加CARCP能够维持FMD疫苗的稳定性,与菊粉多糖、刺五加多糖等中药多糖的研究结果相似[6, 17],提示CARCP作为佐剂和乳化剂增强了疫苗的稳定性和效力。
4 结论搅拌和超声乳化制备的FMD-Ag+ISA-206+CARCP免疫效果没有差异。CARCP协同ISA-206油乳剂促进了FMD疫苗的稳定性和效力,为CARCP作为FMD疫苗的免疫增强剂和乳化剂的研究提供重要的试验依据。
| [1] |
DE LOS SANTOS T, DIAZ-SAN SEGUNDO F, RODRIGUEZ L L. The need for improved vaccines against foot-and-mouth disease[J]. Curr Opin Virol, 2018, 29(S1): 16-25. |
| [2] |
BELSHAM G J, KRISTENSEN T, JACKSON T. Foot-and-mouth disease virus: Prospects for using knowledge of virus biology to improve control of this continuing global threat[J]. Virus Res, 2020, 281: 197909. DOI:10.1016/j.virusres.2020.197909 |
| [3] |
CAO Y M. Adjuvants for foot-and-mouth disease virus vaccines: recent progress[J]. Expert Rev Vaccines, 2014, 13(11): 1377-1385. DOI:10.1586/14760584.2014.963562 |
| [4] |
WANG D Y, LIU Y H, ZHAO W. The adjuvant effects on vaccine and the immunomodulatory mechanisms of polysaccharides from traditional Chinese medicine[J]. Front Mol Biosci, 2021, 8: 655570. DOI:10.3389/fmolb.2021.655570 |
| [5] |
伯若楠, 王晶, 刘晓盼, 等. 中药多糖作为免疫增强剂及其对肠道黏膜影响的研究进展[J]. 畜牧兽医学报, 2022, 53(7): 2066-2073. BO R N, WANG J, LIU X P, et al. Research progress of Chinese Herbal Polysaccharides as immunopotentiator and its effect on intestinal mucosa[J]. Acta Veterinaria et Zootechnica Sinica, 2022, 53(7): 2066-2073. (in Chinese) |
| [6] |
SHAO P, FENG J R, SUN P L, et al. Recent advances in improving stability of food emulsion by plant polysaccharides[J]. Food Res Int, 2020, 137(9): 109376. |
| [7] |
TANG Q L, HUANG G L. Improving method, properties and application of polysaccharide as emulsifier[J]. Food Chem, 2022, 376: 131937. DOI:10.1016/j.foodchem.2021.131937 |
| [8] |
CAO X Q, LI M C, MA L C, et al. Quality assessment of Artemisia rupestris L. using quantitative analysis of multi-components by single marker and fingerprint analysis[J]. Molecules, 2022, 27(9): 2634. DOI:10.3390/molecules27092634 |
| [9] |
CAO Y, ZANG Y C, HUANG X Y, et al. Chemical constituents from Artemisia rupestris and their neuraminidase inhibitory activity[J]. Nat Prod Res, 2021, 35(11): 1775-1782. DOI:10.1080/14786419.2019.1639178 |
| [10] |
WANG D Y, YANG Y, LI J Y, et al. Enhancing immune responses to inactivated foot-and-mouth virus vaccine by a polysaccharide adjuvant of aqueous extracts from Artemisia rupestris L. [J]. J Vet Sci, 2021, 22(3): e30.
|
| [11] |
ZHANG A L, YANG Y, WANG Y, et al. Adjuvant-active aqueous extracts from Artemisia rupestris L. improve immune responses through TLR4 signaling pathway[J]. Vaccine, 2017, 35(7): 1037-1045. DOI:10.1016/j.vaccine.2017.01.002 |
| [12] |
HANSEN T, HOLM P, SCHULTZ K. Process characteristics and compaction of spray-dried emulsions containing a drug dissolved in lipid[J]. Int J Pharm, 2004, 287(1-2): 55-66. DOI:10.1016/j.ijpharm.2004.08.014 |
| [13] |
LI W, LEONG T S H, ASHOKKUMAR M, et al. A study of the effectiveness and energy efficiency of ultrasonic emulsification[J]. Phys Chem Chem Phys, 2018, 20(1): 86-96. DOI:10.1039/C7CP07133G |
| [14] |
PANG B, LIU H, ZHANG K. Recent progress on Pickering emulsions stabilized by polysaccharides-based micro/nanoparticles[J]. Adv Colloid Interface Sci, 2021, 296: 102522. DOI:10.1016/j.cis.2021.102522 |
| [15] |
CHEN G L, TAO D. An experimental study of stability of oil-water emulsion[J]. Fuel Process Technol, 2005, 86(5): 499-508. DOI:10.1016/j.fuproc.2004.03.010 |
| [16] |
CARR B V, LEFEVRE E A, WINDSOR M A, et al. CD4+ T-cell responses to foot-and-mouth disease virus in vaccinated cattle[J]. J Gen Virol, 2013, 94(Pt 1): 97-107. |
| [17] |
LÓPEZ-CASTEJÓN M L, BENGOECHEA C, ESPINOSA S, et al. Characterization of prebiotic emulsions stabilized by inulin and β-lactoglobulin[J]. Food Hydrocoll, 2019, 87(3): 382-393. |
(编辑 白永平)



