猫瘙痒性皮肤病,又称猫瘙痒症,指一类伴有瘙痒症状的猫皮肤病,在小动物皮肤病临床较为常见[1],这类疾病大抵可分为5类:寄生虫感染(跳蚤、姬螯螨、猫蠕形螨、耳螨、虱、蚊蝇等)、过敏(食物过敏、跳蚤叮咬过敏、猫特应性皮肤综合征等)、炎症性疾病(浅表脓皮病、皮肤癣菌病、酵母菌感染、接触性刺激、免疫性皮肤病等)、肿瘤类疾病(肥大细胞瘤、趋上皮性淋巴瘤等)、精神性皮肤病[1]。其中,过敏性皮肤病最为常见,且需要长期的治疗管理,常用的口服抗炎止痒药物有糖皮质激素类药物(如泼尼松龙)、Janus激酶(Janus kinase, JAK)抑制剂(如奥拉替尼)、抗组胺药物、环孢素等[2]。本研究旨在通过对138例猫瘙痒性皮肤病病例进行归纳总结,比较奥拉替尼和泼尼松龙对猫过敏性皮肤病的疗效,为猫瘙痒性皮肤病的临床诊断和治疗提供参考。
1 材料与方法 1.1 临床病例收集本研究的病例来源为2021年1月—2022年3月前往中国农业大学动物医院就诊,主诉有瘙痒症状的皮肤病患病猫。记录患病猫信息,包括品种、性别、年龄、就诊时间、发病时间、病史、主要症状、病灶类型及分布等信息。
1.2 评分量表本研究选用两种评分量表,分别为视觉瘙痒评分表(pruritus visual analog scale, pVAS)[3]以及猫过敏性皮炎病变严重程度评分表(scoring feline allergic dermatitis, SCORFAD)[4-5]。
pVAS量表将患病动物的瘙痒程度量化,动物主人通过10 cm长的视觉模拟量表进行评分,不同分数对应着相应的瘙痒行为描述[6-7]。
SCORFAD量表评估猫过敏性皮肤病的皮肤损伤程度,通过描述四类病变(粟粒性皮炎、嗜酸性斑块、自损性脱毛、抓痕)的严重程度、范围以及涉及的身体区域数量,得出每种病变0~4分的得分,相应计算出0~16分的总分[4-5]。
1.3 数据分析方法使用Microsoft Excel统计数据,包括患病猫年龄、就诊时间、性别、品种、病灶类型、病灶部位、pVAS评分、SCORFAD评分、用药种类。使用SPSS 26.0和Graphpad prism 8分析数据,首先检验数据是否符合正态分布[8],由于不符合正态分布,选用非参数检验方法进行治疗效果分析。
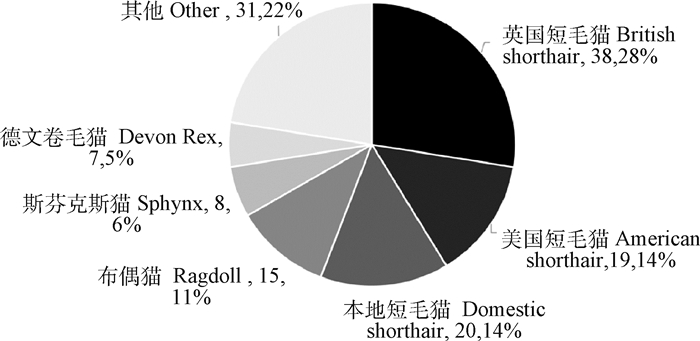
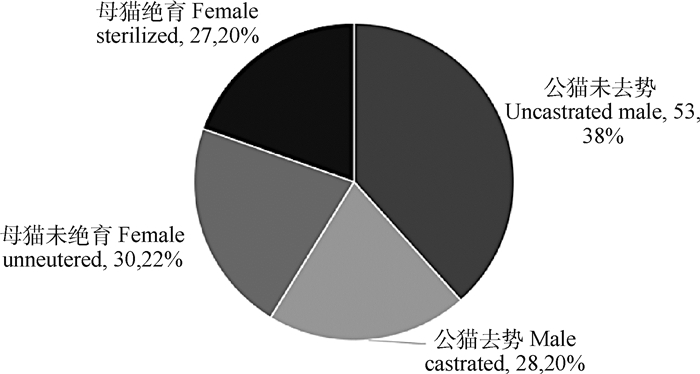
2 结果 2.1 猫瘙痒性皮肤病临床特征2.1.1 品种、性别与年龄 本次调查统计的138例患病猫分属16个品种(图 1),排在前三位的是英国短毛猫38例(28%)、本地短毛猫20例(14%)、美国短毛猫19例(14%)。这些病例的平均就诊年龄为2.84岁,最小发病年龄为2月龄,最大发病年龄为13岁,46%的病例在6月龄~2岁发病,34%的病例在2~6岁发病,多数患病猫在青中年时期发病。在性别分布情况上,雄性与雌性的比例为1.42∶1(81∶57)(图 2)。
|
其他:苏格兰折耳猫、曼基康矮脚猫、本地长毛猫、暹罗猫、孟加拉豹猫、异国短毛猫、杂种猫、英国长毛猫、缅因猫 Others: Scottish Fold, Munchkin cat, Domestic Longhair, Siamese, Bengal, Exotic Shorthair, Mix, British Longhair, Maine Coon 图 1 138只患病猫品种分布 Fig. 1 Breed distribution of 138 cases |
|
图 2 病例性别分布 Fig. 2 Gender distribution of affected cats |
2.1.2 临床症状 对瘙痒性皮肤病患病猫的临床症状进行总结,最常见的病灶类型为抓痕(100例,72%),包含有浅表皮损、溃疡、结痂等[9];其次是自损性脱毛(75例,54%);有69例(50%)患病猫的体表同时出现两种及两种以上的病灶。
病灶在体表分布的情况如图 3所示,63例(46%)病灶出现在头部,包括耳廓、耳周、面颊、下颌等部位,其次是32例(23%)病灶出现在颈部。62例(45%)患病猫的病灶涉及体表一个以上的区域。

|
图 3 猫瘙痒性皮肤病患病猫病灶部位 Fig. 3 Affected body regions of cases |
2.1.3 疾病诊断 在138例病例中,过敏性皮肤病占比最高(88例,64%),其次是感染性皮肤病(18例,13%)和耳部疾病(18例,13%)。其他造成瘙痒的因素包括角化异常、肿瘤性疾病、精神性脱毛、免疫性皮肤病等,具体疾病诊断比例如图 4。

|
图 4 瘙痒性皮肤病患病猫疾病诊断 Fig. 4 Diseases of affected cats |

|
图 5 每组中pVAS或SCORFAD降低≥ 50%的百分比和无反应猫的占比 Fig. 5 Percentage of cats in each group showing a decrease of pVAS or SCORFAD by ≥50% and percentage of non-responders |
2.2.1 用药情况总结 在治疗方面,笔者对111例患病猫的治疗方案进行汇总(表 1),可见最常用的口服药物为泼尼松龙(57例, 51%)和奥拉替尼(48例, 43%)。最常用外用药为植物成分保湿抗菌剂(40例, 36%), 其次为次氯酸电解水(34例, 31%)。
|
|
表 1 瘙痒性皮肤病患病猫用药情况汇总 Table 1 Summary of drug use in cats with pruritic skin disease |
本研究中最常见的诊断印象为过敏性皮肤病,在88例过敏性皮肤病患病猫中,最常用的药物仍为泼尼松龙和奥拉替尼,其中17例(19%),病例在治疗过程中采用过奥拉替尼与泼尼松龙隔日交替给药的治疗方案,此外有部分病例曾先后使用上述两种药物进行治疗。部分病例因存在合并感染的情况而使用抗生素进行治疗。
在外用药方面,有34例(39%)曾使用不同品牌的植物成分免洗浴液,25例(28%)患病猫曾外用次氯酸电解水,9例(10%)曾使用含有药物成分的浴液,10例(11%)曾用含有溶菌酶成分的药物棉片。5例(6%)曾在局部使用复方咪康唑滴耳液,这种药物的有效成分还包括氢化可的松丙酯,虽然说明用法为外耳道用药,但使用在局部皮炎病灶同样具有抗炎效果。
诊断为皮肤癣菌病的患病猫的常用口服药物为伊曲康唑(6例, 33%),且全部同时配合外用药进行治疗。诊断为脓皮病的患病猫多采用外用药而非口服药,如次氯酸电解水,植物成分保湿抗菌剂等。
2.2.2 猫过敏性皮肤病治疗效果 对88例猫过敏性皮肤病患病猫进行就诊后3~4个月的跟踪,按照有好转、没有好转/变差、不详3类[10]进行疗效统计显示(表 2),尽管用药方案和病例数量各不相同,口服药与外用药结合治疗的病例仍占多数,并且组内治疗反馈较好的病例比例最高。
|
|
表 2 过敏性皮肤病患病猫治疗效果 Table 2 Treatment response of affected cats |
2.2.3 泼尼松龙与奥拉替尼在猫过敏性皮肤病临床用药效果比较 跟踪19例在1~4周内仅选用奥拉替尼为口服药物进行治疗的过敏性皮肤病患病猫,记录其治疗前后pVAS和SCORFAD评分。pVAS是否改善50%是临床相关的阈值之一,超过该比例,多数动物主人对治疗效果感到满意[11],该组16例(68%)的病例pVAS评分下降>50%,15例(74%)病例的SCORFAD评分下降>50%。
跟踪21例1~4周内仅选用泼尼松龙为口服药物进行治疗的过敏性皮肤病患病猫,记录其治疗前后上述两项评分,该组71%的病例治疗后瘙痒程度改善多于50%,71%的病例皮损程度改善>50%(图7)。综上所述,在治疗猫过敏性皮肤病的过程中,口服奥拉替尼的治疗有效率低于泼尼松龙。
用Wilcoxon符号秩和检验分析同组患病猫用药前后的pVAS评分及SCORFAD评分,结果如图 6a、b所示,口服奥拉替尼与口服泼尼松龙可显著降低pVAS与SCORFAD评分(P < 0.05)。用Mann Whitney U检验对pVAS评分及SCORFAD评分较基线评分变化百分比进行进一步分析显示,两种药物对临床症状的改善程度不存在显著差异(P>0.05)(图 6c)。

|
a. pVAS评分;b. SCORFAD评分;c.变化比例。****、***.P < 0.05, ns. P>0.05 a. pVAS score; b. SCORFAD score; c. Change ratio. ****, ***.P < 0.05, ns. P>0.05 图 6 用药前后pVAS、SCORFAD评分差异性分析 Fig. 6 Difference analysis of pVAS and SCORFAD scores before and after treatment |
有研究报道猫特应性皮炎在本地品种猫、阿比西尼亚猫以及德文卷毛猫中显示出一定的品种倾向性[7],但有关猫过敏性皮肤病的遗传学研究仍比较少。本次调查所涉不全,因此无法严格计算发病率来分析品种倾向性和性别倾向。收集到的英国短毛猫比例最高、雄性偏多,可能与饲养偏好相关。
在138例病例中, 62%的病例诊断为过敏性皮肤病,分析认为与过敏性疾病复杂的影响因素相关,Day[12]将这些影响因素归为3大类;基因学因素、环境影响因素以及免疫系统失调。关于环境因素,目前在人医临床较有影响力的假说是“卫生假说”,即人们的生活环境越“卫生”,过敏和其他自身免疫性疾病的患病率越高[13],儿童缺乏与微生物等外界抗原的接触,会造成Th1型免疫弱,而更偏向Th2型免疫,因此易感过敏性疾病[14]。类此假说,在小动物临床收集到的病例中,患病猫基本为完全室内生活的状态,自幼龄时期缺乏与外界抗原接触,或许是许多病例青年时期发病的原因之一。
在病灶类型与病灶部位方面,患病猫因瘙痒而出现抓挠行为,进而出现抓痕与自损性脱毛。随着病程的发展,嗜酸性斑块和粟粒状皮炎的征象也会逐渐明显[12]。猫瘙痒性皮肤病最常涉及的部位是头颈部,这与现有的研究较为一致[7],在人医特应性皮炎也有类似的情况[15]。笔者分析这与相关部位血管分布较体表其他区域更为密集有关[16]。体表不同部位出现每种病灶均对应多种鉴别诊断,因此,不能仅从病灶进行确诊[7]。
3.2 猫瘙痒性皮肤病用药分析传统疗法治疗猫过敏性皮肤病是使用糖皮质激素,而对于患有心脏病或糖尿病等基础疾病的猫,使用糖皮质激素会带来更大的风险,因此可以考虑使用奥拉替尼、环孢素进行替代治疗[17]。
多个研究显示,猫对奥拉替尼有良好的耐受性[3],仅有少量报道称存在呕吐、软便、机会性感染等不良反应[18-19],其优良的止痒效果使之成为替代糖皮质激素的潜力股。本次调查中奥拉替尼的止痒效果和泼尼松龙相近,但奥拉替尼的有效率较低,其原因可能有两点:一是两种药物作用机制不同,二是用药剂量不足。就作用机制而言,相比于糖皮质激素类药物广泛的抗炎作用,奥拉替尼只能选择性地作用于JAK1[20]。此外,瘙痒产生传导的循环中,除细胞因子以外,还涉及多种神经递质、电信号传导、神经胶质细胞相互作用等复杂机制[21]。这些因素一定程度上限制了奥拉替尼的效果。就用药剂量而言,奥拉替尼在猫中的药代动力学参数与对犬的描述相似,但吸收和消除更快,而且个体之间的变异性较大。因此,有研究者建议在猫中使用更大剂量和/或更短的给药间隔,以达到与犬相似的血液浓度[22]。关于用药安全性,笔者本次进行评分分析的两组病例均未报告有不良反应。
除此以外,环孢素也可有效控制猫过敏性皮肤病[2]。本次回访到有两例过敏性皮肤病病例逐渐换药至环孢素后效果良好,其中一例以5 mg·kg-1剂量口服半年后复诊,肝肾功能等常规体检项目未见异常,另一例动物主人仅在动物无规律地出现发病迹象时给药,主诉给药当日症状即消退,但也存在反馈无效的病例。
3.3 量表补充分析本次选用的pVAS量表适用于所有猫瘙痒性皮肤病病例,用于评价瘙痒程度,SCORFAD适用于过敏性皮肤病患病猫[4],用于评价皮损严重程度。两种量表描述简洁,将评估猫好转程度的两个特征量化,较为实用。初次就诊时,患病猫SCORFAD量表的平均分是4.39,这与该量表的计分方式有关,如果某个病例有严重的嗜酸性斑块,涉及体表多个区域,而没有其他类型的病灶,其得分为4分,但这绝不代表着其体表病灶程度不严重。因此,笔者主要将该量表评分的改善程度,作为量化评估过敏性皮肤病患病猫的皮损改善程度工具,而未以该量表评分对患病动物的严重程度进行评价。
由于本研究收集到的病例数量有限,未来还需更多研究来评估奥拉替尼对猫瘙痒性皮肤病的疗效如何,优化给药剂量;验证pVAS和SCORFAD的有效性和实用性。
4 结论本文回顾发现,猫瘙痒性皮肤病发病无明显的品种和性别偏向,年龄多集中在青年时期;最常见的病灶类型为抓痕,最常出现部位为头颈部;引起猫瘙痒性皮肤病的最常见疾病为猫过敏性皮肤病。在猫瘙痒性皮肤病的治疗方案中,与仅使用口服药和仅使用外用药相比,口服药与外用药相结合的治疗方案效果更优。奥拉替尼治疗猫过敏性皮肤病有显著疗效,且其疗效与泼尼松龙相似,有效率较泼尼松龙低,但现有研究显示奥拉替尼的不良反应较少见,故可以尝试使用奥拉替尼替代泼尼松龙对猫过敏性皮肤病进行瘙痒控制。然而猫用奥拉替尼属于标签外使用,因此仍需进一步研究奥拉替尼对猫的安全性及使用剂量。
| [1] |
GRAHAM D. Muller and kirk's small animal dermatology[J]. New Zeal Vet J, 2014, 62(4): 234. DOI:10.1080/00480169.2013.830281 |
| [2] |
MUELLER R S, NUTTALL T, PROST C, et al. Treatment of the feline atopic syndrome-a systematic review[J]. Vet Dermatol, 2021, 32(1): 43-60. DOI:10.1111/vde.12933 |
| [3] |
LOPES N L, CAMPOS D R, MACHADO M A, et al. A blinded, randomized, placebo-controlled trial of the safety of oclacitinib in cats[J]. BMC Vet Res, 2019, 15(1): 137. DOI:10.1186/s12917-019-1893-x |
| [4] |
NOLI C, CENA T. Comparison of FEDESI and SCORFAD scoring systems for the evaluation of skin lesions in allergic cats[J]. Vet Dermatol, 2015, 26(6): 481-e113. DOI:10.1111/vde.12253 |
| [5] |
STEFFAN J, OLIVRY T, FORSTER S L, et al. Responsiveness and validity of the SCORFAD, an extent and severity scale for feline hypersensitivity dermatitis[J]. Vet Dermatol, 2012, 23(5): 410-417. DOI:10.1111/j.1365-3164.2012.01071.x |
| [6] |
RYBNÍČEK J, LAU-GILLARD P J, HARVEY R, et al. Further validation of a pruritus severity scale for use in dogs[J]. Vet Dermatol, 2009, 20(2): 115-122. DOI:10.1111/j.1365-3164.2008.00728.x |
| [7] |
HOBI S, LINEK M, MARIGNAC G, et al. Clinical characteristics and causes of pruritus in cats: a multicentre study on feline hypersensitivity-associated dermatoses[J]. Vet Dermatol, 2011, 22(5): 406-413. DOI:10.1111/j.1365-3164.2011.00962.x |
| [8] |
HAZRA A, GOGTAY N. Biostatistics series module 3: comparing groups: numerical variables[J]. Indian J Dermatol, 2016, 61(3): 251-260. DOI:10.4103/0019-5154.182416 |
| [9] |
VOGT A H, RODAN I, BROWN M, et al. AAFP-AAHA: feline life stage guidelines[J]. J Feline Med Surg, 2010, 12(1): 43-54. DOI:10.1016/j.jfms.2009.12.006 |
| [10] |
YU H W, VOGELNEST L J. Feline superficial pyoderma: a retrospective study of 52 cases (2001-2011)[J]. Vet Dermatol, 2012, 23(5): 448-455. DOI:10.1111/j.1365-3164.2012.01085.x |
| [11] |
OLIVRY T, STEFFAN J, FISCH R D, et al. Randomized controlled trial of the efficacy of cyclosporine in the treatment of atopic dermatitis in dogs[J]. J Am Vet Med Assoc, 2002, 221(3): 370-377. DOI:10.2460/javma.2002.221.370 |
| [12] |
DAY J M. Introduction: the immunological basis of allergic disease[M]//NOLI C, FOSTER A, ROSENKRANTZ W. Veterinary allergy. New York: John Wiley & Sons, 2014.
|
| [13] |
PFEFFERLE P I, KEBER C U, COHEN R M, et al. The hygiene hypothesis-learning from but not living in the past[J]. Front Immunol, 2021, 12: 635935. DOI:10.3389/fimmu.2021.635935 |
| [14] |
KOSHIBA R, OBA T, FUWA A, et al. Aggravation of food allergy by skin sensitization via systemic Th2 enhancement[J]. Int Arch Allergy Immunol, 2020, 182(4): 292-300. |
| [15] |
SABIN B R, PETERS N, PETERS A T. Chapter 20: atopic dermatitis[J]. Allergy Asthma Proc, 2012, 33(Suppl 1): S67-S69. |
| [16] |
DONE S H, GOODY P C, EVANS S A, et al. Color atlas of veterinary anatomy: Volume 3. The dog and cat[M]. 2nd ed. Oxford: Elsevier, 2009: 10.4.
|
| [17] |
RZESZUTEK U. Successful treatment of a multi-drug-resistant severely pruritic hypersensitivity dermatitis in a cat[J]. Case Rep Vet Med, 2020, 2020: 8897365. |
| [18] |
COSGROVE S B, WREN J A, CLEAVER D M, et al. A blinded, randomized, placebo-controlled trial of the efficacy and safety of the Janus kinase inhibitor oclacitinib (Apoquel®) in client-owned dogs with atopic dermatitis[J]. Vet Dermatol, 2013, 24(6): 587-597. DOI:10.1111/vde.12088 |
| [19] |
MOORE A, BURROWS A K, MALIK R, et al. Fatal disseminated toxoplasmosis in a feline immunodeficiency virus-positive cat receiving oclacitinib for feline atopic skin syndrome[J]. Vet Dermatol, 2022, 33(5): 435-439. DOI:10.1111/vde.13097 |
| [20] |
GONZALES A J, BOWMAN J W, FICI G J, et al. Oclacitinib (APOQUEL®) is a novel Janus kinase inhibitor with activity against cytokines involved in allergy[J]. J Vet Pharmacol Ther, 2014, 37(4): 317-324. DOI:10.1111/jvp.12101 |
| [21] |
CEVIKBAS F, LERNER E A. Physiology and pathophysiology of itch[J]. Physiol Rev, 2020, 100(3): 945-982. DOI:10.1152/physrev.00017.2019 |
| [22] |
FERRER L, CARRASCO I, CRISTÒFOL C, et al. A pharmacokinetic study of oclacitinib maleate in six cats[J]. Vet Dermatol, 2020, 31(2): 134-137. DOI:10.1111/vde.12819 |
(编辑 白永平)



