细胞外陷网是免疫相关细胞(如中性粒细胞)被激活之后,细胞核失去原有的形态而出现的染色质和异染色质均化,核膜和胞膜裂解,核内容物和颗粒酶混合,最后释放到细胞外形成的以DNA为主要结构,富含抗菌颗粒的丝状或网状结构[1]。细胞外陷网结构中的支架DNA和颗粒蛋白、弹性蛋白酶、髓过氧化物酶、抗菌肽及组蛋白等具有捕获、固定和杀伤微生物的作用[1-2],在感染早期发挥重要的天然免疫作用。许多学者发现细菌、真菌及其毒素、炎症介质、疾病状态等可诱导动物巨噬细胞外陷网的产生[3-6]。沙门菌可结合巨噬细胞表面CD18受体,或其LPS结合TLR4受体,再经MAPK激活NADPH氧化还原酶产生ROS并诱导METs的产生,METs是巨噬细胞除了吞噬、分泌细胞因子外的新的抵御沙门菌感染的重要方式[7-8]。
肠道沙门菌致病的一个重要机制是利用其三型分泌系统分泌一系列毒力因子(又称效应蛋白),调控宿主细胞关键的信号通路。TTSS1和TTSS2分别由沙门菌21个毒力岛中的SPI-1和SPI-2编码。其主要介导效应蛋白的分泌和在靶细胞的转位,调节和改变宿主细胞进程,如骨架重排、膜运输、信号转导、细胞因子表达等,在细菌入侵、组织内存活与定殖、宿主免疫逃避过程中发挥重要作用。SPI-1和SPI-2编码沙门菌入侵和肠炎的关键效应蛋白,包括AvrA、Sips、SptP和Sops等,共44个基因[9-10],但是否参与METs调控尚不清楚。
本研究在发现不同沙门菌菌株引起的METs水平差异的基础上,通过Domain—Domain相互作用生物信息学预测锁定了SptP基因,进一步通过免疫共沉淀和MALDI-TOF质谱试验研究发现,SptP可能通过水解ABL1的磷酸基团,调控MAPK-CDK6-RB通路,影响METs的生成。
1 材料与方法 1.1 试验材料沙门菌Salmonella 14028(S.enterica enterica Typhimurium)、Salmonella 13312(S.enterica enterica Choleraesuis)、Salmonella 13314(S.enterica arizonae)菌株由长江大学动物科学学院实验室保存,SptP兔源多克隆抗体由长江大学动物科学学院动物生物化学实验室制备,Ficoll分离液按Ficoll-Paque配方配制[11],CSF-1(ab259396)、RIPA Buffer(ab156034)购自Abcam公司,Sytox Green(S7020)购自ThermoFisher公司,甲醛、SDS、2, 5-二羟基苯甲酸等生化试剂均购自Sigma公司。
1.2 试验方法1.2.1 METs水平检测 取6头健康成年猪的外周血,Ficoll离心法分离PBMC细胞,经CSF-1(20 ng·mL-1)处理6 d后得到猪巨噬细胞。将猪巨噬细胞铺于24孔细胞培养板,PBS清洗后使用细胞松弛素B(10 μg·mL-1)在37 ℃条件下处理15 min以抑制巨噬细胞对细菌的吞噬作用。沙门菌以MOI=10处理巨噬细胞以激活巨噬细胞形成METs。沙门菌刺激0、4和8 h的细胞经生理盐水漂洗3次后,Sytox Green(100 nmol·L-1)染色10 min,莱卡荧光显微镜采集图像。计算20个随机采集的图像内METs荧光点的总面积,评价METs的水平。
1.2.2 基于Domain—Domain方法的沙门菌—宿主相互作用预测 沙门菌的蛋白质序列数据及其注释信息、猪的蛋白质序列数据及其注释信息均下载自NCBI Genome数据库,Domain-Domain相互作用数据下载自PPIDM数据库[12]。预测参考Loaiza等的方法[13]按以下步骤进行:(i)提取Pfam中与PPIDM1对应的Motif数据;(ii)将提取的Motif分别与沙门菌的蛋白序列、猪的蛋白序列进行比对;(iii)根据比对结果构建沙门菌基因—Motif1—Motif2—猪基因调控模式,其中Motif1—Motif2信息源自PPIDM数据库。沙门菌基因—Motif1的控制在1×10-18以下,大约包含了45%的沙门菌基因,Motif2—猪基因的e-value控制在1×10-23以下,大约包含了20%的猪的基因。
对Salmonella 14028、Salmonella 13312、Salmonella 13314基因作用的宿主基因集合进行两两比较,设沙门菌基因作用的宿主基因集合分别为T1和T2,可以将其分为两部分:(i)相同的基因集合,即2菌株作用的宿主基因T1、T2的交集S1,该部分可计算两个参数,①基因数量排序R1——用于评价2个菌株各基因作用于宿主基因的潜在效应大小,②S1中T1、T2基因所对应的沙门菌基因—Motif1—Motif2—猪基因模型的匹配度的差值排序R2——用于评价2个菌株各基因作用于宿主基因的保守性;(ii)相异的基因集合,即S1与T1、T2并集的补集D1,D1按数量排序可计算指数R3,用于评价2个菌株各基因作用于宿主基因的差异部分。计算相似指数R= 3 R1R2R3 /N,其中,N为沙门菌基因总数。计算各沙门菌间比较的平均R指数R_CUBE。
1.2.3 SptP作用的靶基因ABL1分析 收集感染沙门菌的巨噬细胞,使用1 mL RIPA Buffer(含蛋白酶抑制剂)处理30 min以裂解并抽提细胞总蛋白。先后加入SptP蛋白特异性抗体(1∶200稀释)和Protein A磁珠,以富集与SptP互作的蛋白质。磁珠洗涤液进行SDS-PAGE电泳分析,回收大小约120 ku的条带,经胰蛋白酶(0.25%)水解并进行SDS-PAGE电泳分析,切取大小约为3.5、1.8 ku的片段,以2, 5-二羟基苯甲酸为基质进行MALDI-TOF质谱分析。样品制备方法如下,先将基质配制成浓度为0.1 mol·L-1基质/甲酸溶液,以纯水配制被分析物,浓度为1 μmol·L-1。将基质/被分析物按300∶1的比例制备于MALDI样品靶板上使其干燥结晶,在MALDI-TOF质谱仪(Shimadzu, Kyoto, Japan)上进行分析,mMass软件分析和处理获得的信息[14]。
1.2.4 统计学分析 数据采用SAS 9.2多因素方差分析考察不同沙门菌菌株和不同处理时间对沙门菌感染猪巨噬细胞的METs水平和ABL1磷酸化水平的效应,邓肯氏多重检验不同水平间的差异。
2 结果 2.1 不同沙门菌菌株诱导的METs水平不同本研究分析了Salmonella 14028、Salmonella 13312、Salmonella 13314菌株诱导METs形成的情况。结果如图 1所示,不同沙门菌菌株诱导的猪巨噬细胞数小时内均可产生一定水平的METs。其中0和4 h时,3个沙门菌菌株诱导的METs水平间无显著差异(P>0.05),8 h时,Salmonella 13314诱导的METs水平显著高于Salmonella 14028和Salmonella 13312(P < 0.05),Salmonella 13314菌株诱导的METs约为Salmonella 14028和Salmonella 13312的1.8倍(图 2)。3个菌株诱导巨噬细胞产生METs的水平均随诱导时间延长而上升,Salmonella 14028和Salmonella 13312菌株在诱导4和8 h时产生的METs水平显著高于0 h(P < 0.05),但在4和8 h间均无显著差异(P>0.05)。Salmonella 13314诱导的METs水平存在时间依赖,0和4 h、4和8 h间存在显著差异(P < 0.05)(图 2)。
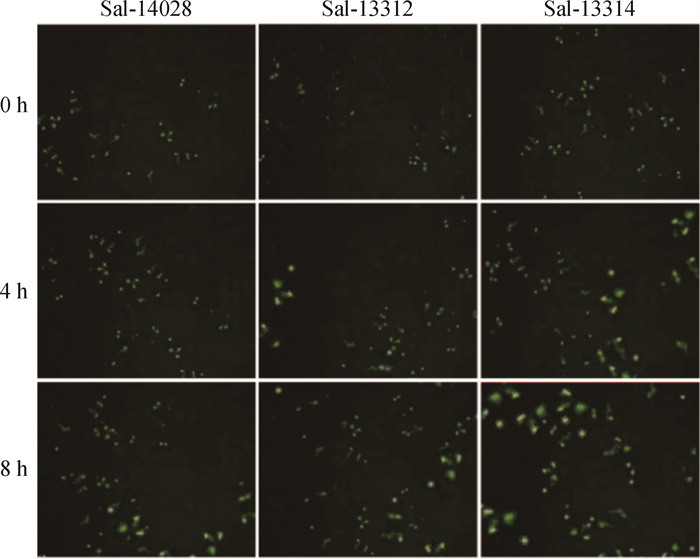
|
纵列分别为Salmonella 14028 (鼠伤寒沙门菌)、Salmonella 13312 (猪霍乱沙门菌)、Salmonella 13314 (亚利桑那沙门菌)处理;横行分别为处理时间0、4、8 h The column were treatments with Salmonella 14028 (Salmonella typhimurium), Salmonella 13312 (Salmonella Choleraesuis), Salmonella 13314 (Salmonella Arizona), respectively; the rows were treatment time 0, 4 and 8 h, respectively 图 1 SYTOXTM Green染色的沙门菌处理猪巨噬细胞(100×) Fig. 1 SYTOXTM Green stained Salmonella treated porcine macrophages (100×) |
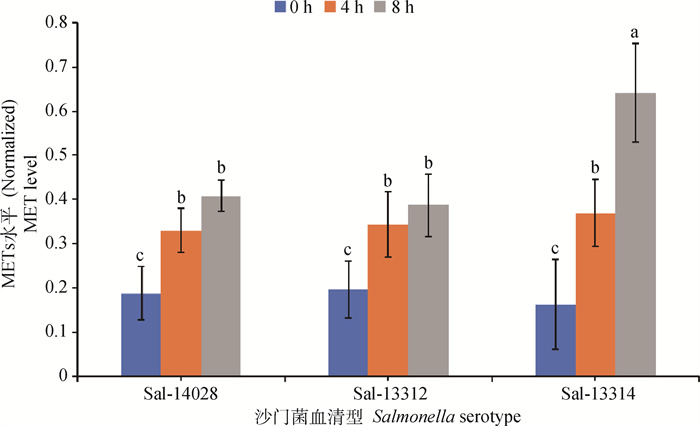
|
字母相同代表差异不显著(P>0.05),字母不同代表差异显著(P < 0.05) The same letter means no significant difference (P>0.05), and the different letters mean significant difference (P < 0.05) 图 2 3个沙门菌菌株诱导不同时间猪巨噬细胞产生的METs水平 Fig. 2 Three Salmonella serotype strains induced different levels of METs produced by porcine macrophages at different time points |
比较Salmonella 14028、Salmonella 13312、Salmonella 13314作用于细胞外陷网已知的主要通路(如MAPK和Cell Cycle)的基因数量,发现约有336个沙门菌基因作用于上述通路中的321基因(表 1)。
|
|
表 1 Salmonella 13312(猪霍乱沙门菌)与Salmonella 14028(鼠伤寒沙门菌)、Salmonella 13314(亚利桑那沙门菌)作用于宿主基因数量的比较 Table 1 Comparison of the number of host genes affected by Salmonella 13312 (Salmonella Choleraesuis), Salmonella 14028 (Salmonella Typhimurium) and Salmonella 13314 (Salmonella Arizona) |
在这些基因中作者基于以下规则选择了SptP作为进一步的研究对象:(i)作用基因数量较多,SptP可与宿主MAPK、Cell Cycle通路中约146个基因相互作用;(ii)作用的宿主基因与细胞外陷网的生成密切相关,SptP的酪氨酸磷酸酶结构域(SptP300-543、SptP479-489)作用的宿主基因结构域见表 2,其中,ABL1排首位,ABL1负责RB的酪氨酸磷酸基团水解并释放E2F2的转录活性,ABL1是上调细胞周期蛋白转录因子E2F2的重要磷酸激酶,在细胞循环、细胞外陷网产生过程中发挥重要的调节作用,另外CDK6等多个与细胞外陷网相关的基因也是SptP酪氨酸磷酸酶的潜在靶分子;(iii)3个沙门菌菌株作用的宿主基因的平均R指数(R_CUBE)最高的基因为SptP,值为0.95,Salmonella 13314与Salmonella 13312、Salmonella 13314与Salmonella 14028之间R1指数的绝对值均为19,显著小于Salmonella 13312与Salmonella 14028间的R1指数146,表明前两个比较组间相同基因集合均小于后者,Salmonella 13314与Salmonella 13312、Salmonella 13314与Salmonella 14028之间R2指数的绝对值分别为52.47和52.22,显著大于Salmonella 13312与Salmonella 14028间的R2指数2.64,表明前两个比较组间基因保守性低于后者,Salmonella 13314与Salmonella 13312、Salmonella 13314与Salmonella 14028之间R3指数均为127,显著高于Salmonella 13312与Salmonella 14028间的R3指数0,表明前两个比较组间相异基因集合均多余后者;(iv)Salmonella 13314引起的METs水平较高、Salmonella 13312和Salmonella 14028引起的METs水平均较低,菌株间METs水平的差异与3个菌株SptP的R1、R2、R3指数吻合较好。
|
|
表 2 沙门菌SptP与细胞外陷网作用的宿主基因及结构域的比较 Table 2 Comparison of host genes and domains targeted by Salmonella SptP in extracellular traps biogenesis |
利用SptP特异性抗体免疫共沉淀富集与SptP作用的猪巨噬细胞蛋白,经SDS-PAGE电泳分析,回收大小约120 ku的条带(分子量比对结果显示可能为ABL1),胰蛋白酶水解并进行SDS-PAGE电泳分析,切取大小约为1.8 ku片段的MALDI-TOF质谱分析结果见图 3。经肽指纹图谱数据库比对证实该片段为VLGYNHNGEWCEAQTK,为ABL1的90—105区域片段(P < 0.05)。
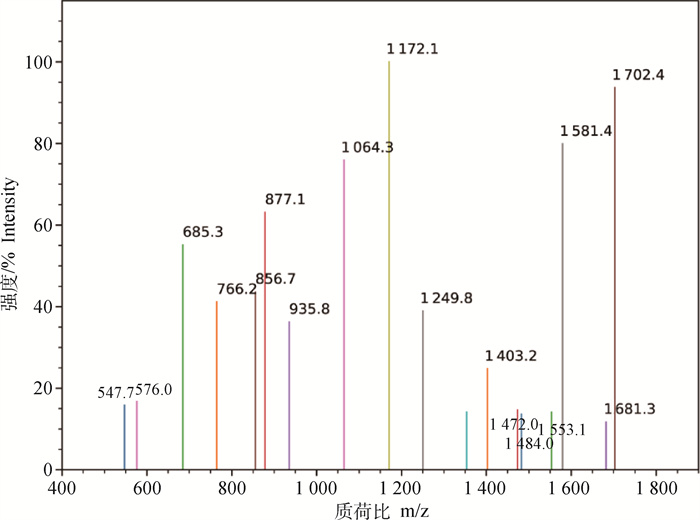
|
图中所示为Y-ion和B-ion型离子碎片 Y-ion and B-ion type ion fragments are shown in the figure 图 3 SptP特异性抗体富集的猪巨噬细胞蛋白的1.8 ku片段的MALDI-TOF图谱 Fig. 3 MALDI-TOF map of 1.8 ku fragment of porcine macrophage protein enriched by SptP specific antibody |
SptP特异性抗体富集的猪巨噬细胞蛋白的3.5 ku片段的MALDI-TOF图谱如图 3所示,经肽指纹图谱数据库比对证实该片段为ENLLAGPSEN DPNLFVALYDFVASGDNTLSITK,为ABL1的52—84区域片段(P < 0.05)。进一步分析发现,该图谱中存在19-Y磷酸化型离子碎片,质荷比m/z 1 815.9的片段为ENLLAGPSENDPNLFVALYDF,对应的磷酸化片段ENLLAGPSENDPNLFVALY(p)DF的质荷比m/z为1 895.6(图 4)。质荷比m/z 2 058.6的片段为ENLLAGPSENDPNLFVALYDFVA,对应的磷酸化片段ENLLAGPSENDPNLFVALY(p)DFVA的质荷比m/z为2 140.2(图 4)。
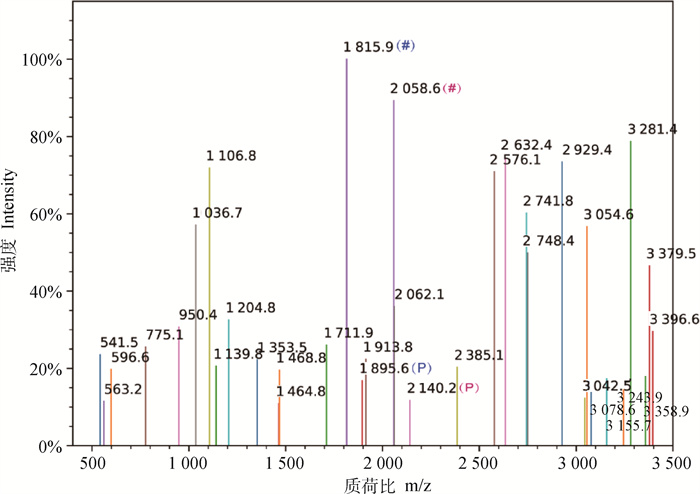
|
图中所示为Y-ion和B-ion型离子碎片。#标注的离子碎片为典型非磷酸化片段,相同颜色P字母标注的离子碎片为对应磷酸化片段 Y-ion and B-Ion type ion fragments are shown in the figure. The ion fragments marked with # symbol are typical non phosphorylated fragments, and the ion fragments marked with the same color with 'P' letter are corresponding phosphorylated fragments 图 4 SptP特异性抗体富集的猪巨噬细胞蛋白的3.5 ku片段的MALDI-TOF图谱 Fig. 4 MALDI-TOF map of 3.5 ku fragment of porcine macrophage protein enriched by SptP specific antibody |
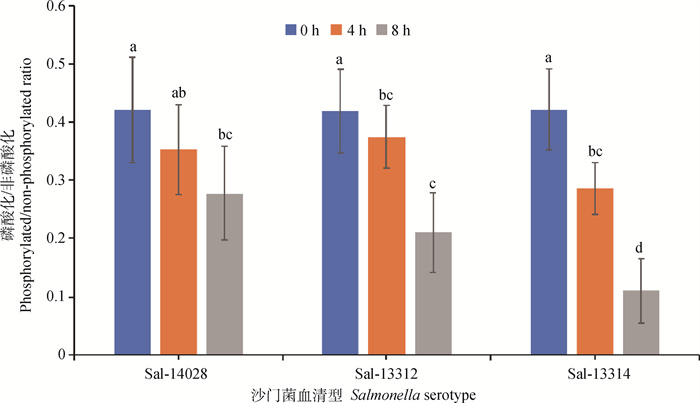
比较不同沙门菌菌株感染的猪巨噬细胞的磷酸化ABL1离子强度/非磷酸化ABL1离子强度比值发现,3个菌株引起磷酸化ABL1离子强度/非磷酸化ABL1离子强度比值随处理时间的延长均下降。Salmonella 13312菌株和Salmonella 14028处理4 h细胞磷酸化ABL1/非磷酸化ABL1比值与0 h相比均无显著差异(P>0.05),但8 h和0 h相比均显著下降(P < 0.05)。Salmonella 13312菌株处理8 h细胞的磷酸化ABL1/非磷酸化ABL1比值显著低于4 h(P < 0.05)。Salmonella 13314菌株处理细胞的磷酸化ABL1/非磷酸化ABL1比值,0 h与4 h、4 h与8 h间均显著差异(P < 0.05),且Salmonella 13314菌株处理8 h细胞的磷酸化ABL1/非磷酸化ABL1比值显著低于其他2个菌株(P < 0.05)(图 5)。对比3种沙门菌诱导的METs水平发现,沙门菌诱导的METs水平与磷酸化ABL1/非磷酸化ABL1比值存在显著负相关(P < 0.05),诱导较高水平METs的菌株Salmonella 13314具有较低水平的磷酸化ABL1/非磷酸化ABL1比值,暗示细胞ABL1的磷酸化水平可能与METs的水平存在联系。
|
字母相同代表差异不显著(P>0.05),字母不同代表差异显著(P < 0.05) The same letter means no significant difference (P>0.05), and the different letter means significant difference (P < 0.05) 图 5 不同沙门菌菌株感染的猪巨噬细胞的磷酸化ABL1/非磷酸化ABL1比值 Fig. 5 Phosphorylated ABL1/non-phosphorylated ABL1 ratio of porcine macrophages infected with different Salmonella strains |
研究报道,沙门菌能诱导巨噬细胞产生可限制细菌扩散和杀菌作用的METs[8]。METs是巨噬细胞除了吞噬、分泌细胞因子外的新的抵御沙门菌感染的重要途径。本研究发现,不同沙门菌菌株诱导的猪巨噬细胞数小时内均可产生一定水平的METs。Salmonella 13314诱导的METs水平显著高于Salmonella 14028和Salmonella 13312的同时,也发现沙门菌三型分泌系统效应蛋白SptP作用的宿主基因的数量和对应的结构域在3个沙门菌菌株间的差异。研究结果提示效应蛋白SptP在调控METs产生中的重要调控作用。
沙门菌SptP的磷酸酶活性与其入侵、胞内存活增殖和免疫逃避密切相关。文献报道,SptP酪氨酸磷酸酶结构可通过抑制Raf和Erk,经Ras-MAPK信号转导抑制下游炎症介质TNFa的释放,从而调控宿主细胞的固有免疫[15]。SptP磷酸酶结构域也导致宿主AAA+ATPase的去磷酸化,使囊泡内环境适于细菌存活和增殖[16]。SptP的酪氨酸磷酸酶还能靶向鞭毛相关波形蛋白的磷酸水解作用,调节肠绒毛刷状缘绒毛蛋白的磷酸化水平,介导细菌入侵和细胞膜修复[17-18]。SptP也能通过磷酸水解酶活性阻断Syk的磷酸化水平,从而抑制肥大细胞的脱颗粒作用[19]。
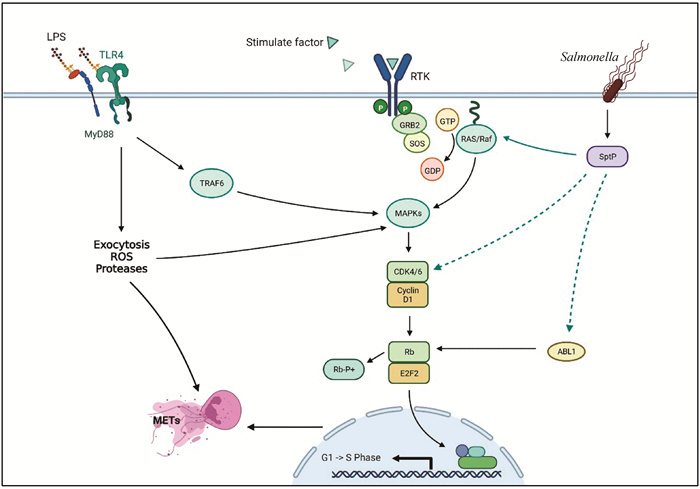
上述已报道的SptP的靶基因均存在于本研究预测分析SptP磷酸酶靶基因列表中,包括ERK、Ras等。本研究发现ABL1可能是SptP酪氨酸磷酸酶作用的新的靶点并参与METs的调控。虽然细胞外陷网的发生机制尚未完全阐明,关键通路MAPK和关键基因CDK6在中性粒细胞外陷网(NETs)中的重要作用已阐释清楚[20-22]。细胞外陷网的形成有两个关键步骤:(i)MAPK诱导CDK4/6活化,导致肌动蛋白微丝蛋白溶解、细胞微管的移动和中心体分离;(ii)在PAD4作用下,组蛋白瓜氨酸化、电荷改变,其与染色质DNA的结合变得松散,在蛋白酶的作用下进一步使染色质解聚、核膜解体、DNA释放。由于Ras、ABL1和CDK6均可能存在SptP酪氨酸磷酸酶作用的靶位点。SptP可从以上多个路径下调下游Rb的磷酸化水平,增强其与转录因子E2F2的结合,阻碍E2F2的转录活性,抑制染色质重建过程,这是METs抑制的重要信号。SptP调控NETs形成的假说归纳于图 6。
|
黑线箭头表示正调控,绿线箭头表示负调控,实线箭头表示METs主通路,虚线箭头为本课题研究部分 The black line arrow indicates positive regulation, the green line arrow indicates negative regulation, the solid line arrow indicates the main pathway of METs, and the dotted line arrow is the research part of this subject 图 6 沙门菌SptP调控MAPK-CDK6-RB通路抑制METs形成的假说 Fig. 6 Hypothesis that Salmonella SptP regulates MAPK-CDK6-RB pathway to inhibit the formation of METs |
本研究以沙门菌SptP为切入点,研究SptP作用于MAPK-CDK6-RB通路的关键靶点ABL1和CDK6,阐明该通路对TLR-ROS-METs分子主线的干扰作用,从而揭示一种由沙门菌SptP从细胞内引发的METs调控新途径,本研究结果为仔猪沙门菌持续感染和长期携带的机理解析提供新视角。
| [1] |
PAPAYANNOPOULOS V. Neutrophil extracellular traps in immunity and disease[J]. Nat Rev Immunol, 2018, 18(2): 134-147. DOI:10.1038/nri.2017.105 |
| [2] |
THIAM H R, WONG S L, WAGNER D D, et al. Cellular mechanisms of NETosis[J]. Annu Rev Cell Dev Biol, 2020, 36: 191-218. DOI:10.1146/annurev-cellbio-020520-111016 |
| [3] |
LOUREIRO A, PAIS C, SAMPAIO P. Relevance of macrophage extracellular traps in C. albicans Killing[J]. Front Immunol, 2019, 10: 2767. DOI:10.3389/fimmu.2019.02767 |
| [4] |
RAYNER B S, ZHANG Y J, BROWN B E, et al. Role of hypochlorous acid (HOCl) and other inflammatory mediators in the induction of macrophage extracellular trap formation[J]. Free Radic Biol Med, 2018, 129: 25-34. DOI:10.1016/j.freeradbiomed.2018.09.001 |
| [5] |
WONG K W, JACOBS W R JR. Mycobacterium tuberculosis exploits human interferon γ to stimulate macrophage extracellular trap formation and necrosis[J]. J Infect Dis, 2013, 208(1): 109-119. DOI:10.1093/infdis/jit097 |
| [6] |
LEE Y, REILLY B, TAN C Y, et al. Extracellular CIRP induces macrophage extracellular trap formation via Gasdermin D activation[J]. Front Immunol, 2021, 12: 780210. DOI:10.3389/fimmu.2021.780210 |
| [7] |
AULIK N A, HELLENBRAND K M, CZUPRYNSKI C J. Mannheimia haemolytica and its leukotoxin cause macrophage extracellular trap formation by bovine macrophages[J]. Infect Immun, 2012, 80(5): 1923-1933. DOI:10.1128/IAI.06120-11 |
| [8] |
MÓNACO A, CANALES-HUERTA N, JARA-WILDE J, et al. Salmonella typhimurium triggers extracellular traps release in murine macrophages[J]. Front Cell Infect Microbiol, 2021, 11: 639768. DOI:10.3389/fcimb.2021.639768 |
| [9] |
HANSEN-WESTER I, STECHER B, HENSEL M. Type Ⅲ secretion of Salmonella enterica serovar Typhimurium translocated effectors and SseFG[J]. Infect Immun, 2002, 70(3): 1403-1409. DOI:10.1128/IAI.70.3.1403-1409.2002 |
| [10] |
ZHANG K, RIBA A, NIETSCHKE M, et al. Minimal SPI1-T3SS effector requirement for Salmonella enterocyte invasion and intracellular proliferation in vivo[J]. PLoS Pathog, 2018, 14(3): e1006925. DOI:10.1371/journal.ppat.1006925 |
| [11] |
BÖYUM A. Isolation of mononuclear cells and granulocytes from human blood. Isolation of monuclear cells by one centrifugation, and of granulocytes by combining centrifugation and sedimentation at 1 g[J]. Scand J Clin Lab Invest Suppl, 1968, 97: 77-89. |
| [12] |
ALBORZI S Z, NACER A A, NAJJAR H, et al. PPIDomainMiner: Inferring domain-domain interactions from multiple sources of protein-protein interactions[J]. PLoS Comput Biol, 2021, 17(8): e1008844. DOI:10.1371/journal.pcbi.1008844 |
| [13] |
LOAIZA C D, DUHAN N, LISTER M, et al. In silico prediction of host-pathogen protein interactions in melioidosis pathogen Burkholderia pseudomallei and human reveals novel virulence factors and their targets[J]. Brief Bioinform, 2021, 22(3): bbz162. DOI:10.1093/bib/bbz162 |
| [14] |
NIEDERMEYER T H J, STROHALM M. mMass as a software tool for the annotation of cyclic peptide tandem mass spectra[J]. PLoS One, 2012, 7(9): e44913. DOI:10.1371/journal.pone.0044913 |
| [15] |
LIN S L, LE T X, COWEN D S. SptP, a Salmonella typhimurium type Ⅲ-secreted protein, inhibits the mitogen-activated protein kinase pathway by inhibiting Raf activation[J]. Cell Microbiol, 2003, 5(4): 267-275. DOI:10.1046/j.1462-5822.2003.t01-1-00274.x |
| [16] |
HUMPHREYS D, HUME P J, KORONAKIS V. The Salmonella effector SptP dephosphorylates host AAA+ ATPase VCP to promote development of its intracellular replicative niche[J]. Cell Host Microbe, 2009, 5(3): 225-233. DOI:10.1016/j.chom.2009.01.010 |
| [17] |
MURLI S, WATSON R O, GALÁN J E. Role of tyrosine kinases and the tyrosine phosphatase SptP in the interaction of Salmonella with host cells[J]. Cell Microbiol, 2001, 3(12): 795-810. DOI:10.1046/j.1462-5822.2001.00158.x |
| [18] |
LHOCINE N, ARENA E T, BOMME P, et al. Apical invasion of intestinal epithelial cells by Salmonella typhimurium requires villin to remodel the brush border actin cytoskeleton[J]. Cell Host Microbe, 2015, 17(2): 164-177. DOI:10.1016/j.chom.2014.12.003 |
| [19] |
CHOI H W, BROOKING-DIXON R, NEUPANE S, et al. Salmonella typhimurium impedes innate immunity with a mast-cell-suppressing protein tyrosine phosphatase, SptP[J]. Immunity, 2013, 39(6): 1108-1120. DOI:10.1016/j.immuni.2013.11.009 |
| [20] |
ALBRENGUES J, WYSOCKI R W, MAIORINO L, et al. Re-cyclin' cell-cycle components to make NETs[J]. Dev Cell, 2017, 43(4): 379-380. DOI:10.1016/j.devcel.2017.11.002 |
| [21] |
AMULIC B, KNACKSTEDT S L, ABU ABED U, et al. Cell-cycle proteins control production of neutrophil extracellular traps[J]. Dev Cell, 2017, 43(4): 449-462.e5. DOI:10.1016/j.devcel.2017.10.013 |
| [22] |
MUÑOZ-CARO T, LENDNER M, DAUGSCHIES A, et al. NADPH oxidase, MPO, NE, ERK1/2, p38 MAPK and Ca2+ influx are essential for Cryptosporidium parvum-induced NET formation[J]. Dev Comp Immunol, 2015, 52(2): 245-254. DOI:10.1016/j.dci.2015.05.007 |
(编辑 白永平)



