猪繁殖与呼吸综合征(porcine reproductive and respiratory syndrome,PRRS)是危害世界养猪业最严重的病毒性疾病之一,临床表现主要包括妊娠母猪流产、早产、产死胎和木乃伊胎,仔猪消瘦、生长缓慢以及成活率下降等,以及各年龄育肥猪的呼吸系统疾病。其病原猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)能够诱导机体免疫抑制,导致继发感染或混合感染[1]。PRRSV的另一特点是变异速度较快。目前,我国主要流行亚型为PRRSV-2(高致病毒株、NADC-30样毒株和NADC-34样毒株),近年来,陆续出现PRRSV-1[2-5]。此外,我国多地免疫猪群出现野毒株和疫苗毒株重组的新毒株,并呈现多毒株并存的现象[6],提示现有的商品化疫苗并不能提供很好的交叉保护,给该病的有效免疫防控带来巨大困难。因此,新的PRRSV防控手段的研发迫在眉睫。抗病毒药物是控制病毒性疾病的一个重要研究方向。天然产物,特别是传统中草药分布广泛、简便易得、低毒,并且可以作为动物饲料的一部分[7]。因其在临床治疗病毒感染性疾病中疗效显著,成为新药物发现的宝贵资源。目前,已经证明多种天然化合物可作为抗PRRSV的潜在药物[8-10]。双香豆素[3, 3-亚甲基双(4-羟基香豆素), dicumarol, DIC]存在于芸香科植物、伞形科植物、菊科植物、豆科植物,主要作为一种抗凝剂用于血栓的预防和治疗,同时也可以通过调节酶活性、诱导细胞凋亡等机制,具有一定的抗病毒作用[11-14]。DIC对PRRSV是否具有抑制作用尚未可知。因此研究DIC对PRRSV增殖的影响并确定其机制,能够为PRRSV预防和控制提供理论依据。
1 材料与方法 1.1 材料1.1.1 细胞和病毒 Marc-145细胞(非洲绿猴肾上皮细胞)及高致病性PRRSV毒株BB0907均由南京农业大学姜平教授馈赠。
1.1.2 主要试剂与仪器 双香豆素(dicumarol,DIC)购自上海麦克林生化科技有限公司;PRRSV N蛋白单克隆抗体由南京农业大学姜平教授馈赠;辣根过氧化物酶标记山羊抗小鼠IgG(H+L)(A0216)购自上海碧云天生物技术有限公司;RNA提取试剂TRIzol、DMEM均购自Invitrogen公司。恒温二氧化碳无菌细胞培养箱(Thermo,型号:3543);荧光定量PCR仪(Stratagene公司,型号:Mx 3005P);酶标仪(Bio-RAD,型号:BR-680)。
1.2 方法1.2.1 Western blot 使用含有蛋白酶抑制剂的RIPA裂解缓冲液提取细胞总蛋白,按照碧云天BCA蛋白浓度测定试剂盒测定蛋白浓度。根据BCA结果将各组蛋白浓度调整统一。加入5×Loading Buffer混匀后,置于100 ℃沸水中煮10 min。利用12.5%聚丙烯酰胺琼脂糖凝胶(SDS-PAGE)电泳分离蛋白质样品,并电印迹到硝酸纤维素膜膜上,通过封闭、孵育PRRSV N蛋白单克隆抗体(1∶1 500)、孵育辣根过氧化物酶标记山羊抗小鼠IgG(H+L)(1∶2 000)等步骤检测目标蛋白。
1.2.2 荧光定量PCR 每孔Marc-145细胞加入200 μL TRIzol收集细胞,按照总RNA提取试剂盒提取细胞中的总RNA,依据HiScript Ⅱ 1 st Strand cDNA Synthesis进行RNA反转录。以cDNA为模板,依据qPCR SYBE Green Master Mix说明书进行qPCR。反应体系:2× SYBR Green Pro Taq HS Premix 10 μL,模板0.2 μL,引物F、R(10 μmol·L-1)各0.4 μL,ROX Reference Dye (20 μmol·L-1),RNase free water 8.6 μL。反应程序:95 ℃ 10 min;95 ℃ 30 s,58 ℃ 30 s,72 ℃ 30 s,40个循环;95 ℃ 1 min,58 ℃ 30 s,95 ℃ 30 s,1个循环。同时设定阴性对照,获得Ct值。目的基因的mRNA的相对表达采用2-△△Ct法分析[15]。所有处理组均重复检测3次。引物详见表 1。
|
|
表 1 荧光定量PCR引物 Table 1 Primers for qPCR |
1.2.3 DIC对Marc-145细胞的毒性测定 在96孔板中培养Marc-145细胞,待细胞汇合度达到70%时,吸弃孔中培养液,加入用DMEM稀释的不同浓度的DIC溶液(0、1.925、3.9、7.812 5、31.25、62.5、125、250、500、1 000 μmol·L-1),置37 ℃培养箱培养48 h后弃去药液,每孔加入10 μL CCK-8溶液和200 μL细胞培养液,37 ℃温箱继续孵育2 h,通过酶标仪测定各组OD450 nm值,利用Graphpad软件计算出DIC对Marc-145细胞的CC50。
1.2.4 DIC对PRRSV的50%抑制浓度(IC50)的测定 将DIC用营养液稀释成不同浓度,同时设立含等量DMSO的阴性对照组;接种PRRSV(0.01 MOI),37 ℃孵育30 h,吸弃细胞上清;进行间接免疫荧光试验:将细胞用PBS洗3遍,用4%多聚甲醛固定15 min,0.1%TritonX-100透膜30 min,用PBS洗3次,每次5 min。加入PRRSV N蛋白单克隆抗体(1∶1 000稀释),37 ℃孵育细胞1 h;PBS洗细胞3次,3 min·次-1;加入绿色荧光二抗Alexa Fluor 488山羊抗小鼠IgG(1∶1 000稀释,Alexa Fluor 488山羊抗小鼠IgG,A0428,上海碧云天生物技术有限公司),37 ℃孵育45 min;于室温下用DAPI染色细胞核10 min;荧光显微镜下观察结果;用尼康A1共聚焦显微镜随机记录3张照片;用ImageJ软件测定其荧光值强度;利用GraphPad Prism 7.0软件统计并计算出DIC对PRRSV的50%抑制浓度(IC50)。
1.2.5 DIC的抗PRRSV活性测定 在24孔板中培养Marc-145细胞,待细胞汇合度达到60%时,将营养液换成含有不同浓度DIC(5、10和25 μmol·L-1) 的10% DMEM培养液。培养细胞12 h,吸弃孔中培养液,用无菌PBS洗1遍后,接种0.1MOI的PRRSV。于37 ℃孵育1 h后弃去病毒液,PBS充分洗涤,再将含有DIC的2% DMEM重新加入细胞孔中,培养36 h,进行qPCR检测PRRSV ORF7的mRNA含量;Western blot检测PRRSV的N蛋白含量;反复冻融3次,检测病毒的TCID50。
1.2.6 DIC不同给药时间对PRRSV感染周期影响的测定 在24孔板中培养Marc-145细胞,待细胞汇合度达到60%时,按试验分组(全程不给药M1、预处理阶段+复制全周期给药M2、预处理阶段+吸附阶段给药M3、吸附阶段给药M4、入侵阶段给药M5、复制阶段给药M6、仅预处理阶段给药M7)接种0.1MOI的PRRSV及DIC。在24 hpi收获细胞,进行荧光定量PCR,检测PRRSV ORF7的mRNA含量;进行Western blot,检测N蛋白含量。
1.2.7 DIC对PRRSV吸附阶段影响的测定 将长满单层的培养在24板中的Marc-145细胞置于4 ℃预冷1 h。弃液,用预冷的PBS清洗细胞表面3次,加入不同浓度的DIC并接种PRRSV(1 MOI),同时设立DMSO对照组。将细胞板置于4 ℃冰箱中1 h,用预冷的PBS清洗细胞表面3次,然后裂解细胞进行细胞RNA的提取,用qPCR检测细胞内PRRSV ORF7 mRNA含量。
1.2.8 DIC对PRRSV入胞阶段影响的测定 将细胞汇合度达到70%的Marc-145细胞,用浓度为10 μg·mL-1蛋白合成抑制剂环乙酰亚胺(cycloheximide,CHX)预处理12 h,用预冷的PBS清洗细胞表面后接种PRRSV(1MOI),4 ℃孵育1 h。再次用预冷的PBS清洗细胞3次,去除游离的病毒粒子,加入含有DIC(25 μmol·L-1)或DMSO的DMEM,37 ℃孵育30 min。用柠檬酸缓冲液(pH=3)洗涤细胞以去除未内化的病毒。用qPCR检测细胞内PRRSV ORF7 mRNA含量。
1.2.9 DIC对PRRSV复制阶段影响的测定 对汇合度达到70%Marc-145细胞接种1 MOI PRRSV,37 ℃培养6 h,用PBS清洗细胞3次,加入含DIC(25 μmol·L-1)或DMSO的新鲜DMEM(含2% FBS),37 ℃孵育。在7、8和9 h后,用qPCR检测细胞内PRRSV ORF7 mRNA含量。
1.2.10 DIC对PRRSV释放阶段影响的测定 对汇合度达到70%的Marc-145细胞接种0.1 MOI PRRSV,37 ℃孵育1 h,吸弃孔内病毒液,加入含2% FBS的DMEM。在18 hpi时,用PBS洗涤细胞3次,加入含有DIC(25 μmol·L-1)或DMSO的DMEM(含2% FBS),并在37 ℃下继续培养10、30和60 min,分别收获上清液。用绝对荧光定量检测细胞上清中存在的病毒含量。
1.3 统计学方法本研究中使用GraphPad prism 8.0软件(One-way ANOVA test)进行统计学分析绘图,所有数据都被表示为“平均值±标准差(x±s)”,P < 0.05(*)表示差异显著,P < 0.01(**)、P < 0.001 (***)和P < 0.000 1(****)表示差异极显著。
2 结果 2.1 DIC对Marc-145细胞的细胞毒性测定DIC的结构式如图 1A所示。用不同浓度DIC溶液处理Marc-145细胞,通过CCK8试验检测细胞毒性。结果显示:当DIC浓度 < 31.25 μmol·L-1时,CCK-8检测DIC对Marc-145细胞无明显毒性。通过GraphPad软件分析,DIC对Marc-145细胞的CC50为96.11 μmol·L-1(图 1B)。用不同浓度(0~150 μmol·L-1)的DIC或溶剂DMSO处理细胞后,接种PRRSV(0.01 MOI),30 h进行间接免疫荧光试验,通过统计DIC与DMSO对照组的PRRSV荧光,计算出DIC对PRRSV的IC50为12.75 μmol·L-1。CC50较高,IC50较低,说明DIC对Marc-145细胞毒性较低,且在该细胞上对PRRSV具有较好的抗病毒作用。

|
A.双香豆素的化学式;B. 双香豆素的CC50测定;C. 双香豆素的IC50测定 A. Chemical formula of DIC; B. CC50 determination of DIC; C. IC50 determination of DIC 图 1 双香豆素的化学式及其CC50和IC50测定 Fig. 1 Chemical formula of DIC and the CC50and IC50 determination |
用不同浓度DIC(5、10和25 μmol·L-1)处理Marc-145细胞12 h后,接种0.1 MOI的PRRSV。于37 ℃培养36 h(培养过程营养液中含有对应浓度DIC)。通过qRT-PCR检测PRRSV ORF7的mRNA含量;Western blot检测PRRSV的N蛋白含量;并反复冻融3次,检测病毒的TCID50。结果显示:与对照组(未添加DIC组)相比,DIC处理组Marc-145细胞中PRRSV的N蛋白表达量(图 2A)与ORF7 mRNA的相对表达量(图 2B)降低,并呈剂量依赖性。DIC浓度为25 μmol·L-1的给药组,差异最为显著(P<0.000 1),几乎检测不到N蛋白。同时,不同浓度给药组TCID50结果也显示DIC可以抑制PRRSV的增殖,并呈剂量依赖性(图 2C)。
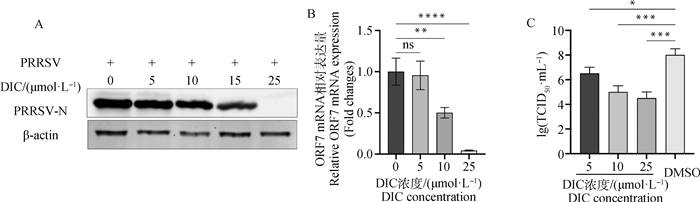
|
A. Western blot检测DIC剂量依赖性抑制PRRSV增殖;B. qPCR法检测DIC剂量依赖性抑制PRRSV增殖;C. TCID50检测DIC剂量依赖性抑制PRRSV增殖。*.P < 0.05,**.P < 0.01,***.P < 0.001,****.P < 0.000 1,ns. P>0.05,下图同 A.Western blot was used to detect the dose-dependent inhibition of PRRSV proliferation by DIC; B. The dose-dependent inhibition of PRRSV proliferation by DIC was detected by qPCR; C. TCID50 detection of DIC dose-dependent inhibition of PRRSV proliferation. *.P < 0.05, **.P < 0.01, ***.P < 0.001, ****.P < 0.000 1, ns. P>0.05, the same as below 图 2 DIC剂量依赖性抑制PRRSV增殖 Fig. 2 DIC dose-dependent inhibition of PRRSV proliferation |
检测DIC在PRRSV增殖的不同时间的作用,分别在病毒接种后的12、24和48 h进行Western blot和qPCR,比较DIC处理组和未处理组细胞内N蛋白表达量与ORF7 mRNA含量的区别。结果如图 3显示,与对照组相比,同一时间点的DIC给药组中PRRSV的N蛋白表达量(图 3A)与ORF7 mRNA的相对表达量(图 3B)显著降低。表明DIC在PRRSV增殖的不同时间均具有抑制病毒增殖的作用。

|
A. Western blot检测N蛋白含量;B. qPCR检测ORF7 mRNA的相对表达量 A. Western blot for N protein content; B. qPCR method for relative expression of ORF7 mRNA 图 3 DIC抑制不同时间的PRRSV增殖 Fig. 3 DIC inhibits PRRSV proliferation at different time |
用不用滴度的PRRSV接种Marc-145细胞,检测DIC是否对不同滴度的病毒具有抑制作用。结果显示,PRRSV在高剂量(0.1MOI)和低剂量(0.01MOI)时,DIC给药组中PRRSV的N蛋白表达量(图 4A)与ORF7 mRNA的相对表达量(图 4B)都显著降低。表明DIC可对不同滴度的PRRSV的增殖起到抑制作用。
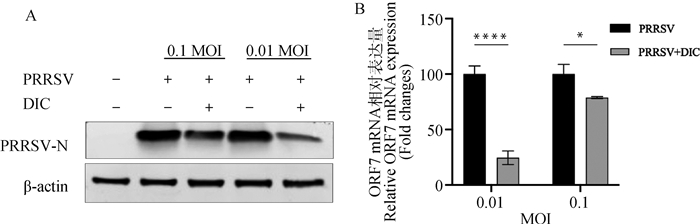
|
A. Western blot检测DIC抑制不同滴度PRRSV增殖;B. qPCR检测DIC抑制不同滴度PRRSV增殖 A.Western blot showed that DIC inhibited the proliferation of PRRSV with different titers; B. Detection of DIC inhibiting PRRSV proliferation with different titers by qPCR 图 4 DIC可抑制不同滴度的PRRSV增殖 Fig. 4 DIC can inhibit the proliferation of PRRSV with different titers |
为了确定DIC抑制PRRSV增殖的具体机制,首先建立了时间过程分析,以确定DIC的抗PRRSV活性阶段,时间过程分为7组(全程不给药M1、预处理阶段+病毒增殖全过程M2、预处理阶段+吸附阶段给药M3、吸附阶段给药M4、入侵阶段给药M5、复制阶段给药M6、仅预处理阶段给药M7)(图 5A)。结果显示,与M1对照组相比,M2和M6给药组的PRRSV的N蛋白(图 5B)和ORF7 mRNA(图 5C)表达水平均显著降低。表明DIC可能主要在PRRSV的复制周期发挥抗病毒作用。
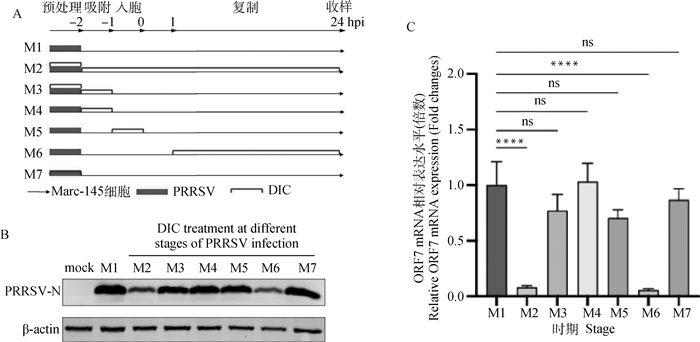
|
A.在不同PRRSV感染时间段给药分组;B. Western blot检测DIC抑制不同时期PRRSV增殖;C. qPCR法检测DIC抑制不同时期PRRSV增殖 A. Different treatment times of DIC and infection time of PRRSV; B. Western blot for N protein content; C. qPCR detection of relative expression of ORF7 mRNA 图 5 感染前后不同时间加入DIC对PRRSV增殖的抑制作用 Fig. 5 Inhibition of PRRSV proliferation by adding DIC at different times before and after infection |
为了进一步确定DIC影响PRRSV感染周期的具体阶段,分别在PRRSV的吸附、入胞、复制和释放阶段检测DIC的作用。
利用qPCR检测加入不同浓度的DIC并接种PRRSV(1 MOI)的Marc-145细胞内PRRSV ORF7 mRNA含量,结果如图 6A所示,DIC对PRRSV吸附阶段无影响。
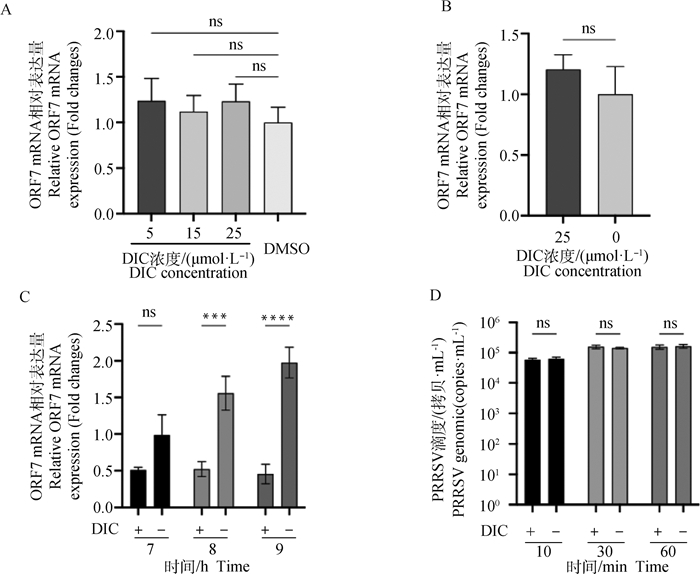
|
A. qPCR检测DIC对PRRSV吸附阶段的影响;B. qPCR检测DIC对PRRSV入胞阶段的影响;C.qPCR检测DIC对PRRSV复制阶段的影响;D. 绝对荧光定量PCR检测DIC对PRRSV释放阶段的影响 A.qPCR method was used to detect the effect of DIC on the adsorption stage of PRRSV; B. qPCR method was used to detect the effect of DIC on the entry stage of PRRSV; C. qPCR was used to detect the effect of DIC on the replication stage of PRRSV; D. Effect of DIC on PRRSV release phase detected by absolute fluorescence quantitative PCR 图 6 DIC对PRRSV不同复制阶段的影响 Fig. 6 Effects of DIC on different replication stages of PRRSV |
进而,用CHX预处理Marc-145细胞,再接种PRRSV(1 MOI),清洗细胞后加入含有DIC (25 μmol·L-1)或DMSO的DMEM,洗涤细胞,用qPCR检测进入细胞内的PRRSV的ORF7 mRNA含量,结果如图 6B所示,DIC对PRRSV入胞阶段无影响。
将Marc-145细胞接种PRRSV后,分别在7、8和9 hpi收集细胞,检测细胞内ORF7 mRNA的相对表达量(图 6C),8和9 hpi组的DIC处理的细胞内ORF7 mRNA的相对表达量显著降低,表明DIC对PRRSV复制阶段有抑制作用。
Marc-145细胞接种0.1 MOI PRRSV,洗涤后加入含有DIC(25 μmol·L-1)或DMSO的DMEM(含2% FBS),继续培养10~60 min,分别收获细胞上清液用绝对荧光定量检测PRRSV含量。结果显示,10、30和60 min DIC处理组与对照组相比,细胞上清中的病毒含量无差别(图 6D)。表明DIC不影响PRRSV的释放阶段。
综上,DIC能够抑制HP-PRRSV的复制阶段。
3 讨论PRRSV对生猪养殖产业造成的经济损失巨大,并在传播和进化过程中极易发生变异。目前,传统PRRS疫苗保护效果不佳,因此,迫切需要新手段来降低该病毒对养殖行业的影响[16-18]。当前在临床上正使用的抗病毒药,价格昂贵且易产生耐药性[3, 19]。鉴于此,基于天然产物的药物治疗具有较大的替代潜力[20]。双香豆素存在于多种植物中,来源广泛。在临床上双香豆素因其与维生素K的化学结构相似而被用作天然抗凝剂,其临床应用时间长,安全性高[21-22]。近年来,一些研究证明了DIC的抗病毒活性,如DIC在体外具有抑制狂犬病病毒复制的活性[23];DIC对多种亚型的流感病毒具有预防或治疗作用[24];此外,DIC表现出显著的抗HBV活性,研究证明,口服DIC显著降低小鼠HBV模型体内的病毒DNA含量[14]。
本研究对双香豆素是否具有抑制PRRSV增殖作用进行了初步探究,证明了DIC在较低浓度时可有效抑制PRRSV在Marc-145细胞上增殖,其机制主要作用于病毒的复制阶段。首先确定双香豆素在Marc-145细胞上的毒性较低,其CC50为96.11 μmol·L-1,但其在25 μmol·L-1时即可表现出较高的抗PRRSV活性,说明其抗PRRSV效果较好。在PRRSV感染的不同时间,DIC均可以抑制PRRSV的增殖;并对高剂量和低剂量的PRRSV均具有抗病毒活性。以上提示DIC对不同程度PRRSV感染均有抑制作用。同时,本研究对DIC抗病毒的具体阶段进行了探究,证明DIC主要抑制PRRSV的复制阶段,提示DIC具有作为PRRSV治疗药物或添加剂的潜力,而不是一种预防性的药物。
4 结论本研究证明天然产物双香豆素在体外对PRRSV的感染具有抑制作用,且主要针对其复制阶段,为双香豆素在临床上治疗PRRS提供理论依据。
| [1] |
LUNNEY J K, FANG Y, LADINIG A, et al. Porcine reproductive and respiratory syndrome virus (PRRSV): pathogenesis and interaction with the immune system[J]. Annu Rev Anim Biosci, 2016, 4: 129-154. DOI:10.1146/annurev-animal-022114-111025 |
| [2] |
YIN B S, QI S S, SHA W L, et al. Molecular characterization of the Nsp2 and ORF5 (ORF5a) genes of PRRSV strains in nine provinces of China during 2016-2018[J]. Front Vet Sci, 2021, 8: 605832. DOI:10.3389/fvets.2021.605832 |
| [3] |
ZHAI S L, LIN T, ZHOU X, et al. Phylogeographic analysis of porcine reproductive and respiratory syndrome virus 1 in Guangdong province, Southern China[J]. Arch Virol, 2018, 163(9): 2443-2449. DOI:10.1007/s00705-018-3873-z |
| [4] |
ZHU Z B, YUAN L L, HU D H, et al. Isolation and genomic characterization of a Chinese NADC34-like PRRSV isolated from Jiangsu province[J]. Transbound Emerg Dis, 2022, 69(4): e1015-e1027. |
| [5] |
ZHANG Q Y, JIANG P, SONG Z B, et al. Pathogenicity and antigenicity of a novel NADC30-like strain of porcine reproductive and respiratory syndrome virus emerged in China[J]. Vet Microbiol, 2016, 197: 93-101. DOI:10.1016/j.vetmic.2016.11.010 |
| [6] |
XIE C Z, WANG Z, HA Z, et al. Genetic characterization of a new NSP2-deletion porcine reproductive and Respiratory Syndrome Virus in China[J]. Microb Pathog, 2021, 150: 104729. DOI:10.1016/j.micpath.2021.104729 |
| [7] |
AKRAM M, TAHIR I M, SHAH S M A, et al. Antiviral potential of medicinal plants against HIV, HSV, influenza, hepatitis, and coxsackievirus: a systematic review[J]. Phytother Res, 2018, 32(5): 811-822. DOI:10.1002/ptr.6024 |
| [8] |
KARUPPANNAN A K, WU K X, QIANG J, et al. Natural compounds inhibiting the replication of Porcine reproductive and respiratory syndrome virus[J]. Antiviral Res, 2012, 94(2): 188-194. DOI:10.1016/j.antiviral.2012.03.008 |
| [9] |
LIU X W, BAI J, JIANG C L, et al. Therapeutic effect of Xanthohumol against highly pathogenic porcine reproductive and respiratory syndrome viruses[J]. Vet Microbiol, 2019, 238: 108431. DOI:10.1016/j.vetmic.2019.108431 |
| [10] |
胡安君, 毕亚楠, 杨婉莉, 等. 甘草酸体外抗PRRSV的作用机制[J]. 中国兽医学报, 2018, 38(7): 1386-1393. HU A J, BI Y N, YANG W L, et al. Mechanism of glycyrrhizic acid against PRRSV in vitro[J]. Chinese Journal of Veterinary Science, 2018, 38(7): 1386-1393. (in Chinese) |
| [11] |
HERNANDEZ A, LOÓPEZ-LLUCH G, BERNAL J A, et al. Dicoumarol down-regulates human PTTG1/Securin mRNA expression through inhibition of Hsp90[J]. Mol Cancer Ther, 2008, 7(3): 474-482. DOI:10.1158/1535-7163.MCT-07-0457 |
| [12] |
魏静, 冯跃平, 郑茜, 等. 双香豆素体外抗肿瘤活性筛选及相关机制初探[J]. 药学学报, 2020, 55(12): 2904-2910. WEI J, FENG Y P, ZHENG X, et al. Anti-tumor activity screening and research on the primary mechanism of dicumarol in vitro[J]. Acta Pharmaceutica Sinica, 2020, 55(12): 2904-2910. (in Chinese) |
| [13] |
CHEN C H, HSIEH Y C, YANG P M, et al. Dicoumarol suppresses HMGA2-mediated oncogenic capacities and inhibits cell proliferation by inducing apoptosis in colon cancer[J]. Biochem Res Commun, 2020, 524(4): 1003-1009. DOI:10.1016/j.bbrc.2020.01.147 |
| [14] |
CHENG S T, HU J L, REN J H, et al. Dicoumarol, an NQO1 inhibitor, blocks cccDNA transcription by promoting degradation of HBx[J]. J Hepatol, 2021, 74(3): 522-534. DOI:10.1016/j.jhep.2020.09.019 |
| [15] |
LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the method[J]. Methods, 2001, 25(4): 402-408. DOI:10.1006/meth.2001.1262 |
| [16] |
SCORTTI M, PRIETO C, ÁLVAREZ E, et al. Failure of an inactivated vaccine against porcine reproductive and respiratory syndrome to protect gilts against a heterologous challenge with PRRSV[J]. Vet Rec, 2007, 161(24): 809-813. |
| [17] |
ROSE N, RENSON P, ANDRAUD M, et al. Porcine reproductive and respiratory syndrome virus (PRRSv) modified-live vaccine reduces virus transmission in experimental conditions[J]. Vaccine, 2015, 33(21): 2493-2499. DOI:10.1016/j.vaccine.2015.03.040 |
| [18] |
HOLTKAMP D J, KLIEBENSTEIN J B, NEUMANN E J, et al. Assessment of the economic impact of porcine reproductive and respiratory syndrome virus on United States pork producers[J]. J Swine Health Prod, 2013, 21(2): 72-84. |
| [19] |
KHATUN A, SHABIR N, SEO B J, et al. The attenuation phenotype of a ribavirin-resistant porcine reproductive and respiratory syndrome virus is maintained during sequential passages in pigs[J]. J Virol, 2016, 90(9): 4454-4468. DOI:10.1128/JVI.02836-15 |
| [20] |
BEN-SHABAT S, YARMOLINSKY L, PORAT D, et al. Antiviral effect of phytochemicals from medicinal plants: applications and drug delivery strategies[J]. Drug Deliv Trans Res, 2020, 10(2): 354-367. DOI:10.1007/s13346-019-00691-6 |
| [21] |
SUN C, ZHAO W W, WANG X M, et al. A pharmacological review of dicoumarol: an old natural anticoagulant agent[J]. Pharmacol Res, 2020, 160: 105193. DOI:10.1016/j.phrs.2020.105193 |
| [22] |
WISHART J H, CHAPMAN C B. Dicumarol therapy in congestive heart failure[J]. N Engl J Med, 1948, 239(19): 701-704. DOI:10.1056/NEJM194811042391902 |
| [23] |
徐梦娴, 李明凯, 涂忠忠, 等. 香豆素化合物体内外抗狂犬病病毒的效果[J]. 中国兽医学报, 2019, 39(2): 250-259. XU M X, LI M K, TU Z Z, et al. Inhibition of rabies virus by coumarin in vitro and in vivo[J]. Chinese Journal of Veterinary Science, 2019, 39(2): 250-259. (in Chinese) |
| [24] |
陈绪林, 安利伟. 双香豆素在制备治疗或预防流感病毒感染的药物中的应用: 中国, 103720687A[P]. 2014-04-16. CHEN X L, AN L W. Application of bicoumarins in the preparation of drugs for the treatment or prevention of influenza virus infection: CN, 103720687A[P]. 2014-04-16. (in Chinese) |
(编辑 孟培)



