2. 陕西省动物遗传育种与繁殖重点实验室, 杨凌 712100
2. Key Laboratory of Animal Genetics, Breeding and Reproduction of Shaanxi Province, Yangling 712100, China
生猪养殖场的经济效益很大程度上由母猪的生产成绩决定。母猪繁殖效率越高其年生产力越高,为养殖场创造的价值就越多[1]。排卵数对猪的产仔数具有决定性的影响[2],一般排卵率高的母猪平均窝产仔数更高[3]。卵巢卵泡的发育受严格的动态调控,颗粒细胞作为卵泡中主要的体细胞群,为卵母细胞的生长和成熟[4]提供营养物质和稳定的内环境[5]。哺乳动物卵巢中,只有1%的卵泡发育排卵,其余99%的卵泡在发育过程中闭锁[6],而颗粒细胞凋亡是卵泡闭锁的主要原因。因此,研究卵巢颗粒细胞凋亡调控机制对进一步解析卵泡发育,提高动物繁殖力具有重要的意义。
FGF21近些年在糖脂代谢方面成为研究热点,甚至有学者认为FGF21的发现可媲美科学家对胰岛素的发现[7]。FGF21是一种非经典的成纤维细胞生长因子,主要作为内分泌激素发挥作用,向全身不同的靶组织发出信号[8]。最近研究表明,FGF21在脂肪细胞中以自分泌方式在调节白色脂肪棕色化过程中发挥重要作用[9-11]。FGF21通过结合成纤维细胞生长因子受体1C(fibroblast growth factor receptor 1C, FGFR1C)和辅助受体β-klotho(KLB)形成受体复合物激活下游信号通路[12]。FGFR1C在多种组织中广泛表达,而KLB主要在特定的代谢组织(例如:肝、胰、脂肪组织、大脑和卵巢)表达[13-15]。除此之外,研究发现FGF21辅助受体KLB在猪卵巢中有较强的表达并且在成熟卵丘卵母细胞复合体(cumulus-oocyte complex, COC)中比未成熟COC中表达更高[15]。
FGF21调控雌性动物生殖功能的相关研究不多。肝过表达FGF21小鼠初情期延迟[16],但饲喂高脂饮食可以恢复其生育能力[17]。研究人员使用KLB敲除小鼠模型研究发现,KLB敲除后FGF21引起的促进促性腺激素释放激素(gonadotropin-releasing hormone,GnRH)的分泌作用消失,表现出与FGF21过表达小鼠类似的特征,即初情期被推迟,发情周期紊乱,卵泡发育受阻[18]。此外,也有研究发现FGF21通过影响脂联素的分泌,间接调节啮齿动物卵巢原始卵泡的激活[19]。FGF21作为一种“线粒体因子(mitokine)”[20]可改善受损线粒体功能并减少器官炎症和脑细胞凋亡的发生[21-23]而影响全身代谢。然而,FGF21对哺乳动物卵巢颗粒细胞凋亡的作用鲜有报道。因此,本研究利用体外培养的猪卵巢颗粒细胞,探讨FGF21对颗粒细胞凋亡的影响及其可能的调控机制,旨在为提高母猪繁殖力提供理论依据。
1 材料与方法 1.1 试验材料1.1.1 主要试剂 DMEM/F12培养基、青霉素和链霉素购自武汉赛维尔生物公司,胎牛血清FBS、X-treme-GENE siRNA转染试剂(Roche)购自Sigma公司,FGF21 siRNA和阴性对照(NC)序列设计均由广州锐博公司完成,FGF21重组蛋白(rFGF21)购自北京义翘神州公司,0.25%不含EDTA的胰蛋白酶购自Gibco公司,TRIzol试剂和反转录试剂盒购自TaKaRa公司,凋亡检测试剂盒(Annexin V-FITC/PI Apoptosis Detection Kit)购自诺唯赞公司。
1.1.2 主要仪器 CO2细胞培养箱(Thermo Fisher),实时定量分析仪StepOne Real-Time PCR Machine (Biosystems),流式细胞仪(BD),凝胶成像系统(BIO-RAD),多功能酶标仪(Thermo Fisher),超声波破碎仪(Thermo Fisher),NanoDrop 2000分光光度计(Thermo Fisher)。
1.2 试验方法1.2.1 猪卵巢颗粒细胞分离和培养 在杨凌本香屠宰厂采集成熟长白母猪((8±1)月龄)新鲜卵巢组织(n=30),立即放入含有100 IU·mL-1青霉素、100 μg·mL-1链霉素的37 ℃生理盐水中。每次试验保证采集新鲜卵巢在2 h内运回实验室,用75%酒精清洗卵巢表面2~3次后用提前预热的含有100 IU·mL-1青霉素、100 μg·mL-1链霉素的37 ℃生理盐水清洗3~4次,并浸泡在恒温的37 ℃生理盐水中。使用20号针头的注射器穿刺位于卵巢表面的窦状卵泡(直径3~6 mm)收集卵泡液,收集的卵泡液静置5 min后,将上层卵泡液转移至新的离心管中800×g离心8 min,弃掉上清,用PBS重悬下层颗粒细胞沉淀,800×g离心5 min。然后将颗粒细胞在含有10%胎牛血清(FBS)的DMEM/F12(Servicebio,武汉,中国)培养基中重悬。按照相应密度要求接种到细胞培养板中,并在37 ℃,5% CO2的细胞培养箱中培养[24]。
1.2.2 RNA干扰 FGF21 siRNA和阴性对照(NC)序列设计由锐博(中国广州)完成。猪si-FGF21的靶序列是:ATGGCTACAACGTTTACCA,NC-siRNA的序列为:UUCUCCGAACGUGUCACGU。在细胞生长至40%~50%的密度进行转染试验。所有转染程序均按照X-treme-GENE siRNA转染试剂(Roche)使用说明书进行。FGF21 siRNA处理细胞24 h后,收集细胞暂时储存于-80 ℃用于后续检测。
1.2.3 重组蛋白FGF21(rFGF21)处理 颗粒细胞在细胞密度达到40%~50%时,用不同浓度(0、0.1、1和10 ng·mL-1)的FGF21重组蛋白(rFGF21)(Sino Biological;50421-M08H)处理细胞。rFGF21处理细胞24 h后,收集细胞暂时储存于-80 ℃用于后续检测。
1.2.4 实时荧光定量PCR 使用TRIzol试剂(TaKaRa,Otsu,Japan)从颗粒细胞中提取总RNA,并使用NanoDrop 2000分光光度计(Thermo Fisher Scientific,Waltham,MA,USA)测定浓度。使用反转录试剂盒(TaKaRa)将总RNA(500 ng)逆转录为cDNA。使用SYBR Primer RT-PCR试剂盒在实时定量分析仪StepOne Real-Time PCR Machine (Applied Biosystems, Carlsbad, CA, USA)上进行。通过熔解曲线分析验证每个PCR扩增的特异性,β-actin基因被用作管家基因来标准化其他基因的表达水平。采用2-ΔΔCt算法估计每个基因的相对表达水平。用于qRT-PCR的引物序列见表 1。
|
|
表 1 qRT-PCR引物序列信息 Table 1 qRT-PCR primers sequence information |
1.2.5 流式细胞术检测细胞凋亡 根据早期凋亡检测试剂盒(Annexin V-FITC/PI Apoptosis Detection Kit,Vazyme Biotech)说明书操作。简而言之,用0.25%不含EDTA的胰蛋白酶(Gibco)消化6孔板中的贴壁细胞,并在4 ℃下用Annexin V-FITC避光孵育10 min,再用碘化丙啶(Propidium Iodide, PI)避光孵育5 min。流式细胞仪上机检测:右上方象限(Annexin V+/PI+,晚期凋亡细胞),右下方象限(Annexin V+/PI-,早期凋亡细胞),左上方象限(Annexin V-/PI+,死细胞),左下方象限(Annexin V-/PI-,活细胞)。
1.2.6 总蛋白提取和Western blot检测 细胞总蛋白提取需要在细胞板中加入蛋白裂解液(含有蛋白酶抑制剂和磷酸酶抑制剂),在冰上裂解30 min,之后收集细胞与裂解液至离心管中,4 ℃,12 000 r·min-1离心10 min,收集上清液,弃掉细胞碎片沉淀。使用少量蛋白悬液,按BCA蛋白测定说明书测定蛋白浓度。最后蛋白悬液中加入1/5体积的5×溴酚蓝上样缓冲液,水浴煮沸10 min后,将总蛋白在SDS-聚丙烯酰胺凝胶中电泳,然后转移至PVDF膜(Millipore Corporation)。在5%脱脂牛奶中室温封闭2 h后,使用TBST清洗3遍,将膜浸泡于对应的一抗:B淋巴细胞瘤2蛋白(B-cell lymphoma 2,BCL2,Cat# ab32370,Abcam),BCL2相关X蛋白(BCL2 associated X protein,BAX,Cat# ab104156,Abcam)和线粒体氧化磷酸化复合物(mito- chondrial oxidative phosphorylation,OxPhos,Cat#ab110413,Abcam),4 ℃孵育过夜,再用TBST清洗3遍,之后使用对应的二抗孵育70 min,用TBST清洗3遍后,使用ECL化学发光液(Millipore)及凝胶成像系统(BIO-RAD)检测免疫标记,使用Image J进行图像分析。
1.2.7 线粒体Mito-Tracker Green标记检测 PBS清洗细胞2次,加入1 mmol·L-1 Mito-Tracker Green(M7514,ThermoFisher,1∶10 000稀释到培养基中)37 ℃孵育25 min,用PBS清洗3次。使用多功能酶标仪检测荧光强度。
1.2.8 线粒体DNA拷贝数检测 使用动物细胞基因组DNA提取试剂盒(D1700,索莱宝)提取颗粒细胞基因组DNA。利用单拷贝核基因GCG作为内参基因,COX1α为线粒体基因。mtDNA拷贝数根据COX1α与核基因(GCG)的DNA丰度比计算得出。
1.2.9 ATP浓度检测 使用增强型ATP检测试剂盒(S0027,碧云天)检测细胞ATP水平。吸除培养液,按照6孔板每孔加入200 μL裂解液,裂解细胞。12 000 g离心5 min,取上清待测。将配置好的ATP标准溶液(4 μL)和待测液(4 μL)与ATP检测工作液(100 μL)混匀,迅速用多功能酶标仪检测化学发光度。样品裂解全程在冰上操作。
1.2.10 总抗氧化活性(T-AOC)检测 使用总抗氧化能力(T-AOC)测定试剂盒(A015-2-1 ABTS法;南京建成)检测细胞总抗氧化能力。简言之,冷PBS清洗细胞2次,用细胞刮板收集细胞,加入200 μL PBS用超声波破碎仪破碎细胞并释放其中的抗氧化物,4 ℃,1 000 r · min-1离心5 min,取上清测定。
1.2.11 活性氧(ROS)检测 使用活性氧(ROS)测定试剂盒(E004化学荧光法;南京建成)检测细胞活性氧水平。简言之,PBS洗涤细胞2次,加入0.25% 胰蛋白酶将细胞消化收集到1.5 mL离心管中,1 000 r · min-1离心5 min,弃掉上清,加入50 μmol·L-1 DCFH-DA探针37 ℃孵育30 min。用PBS离心洗涤2次,通过多功能酶标仪检测荧光强度。
1.3 数据分析所有试验至少重复3次,每组设置重复3个以上,数据均通过Graphpad Prism软件进行绘图和统计分析,结果表示为“平均值±标准误差”。使用Multiple t-test统计来分析显著性(*P < 0.05,**P < 0.01,***P < 0.001)
2 结果 2.1 干扰FGF21促进颗粒细胞凋亡为了揭示FGF21在猪卵巢颗粒细胞中的生物学功能,本研究设计并合成了FGF21小干扰siRNA序列。FGF21 siRNA被转染到颗粒细胞24 h后,通过qRT-PCR和Western blot检测FGF21的干扰效率为41%,能够有效敲低FGF21基因表达(P < 0.01)(图 1A和1B)。FGF21基因敲低后,颗粒细胞晚期凋亡细胞比例显著上升(P < 0.05),活细胞比例显著下降(P < 0.05)(图 1C和1D)。进一步通过qRT-PCR和Western blot检测发现,FGF21 siRNA处理颗粒细胞增加了促凋亡基因BAX的mRNA和蛋白水平(P < 0.05),降低了抑制凋亡基因BCL2的表达(P < 0.05)(图 1E和1F)。数据表明干扰FGF21促进了颗粒细胞凋亡。

|
A. FGF21小干扰处理颗粒细胞24 h后,收集细胞检测FGF21干扰效率;B. FGF21小干扰处理颗粒细胞24 h后,收集细胞通过Western blot检测FGF21干扰效率; C. FGF21小干扰处理颗粒细胞24 h后,收集细胞进行流式细胞术检测分析细胞凋亡情况;D. 细胞凋亡百分比分析;E. qRT-PCR检测细胞凋亡相关基因BAX和BCL2 mRNA表达水平;F. Western Blot检测细胞凋亡相关基因BAX和BCL2蛋白表达水平 A. GCs were transfected with FGF21 siRNA or scramble control siRNA for 24 h, then collected to detect the efficiency of FGF21 interference; B. GCs were transfected with FGF21 siRNA or scramble control siRNA for 24 h, then collected to detect the efficiency of FGF21 interference by Western blot; C. GCs were transfected with FGF21 siRNA or scramble control siRNA for 24 h, then collected for cell apoptosis analysis; D. Quantification analysis of the percentage of GCs apoptosis in C; E. qRT-PCR detection of apoptosis-related genes BAX and BCL2 mRNA expression levels; F. Western blot detection of apoptosis-related genes BAX and BCL2 protein expression levels 图 1 干扰FGF21对颗粒细胞凋亡的影响 Fig. 1 Effect of interfering with FGF21 on apoptosis of granulosa cells |
为了进一步确认FGF21对颗粒细胞凋亡的作用,本研究用不同浓度(0、0.1、1、10 ng·mL-1)的FGF21重组蛋白(rFGF21)处理颗粒细胞24 h。通过流式细胞术和凋亡相关基因的表达检测发现,rFGF21处理颗粒细胞显著降低了早期凋亡细胞比例(P < 0.05)(图 2A和2B)。并且rFGF21以剂量依赖性的方式增加了抗凋亡相关基因BCL2的mRNA和蛋白表达(图 2C-E)。同时,降低了促凋亡相关基因BAX的mRNA和蛋白表达(图 2C-E)。这些数据表明FGF21抑制颗粒细胞凋亡。
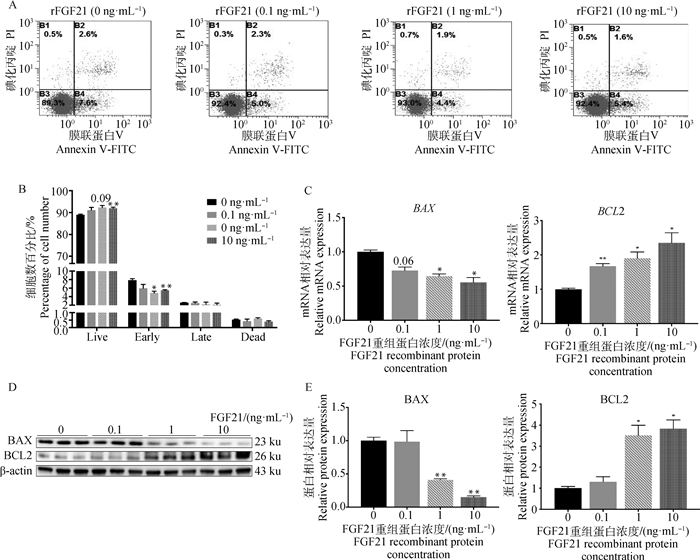
|
A. 不同浓度重组蛋白FGF21(0、0.1、1、10 ng·mL-1)处理颗粒细胞24 h,收集细胞进行流式细胞术检测细胞凋亡;B. 细胞凋亡百分比分析;C. qRT-PCR检测细胞凋亡相关基因BAX和BCL2 mRNA表达水平;D. Western Blot检测细胞凋亡相关基因BAX和BCL2蛋白表达水平;E. 图D的定量分析 A. GCs were exposed to rFGF21 (0, 0.1, 1, 10 ng·mL-1) for 24 h and then collected for cell apoptosis analysis; B. Quantification analysis of the percentage of GCs apoptosis in A; C. qRT-PCR detection of apoptosis-related genes BAX and BCL2 mRNA expression levels; D. Western blot detection of apoptosis-related genes BAX and BCL2 protein expression levels; E. Quantitation analysis of the protein levels in D 图 2 重组蛋白FGF21处理对颗粒细胞凋亡的影响 Fig. 2 Effects of recombinant protein FGF21 treatment on apoptosis of granulosa cells |
细胞凋亡是细胞程序性死亡的主要形式[25],调控细胞凋亡的信号通路主要有两种:细胞凋亡外在(也称为死亡受体)通路和细胞凋亡内在(线粒体)通路[26]。干扰FGF21后,Western blot检测线粒体氧化磷酸化复合物发现,复合物II SDHB表达显著被抑制(P < 0.05)(图 3A和3B)。采用Mito-Tracker Green进行线粒体染色,通过荧光酶标仪检测发现干扰FGF21对颗粒细胞线粒体数目没有显著影响(P=0.089 1)(图 3C),但是极显著降低了线粒体DNA拷贝数(P < 0.001)(图 3D)。进一步检测颗粒细胞ATP含量和T-AOC活性,发现FGF21敲低均导致ATP浓度和T-AOC活性极显著下降(P < 0.01)(图 3E和3F);而活性氧(ROS)水平显著升高(P < 0.05)(图 3G)。通过mRNA检测超氧化物歧化酶(superoxide dismutase,SOD)发现,FGF21敲低导致SOD表达显著降低(P < 0.05)(图 3H)。检测线粒体生物合成过程中的关键基因mRNA水平发现,NADH-脱氧酶亚基3(NADH-dehydrogenase subunit 3,ND3)和细胞色素C氧化酶亚型2(cytochrome C oxidase subunit II,COX2)的表达被显著降低(P < 0.05)(图 3I和3J),细胞色素C氧化酶亚型3(cytochrome C oxidase subunit III,COX3)和细胞色素B(cytochrome B,Cytb)的表达水平没有发生显著变化(图 3K和3L)。以上结果说明,敲低FGF21降低了颗粒细胞线粒体生物合成以及破坏了细胞内氧化还原系统的平衡导致了颗粒细胞凋亡的发生。

|
A. FGF21小干扰处理颗粒细胞24 h后,收集细胞进行Western blot检测线粒体氧化磷酸化复合物的表达;B. SDHB蛋白表达的定量分析;C. FGF21小干扰处理颗粒细胞24 h后,Mito-tracker Green染色通过荧光酶标仪检测线粒体数目的差异;D. 提取颗粒细胞DNA进行线粒体DNA拷贝数检测;E. FGF21小干扰处理颗粒细胞24 h后,进行细胞内ATP浓度检测;F. 细胞总抗氧化(T-AOC)活性检测;G. 细胞活性氧(ROS)水平检测;H. qRT-PCR检测细胞内SOD的mRNA表达水平;I. qRT-PCR检测细胞内ND3的mRNA表达水平;J. qRT-PCR检测细胞内COX2的mRNA表达水平; K. qRT-PCR检测细胞内COX3的mRNA表达水平; L. qRT-PCR检测细胞内Cytb的mRNA表达水平 A.GCs were transfected with FGF21 siRNA or scramble control siRNA for 24 h, then collected for Western blot to detect the expression of mitochondrial oxidative phosphorylation complexes; B. Quantitative analysis of SDHB protein expression; C. Mito-tracker Green staining was used to detect the difference in the number of mitochondria by fluorescence microplate reader after FGF21 siRNA treatment of granulosa cells for 24 h; D. Extraction of granulosa cell DNA for mitochondrial DNA copy number detection; E. After 24 h of FGF21 siRNA treatment of granulosa cells, the intracellular ATP concentration was detected; F. Detection of total cellular antioxidant (T-AOC) activity; G. Detection of cellular reactive oxygen species (ROS) levels; H. Detection of SOD mRNA expression by qRT-PCR; I. qRT-PCR detection of intracellular mRNA expression level of ND3; J. qRT-PCR to detect the mRNA expression level of COX2; K. qRT-PCR to detect the mRNA expression level of COX3; L. The mRNA expression level of Cytb was detected by qRT-PCR 图 3 干扰FGF21对颗粒细胞线粒体功能的影响 Fig. 3 Effects of interfering with FGF21 on mitochondrial function in granulosa cells |
为了进一步验证FGF21抑制颗粒细胞凋亡与线粒体功能之间的关系,不同浓度(0、0.1、1、10 ng·mL-1) 的重组蛋白FGF21处理细胞24 h。Western blot检测线粒体氧化磷酸化复合物水平发现,当重组蛋白FGF21添加浓度为1和10 ng·mL-1时,复合物II SDHB表达水平显著升高(P < 0.05)(图 4A和4B)。采用Mito-Tracker Green进行线粒体染色,通过荧光酶标仪检测发现当FGF21重组蛋白添加浓度为1和10 ng·mL-1时,颗粒细胞线粒体数目显著增加(P < 0.05)(图 4C),同时显著增加了线粒体DNA拷贝数(P < 0.05)(图 4D)。进一步检测发现,FGF21重组蛋白添加导致ATP浓度和T-AOC活性呈浓度依赖型上升(P < 0.05)(图 4E和4F);而活性氧(ROS)水平显著降低(P < 0.05)(图 4G)。通过mRNA检测超氧化物歧化酶(superoxide dismutase,SOD)发现,FGF21重组蛋白处理导致SOD表达显著增加(P < 0.05)(图 4H)。线粒体生物合成过程中的关键基因ND3、COX2和COX3的mRNA表达水平显著增加(P < 0.05)(图 4I-K),然而Cytb的mRNA表达水平没有发生显著变化(图 4L)。以上结果说明,重组蛋白FGF21促进了颗粒细胞线粒体生物合成并且维持了细胞内氧化还原系统的平衡从而抑制了颗粒细胞凋亡的发生。

|
A. 不同浓度FGF21重组蛋白(0、0.1、1、10 ng·mL-1)处理颗粒细胞24 h后,收集细胞进行Western blot检测线粒体氧化磷酸化复合物的表达;B. SDHB蛋白表达的定量分析;C. 不同浓度FGF21重组蛋白(0、0.1、1、10 ng·mL-1)处理颗粒细胞24 h后,Mito-tracker Green染色通过荧光酶标仪检测线粒体数目的差异;D. 提取颗粒细胞DNA进行线粒体DNA拷贝数检测;E. 不同浓度FGF21重组蛋白(0、0.1、1、10 ng·mL-1)处理颗粒细胞24 h后,进行细胞内ATP浓度检测;F. T-AOC活性检测;G. 细胞活性氧(ROS)水平检测;H. qRT-PCR检测细胞内SOD的mRNA表达水平;I. qRT-PCR检测细胞内ND3的mRNA表达水平;J. qRT-PCR检测细胞内COX2的mRNA表达水平; K. qRT-PCR检测细胞内COX3的mRNA表达水平; L. qRT-PCR检测细胞内Cytb的mRNA表达水平 A. After granulosa cells were treated with different concentrations of FGF21 recombinant protein (0, 0.1, 1, 10 ng·mL-1) for 24 h, the cells were collected for Western blot to detect the expression of mitochondrial oxidative phosphorylation complexes; B. Quantitative analysis of SDHB protein expression; C. After treating granulosa cells with different concentrations of FGF21 recombinant protein (0, 0.1, 1, 10 ng·mL-1) for 24 h, Mito-tracker Green staining was used to detect the difference in the number of mitochondria by fluorescence microplate reader; D. Extraction of granulosa cell DNA for mitochondrial DNA copy number detection; E. After granulosa cells were treated with different concentrations of FGF21 recombinant protein (0, 0.1, 1, 10 ng·mL-1) for 24 h, the intracellular ATP concentration was detected; F. Detection of T-AOC activity; G. Detection of ROS levels; H. Detection of SOD mRNA expression by qRT-PCR; I. qRT-PCR detection of intracellular mRNA expression level of ND3; J. qRT-PCR to detect the mRNA expression level of intracellular COX2; K. qRT-PCR to detect the mRNA expression level of intracellular COX3; L. The mRNA expression level of intracellular Cytb was detected by qRT-PCR 图 4 重组蛋白FGF21对颗粒细胞线粒体功能的影响 Fig. 4 Effects of recombinant protein FGF21 on mitochondrial function in granulosa cells |
本研究采用细胞流式术检测发现,通过RNAi技术敲低颗粒细胞中FGF21基因表达后增加了晚期凋亡细胞比例。然而使用不同浓度的重组蛋白FGF21(0、0.1、1、10 ng·mL-1)处理颗粒细胞后,添加浓度为1和10 ng·mL-1组显著降低了早期凋亡的细胞比例。FGF21发挥作用的浓度与猪血浆FGF21浓度(5.2~8.9 ng·mL-1)是一致的[27]。FGF21重组蛋白添加0.1 ng·mL-1组没有明显效果,可能是低于生理浓度效果太微弱。线粒体在细胞凋亡中的作用已得到明确证实,其主要受BCL2蛋白家族调节,包括:促细胞凋亡蛋白(BAX、BAK和BOK)、抗细胞凋亡蛋白(BCL2、BCLXL、MCL1)[28-29]。检测促凋亡基因BAX和抑凋亡基因BCL2的mRNA和蛋白水平与细胞流式术结果一致。
由于线粒体调节在控制细胞命运方面起着非常关键的作用,因此,研究人员对于探索线粒体生物发生与细胞凋亡之间关系的研究很感兴趣[30]。一般来说,细胞凋亡是由半胱天冬酶通路的激活所介导的,该通路与线粒体损伤相关,伴随着电子传递的破坏、氧化磷酸化、ATP产生和细胞氧化还原电位的变化[31]。事实上,一些研究证明线粒体生物发生与细胞凋亡之间存在负相关,即细胞凋亡通常受到线粒体生物发生抑制的影响[32]。本研究也发现在颗粒细胞中降低FGF21表达会导致线粒体损伤,包括ATP生成下降和线粒体DNA拷贝数降低,并提高了细胞内ROS水平。ROS是触发颗粒细胞凋亡所必需的[33]。过量的ROS产生使细胞氧化-抗氧化系统失衡,导致氧化应激[34]。检测发现,敲低FGF21导致细胞ROS升高后,细胞内超氧化物歧化酶(SOD)的mRNA水平显著下降,表明细胞遭受氧化应激,导致氧化-抗氧化系统失衡。然而,添加不同浓度(0、0.1、1、10 ng·mL-1)的FGF21重组蛋白则显示,细胞中ATP生成和线粒体DNA拷贝数呈浓度依赖性增加,细胞内ROS水平降低,超氧化物歧化酶(SOD)的mRNA水平显著增加。所有这些结果都是相互一致的,进一步说明FGF21对颗粒细胞线粒体功能具有调控作用。这与FGF21通过调节线粒体动力学提高间充质干细胞质量和数量的作用类似[35]。
线粒体传统上被认为是细胞通过氧化磷酸化(OxPhos)产生ATP的发电厂[36];另一方面,线粒体在细胞死亡(如细胞凋亡或坏死)以及自噬中起关键作用[20]。通过检测发现,敲低FGF21降低了线粒体氧化磷酸化复合物(OxPhos)中复合物II(SDHB)的表达。线粒体氧化磷酸化复合物II是电子进入线粒体电子传递链(ETC)的主要元素。SDHB敲除小鼠ROS水平增加,破坏了线粒体功能导致DNA氧化损伤和细胞凋亡[37]。FGF21重组蛋白的添加增加了线粒体氧化磷酸化复合物II(SDHB)的表达,降低了颗粒细胞发生凋亡的比例。
4 结论综上所述,FGF21促进了颗粒细胞线粒体生物合成以及维持了细胞内氧化-抗氧化系统的平衡从而抑制了颗粒细胞凋亡的发生。本研究为进一步揭示家畜卵泡发育潜在的调控机制提供了理论依据。
| [1] |
DISTL O. Mechanisms of regulation of litter size in pigs on the genome level[J]. Reprod Domest Anim, 2007, 42(Suppl 2): 10-16. |
| [2] |
VINET A, DROUILHET L, BODIN L, et al. Genetic control of multiple births in low ovulating mammalian species[J]. Mamm Genome, 2012, 23(11-12): 727-740. DOI:10.1007/s00335-012-9412-4 |
| [3] |
TANTASUPARUK W, TECHAKUMPHU M, DORNIN S. Relationships between ovulation rate and litter size in purebred Landrace and Yorkshire gilts[J]. Theriogenology, 2005, 63(4): 1142-1148. DOI:10.1016/j.theriogenology.2004.06.005 |
| [4] |
DUMESIC D A, MELDRUM D R, KATZ-JAFFE M G, et al. Oocyte environment: follicular fluid and cumulus cells are critical for oocyte health[J]. Fertil Steril, 2015, 103(2): 303-316. DOI:10.1016/j.fertnstert.2014.11.015 |
| [5] |
MANABE N, MATSUDA-MINEHATA F, GOTO Y, et al. Role of cell death ligand and receptor system on regulation of follicular atresia in pig ovaries[J]. Reprod Domest Anim, 2008, 43(Suppl 2): 268-272. |
| [6] |
ZHANG K, HANSEN P J, EALY A D. Fibroblast growth factor 10 enhances bovine oocyte maturation and developmental competence in vitro[J]. Reproduction, 2010, 140(6): 815-826. DOI:10.1530/REP-10-0190 |
| [7] |
KHARITONENKOV A, ADAMS A C. Inventing new medicines: The FGF21 story[J]. Mol Metab, 2014, 3(3): 221-229. DOI:10.1016/j.molmet.2013.12.003 |
| [8] |
FLIPPO K H, POTTHOFF M J. Metabolic messengers: FGF21[J]. Nat Metab, 2021, 3(3): 309-317. DOI:10.1038/s42255-021-00354-2 |
| [9] |
FISHER F M, KLEINER S, DOURIS N, et al. FGF21 regulates PGC-1α and browning of white adipose tissues in adaptive thermogenesis[J]. Genes Dev, 2012, 26(3): 271-281. DOI:10.1101/gad.177857.111 |
| [10] |
JUSTESEN S, HAUGEGAARD K V, HANSEN J B, et al. The autocrine role of FGF21 in cultured adipocytes[J]. Biochem J, 2020, 477(13): 2477-2487. DOI:10.1042/BCJ20200220 |
| [11] |
ABU-ODEH M, ZHANG Y, REILLY S M, et al. FGF21 promotes thermogenic gene expression as an autocrine factor in adipocytes[J]. Cell Rep, 2021, 35(13): 109331. DOI:10.1016/j.celrep.2021.109331 |
| [12] |
LAN T, MORGAN D A, RAHMOUNI K, et al. FGF19, FGF21, and an FGFR1/β-klotho-activating antibody act on the nervous system to regulate body weight and glycemia[J]. Cell Metab, 2017, 26(5): 709-718.e3. DOI:10.1016/j.cmet.2017.09.005 |
| [13] |
FON TACER K, BOOKOUT A L, DING X S, et al. Research resource: Comprehensive expression atlas of the fibroblast growth factor system in adult mouse[J]. Mol Endocrinol, 2010, 24(10): 2050-2064. DOI:10.1210/me.2010-0142 |
| [14] |
LIANG Q N, ZHONG L, ZHANG J L, et al. FGF21 maintains glucose homeostasis by mediating the cross talk between liver and brain during prolonged fasting[J]. Diabetes, 2014, 63(12): 4064-4075. DOI:10.2337/db14-0541 |
| [15] |
KIM E H, TAWEECHAIPAISANKUL A, RIDLO M R, et al. Effect of Klotho protein during porcine oocyte maturation via Wnt signaling[J]. Aging (Albany NY), 2020, 12(23): 23808-23821. |
| [16] |
OWEN B M, BOOKOUT A L, DING X S, et al. FGF21 contributes to neuroendocrine control of female reproduction[J]. Nat Med, 2013, 19(9): 1153-1156. DOI:10.1038/nm.3250 |
| [17] |
SINGHAL G, DOURIS N, FISH A J, et al. Fibroblast growth factor 21 has no direct role in regulating fertility in female mice[J]. Mol Metab, 2016, 5(8): 690-698. DOI:10.1016/j.molmet.2016.05.010 |
| [18] |
XU C, MESSINA A, SOMM E, et al. KLB, encoding β-Klotho, is mutated in patients with congenital hypogonadotropic hypogonadism[J]. EMBO Mol Med, 2017, 9(10): 1379-1397. DOI:10.15252/emmm.201607376 |
| [19] |
ZHUO Y, HUA L, FENG B, et al. Fibroblast growth factor 21 coordinates adiponectin to mediate the beneficial effects of low-protein diet on primordial follicle reserve[J]. EBioMedicine, 2019, 41: 623-635. DOI:10.1016/j.ebiom.2019.02.020 |
| [20] |
LEE M S. Role of mitochondrial function in cell death and body metabolism[J]. Front Biosci (Landmark Ed), 2016, 21(6): 1233-1244. DOI:10.2741/4453 |
| [21] |
JI K Q, ZHENG J F, LV J W, et al. Skeletal muscle increases FGF21 expression in mitochondrial disorders to compensate for energy metabolic insufficiency by activating the mTOR-YY1-PGC1α pathway[J]. Free Radic Biol Med, 2015, 84: 161-170. DOI:10.1016/j.freeradbiomed.2015.03.020 |
| [22] |
RESTELLI L M, OETTINGHAUS B, HALLIDAY M, et al. Neuronal mitochondrial dysfunction activates the integrated stress response to induce fibroblast growth factor 21[J]. Cell Rep, 2018, 24(6): 1407-1414. DOI:10.1016/j.celrep.2018.07.023 |
| [23] |
SA-NGUANMOO P, TANAJAK P, KERDPHOO S, et al. FGF21 improves cognition by restored synaptic plasticity, dendritic spine density, brain mitochondrial function and cell apoptosis in obese-insulin resistant male rats[J]. Horm Behav, 2016, 85: 86-95. DOI:10.1016/j.yhbeh.2016.08.006 |
| [24] |
WU G, LI C Y, TAO J L, et al. FSH mediates estradiol synthesis in hypoxic granulosa cells by activating glycolytic metabolism through the HIF-1α-AMPK-GLUT1 signaling pathway[J]. J Biol Chem, 2022, 298(5): 101830. DOI:10.1016/j.jbc.2022.101830 |
| [25] |
TUZLAK S, KAUFMANN T, VILLUNGER A. Interrogating the relevance of mitochondrial apoptosis for vertebrate development and postnatal tissue homeostasis[J]. Genes Dev, 2016, 30(19): 2133-2151. DOI:10.1101/gad.289298.116 |
| [26] |
BOCK F J, TAIT S W G. Mitochondria as multifaceted regulators of cell death[J]. Nat Rev Mol Cell Biol, 2020, 21(2): 85-100. DOI:10.1038/s41580-019-0173-8 |
| [27] |
COSTERMANS N G J, TEERDS K J, KEIJER J, et al. Follicular development of sows at weaning in relation to estimated breeding value for within-litter variation in piglet birth weight[J]. Animal, 2019, 13(3): 554-563. DOI:10.1017/S1751731118001684 |
| [28] |
SINGH R, LETAI A, SAROSIEK K. Regulation of apoptosis in health and disease: the balancing act of BCL-2 family proteins[J]. Nat Rev Mol Cell Biol, 2019, 20(3): 175-193. DOI:10.1038/s41580-018-0089-8 |
| [29] |
YOULE R J, STRASSER A. The BCL-2 protein family: opposing activities that mediate cell death[J]. Nat Rev Mol Cell Biol, 2008, 9(1): 47-59. DOI:10.1038/nrm2308 |
| [30] |
SHAO C S, ZHOU X H, MIAO Y H, et al. In situ observation of mitochondrial biogenesis as the early event of apoptosis[J]. iScience, 2021, 24(9): 103038. DOI:10.1016/j.isci.2021.103038 |
| [31] |
BURKE P J. Mitochondria, bioenergetics and apoptosis in cancer[J]. Trends Cancer, 2017, 3(12): 857-870. DOI:10.1016/j.trecan.2017.10.006 |
| [32] |
CAO C H, YU H Y, WU F, et al. Antibiotic anisomycin induces cell cycle arrest and apoptosis through inhibiting mitochondrial biogenesis in osteosarcoma[J]. J Bioenerg Biomembr, 2017, 49(6): 437-443. DOI:10.1007/s10863-017-9734-8 |
| [33] |
XU G F, LIU S, HUANG M Q, et al. Cadmium induces apoptosis of human granulosa cell line KGN via mitochondrial dysfunction-mediated pathways[J]. Ecotoxicol Environ Saf, 2021, 220: 112341. DOI:10.1016/j.ecoenv.2021.112341 |
| [34] |
SCHIEBER M, CHANDEL N S. ROS function in redox signaling and oxidative stress[J]. Curr Biol, 2014, 24(10): R453-R462. DOI:10.1016/j.cub.2014.03.034 |
| [35] |
LI X, HONG Y M, HE H W, et al. FGF21 mediates mesenchymal stem cell senescence via regulation of mitochondrial dynamics[J]. Oxid Med Cell Longev, 2019, 2019: 4915149. |
| [36] |
ABATE M, FESTA A, FALCO M, et al. Mitochondria as playmakers of apoptosis, autophagy and senescence[J]. Semin Cell Dev Biol, 2020, 98: 139-153. DOI:10.1016/j.semcdb.2019.05.022 |
| [37] |
LIU Y, PANG Y, ZHU B Q, et al. Therapeutic targeting of SDHB-mutated pheochromocytoma/paraganglioma with pharmacologic ascorbic acid[J]. Clin Cancer Res, 2020, 26(14): 3868-3880. DOI:10.1158/1078-0432.CCR-19-2335 |
(编辑 郭云雁)



