肌肉主要由肌细胞(肌纤维)组成,其对生命活动和机体健康都具有极其重要的作用。原肠形成过程中形成的中胚层经历了由上皮细胞向间充质细胞的转变,可分为轴旁中胚层、中间中胚层和侧中胚层。这一层形成了骨骼肌、心肌、大部分平滑肌、软骨、血管和骨髓。中胚层被分割成一簇一簇的细胞,称为体节,形成脊椎、躯干肌肉和皮肤真皮。卫星细胞在肌形成过程中作为前体的一个子集,也起源于这些多能的中胚层祖细胞[1-4]。骨骼肌的生长发育伴随着众多基因调控,因而从不同层面研究肌肉的生长发育调控网络有助于了解和提升动物的产肉性能。长链非编码RNA(long non-coding RNA,lncRNA)是一类长度超过200个核苷酸,编码能力弱或不具有编码潜能的RNA。研究表明,lncRNA能够通过靶向肌细胞分化和骨骼肌发育的关键调控因子参与调控成肌分化[5-6]。H19是研究者们发现的首例lncRNA,由H19/Igf2位点的母源等位基因转录而来,对肌肉的生长发育有着重要作用[7]。lncRNA-H19能够通过抑制SIRT1/FOXO1信号通路促进牛骨骼肌卫星细胞的分化[8]。lincMD1是最早在小鼠和人细胞中被鉴定的与肌细胞生成有关的lncRNA,它在成肌细胞分化时特异表达,通过作为miR-133和miR-135的内源竞争RNA(competing endogenous RNA,ceRNA)上调MEF2C和MAML的表达进而触发从早期肌肉分化到晚期肌肉分化的转换[9]。PPP1r1b-lncRNA能够通过抑制PRC2(肌源性调控基因多梳抑制复合物2)促进小鼠和人的心及骨骼肌发育[10]。lncRNA Irm能够和MEF2D直接结合,促进成肌细胞分化和再生[11]。在湖羊骨骼肌卫星细胞中,CTTN-IT1(lncRNA)能够与miR-29a竞争结合从而降低miR-29a对癌蛋白YAP1的抑制作用,促进湖羊骨骼肌卫星细胞的增殖和分化[12]。lnc-SEMT海绵吸附miR-125b后拮抗控制IGF2(胰岛素样生长因子2)的蛋白丰度,促进绵羊成肌细胞分化[13]。在牛肌肉发育过程中,IGF2能够被肌肉特异表达的lncMD上调,通过结合miR-125b从而减弱其对IGF2的抑制作用[14]。一种新型的lncRNA:IGF2 AS(胰岛素样生长因子2反义转录物),可能通过与IGF2 mRNA的前体序列结合并通过影响其表达来调节牛成肌细胞的增殖及分化。同时,深入研究表明,IGF2 AS还能够通过与白介素增强子结合因子3(ILF3)蛋白结合来调节牛骨骼肌的发育[15]。
本课题组在前期研究中通过高通量测序获得一条新的在肌肉中特异表达的lncRNA,通过RACE获得了其全长,并发现其在牛骨骼肌卫星细胞分化前后的表达量具有显著差异,推测其可能对牛肌卫星细胞的增殖分化发挥调控作用,基于此,本研究利用牛肌卫星细胞体外诱导成肌分化模型,通过干扰lncbMD在牛肌卫星细胞中的表达,研究其对牛肌卫星细胞的作用,为进一步挖掘影响牛肌肉发育的基因奠定基础。
1 材料与方法 1.1 主要材料牛骨骼肌卫星细胞由天津市农业动物繁育与健康养殖重点实验室分离冻存。
1.2 主要仪器荧光显微镜(Leica);二氧化碳培养箱(SANYO);脱色摇床(IKA);LightCycle 96实时荧光定量PCR仪(Roche);PowerPac Basic电泳仪;电泳凝胶成像系统ChemiDoc XRS+(Bio-Rad)等。
1.3 主要试剂胎牛血清(FBS)和马血清(HS)(Gibco, USA);PBS磷酸缓冲液、0.25%胰蛋白酶(Solarbio, 北京);DMEM高糖培养基(Hyclone, USA);EdU细胞增殖检测试剂盒(锐博,广州);RNA快速提取试剂盒(艾德莱,北京);PrimeScript II 1 st Strand cDNA Synthesis Kit(Takara,大连);NE-PER Nuclear and Cytoplasmic Extraction Reagents Kit(赛默飞,美国)等。
1.4 方法1.4.1 牛骨骼肌卫星细胞的复苏、传代与诱导分化 牛骨骼肌卫星细胞体外诱导成肌分化模型的建立参考天津市农业动物繁育与健康养殖重点实验室已建立的方法[16],液氮中取出细胞,37 ℃水浴迅速摇晃使细胞复苏,用等体积的增殖培养基(20%FBS+ 80%DMEM)中和,立刻转移到离心管中离心10 min(1 000 r·min-1),离心后弃上清,加3 mL增殖培养基重悬,均匀接种于60 mm细胞培养板,细胞融合度达到80%,细胞量约为1×106时传代,用胰酶进行消化,增殖培养基中和以终止消化,差速离心收集沉淀,加入增殖培养基重悬后接种于6孔板和24孔板中培养,24 h后收取增殖期细胞(GM期细胞)。细胞融合度达到80%~90%后,换分化培养基(2%HS+98%DMEM)进行体外诱导分化,培养24、48、72 h后收取分化期第1(DM1)、2(DM2)、3(DM3)天细胞。
1.4.2 PCR验证RACE扩增结果 通过cDNA末端快速扩增技术(rapid amplification of cDNA ends,RACE)得到了lncbMD的全长序列1 902 nt,用PCR技术进行验证。提取分化期第2天牛骨骼肌卫星细胞总RNA,利用PrimeScript II 1 st Strand cDNA Synthesis Kit进行cDNA第一链的合成,PCR扩增反应引物F(上游引物):GGTGAAATACCATTGAGAGA;R(下游引物):CCCAGATTATTTTTTTAGCTTC;反应体系(50 μL):TaKaRa LA Taq 0.5 μL,10×LA PCR Buffer II 5 μL,dNTP Mixture 8 μL,cDNA template 5 μL,Forward primer 2 μL,Reverse primer 2 μL,ddH2O 27.5 μL;反应程序:94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸3 min;35个循环。
1.4.3 lncbMD干扰效果检测 根据lncbMD序列设计特异性干扰RNA(ASO-SI-1:ACCGGCAGTGACTCCAGTAC,ASO-SI-2:CATGGGAAACCACCATCCTT,ASO-NC:CAAGGACCCTGTTAGACGCC),反义寡核苷酸(antisense oligonucleotide, ASO)是指长度为15~25个核苷酸的化学修饰短链核酸,依赖RNase H发挥功能,能够特异性敲降细胞质和细胞核内的RNA。ASO-lncbMD能够针对单链特异性干扰lncbMD的表达。将细胞培养于24孔板中,设置试验组和对照组,每组3个重复,细胞融合度达80%,细胞量约为1×106时参考Lipofectamine3000说明书转染ASO-lncbMD及对照。转染24 h后收取增殖期(GM)细胞,通过qRT-PCR技术检测GM期的干扰效果,并选取干扰成功的ASO-lncbMD进行后续试验。
1.4.4 EdU染色法检测细胞增殖 按Cell-LightTM EdU Apollo 567 In Vitro Kit说明操作EdU染色试验,于96孔板中培养细胞,转染24 h后对细胞进行处理,利用荧光显微镜检测阳性细胞数,每组设置3个生物学重复,荧光显微镜拍照存图,每孔至少采集5个不同视野。
1.4.5 荧光定量PCR检测基因表达 24孔板中培养细胞,收取细胞后按照试剂盒说明书提取总RNA,RNA浓度检测合格后进行反转录,将反转录后的cDNA稀释5倍,利用qRT-PCR技术检测lncbMD的mRNA表达水平以及增殖标志因子Pax7、Cyclin D1和分化标志因子MyoG、MyHC的mRNA表达水平。荧光定量PCR体系(总20 μL):cDNA 2 μL,Forward primer 0.5 μL,Reverse primer 0.5 μL,Mix 10 μL,RNase free water 7 μL。荧光定量PCR程序:95 ℃预变性60 s;:95 ℃变性10 s,61 ℃退火20 s,72 ℃延伸15 s,40个循环;熔解曲线:95 ℃ 10 s;65 ℃ 60 s;97 ℃ 1 s;冷却:37 ℃ 30 s。qRT-PCR反应引物详情见表 1。
|
|
表 1 qRT-PCR引物信息 Table 1 qRT-PCR primers information |
1.4.6 核质分离进行亚细胞定位 分别取增殖期与分化第2天的细胞,吸弃培养基,用胰酶进行消化,500×g离心5 min,PBS清洗细胞1~2次。加1 mL PBS重悬细胞,取20 μL用于细胞计数,转移1×107个细胞于1.5 mL无酶离心管中,500×g离心2~3 min后弃上清,尽量干燥细胞沉淀。加入预冷的含RNase Inhibitor的CER I,剧烈震荡15 s,冰浴10 min。加入预冷的CER II,剧烈震荡5 s,冰浴1 min。剧烈震荡5 s,4 ℃ 16 000×g离心5 min。迅速转移上清至新的1.5 mL无酶离心管中,加入700 μL裂解液,提取细胞质RNA,-80 ℃保存备用;用预冷过的PBS清洗沉淀2~3次,加入700 μL裂解液,提取细胞核RNA,-80 ℃保存备用。将提取的不同时期细胞核RNA和细胞质RNA进行反转录,后通过semi-qRT-PCR检测lncbMD在牛骨骼肌卫星细胞和肌管中的表达量。lncbMD引物信息为Pre-GAPDH上游引物:TCCCTCCACGATGCCAAAG;下游引物:GAAG-CGGGCTGATAGTGCC,产物长度143 bp;PCR反应体系(20 μL):2×Es Taq MasterMix 10 μL,模板DNA 2 μL,上游引物0.5 μL,下游引物0.5 μL,灭菌超纯水7 μL。反应条件:94 ℃预变性2 min;94 ℃变性30 s;62 ℃退火30 s,72 ℃延伸45 s,循环35次;72 ℃延伸2 min。反应完成后,称取0.6 g琼脂粉于40 mL电泳缓冲液(TAE)中,配制1.5%琼脂糖凝胶。加热后加入4 μL核酸染料,倒入凝胶槽中进行凝固。待胶凝固后放入电泳槽中,加入PCR产物,电泳10 min后进行曝光成像。
1.4.7 统计分析 每组试验均设置3个生物学重复,每个生物学重复至少采集3个技术重复或视野。qRT-PCR结果用t检验分析(SPSS),EdU细胞增殖试验采用ImageJ软件进行细胞计数、计数结果采用t检验分析(SPSS),semi-qRT-PCR结果分析采用ImageJ软件进行,“*”表示差异显著(P < 0.05),“**”表示差异极显著(P < 0.01),“N.S.”表示差异不显著(P>0.05)。
2 结果 2.1 lncbMD验证实验室前期利用超数排卵和胚胎移植技术获得了遗传背景高度一致的和牛样品,分别采集3月龄胎儿、6月龄胎儿和9月龄出生个体的肌肉样品(背腰肌、腿臀肌、肩胛肌和肋间肌)进行lncRNAs高通量测序。分析测序数据,获得一条在3个时期的牛肌肉组织中均有表达且表达量较高的lncRNA序列。提取分化期第2天牛骨骼肌卫星细胞总RNA,通过RACE获取其全长序列。最终得到该lncRNA的全长序列1 902 nt,将其命名为lncbMD。通过PCR技术进行验证,成功得到目的片段(图 1A)。通过在Ensembl数据库(http://asia.ensembl.org/)中检索发现lncbMD位于牛基因组23号染色体上,其上游基因为PKHD1,下游基因为miR-206和miR-133b(图 1B),是未曾报道的lncRNA。
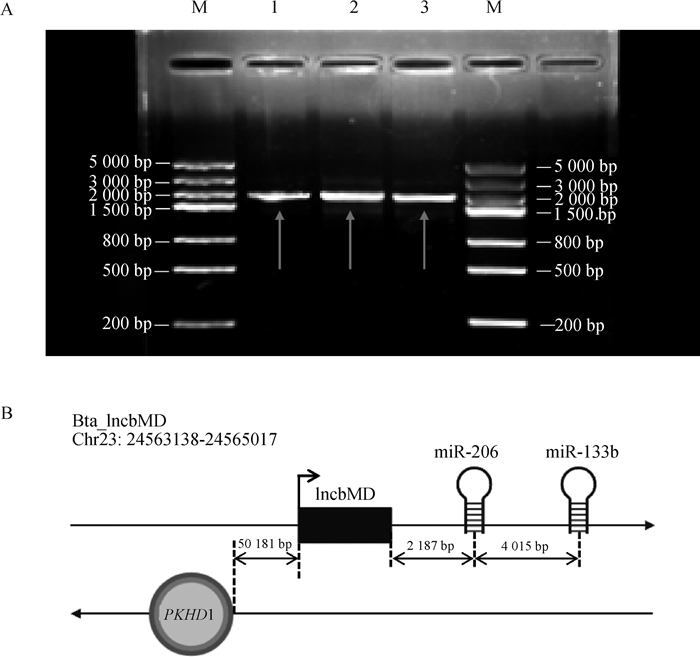
|
A. PCR验证lncbMD(M. DNA相对分子质量标准;1、2、3. 目的基因的3个重复);B. lncbMD基因组定位示意图 A. PCR validation of lncbMD (M. DL5000 DNA marker; 1, 2, 3. The 3 repeats of the target gene, respectively); B. Schematic diagram of lncbMD genome location 图 1 lncbMD全长序列的验证及其基因组定位 Fig. 1 Validation of the full-length sequence of lncbMD and its genomic location |
运用CPC(Coding Potential Calculator)在线网站预测lncbMD的编码潜能,与已知的非编码lncRNA-MEG9相比,其编码潜能更低,证明lncbMD不具有编码潜能,其中GAPDH作为可以编码的阳性对照(表 2)。
|
|
表 2 lncbMD编码潜能分析 Table 2 Coding potential analysis of lncbMD |
由于lncRNA具有不同空间特异性,亚细胞定位往往能够决定其功能。因此,采用核质分离技术分离GM期和DM2期的细胞核与细胞质RNA,通过semi-qRT-PCR检测lncbMD在牛骨骼肌卫星细胞和肌管中的表达量。semi-qRT-PCR(图 2A)和灰度量化(图 2B)结果显示,lncbMD在牛骨骼肌卫星细胞与肌管中均主要存在于细胞核。

|
A.lncbMD核质分布情况,pre-GAPDH作为核标志因子;B.琼脂糖凝胶图量化结果 A. Nuclear and cytoplasmic distribution of lncbMD, pre-GAPDH as a nuclear marker factor; B. Quantification results of agarose gel maps 图 2 lncbMD亚细胞定位 Fig. 2 Subcellular localization of lncbMD |
为鉴定lncbMD是否在成肌分化前后具有关键作用,通过qRT-PCR对lncbMD进行时间序列表达分析,结果显示(图 3),随着牛骨骼肌卫星细胞分化时间的延长,lncbMD的mRNA表达水平呈现先上升后下降的趋势,且在诱导分化第2天lncbMD的mRNA表达量最高,与增殖期相比,分化第2天及分化第3天的表达量均极显著上升(P < 0.01),表明lncbMD可能具有调控牛骨骼肌卫星细胞成肌分化的作用。
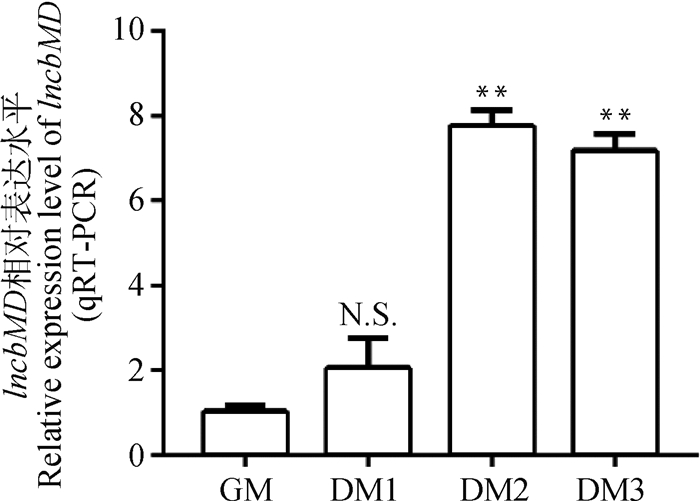
|
*.P < 0.05; **.P < 0.01; N.S..P>0.05。下同 *.P < 0.05; **.P < 0.01; N.S..P>0.05. The same as below 图 3 lncbMD时间序列表达谱 Fig. 3 Time series expression profile of lncbMD |
构建牛骨骼肌卫星细胞抑制表达模型,对牛骨骼肌卫星细胞进行转染ASO-SI-1和ASO-SI-2处理24 h后,通过qRT-PCR对干扰效果进行分析,结果显示,与ASO-NC相比,转染ASO-SI-2后lncbMD的表达量极显著下降(P < 0.01)(图 4A),因此选用ASO-SI-2进行后续的干扰处理。干扰24 h后通过EdU细胞增殖试验检测细胞的增殖情况,qRT-PCR检测增殖期细胞中lncbMD和增殖标志因子Pax7、Cyclin D1的mRNA水平变化。结果显示,转染ASO-lncbMD后lncbMD的mRNA表达水平极显著降低(P < 0.01),增殖标志因子Pax7的mRNA表达水平显著升高(P < 0.05)(图 4B),EdU阳性细胞率显著上升(P < 0.05)(图 4C-D),倒置显微镜观察细胞生长状态(图 4E),表明干扰lncbMD后促进牛骨骼肌卫星细胞增殖。
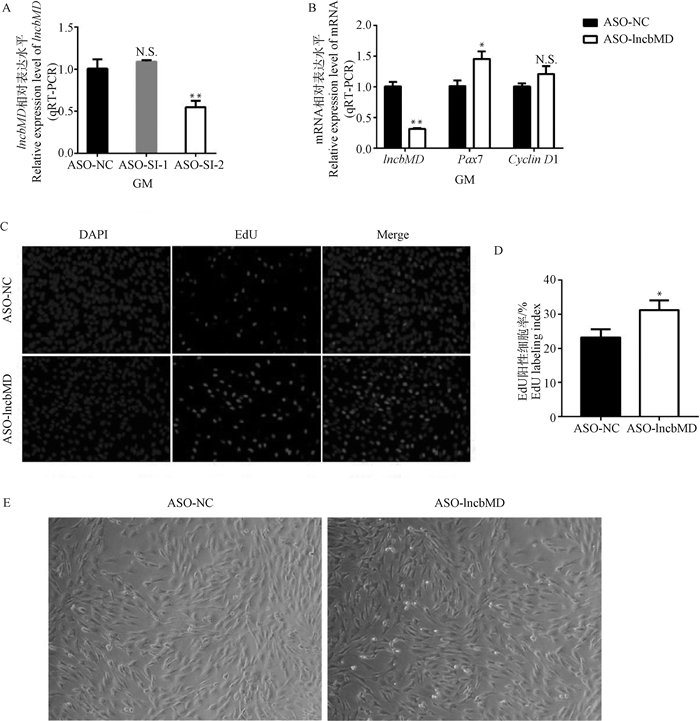
|
A.干扰效果分析;B.干扰lncbMD后细胞增殖标志因子的mRNA表达水平检测;C. GM期牛骨骼肌卫星细胞EdU染色(200×);D. EdU标记指数,以阳性细胞核数/总细胞核数表示;E.转染ASO-lncbMD与ASO-NC 24 h后,倒置显微镜观察细胞生长状态(200×) A. Analysis of interference effect; B. Detection of mRNA expression levels of cell proliferation marker factors after interfering with lncbMD; C. EdU staining of bovine skeletal muscle satellite cells at GM stage (200×); D. EdU labeling index, expressed as the number of positive cell nuclei/the total number of nuclei; E. After 24 h transfection of ASO-lncbMD and ASO-NC, the cell growth state was observed by an inverted microscope (200×) 图 4 干扰lncbMD对牛骨骼肌卫星细胞增殖的影响 Fig. 4 Effects of interfering lncbMD on the proliferation of bovine skeletal muscle satellite cells |
转染ASO-lncbMD处理牛骨骼肌卫星细胞72 h后,qRT-PCR检测细胞中lncbMD与分化标志因子MyHC、MyoG的mRNA表达水平变化,显微镜观察细胞成肌分化后的肌管形态。转染ASO-lncbMD 72 h后,lncbMD的mRNA表达水平极显著降低(P < 0.01),分化标志因子MyoG、MyHC的mRNA表达水平无显著变化(P>0.05)(图 5A),倒置显微镜下观察干扰lncbMD组与对照组,肌管分化状态无显著变化(图 5B)。结果表明,干扰lncbMD对牛骨骼肌卫星细胞的分化无显著影响。
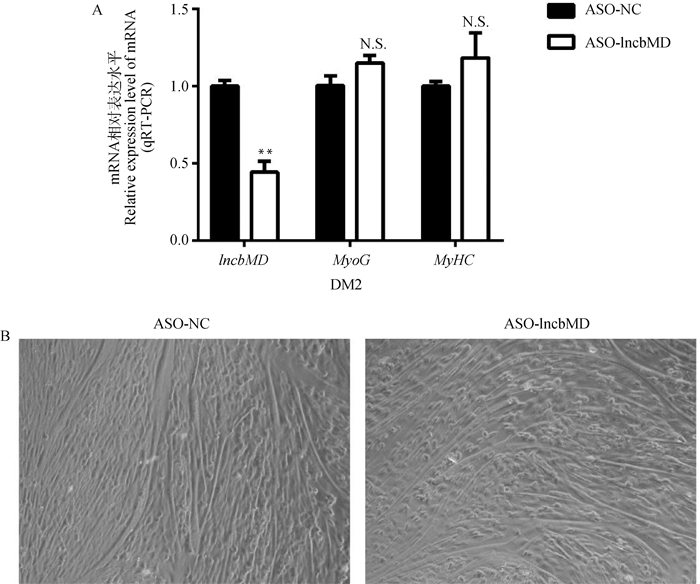
|
A.干扰lncbMD后细胞分化标志因子的mRNA表达水平检测;B. 转染ASO-lncbMD与ASO-NC 72 h后,倒置显微镜观察细胞生长状态(200×) A. Detection of mRNA expression of cell differentiation marker factors after interfering with lncbMD; B. After 72 h transfection of ASO-lncbMD and ASO-NC, the cell growth state was observed by an inverted microscope (200×) 图 5 干扰lncbMD对牛骨骼肌卫星细胞分化的影响 Fig. 5 Effect of interfering lncbMD on differentiation of bovine skeletal muscle satellite cells |
在肉用畜禽躯体中约有一半为骨骼肌,且肉类在畜禽生产中占据主要地位,研究骨骼肌的生长发育在生产工作中有重要意义[17],卫星细胞是位于肌纤维质膜和基底膜之间的肌肉干细胞[18],骨骼肌受损后,卫星细胞被激活,进入增殖分化进程,最后形成新的肌纤维[19],Pax(Paried box)基因家族是与发育相关的转录因子,Pax7属于该基因家族第III组,是在卫星细胞中表达的标志性基因,能够作为肌生成的上游调节因子[20],所有卫星细胞都表达转录因子Pax7,它是肌肉卫星细胞维持和再生能力不可或缺的因子,对骨骼肌的发育具有重要作用,尤其是在骨骼肌受损伤时的修复中发挥作用[21]。
研究人员构建了大量可靠的lncRNA数据库,其中人和小鼠的信息最为详尽。家畜家禽等动物的lncRNA研究大多还只处于鉴定阶段,对其在畜牧生产中的功能知之甚少。目前为止,在牛上进行肌肉lncRNA研究公开发表的国际性报道为数不多,因而开展牛lncRNA调控肌肉生长发育的研究很有必要。lncRNA的表达水平通常较低,与编码基因相比,其具有较高的组织、时间特异性和较低的序列保守性等特点[22]。近年来,越来越多的证据表明,包括lncRNAs等在内的非编码RNA广泛参与到如卫星细胞的激活、增殖、分化和自我更新等骨骼肌发生过程中基因表达的调控,其异常表达严重影响了骨骼肌的发育和多种肌肉疾病[23-24]。大量的lncRNA在肌肉中被识别,但只有部分lncRNA在肌肉生长发育过程中的功能和机制被研究。所以本研究探究了一条肌肉特异高表达lncRNA对牛骨骼肌卫星细胞的影响,通过cDNA末端快速扩增技术得到其全长1 902 nt,命名为lncbMD。编码能力预测显示lncbMD不具有编码能力,生物信息学分析显示lncbMD位于牛基因组23号染色体上。qRT-PCR检测结果显示,lncbMD在牛骨骼肌卫星细胞分化进程中的表达量呈现先上升后下降的趋势,且在诱导分化的第2天表达量最高,暗示lncbMD可能对牛骨骼肌细胞具有调控作用。由于lncRNAs的表达具有空间特异性,亚细胞定位通常能够决定其功能。采用核质分离技术分离了GM期和DM2期的细胞质与细胞核RNA,结果显示lncbMD在牛骨骼肌卫星细胞和肌管中均主要存在于细胞核。干扰牛骨骼肌卫星细胞中lncbMD的表达后,增殖标志因子Pax7的mRNA表达水平显著上升,EdU细胞阳性率显著上升,由此可知干扰lncbMD对牛肌卫星细胞具有相应的影响,抑制lncbMD的表达能够促进牛骨骼肌卫星细胞的增殖。类似的,lncRNA对其它类型细胞的增殖也有着一定影响。如lncRNA-SYISL能够与PRC2(多梳抑制性复合物2)增强子相互作用以促进C2C12细胞的增殖[25]。一条新鉴定的lncIRS1能够通过海绵作用于miR-15家族来调节胰岛素受体底物1(IRS1)的表达,从而促进鸡骨骼肌细胞增殖[26]。鸡骨骼肌细胞高表达lncEDCH1能够通过提高钙转运ATP酶(SERCA2) 的蛋白稳定性来促进成肌细胞增殖[27]。lncRNA-SIX1能够增强肌肉生长相关基因(MYOG、MYHC、MYOD、IGF1R和INSR)的表达,并编码一种以顺式调节方式影响SIX1蛋白表达的微肽,促进鸡成肌细胞增殖[28]。lncRNA-FKBP1C可以与MYH1B结合,抑制鸡成肌细胞增殖[29]。上述结果表明,lncRNA影响众多细胞的增殖,但作用效果不尽相同,这可能是由于lncRNA在不同类型的细胞中会发挥不同的作用。细胞从增殖进入分化,逐渐融合形成肌管的阶段对骨骼肌卫星细胞的修复及再生有着重要意义,一些lncRNA通过影响肌细胞的分化来参与肌肉的生长发育,例如lncR-125b能够通过海绵吸附miR-125b来促进山羊骨骼肌卫星细胞的分化[30]。敲低小鼠原代成骨细胞中lncRNA-1的表达能够抑制成骨分化,表明lncRNA-1能够促进成骨分化[31]。lncRNA Atcayos、Trp53cor1与骨骼肌发育过程中卫星细胞的肌源性分化呈正相关:抑制lncRNA Atcayos和Trp53cor1导致卫星细胞分化延迟[32]。lncMyoD通过调节MyoD对染色质的可接近性促进肌源性基因表达[33]等。本试验发现,lncbMD能够促进牛骨骼肌卫星细胞的增殖,而对牛骨骼肌卫星细胞的分化没有显著影响,具体的作用机制还需要进一步研究。
4 结论本研究获得了实验室测序发现的一条全长为1 902 nt的lncRNA序列,将其命名为lncbMD。通过试验证实lncbMD主要存在于牛骨骼肌卫星细胞和肌管的细胞核中,并随着成肌分化的进行表达水平逐渐升高;发现干扰lncbMD的表达能够促进牛骨骼肌卫星细胞的增殖,对其分化没有显著影响,初步说明lncbMD可能抑制牛骨骼肌卫星细胞的增殖。
| [1] |
PINHEIRO A, NAYA F J. The Key Lnc (RNA)s in cardiac and skeletal muscle development, regeneration, and disease[J]. J Cardiovasc Dev Dis, 2021, 8(8): 84. DOI:10.3390/jcdd8080084 |
| [2] |
WESKAMP K, OLWIN B B, PARKER R. Post-transcriptional regulation in skeletal muscle development, repair, and disease[J]. Trends Mol Med, 2021, 27(5): 469-481. DOI:10.1016/j.molmed.2020.12.002 |
| [3] |
OKSBJERG N, GONDRET F, VESTERGAARD M. Basic principles of muscle development and growth in meat-producing mammals as affected by the insulin-like growth factor (IGF) system[J]. Domest Anim Endocrinol, 2004, 27(3): 219-240. DOI:10.1016/j.domaniend.2004.06.007 |
| [4] |
CHEN B D, YOU W J, WANG Y Z, et al. The regulatory role of Myomaker and Myomixer-Myomerger-Minion in muscle development and regeneration[J]. Cell Mol Life Sci, 2020, 77(8): 1551-1569. DOI:10.1007/s00018-019-03341-9 |
| [5] |
MERCER T R, DINGER M E, MATTICK J S. Long non-coding RNAs: insights into functions[J]. Nat Rev Genet, 2009, 10(3): 155-159. DOI:10.1038/nrg2521 |
| [6] |
ULITSKY I, SHKUMATAVA A, JAN C H, et al. Conserved function of lincRNAs in vertebrate embryonic development despite rapid sequence evolution[J]. Cell, 2011, 147(7): 1537-1550. DOI:10.1016/j.cell.2011.11.055 |
| [7] |
贺健, 王飞, 张鹏, 等. 长链非编码RNA在肌肉分化发育及疾病中的研究进展[J]. 航天医学与医学工程, 2017, 30(5): 378-383. HE J, WANG F, ZHANG P, et al. Progress of research on long non-coding RNAs in muscle development and disorders[J]. Space Medicine & Medical Engineering, 2017, 30(5): 378-383. DOI:10.16289/j.cnki.1002-0837.2017.05.012 (in Chinese) |
| [8] |
XU X C, JI S Y, LI W L, et al. lncRNA H19 promotes the differentiation of bovine skeletal muscle satellite cells by suppressing Sirt1/FoxO1[J]. Cell Mol Biol Lett, 2017, 22: 10. DOI:10.1186/s11658-017-0040-6 |
| [9] |
CESANA M, CACCHIARELLI D, LEGNINI I, et al. A long noncoding RNA controls muscle differentiation by functioning as a competing endogenous RNA[J]. Cell, 2011, 147(2): 358-369. DOI:10.1016/j.cell.2011.09.028 |
| [10] |
KANG X D, ZHAO Y, VAN ARSDELL G, et al. Ppp1r1b-lncRNA inhibits PRC2 at myogenic regulatory genes to promote cardiac and skeletal muscle development in mouse and human[J]. RNA, 2020, 26(4): 481-491. DOI:10.1261/rna.073692.119 |
| [11] |
YONG H, WU G M, CHEN J Y, et al. lncRNA MALAT1 accelerates skeletal muscle cell apoptosis and inflammatory response in sepsis by decreasing BRCA1 expression by recruiting EZH2[J]. Mol Ther Nucl Acids, 2020, 19: 97-108. DOI:10.1016/j.omtn.2019.10.028 |
| [12] |
WU T Y, WANG S H, WANG L H, et al. Long noncoding RNA (lncRNA) CTTN-IT1 elevates skeletal muscle satellite cell proliferation and differentiation by acting as ceRNA for YAP1 through absorbing miR-29a in Hu Sheep[J]. Front Genet, 2020, 11: 843. DOI:10.3389/fgene.2020.00843 |
| [13] |
WEI C H, WU M M, WANG C D, et al. Long noncoding RNA Lnc-SEMT modulates IGF2 Expression by sponging miR-125b to promote sheep muscle development and growth[J]. Cell Physiol Biochem, 2018, 49(2): 447-462. DOI:10.1159/000492979 |
| [14] |
SUN X M, LI M X, SUN Y J, et al. The developmental transcriptome sequencing of bovine skeletal muscle reveals a long noncoding RNA, lncMD, promotes muscle differentiation by sponging miR-125b[J]. Biochim Biophys Acta (BBA) - Mol Cell Res, 2016, 1863(11): 2835-2845. DOI:10.1016/j.bbamcr.2016.08.014 |
| [15] |
SONG C C, YANG Z X, JIANG R, et al. lncRNA IGF2 AS regulates bovine myogenesis through different pathways[J]. Mol Ther Nucl Acids, 2020, 21: 874-884. DOI:10.1016/j.omtn.2020.07.002 |
| [16] |
王轶敏, 代阳, 刘新峰, 等. 牛骨骼肌卫星细胞的分离鉴定和诱导分化[J]. 中国畜牧兽医, 2014, 41(7): 142-147. WANG Y M, DAI Y, LIU X F, et al. Isolation, identification and induced differentiation of bovine skeletal muscle satellite cells[J]. China Animal Husbandry & Veterinary Medicine, 2014, 41(7): 142-147. (in Chinese) |
| [17] |
李伯江, 李平华, 吴望军, 等. 骨骼肌肌纤维形成机制的研究进展[J]. 中国农业科学, 2014, 47(6): 1200-1207. LI B J, LI P H, WU W J, et al. Progresses in research of the mechanisms of skeletal muscle fiber formation[J]. Scientia Agricultura Sinica, 2014, 47(6): 1200-1207. DOI:10.3864/j.issn.0578-1752.2014.06.017 (in Chinese) |
| [18] |
LINDSTRÖM M, TJUST A E, PEDROSA DOMELLÖF F. Pax7-positive cells/satellite cells in human extraocular muscles[J]. Invest Ophthalmol Vis Sci, 2015, 56(10): 6132-6143. DOI:10.1167/iovs.15-16544 |
| [19] |
MAVALLI M D, DIGIROLAMO D J, FAN Y, et al. Distinct growth hormone receptor signaling modes regulate skeletal muscle development and insulin sensitivity in mice[J]. J Clin Invest, 2010, 120(11): 4007-4020. DOI:10.1172/JCI42447 |
| [20] |
BUCKINGHAM M, RELAIX F. PAX3 and PAX7 as upstream regulators of myogenesis[J]. Semin Cell Dev Biol, 2015, 44: 115-125. DOI:10.1016/j.semcdb.2015.09.017 |
| [21] |
SINCENNES M C, BRUN C E, LIN A Y T, et al. Acetylation of PAX7 controls muscle stem cell self-renewal and differentiation potential in mice[J]. Nat Commun, 2021, 12(1): 3253. DOI:10.1038/s41467-021-23577-z |
| [22] |
HITACHI K, HONDA M, TSUCHIDA K. The functional role of long non-coding RNA in myogenesis and skeletal muscle atrophy[J]. Cells, 2022, 11(15): 2291. DOI:10.3390/cells11152291 |
| [23] |
LI Y Y, CHEN X N, SUN H, et al. Long non-coding RNAs in the regulation of skeletal myogenesis and muscle diseases[J]. Cancer Lett, 2018, 417: 58-64. DOI:10.1016/j.canlet.2017.12.015 |
| [24] |
ZHANG X J, CHEN M M, LIU X F, et al. A novel lncRNA, lnc403, involved in bovine skeletal muscle myogenesis by mediating KRAS/Myf6[J]. Gene, 2020, 751: 144706. DOI:10.1016/j.gene.2020.144706 |
| [25] |
JIM J J, LV W, XIA P, et al. Long noncoding RNA SYISL regulates myogenesis by interacting with polycomb repressive complex 2[J]. Proc Natl Acad Sci U S A, 2018, 115(42): E9802-E9811. |
| [26] |
LI Z H, CAI B L, ABDALLA B A, et al. LncIRS1 controls muscle atrophy via sponging miR-15 family to activate IGF1-PI3K/AKT pathway[J]. J Cachexia, Sarcopenia Muscle, 2019, 10(2): 391-410. DOI:10.1002/jcsm.12374 |
| [27] |
CAR B L, MA M T, ZHANG J, et al. LncEDCH1 improves mitochondrial function to reduce muscle atrophy by interacting with SERCA2[J]. Mol Ther Nucl Acids, 2022, 27: 319-334. DOI:10.1016/j.omtn.2021.12.004 |
| [28] |
CAI B L, LI Z H, MA M T, et al. lncRNA-Six1 encodes a micropeptide to activate Six1 in Cis and is involved in cell proliferation and muscle growth[J]. Front Physiol, 2017, 8: 230. DOI:10.3389/fphys.2017.00230 |
| [29] |
YU J A, WANG Z J, YANG X, et al. lncRNA-FKBP1C regulates muscle fiber type switching by affecting the stability of MYH1B[J]. Cell Death Discov, 2021, 7(1): 73. DOI:10.1038/s41420-021-00463-7 |
| [30] |
ZHAN S Y, QIN C Y, LI D D, et al. A novel long noncoding RNA, lncR-125b, promotes the differentiation of goat skeletal muscle satellite cells by sponging miR-125b[J]. Front Genet, 2019, 10: 1171. DOI:10.3389/fgene.2019.01171 |
| [31] |
NARDOCCI G, CARRASCO M E, ACEVEDO E, et al. Identification of a novel long noncoding RNA that promotes osteoblast differentiation[J]. J Cell Biochem, 2018, 119(9): 7657-7666. DOI:10.1002/jcb.27113 |
| [32] |
QI X L, HU M Y, XIANG Y, et al. LncRNAs are regulated by chromatin states and affect the skeletal muscle cell differentiation[J]. Cell Prolif, 2020, 53(9): e12879. |
| [33] |
DONG A Q, PREUSCH C B, SO W K, et al. A long noncoding RNA, LncMyoD, modulates chromatin accessibility to regulate muscle stem cell myogenic lineage progression[J]. Proc Natl Acad Sci U S A, 2020, 117(51): 32464-32475. DOI:10.1073/pnas.2005868117 |
(编辑 郭云雁)



