2. 广东壹号地方猪研究院有限公司, 湛江 524000
2. Guangdong Yihao Indigenous Pig Research Institute Co. Ltd., Zhanjiang 524000, China
FOXL2(forkhead box protein L2)是调控性腺向卵巢分化[1]、维持卵巢表型的转录因子[2-3]。研究表明,FOXL2缺失会导致小鼠卵巢颗粒细胞丧失特性且向雄性睾丸的支持样细胞转化,致使卵泡闭锁[4];FOXL2突变虽然不会致使性别逆转,但是会致使人的卵巢早衰[5]。另外,FOXL2是激活素刺激FSH-β启动子活性的必要条件[6-7]。卵泡刺激素(follicle stimulating hormone,FSH)是由α亚基和β亚基非共价结合产生的异二聚体糖蛋白[8],而FSH浓度必须超过一定的阈值才能促进卵泡募集、生长、选择和优势[9]。可见,FOXL2对卵巢功能的维持及其排卵状态都至关重要,它的突变或者缺失会使排卵提前终止[10]。研究表明,FOX家族里存在大量与乳腺癌相关的转录因子,比如FOXC1[11]、FOXQ1[12]、FOXL2[13]等与乳腺癌患者的预后能力相关;FOXF2[14]、FOXA1[15]、FOXL1[16]的缺乏使得乳腺癌细胞的侵袭性增加。另外,国内有研究表明母猪FSH-β的基因多态性对母猪乳头数有显著效应[17],且FOXL2会调控FSH-β的活性。FOXO1也是FOX转录因子家族中的一员。FOXO1基因多态性与猪的肌肉质量以及纤维类型有关[18],是一个影响屠宰性状和肉质性状的候选基因[19-20]。虽然目前未见FOXL2基因与猪乳头数和屠宰性状有关的报道,但是我们推测FOXL2对母猪的乳头数和重要生产性状有关。
两广小花猪的母性强、产仔数多且能稳定遗传,有较高的育种价值[21],是国家级畜禽遗传资源保护品种[22]。虽然两广小花猪的瘦肉率低于国外引进的杜洛克、大白猪和长白猪等品种,但是其肉嫩、肌内脂肪含量高,适口性好[23],有一定的经济价值[24]。因此,筛选对两广小花猪的排卵状态和屠宰性状有显著效应的分子标记位点,提供有效的分子标记手段,有助于品种选育和杂交改良,进而提高猪的经济效益。因此,本研究通过靶向测序基因型检测(genotyping by target sequencing,GBTS)技术分析FOXL2基因多态性,对两广小花猪的排卵状态和屠宰性状进行关联性分析,以期筛选与排卵状态和屠宰性状相关的SNPs位点,为今后两广小花猪的分子育种和品种改良提供参考依据。
1 材料与方法 1.1 材料随机选取由壹号食品某猪场提供的107头、(365±25)日龄、体况良好的两广小花猪为试验对象。对107头母猪进行屠宰后,测定胴体的屠宰性状,鉴定母猪卵巢组织的排卵状态。统一取卵巢组织,浸于75%酒精中,-20 ℃保存。使用液相探针杂交的GBTS技术定位FOXL2基因的SNPs位点,得到的SNPs位点用于后续关联分析。
1.2 方法1.2.1 基因检测及注释 由石家庄博瑞迪生物技术有限公司对猪13号染色体上的FOXL2基因(Gene ID:100622956)进行引物和芯片的设计。基因的平均探针覆盖率为81.6%,利用GBTS技术对本试验107个样本进行检测,测序结果与猪参考基因组(Sus-scrofa 11.1,http://www.ensembl.org/Sus_scrofa/Info/Index/)基因型比对分析,确定与FOXL2基因相关的24个突变位点,并利用ANNOVAR软件[25]对检测结果进行注释。
1.2.2 屠宰性状性能及排卵状态测定 试验动物在(365±25)日龄时被屠宰。屠宰后,按照NY/T 825—2004《瘦肉型猪胴体性状测定技术规范》[26]进行测定。共有17个胴体性状被测定:瘦肉率、皮脂率、骨率、左胴体重、板油重、肾脏重、皮脂重、骨重、瘦肉重、腿臀重、头重、蹄重、右胴体重、胴体直长、胴体斜长、膘厚(倒数3~4肋)、眼肌面积(坐标法)。采集并观测猪两侧卵巢的排卵状态。根据母猪是否具有红体或黄体判断母猪排卵状态。如果至少一侧卵巢有红体或黄体,说明该母猪卵巢排卵状态正常;如果未出现红体或黄体,则母猪卵巢排卵状态异常。
1.2.3 SNPs基因分型及关联分析 根据筛选的SNPs位点,将107头母猪进行SNPs基因分型,并对排卵状态和屠宰性状进行关联分析。使用Haploview v4.2软件[27]对所有SNPs位点进行连锁不平衡分析,并构建单倍型块。
1.3 数据统计分析使用Excel 2019软件对数据进行汇总整理,计算各SNPs位点的等位基因频率和基因型频率,以及群体遗传参数:纯合度(Ho)、杂合度(He)和有效等位基因数(Ne)。使用R软件(R x64 4.0.3,https://www.r-project.org/) 对个体基因型与母猪排卵状态进行χ2检验,对屠宰性状使用最小显著差数检验法(least significant difference test,LSD法)进行多重比较。试验数据用“平均值±标准差”表示。
2 结果 2.1 FOXL2基因突变位点筛选和遗传结构分析对107份猪卵巢FOXL2基因进行测序,得到24个突变位点,包含19个SNPs,2个InDel突变,3个位点同时发生了SNPs和InDel突变。剔除突变频率小于1%的9个突变位点,这些位点被认为是点突变,没有多态性。在此基础上,继续剔除发生InDel突变的3个突变位点,质控后的12个SNPs位点如表 1所示。g.79709005 T>C、g.79709017 A>G位点位于编码区,其他10个SNPs位点位于非编码区。
|
|
表 1 FOXL2基因SNPs位点的突变频率、基因型频率、等位基因频率和群体遗传学指标 Table 1 Mutation frequency, genotype frequency, allele frequency and population genetic indexes of SNPs in FOXL2 gene |
在筛选出来的12个SNPs位点中,得到如表 2所示的对排卵状态有显著性影响的4个SNPs位点(P < 0.05)。这4个位点分别为g.79706726 T>C、g.79706898 C>T、g.79707794 T>C、g. 79709005 T>C,其中g.79709005 T>C在FOXL2的编码区。对总乳头数性状无显著性影响(P>0.05)。
|
|
表 2 SNPs与猪排卵状态和乳头数的关联分析 Table 2 Association analysis between SNPs and pig ovulation status and teat number |
在筛选出来的12个SNPs位点中,得到如表 3所示的与屠宰性状相关的6个SNPs位点。g.79707040 A>G、g.79708079 T>C、g.79708152 G>T、g.79706726 T>C、g.79706898 C>T、g.79707794 T>C这6个位点对骨重、瘦肉率、腿臀重、左胴体重性状均有显著性影响(P < 0.05),其中3个SNPs位点g.79707040 A>G、g.79708079 T> C、g.79708152 G>T对板油重性状有显著性影响(P < 0.05)。这6个SNPs位点在FOXL2的非编码区。g.79707040 A>G中,GG基因型个体的板油重、骨重、腿臀重和左胴体重性状都显著高于AA基因型个体, GG基因型个体的瘦肉率显著低于AA基因型个体;g.79708079 T>C中,CC基因型个体的板油重、骨重、腿臀重和左胴体重性状都显著高于TT基因型个体(P < 0.05),CC基因型个体的瘦肉率显著低于TT基因型个体(P < 0.05);g.79708152 G>T中,TT基因型个体的板油重、骨重、腿臀重和左胴体重性状都显著高于GG基因型个体(P < 0.05),TT基因型个体的瘦肉率显著低于GG基因型个体(P < 0.05)。g.79706726 T>C中,CC基因型个体的骨重、腿臀重和左胴体重性状都显著高于TT基因型个体(P < 0.05),CC基因型个体的瘦肉率显著低于TT基因型个体(P < 0.05);g.79706898 C>T中,TT基因型个体的骨重、腿臀重和左胴体重性状都显著高于CC基因型个体(P < 0.05),TT基因型个体的瘦肉率显著低于CC基因型个体(P < 0.05);g.79707794 T>C中,CC基因型个体的骨重、腿臀重和左胴体重性状都显著高于TT基因型个体(P < 0.05),CC基因型个体的瘦肉率显著低于TT基因型个体(P < 0.05)。
|
|
表 3 SNPs与猪屠宰性状的关联分析 Table 3 Associations analysis between SNPs and pig slaughter traits |
使用Haploview v4.2软件对8个SNPs位点进行连锁不平衡分析,并构建单倍型块。结果见图 1。由图 1可知,g.79706726 T>C、g.79706898 C> T、g.79707794 T>C这3个位点存在强连锁(r2>0.9),分别命名为H1、H2、H3。
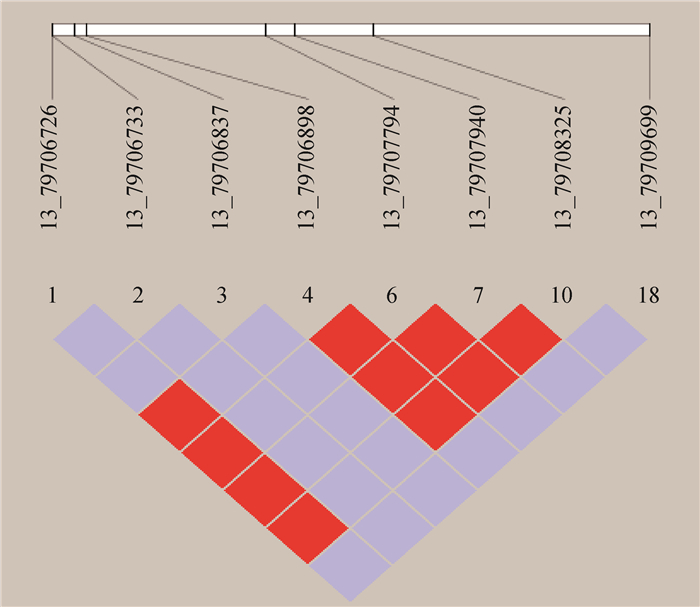
|
方框根据标准的Haploview v4.2软件配色方案进行着色 Boxes are colored according to the standard Haploview v4.2 software color scheme 图 1 SNPs位点连锁不平衡分析 Fig. 1 Analysis of linkage disequilibrium of SNPs |
H1H2单倍型块有3种单倍型,H2H3单倍型块和H1H3单倍型块各产生4种单倍型(表 4)。猪卵巢排卵状态在H1H2单倍型块的3种单倍型有显著性差异(P < 0.05),而乳头数性状无显著性差异。说明FOXL2基因中g.79706726 T>C和g.79706898 C> T组合的位点对卵巢排卵状态有显著性影响(P < 0.05),对乳头数没有显著性影响(P>0.05)。
|
|
表 4 SNPs位点单倍型块与卵巢排卵状态、乳头数的关联分析 Table 4 Association analysis of haplotype blocks of SNPs with ovarian ovulation status and teat number |
如表 5所示,H1H2组合产生的3种单倍型中,CCTT单倍型的骨重、腿臀重和左胴体重性状显著高于TTCC单倍型(P < 0.05),但是CCTT单倍型的瘦肉率性状显著低于TTCC单倍型(P < 0.05)。H2H3组合和H1H3组合各单倍型个体间的板油重、骨重、瘦肉率、腿臀重和左胴体重性状均无显著性差异(P>0.05)。
|
|
表 5 SNPs位点单倍型块与猪屠宰性状的关联分析 Table 5 Association analysis between haplotype blocks of SNPs and pig slaughter traits |
鉴于FOXL2在乳腺癌[13]、宫颈癌细胞[28]、卵巢颗粒细胞瘤[29-30]中均有报道,本研究对FOXL2基因与两广小花猪的排卵状态和乳头数进行了关联分析。排卵状态会限制猪窝产仔数,乳头数会影响母猪的哺乳能力且与产仔数遗传相关[31]。而窝产仔数和乳头数是重要的繁殖性状[32],对猪场的生产管理和效益有重要影响。卵泡的发育和闭锁是一个复杂的生理生化过程,FOXL2和SMAD形成复合顺式元件协同调节FSH-β的转录[33];抑制素-激活素-卵泡抑素系统通过内分泌机制调节垂体FSH的分泌[34-35],从而调控卵巢内颗粒细胞的生长和雌激素的产生[36]。两广小花猪的母猪初情期平均为119.1 d,怀孕期平均为113.1 d,三胎及三胎以上可产仔10.4头[37-38]。(365±25)日龄的母猪生育能力正佳,卵巢应正常排卵。但是,通过采集母猪两侧卵巢,本研究发现有20头母猪的两侧卵巢都未见红体或者黄体的发生,这可能是母猪卵巢早衰的征兆;发现4个对排卵状态有显著性影响的SNPs位点(g.79706726 T>C、g.79706898 C>T、g.79707794 T> C、g.79709005 T>C),其中g.79709005 T>C在FOXL2的编码区。以上4个SNPs位点可以有效预防母猪提前终止排卵,为提高母猪利用年限和繁殖力提供新的分子标记和理论依据。试验表明,FOXL2免疫靶向的疫苗可抑制小鼠卵巢癌模型的肿瘤生长[39],这4个SNPs位点也为卵巢颗粒细胞瘤的免疫治疗提供新的靶点以及理论基础。
芳香酶是雌激素局部合成的重要酶[40],绝经后乳腺癌患者中FOXL2转录因子可能会与芳香化酶的启动子区结合,从而改善有核表达病例的无复发生存率[13]。FOXL1在体外抑制乳腺癌的增殖、侵袭和迁移能力,并在体内抑制乳腺癌的生长[16]。但是本研究在FOXL2基因与两广小花猪乳头数的关联分析中未发现有显著性影响乳头数的SNPs位点。
本研究发现,FOXL2基因与猪的屠宰性状相关,在FOXL2基因与两广小花猪屠宰性状的关联分析中发现了6个显著性SNPs位点(g.79707040 A>G、g.79708079 T>C、g.79708152 G>T、g.79706726 T>C、g.79706898 C>T、g.79707794 T> C)。虽然g.79706726 T>C、g.79706898 C>T、g.79707794 T>C 3个SNPs位点对板油重无显著影响,但是板油重、骨重、腿臀重和左胴体重4个性状在这6个SNPs的优势基因型基本一致,且该优势基因型为纯合子,在群体中频率较高。有利于选育,可稳定遗传。这4个性状优势基因型一致的原因可能是左胴体重包含了板油重、骨重与腿臀重。
3.2 单倍型组与猪排卵状态和屠宰性状的关联分析本研究对8个SNPs位点进行了连锁不平衡分析,其中g.79706726 T>C和g.79706898 C>T的SNPs位点组成H1H2单倍型组,两个SNPs位点步长为172 bp。H1H2组合的3种单倍型块对猪排卵状态、瘦肉率、骨重、腿臀重和左胴体重性状均有显著性影响,CCTT单倍型个体在群体中数量最多,CCTT单倍型个体的骨重、腿臀重和左胴体重显著高于TTCC单倍型个体,CCTT单倍型个体的瘦肉率显著低于TTCC单倍型个体。H2H3和H1H3的单倍型块对猪排卵状态虽然无显著性影响,但是其P值接近0.05。这可能是由于本研究中的样本量不够充足导致的。
4 结论FOXL2转录因子中有与排卵状态显著相关的g.79706726 T>C、g.79706898 C>T、g.79707794 T>C、g.79709005 T>C的SNPs位点,这些位点可能与卵泡提前闭锁和卵泡竭耗相关。另外,本研究发现了FOXL2转录因子与猪屠宰性状相关的6个SNPs位点,这证实了基因多效性假说。其中g.79706726 T>C、g.79706898 C>T、g.79707794 T>C既与排卵状态有关,又与屠宰性状有关。表明FOXL2转录因子除了维持卵巢表型和功能以外,还和猪的生长发育息息相关。可为FOXL2基因在两广小花猪中的选种选育提供重要参考,为分子标记辅助育种提供理论依据。
| [1] |
GARCIA-ORTIZ J E, PELOSI E, OMARI S, et al. Foxl2 functions in sex determination and histogenesis throughout mouse ovary development[J]. BMC Dev Biol, 2009, 9: 36. DOI:10.1186/1471-213X-9-36 |
| [2] |
SINCLAIR A, SMITH C. Females battle to suppress their inner male[J]. Cell, 2009, 139(6): 1051-1053. DOI:10.1016/j.cell.2009.11.036 |
| [3] |
徐超, 李凤, 郝海生, 等. 性别相关基因在牛早期性别发育中的表达规律研究[J]. 畜牧兽医学报, 2017, 48(10): 1892-1901. XU C, LI F, HAO H S, et al. Sex-related genes expression during development of the early bovine fetuses[J]. Acta Veterinaria et Zootechnica Sinica, 2017, 48(10): 1892-1901. DOI:10.11843/j.issn.0366-6964.2017.10.012 (in Chinese) |
| [4] |
SCHMIDT D, OVITT C E, ANLAG K, et al. The murine winged-helix transcription factor Foxl2 is required for granulosa cell differentiation and ovary maintenance[J]. Development, 2004, 131(4): 933-942. DOI:10.1242/dev.00969 |
| [5] |
MORK L, MAATOUK D M, MCMAHON J A, et al. Temporal differences in granulosa cell specification in the ovary reflect distinct follicle fates in mice[J]. Biol Reprod, 2012, 86(2): 37. |
| [6] |
BERNARD D J, TRAN S. Mechanisms of activin-stimulated FSH synthesis: the story of a pig and a FOX[J]. Biol Reprod, 2013, 88(3): 78. |
| [7] |
BILEZIKJIAN L M, JUSTICE N J, BLACKLER A N, et al. Cell-type specific modulation of pituitary cells by activin, inhibin and follistatin[J]. Mol Cell Endocrinol, 2012, 359(1-2): 43-52. DOI:10.1016/j.mce.2012.01.025 |
| [8] |
DIAS J A, ULLOA-AGUIRRE A, BOUSFIELD G R, et al. Editorial for the MCE special issue on "Novel endocrine mechanisms in the regulation of reproduction"[J]. Mol Cell Endocrinol, 2014, 382(1): 385-386. DOI:10.1016/j.mce.2013.10.005 |
| [9] |
ODLE A K, CHILDS G V. SMAD-FOXL2 regulation of FSHB: a game of human and mouse[J]. Endocrinology, 2020, 161(7): bqaa077. DOI:10.1210/endocr/bqaa077 |
| [10] |
UHLENHAUT N H, TREIER M. Forkhead transcription factors in ovarian function[J]. Reproduction, 2011, 142(4): 489-495. DOI:10.1530/REP-11-0092 |
| [11] |
RAY P S, WANG J H, QU Y, et al. FOXC1 is a potential prognostic biomarker with functional significance in basal-like breast cancer[J]. Cancer Res, 2010, 70(10): 3870-3876. DOI:10.1158/0008-5472.CAN-09-4120 |
| [12] |
KANG L J, YU Z H, CAI J, et al. Reciprocal transrepression between FOXF2 and FOXQ1 controls basal-like breast cancer aggressiveness[J]. FASEB J, 2019, 33(5): 6564-6573. DOI:10.1096/fj.201801916R |
| [13] |
WEGMAN P, EREMO A G, LINDLÖF A, et al. Expression of the forkhead transcription factor FOXL2 correlates with good prognosis in breast cancer patients treated with tamoxifen[J]. Int J Oncol, 2011, 38(4): 1145-1151. |
| [14] |
刘昱翔. FOXA2的互作蛋白FOXP2调控乳腺癌上皮间质转化的机制研究[D]. 长沙: 湖南大学, 2021. LIU Y X. The study of FOXA2-interacting transcription factor FOXP2 in regulating the epithelial-mesenchymal transition of breast cancer cells[D]. Changsha: Hunan University, 2021. (in Chinese) |
| [15] |
BERNARDO G M, BEBEK G, GINTHER C L, et al. FOXA1 represses the molecular phenotype of basal breast cancer cells[J]. Oncogene, 2013, 32(5): 554-563. DOI:10.1038/onc.2012.62 |
| [16] |
ZHONG J T, WANG H J, YU J, et al. Overexpression of Forkhead Box L1 (FOXL1) inhibits the proliferation and invasion of breast cancer cells[J]. Oncol Res, 2017, 25(6): 959-965. DOI:10.3727/096504016X14803482769179 |
| [17] |
朱猛进, 钱云, 丁家桐, 等. 母猪FSHβ基因多态与乳头数的关系研究[J]. 畜牧与兽医, 2000, 32(3): 12-14. ZHU M J, QIAN Y, DING J T, et al. A study on the relationship between polymorphisms of sows' FSHβ gene and their teat numbers[J]. Animal Husbandry & Veterinary Medicine, 2000, 32(3): 12-14. DOI:10.3969/j.issn.0529-5130.2000.03.006 (in Chinese) |
| [18] |
ROPKA-MOLIK K, BERETA A, UKOWSKI K, et al. Screening for candidate genes related with histological microstructure, meat quality and carcass characteristic in pig based on RNA-seq data[J]. Asian-Australas J Anim Sci, 2018, 31(10): 1565-1574. DOI:10.5713/ajas.17.0714 |
| [19] |
潘泽滚, 李志雄. 藏鸡FoxO1基因多态性及与屠宰和生长性状的关联分析[J]. 中国家禽, 2022, 44(4): 13-21. PAN Z G, LI Z X. Polymorphisms of FoxO1 gene related to growth and slaughter traits in Tibetan chicken[J]. China Poultry, 2022, 44(4): 13-21. (in Chinese) |
| [20] |
王玲. 普通牛FoxO1、FoxO3、FoxO4基因的克隆、表达及其对肉质性状的遗传效应分析[D]. 雅安: 四川农业大学, 2010. WANG L. Cloning, expression and genetic effects of bovine FoxO1, FoxO3 and FoxO4 genes on meat quality traits[D]. Yaan: Sichuan Agricultural University, 2010. (in Chinese) |
| [21] |
曾检华, 李闯, 韦明飞, 等. 两广小花猪(壹号黑猪)新品系选育进展[J]. 养猪, 2019(4): 65-68. ZENG J H, LI C, WEI M F, et al. Porgress of breeding on Liang Guang Small-spotted Pig (Yihao Black Pig)[J]. Swine Production, 2019(4): 65-68. DOI:10.3969/j.issn.1002-1957.2019.04.030 (in Chinese) |
| [22] |
黄雅琼, 江永强, 梁文全, 等. 陆川猪的生物学特征及其优良性能的研究概况[J]. 家畜生态学报, 2013, 34(5): 82-84. HUANG Y Q, JIANG Y Q, LIANG W Q, et al. A review of biological characteristics and performance in Luchuan pig[J]. Acta Ecologiae Animalis Domastici, 2013, 34(5): 82-84. DOI:10.3969/j.issn.1673-1182.2013.05.018 (in Chinese) |
| [23] |
薛尚军, 杨晓奋, 刘宏, 等. 中国地方猪种的肉质特性[J]. 国外畜牧学-猪与禽, 2011, 31(2): 92-94. XUE S J, YANG X F, LIU H, et al. Meat quality characteristics of local pig breeds in China[J]. Animal Science Abroad (Pigs and Poultry), 2011, 31(2): 92-94. (in Chinese) |
| [24] |
任红艳, 胡景杰, 杜生明. 中国地方猪种成肌与肌内沉脂的遗传机制解析——国家自然科学基金重大项目介绍[J]. 畜牧兽医学报, 2018, 49(5): 1096-1098. REN H Y, HU J J, DU S M. Genetic mechanisms of myogenesis and intramuscular adipogenesis in Chinese indigenous pigs—introduction to major program of The National Natural Science Foundation of China[J]. Acta Veterinaria et Zootechnica Sinica, 2018, 49(5): 1096-1098. (in Chinese) |
| [25] |
WANG K, LI M Y, HAKONARSON H. ANNOVAR: functional annotation of genetic variants from high-throughput sequencing data[J]. Nucleic Acids Res, 2010, 38(16): e164. DOI:10.1093/nar/gkq603 |
| [26] |
中华人民共和国农业部. NY/T 825-2004瘦肉型猪胴体性状测定技术规范[S]. 北京: 中国农业出版社, 2004. The Ministry of Agriculture of the People's Republic of China. NY/T 825-2004 Technical regulation for testing of carcass traits in lean-type pig[S]. Beijing: China Agriculture Press, 2004. (in Chinese) |
| [27] |
BARRETT J C, FRY B, MALLER J, et al. Haploview: analysis and visualization of LD and haplotype maps[J]. Bioinformatics, 2005, 21(2): 263-265. DOI:10.1093/bioinformatics/bth457 |
| [28] |
LIU X L, MENG Y H, WANG J L, et al. FOXL2 suppresses proliferation, invasion and promotes apoptosis of cervical cancer cells[J]. Int J Clin Exp Pathol, 2014, 7(4): 1534-1543. |
| [29] |
BELLI M, SECCHI C, STUPACK D, et al. FOXO1 negates the cooperative action of FOXL2C134 W and SMAD3 in CYP19 expression in HGrC1 cells by sequestering SMAD3[J]. J Endocr Soc, 2019, 3(11): 2064-2081. DOI:10.1210/js.2019-00279 |
| [30] |
黄梅梅, 尹如铁. FOXL2基因在卵巢颗粒细胞瘤中的研究现状[J]. 中华妇幼临床医学杂志(电子版), 2019, 15(3): 349-352. HUANG M M, YIN R T. Current research status of FOXL2 gene in granulocytoma of ovary[J]. Chinese Journal of Obstetrics & Gynecology and Pediatrics (Electronic Edition), 2019, 15(3): 349-352. (in Chinese) |
| [31] |
张昌政, 李德森, 黄敏, 等. 基于全基因组填充重测序关联分析鉴别影响苏山猪初生体尺与乳头数性状的遗传位点[J]. 畜牧兽医学报, 2023, 54(1): 88-102. ZHANG C Z, LI D S, HUANG M, et al. An imputed whole-genome sequence-based GWAS approach pinpoints genetic loci for body conformation at birth and teat number traits in Sushan pig population[J]. Acta Veterinaria et Zootechnica Sinica, 2023, 54(1): 88-102. (in Chinese) |
| [32] |
KNOX R V. Physiology and endocrinology symposium: factors influencing follicle development in gilts and sows and management strategies used to regulate growth for control of estrus and ovulation[J]. J Anim Sci, 2019, 97(4): 1433-1445. |
| [33] |
LAMBA P, WANG Y, TRAN S, et al. Activin a regulates porcine follicle-stimulating hormone β-subunit transcription via cooperative actions of SMADs and FOXL2[J]. Endocrinology, 2010, 151(11): 5456-5467. |
| [34] |
熊冬梅, 李蓉. 抑制素、激活素、卵泡抑素与卵泡发育[J]. 华西医学, 2006, 21(1): 188-189. XIONG D M, LI R. Inhibin, activin, follistatin and follicle development[J]. West China Medical Journal, 2006, 21(1): 188-189. (in Chinese) |
| [35] |
SEACHRIST D D, KERI R A. The activin social network: activin, inhibin, and follistatin in breast development and cancer[J]. Endocrinology, 2019, 160(5): 1097-1110. |
| [36] |
RECCHIA K, JORGE A S, DE FIGUEIREDO PESSÔA L V, et al. Actions and roles of FSH in germinative cells[J]. Int J Mol Sci, 2021, 22(18): 10110. |
| [37] |
中国地方猪品种资源介绍(一)[J]. 中国猪业, 2006(2): 20-22. Introduction of Chinese local pig breed resources(1)[J]. China Swine Industry, 2006(2): 20-22. (in Chinese) |
| [38] |
张家富. 陆川猪若干种质特性基础研究[D]. 南宁: 广西大学, 2012. ZHANG J F. Basic research on several breeding characteristics in Luchuan pig[D]. Nanning: Guangxi University, 2012. (in Chinese) |
| [39] |
PIERINI S, TANYI J L, SIMPKINS F, et al. Ovarian granulosa cell tumor characterization identifies FOXL2 as an immunotherapeutic target[J]. JCI Insight, 2020, 5(16): e136773. |
| [40] |
ACARÇEVIK U, KAYAÇAVUŞOǦLU B, SAǦLIK B N, et al. Synthesis, docking studies and biological activity of new benzimidazole- triazolothiadiazine derivatives as aromatase inhibitor[J]. Molecules, 2020, 25(7): 1642. |
(编辑 郭云雁)



