2. 洛阳鑫泰农牧科技股份有限公司, 洛阳 471000
2. Luoyang Xintai Agriculture and Animal Husbandry Technology Co., Ltd., Luoyang 471000, China
肺炎克雷伯菌是一种常见的革兰阴性条件致病菌,属于肠杆菌科,常寄生在人和动物的消化道、呼吸道和泌尿生殖道[1]。近年来,家兔感染肺炎克雷伯菌的报道屡见不鲜。当家兔抵抗力低下时,该致病菌在家兔体内大量生长繁殖,引起家兔大面积发病,从而产生较高的死亡率[2]。家兔感染后常表现为肺炎、腹泻及其他器官化脓性炎症,严重者甚至引发败血症。随着兔规模化养殖的快速发展,由肺炎克雷伯菌引起兔大规模感染时常发生,严重危害养兔业的健康发展。
目前,关于兔肺炎克雷伯菌的相关文献大多集中在病例报道[1, 3-5],而家兔感染肺炎克雷伯菌的组织病理学变化及其相关毒力基因鲜有报道。因此,本研究分别从宏观和微观角度观察家兔感染肺炎克雷伯菌后的病理学特征,通过PCR鉴定其毒力强弱,并采用药敏试验确定肺炎克雷伯菌对常用抗生素的耐药谱,以期为该致病菌感染的防治和科学用药提供参考依据。
1 材料与方法 1.1 材料1.1.1 患病动物临床症状及病料采集 从河南地区某规模化养殖场采集6份具有呼吸道和消化道症状的病兔样品。病兔鼻腔有白色黏液、呼吸困难且腹泻,病兔大量死亡。在无菌条件下,剖检观察病兔组织器官病变情况,分别采集病兔肺、肝、胸腺、脾、肾、肠组织,进行病原菌的分离与纯化。并取病兔肺、肝、胸腺、脾、肾、肠组织于4%多聚甲醛溶液中进行固定。此外,对家兔常感染的病原菌(兔肺炎链球菌、兔沙门菌等)进行例检均为阴性。
1.1.2 主要试剂与仪器 普通琼脂培养基、药敏纸片购自温州康泰生物科技有限公司、DL2000 DNA Marker购自康为世纪生物科技有限公司、细菌基因组DNA小量提取试剂盒、溴化乙锭溶液购自苏州天可贸易有限公司。
主要仪器包括微波炉(P70D20TL-P4)、摊片机(KD-P)、烘片机(KD-H)、普通PCR仪(Applied Biosystems)、电泳仪(北京市六一仪器厂)、凝胶成像系统(BIORAD)等。
1.2 方法1.2.1 细菌的分离与纯化 取“1.1.1”采集的病兔肺、肝、胸腺、脾、肾、肠组织样品分别划线接种于普通营养琼脂培养基和麦康凯琼脂培养基,置于37 ℃恒温培养箱中培养24 h,观察菌落生长情况。挑取单菌落进行革兰染色并镜检观察。
1.2.2 分子生物学鉴定 取1 mL菌液,通过试剂盒提取细菌基因组DNA,并进行PCR扩增。引物序列为:F: 5′-AGAGTTTGATCCTGGCTCAG-3′; R: 5′-ACGGCTACCTTGTTACGACTT-3′。预扩增片段长度约为1 494 bp。引物由通用生物(安徽)股份有限公司合成。PCR反应体系25 μL:上、下游引物各1 μL, DNA模板1 μL, Premix TaqTM 12.5 μL, ddH2O 9.5 μL。PCR反应条件:94 ℃预变性4 min;94 ℃变性30 s,57 ℃ 30 s,72 ℃ 1 min,30个循环;72 ℃ 10 min;4 ℃保存。PCR产物经2%琼脂糖凝胶电泳检测后,由通用生物(安徽)股份有限公司进行测序,将测序结果与GenBank中已收录的菌株进行同源性比对分析,并利用MEGA 7.0构建系统进化树。
1.2.3 毒力基因扩增 以细菌基因组DNA为模板,参考相关文献扩增allS、fimH、kfu、magA、ureA、uge、rmpA和wabG 8种毒力基因,鉴定菌株毒力基因情况。具体序列及目的片段信息见表 1。引物由通用生物(安徽)股份有限公司合成。PCR反应体系25 μL:上、下游引物各1 μL, DNA模板1 μL, Premix TaqTM 12.5 μL, ddH2O 9.5 μL。PCR反应条件:94 ℃预变性5 min;94 ℃变性1 min,48 ℃~57 ℃ 1 min,72 ℃延伸30~60 s,35个循环;72 ℃ 10 min;4 ℃保存。
|
|
表 1 毒力基因引物信息 Table 1 Primer information of virulence genes |
1.2.4 病兔组织病理学观察 取病死兔肝、脾、肺、胸腺、肾、肠等组织器官固定在4%多聚甲醛中。分别在70%、80%、90%、95%、100%无水乙醇中进行逐级脱水,并进行组织块透明和石蜡包埋。再将包埋好的组织块切成5 μm厚切片并烘干。于室温下将切片进行苏木精-伊红染色(HE染色),染色后的切片置于不同浓度无水乙醇中进行脱水,切片透明并封片。最后,使用显微镜观察并采集照片。
1.2.5 分离菌的家兔致病性试验 将该分离菌接种到普通固体培养基上37 ℃培养24 h后,通过平板法进行细菌计数,菌液调整到109 CFU·mL-1。将6只60日龄的家兔随机分为2组,每组3只,试验组家兔腹腔注射2 mL菌液,对照组注射等量的PBS。接种后观察并对病死兔进行剖检。
1.2.6 药敏试验 参考美国临床检验标准委员会(CLSI)抗生素药敏试验标准,利用K-B(琼脂扩散法)测定细菌的耐药性。抗生素纸片包括:氨苄西林、庆大霉素、新霉素、卡那霉素、丁胺卡那、多黏菌素B、杆菌肽、磺胺异恶唑、环丙沙星、诺氟沙星、四环素、多西环素、头孢哌酮、头孢曲松、氟苯尼考、美罗培南。
2 结果 2.1 临床剖检临床剖检发现病死兔多数器官肿大、出血,但不同器官组织的病理损伤程度不同。剖检结果显示:病死兔肺淤血、严重出血,并出现化脓灶(图 1A);肝肿大且有灰黄色坏死小点(图 1B);胸腺肿大、出血(图 1C);脾肿大、呈暗红色(图 1D);肾呈土黄色(图 1E);盲肠壁出血(图 1F)。剖检病死兔各器官病变症状与兔肺炎克雷伯菌病器官病变相似度较高,且各组织器官均出现明显剖检病变,初步表明该致病菌对家兔有很强的致病性。
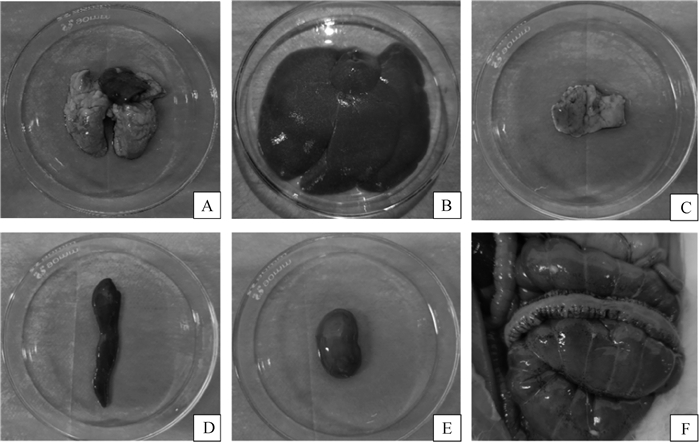
|
A. 肺;B.肝;C.胸腺;D.脾;E.肾;F.肠; A.Lung; B. Liver; C. Thymus; D. Spleen; E. Kidney; F. Intestines; 图 1 病死兔剖检 Fig. 1 Dissection of sick and dead rabbits |
在6只病死兔的内脏组织分离得到致病菌后,将分离菌在37 ℃恒温箱培养24 h,在普通琼脂平板上均长出乳白色、黏稠、湿润的菌落,在麦康凯琼脂培养基上均长出粉红色、湿润、圆形的菌落。将菌落进行革兰染色镜检均为卵圆形的革兰阴性杆菌。如图 2所示。
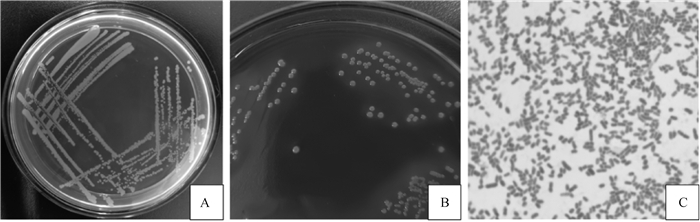
|
A.分离菌在普通琼脂培养基上的菌落形态;B.分离菌在麦康凯琼脂培养基上的菌落形态;C.分离菌革兰染色(1 000×) A. Colony morphology of the isolated bacteria on ordinary agar medium; B. Colony morphology of the isolated bacteria on McKangkai agar culture medium; C. Gram staining of the isolated bacteria (1 000×) 图 2 分离菌的形态和培养特性观察 Fig. 2 Observation on the morphology and culture characteristics of the isolated bacteria |
以分离菌为模板,进行PCR反应后,发现病兔分离纯化得到的细菌均在1 494 bp处出现特异性条带(图 3)。与预期结果的大小一致。将扩增产物进行测序,序列经NCBI(Blast)数据库进行比对分析,与肺炎克雷伯菌序列相似度较高。采用MEGA 7.0软件构建遗传进化树(图 4),结果显示从病兔各器官中分离得到的病原菌与登录号为ON925022.1的肺炎克雷伯菌同源性为99.79%,表明病兔感染的是肺炎克雷伯菌。
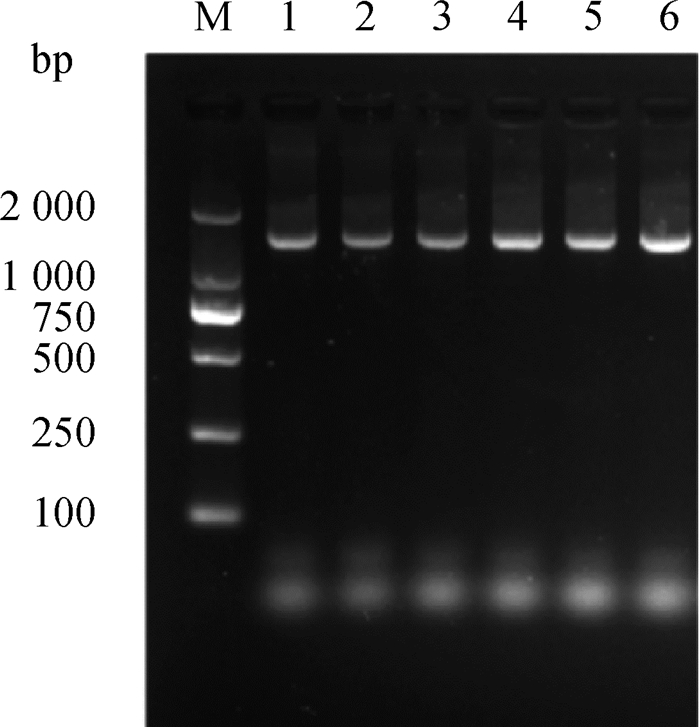
|
M. DL2000 Marker;1~6. 6只病兔肺炎克雷伯菌16S rRNA PCR扩增产物 M. DL2000 Marker; 1-6. PCR products of 16S rRNA from 6 rabbits infected Klebsiella pneumoniae 图 3 肺炎克雷伯菌PCR扩增电泳图 Fig. 3 Electrophoretic diagram of PCR amplification of Klebsiella pneumoniae |

|
图 4 肺炎克雷伯菌16S rRNA基因系统发育树 Fig. 4 Phylogenetic tree of Klebsiella pneumoniae 16S rRNA gene |
通过PCR对分离株8种毒力基因进行检测,其中allS基因、kfu基因和uge基因扩增结果为阳性,扩增条带分别为508、797、535 bp,与预期值相符(图 5)。
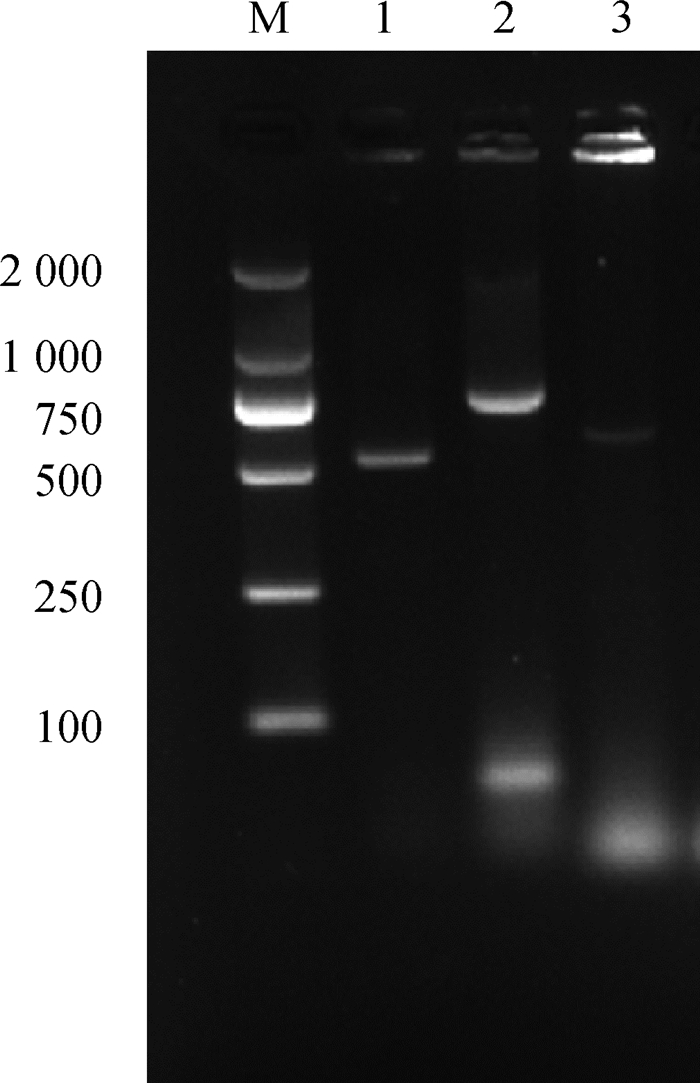
|
M. DL2000 Marker;1~3. allS、kfu、uge基因扩增产物 M. DL2000 Marker; 1-3. Amplification products of allS、kfu、uge gene 图 5 肺炎克雷伯菌毒力基因电泳图 Fig. 5 Electrophoresis of virulence genes of Klebsiella pneumoniae |
制作病兔组织器官的石蜡病理切片,进行组织病理学观察。结果显示,病兔肺泡壁增厚且有大量炎性细胞浸润,肺泡腔内有少量红细胞(图 6A、a);病兔肝细胞肿大,肝索排列紊乱,肝细胞胞浆内存在部分空泡,中央静脉内淤血(图 6B、b);病兔胸腺组织的皮质区扩大, 大部分淋巴细胞浓染,髓质缩小(图 6C、c);病兔脾组织出现淤血、出血,白髓结构不清且伴随大量红细胞散在分布,淋巴细胞坏死崩解(图 6D、d);病兔肾小管管腔缩小,且不规则,肾球囊周围散在红细胞,肾小管上皮细胞肿胀变性,细胞之间的界限不清,有些肾小管上皮细胞脱落至管腔(图 6E、e);病兔空肠管腔内出现少量红细胞,肠绒毛黏膜上皮脱落,固有层内有数量不等的炎性细胞浸润(图 6F、f)。
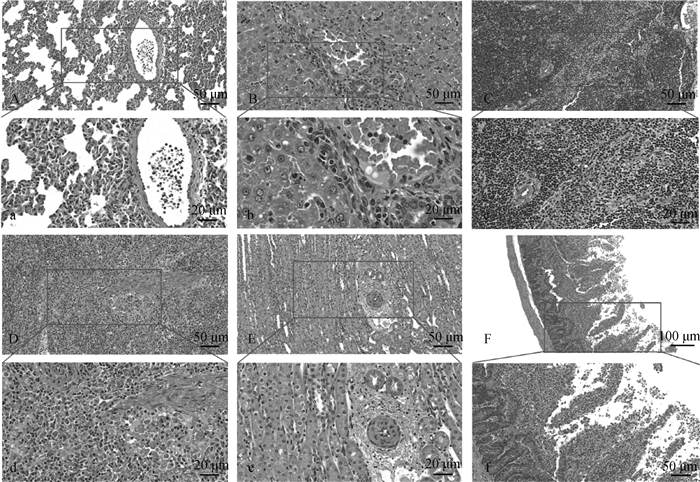
|
A~F和a~f均为病兔组织病理学观察图,且a~f对应为A~F中长方形的放大版;A、a. 肺;B、b. 肝;C、c. 胸腺;D、d. 脾;E、e. 肾;F、f. 空肠 A-F and a-f are histopathological observations of diseased rabbits, and a-f corresponds to an enlarged version of the rectangle in A-F; A, a. Lungs; B, b. Liver; C, c. Thymus; D, d. Spleen; E, e. Kidney; F, f. Jejunum 图 6 肺炎克雷伯菌感染病兔各组织病理学观察 Fig. 6 Histopathological observation of rabbits infected with Klebsiella pneumoniae |
用该分离菌攻毒后,试验组家兔均精神沉郁、被毛脏乱、食欲下降,并且伴有腹泻发生,发病率100%。而对照组家兔无异常。剖检后发现病死兔肺有散在出血点;盲肠壁化脓;盲肠内有黄褐色稀样内容物。通过对病死兔进行细菌的分离鉴定发现与原分离菌株一致,且通过16S rRNA的PCR鉴定其序列与原分离株相同(图 7)。
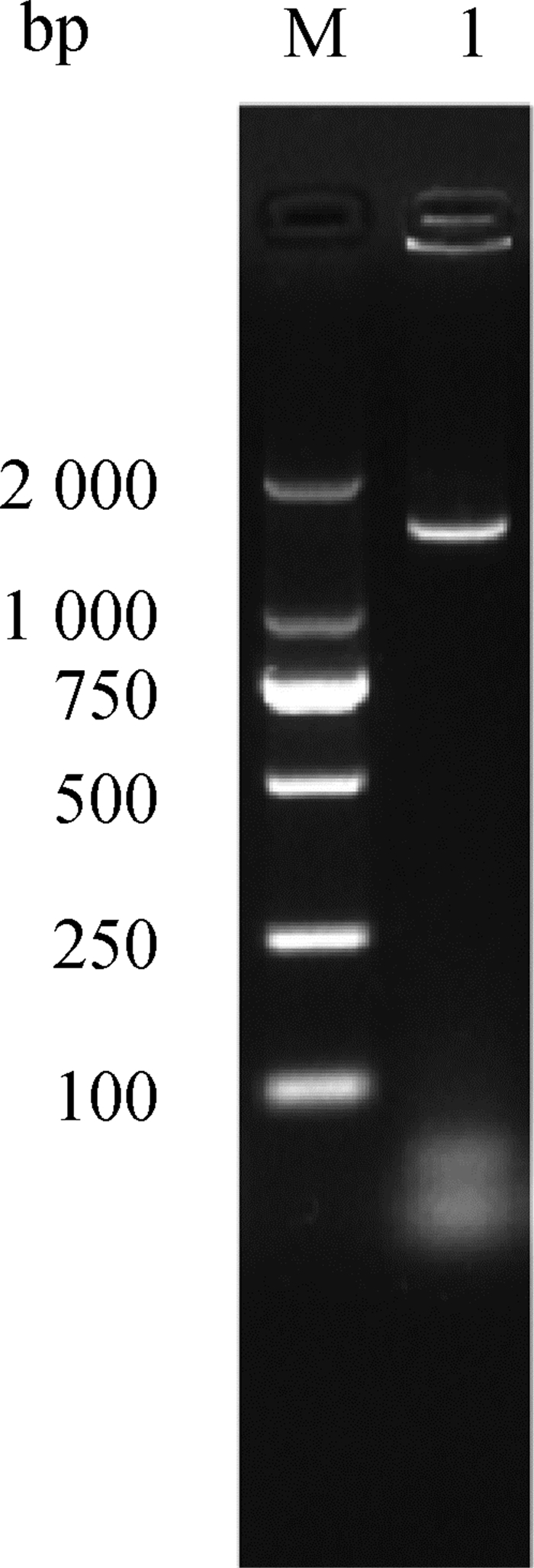
|
M. DL2000 Marker;1. 致病性试验分离菌PCR扩增产物 M. DL2000 Marker; 1. PCR products of strains isolated by pathogenicity test 图 7 致病性试验分离菌PCR扩增电泳图 Fig. 7 Electrophoretic diagram of PCR amplification of strains isolated by pathogenicity test |
将分离菌接种到含抗生素的培养基上,37 ℃恒温培养24 h后测量抑菌圈直径。肺炎克雷伯菌对不同药物的敏感性见表 2。测量结果显示,肺炎克雷伯菌对丁胺卡那、多黏菌素B、头孢哌酮、头孢曲松敏感,对氨苄西林、庆大霉素、多西环素、美罗培南不敏感,对新霉素、卡那霉素、杆菌肽、磺胺异恶唑、环丙沙星、诺氟沙星、四环素、氟苯尼考8种药物有较强耐药性。
|
|
表 2 不同药物对肺炎克雷伯菌的抑菌效果 Table 2 Antibacterial effect of different drugs on Klebsiella pneumoniae |
长期以来,肺炎克雷伯菌作为一种条件性致病菌一直被认为对畜禽危害不大。因此,肺炎克雷伯菌并未受到广泛关注。然而,近年来,随着我国养兔业不断向规模化发展,大规模和高密度的饲养使家兔更易患呼吸道疾病,加之肺炎克雷伯菌耐药性逐渐增强[13]及动物机体抵抗力低下等因素,导致感染肺炎克雷伯菌的病例时常发生,严重阻碍兔养殖业的发展。本试验从河南某规模化兔场病兔肺、肝、胸腺、脾、肾、肠组织器官分离到疑似病原菌,通过临床剖检,结合临床症状及病理变化特点,初步判定为肺炎克雷伯菌,再经分子生物学鉴定与测序,确定引起该场兔死亡的病原菌为肺炎克雷伯菌。
研究表明,当肺炎克雷伯菌感染兔后,常引发兔呼吸系统和消化系统疾病,临床常表现为呼吸困难、打喷嚏和腹泻等症状。此外,还会造成全身各器官系统的机能异常和结构损伤[4, 14-15]。郝中香等[16]发现,扭角羚感染肺炎克雷伯菌后,出现肺严重实变且充血,肝淤血肿大且脾肿大。许皓等[17]研究发现,感染肺炎克雷伯菌的貂出现呼吸困难等症状和突发性死亡。在本研究中,病兔临床症状主要表现为打喷嚏、流水样鼻涕、咳嗽和呼吸困难。病理变化主要表现为气管出血;肺充血出血,有部分化脓;肝淤血肿大,有灰白色坏死灶;脾淤血肿大,边缘钝圆;肾呈土黄色;部分出现盲肠浆膜出血。剖检结果与王孝友等[14]的报道一致,病兔全身各器官均出现不同程度的损伤。
家兔感染呼吸道病原菌的多样性在一定程度上给病原的确定造成了困难,而缺乏组织病理学方面的研究也可能是其重要原因之一。目前关于家兔肺炎克雷伯菌感染的组织病理特征鲜见报道。郭定宗等[18]发现,金丝猴感染肺炎克雷伯菌后,心肌纤维间隙明显增宽,肌纤维粗细肿胀、断裂,肝中央静脉和肝窦严重扩张并充血,脾被膜和小梁水肿,肺泡壁和肾小球毛细血管严重充血扩张,肠绒毛脱落。张诗渝[19]研究发现,感染肺炎克雷伯菌的小鼠肺泡壁毛细血管充血扩张,肝静脉周围、肝血窦内有大量中性粒细胞浸润,脾内淋巴小结增生,同时伴有大量炎性细胞浸润。这与本研究中的组织病理变化存在一定程度的相似性。本研究发现病兔肺、肝、胸腺、脾、肾和肠组织细胞间隙均出现少量红细胞,肺泡壁大量炎性细胞浸润,肝索排列紊乱,胸腺皮质区扩大、髓质变小,脾白髓结构不清,肾小管上皮细胞肿胀变性和肠绒毛黏膜上皮脱落。
肺炎克雷伯菌毒力强弱与其毒力因子数量成正相关。毒力因子在宿主体内通过一系列反应或特点,逃避免疫细胞识别,从而在宿主体内大量繁殖[20]。例如,菌毛在细菌黏附和逃避宿主免疫起着非常重要的作用[21];铁载体主要通过螯合宿主铁,促进细菌在宿主体内大量繁殖,从而造成宿主严重感染[22];脂多糖通过补体介导所形成的连锁反应,在菌体表面聚集成复合物,从而介导细菌逃避或抵抗宿主天然免疫的杀伤[7];荚膜在抑制宿主免疫反应中发挥非常重要的作用[23-24]。本研究通过对肺炎克雷伯菌allS、fimH、kfu、magA、ureA、uge、rmpA和wabG这8种毒力基因进行PCR检测,结果显示,allS基因、kfu基因和uge基因扩增结果为阳性,而其他5种毒力基因均未检测出来。uge基因与荚膜多糖的合成有关[7]。Regué等[10]用uge突变株感染小鼠发现,uge突变株不能引起尿路感染,然而将uge野生型基因再次引入突变株后,野生菌表型完全恢复,且小鼠患尿路感染、肺炎和败血病。此外,黏附素是细菌的传播与定植的关键因素,而kfu与黏附素的形成有关。同时,kfu还参与编码磷酸转移酶系统中的一些成分,帮助肺炎克雷伯菌摄取铁离子,从而增强其毒力[25]。另外,有研究表明,allS与尿囊素代谢有关。尿囊素代谢产生的氨和二氧化碳可以为肺炎克雷伯菌提供氮源和碳源,从而促进肺炎克雷伯菌的生长和繁殖[26]。同时,Yu等[27]通过对50个中国台湾肝脓肿病人的肺炎克雷伯菌菌株调查发现,该50株菌均含有尿囊素代谢相关基因,表明尿囊素代谢相关基因与肝脓肿具有相关性。该病理变化与本研究家兔感染后出现肝肿大的结果一致。根据毒力基因检测结果,认为本研究取样的养殖场产生的粪便存在潜在危害,应加强对粪便的处理,避免产生威胁公共安全的问题。
由于生产实践中常通过抗生素来治疗细菌性感染,从而导致多重耐药性肺炎克雷伯菌的检出率不断升高。张志翔等[28]发现兔源肺炎克雷伯菌对氨基糖苷类、四环素类及头孢类等抗菌药物高度敏感,对米诺环素、恩诺沙星、复方新诺明和杆菌肽3种药物有较强的耐药性。张自强等[4]发现,兔源肺炎克雷伯菌对庆大霉素、头孢曲松、头孢唑林和头孢氨苄4种药物敏感,对大环内酯类、喹诺酮类和头孢类等抗菌药物有较强耐药性。本研究药敏试验结果显示,肺炎克雷伯菌对丁胺卡那、多黏菌素B、头孢哌酮、头孢曲松敏感,对氨苄西林、庆大霉素、多西环素、美罗培南出现不同程度耐药,对新霉素、卡那霉素、杆菌肽、磺胺异恶唑、环丙沙星、诺氟沙星、四环素、氟苯尼考8种药物有较强耐药性,为临床用药提供理论依据。因此,当兔场发病时,及时对病原菌及其耐药情况进行检测分析,并配合环境消毒等措施,可以为兔场的疾病防治提供合理有效的方案。
本研究通过细菌的分离培养等试验方法,对病原菌进行鉴定、检测并分析了该致病菌引发的组织病理学变化和毒力基因分析。结果显示,该病原菌毒力基因携带情况复杂,可能对公共卫生安全具有潜在危害性。此外,该菌还对8种药物具有较强耐药性,存在多重耐药现象。因此,加强对养殖场粪便的处理和在养殖过程中规范使用抗菌药物对家兔的健康养殖具有重要意义。
4 结论从病兔体内分离出一种革兰阴性菌,通过细菌的分离鉴定、序列分析和动物回归试验等方法确定分离株为肺炎克雷伯菌。同时,本研究发现该菌株具有allS、kfu和uge基因,且对丁胺卡那、多黏菌素B、头孢哌酮及头孢曲松4种药物敏感,对其他药物均有不同程度的耐药性。此外,还发现感染该菌株的病兔多器官均出现不同程度病变。
| [1] |
王佳佳, 刘玉梅, 徐靖怡, 等. 兔源多杀性巴氏杆菌和肺炎克雷伯菌的分离鉴定与药敏试验[J]. 中国兽医学报, 2022, 42(4): 698-703. WANG J J, LIU Y M, XU J Y, et al. Isolation and identification of rabbit-derived Pasteurella multocida and Klebsiella pneumoniae and analysis of sensitive drugs[J]. Chinese Journal of Veterinary Science, 2022, 42(4): 698-703. (in Chinese) |
| [2] |
张昕, 张自强, 刘玉梅. 耐药性兔源肺炎克雷伯菌的研究进展[J]. 中国养兔杂志, 2022(1): 26-29, 33. ZHANG X, ZHANG Z Q, LIU Y M. Research progress of drug-resistant Klebsiella pneumoniae from rabbits[J]. Chinese Journal of Rabbit Farming, 2022(1): 26-29, 33. (in Chinese) |
| [3] |
张智, 李再新, 曾光菊, 等. 一株兔源耐药性肺炎克雷伯氏菌的分离与鉴定[J]. 中国畜牧兽医, 2013, 40(9): 199-203. ZHANG Z, LI Z X, ZENG G J, et al. Isolation and identification of a resistant K.peneumoniae strain from rabbits[J]. China Animal Husbandry & Veterinary Medicine, 2013, 40(9): 199-203. (in Chinese) |
| [4] |
张自强, 王佳佳, 任玉莹, 等. 兔源支气管败血波氏杆菌和肺炎克雷伯菌的分离鉴定及其对抗菌药物的敏感性分析[J]. 畜牧兽医学报, 2021, 52(8): 2254-2264. ZHANG Z Q, WANG J J, REN Y Y, et al. Isolation and Identification of rabbit-derived Bordetella bronchiseptica and Klebsiella pneumoniae and their antimicrobial susceptibility analysis[J]. Acta Veterinaria et Zootechnica Sinica, 2021, 52(8): 2254-2264. (in Chinese) |
| [5] |
王召朋, 柴同杰, 牟特, 等. 青岛地区兔肺炎克雷伯氏菌分离鉴定[J]. 山东畜牧兽医, 2012, 33(5): 16-18. WANG Z P, CHAI T J, MOU T, et al. Isolation and identification of Klebsiella pneumoniae in rabbits in Qingdao[J]. Shandong Journal of Animal Science and Veterinary Medicine, 2012, 33(5): 16-18. DOI:10.3969/j.issn.1007-1733.2012.05.009 (in Chinese) |
| [6] |
LIN J C, KOH T H, LEE N, et al. Genotypes and virulence in serotype K2 Klebsiella pneumoniae from liver abscess and non-infectious carriers in Hong Kong, Singapore and Taiwan[J]. Gut Pathogens, 2014, 6: 21. DOI:10.1186/1757-4749-6-21 |
| [7] |
和晋渝. 肺炎克雷伯菌的血清分型及毒力基因分布的研究[D]. 重庆: 重庆医科大学, 2012. HE J Y. Study on serotypes and distribution characteristic of virulence genes of Klebsiella pneumoniae[D]. Chongqing: Chongqing Medical University, 2012. (in Chinese) |
| [8] |
FANG C T, CHUANG Y P, SHUN C T, et al. A novel virulence gene in Klebsiella pneumoniae strains causing primary liver abscess and septic metastatic complications[J]. J Exp Med, 2004, 199(5): 697-705. DOI:10.1084/jem.20030857 |
| [9] |
LEE M H, MULROONEY S B, RENNER M J, et al. Klebsiella aerogenes urease gene cluster: sequence of ureD and demonstration that four accessory genes (ureD, ureE, ureF, and ureG) are involved in nickel metallocenter biosynthesis[J]. J Bacteriol, 1992, 174(13): 4324-4330. DOI:10.1128/jb.174.13.4324-4330.1992 |
| [10] |
REGUÉ M, HITA B, PIQUÉ N, et al. A gene, uge, is essential for Klebsiella pneumoniae virulence[J]. Infect Immun, 2004, 72(1): 54-61. DOI:10.1128/IAI.72.1.54-61.2004 |
| [11] |
YU W L, KO W C, CHENG K C, et al. Association between rmpA and magA genes and clinical syndromes caused by Klebsiella pneumoniae in Taiwan[J]. Clin Infect Dis, 2006, 42(10): 1351-1358. DOI:10.1086/503420 |
| [12] |
IZQUIERDO L, CODERCH N, PIQUE N, et al. The Klebsiella pneumoniae wabG gene: role in biosynthesis of the core lipopolysaccharide and virulence[J]. J Bacteriol, 2003, 185(24): 7213-7221. DOI:10.1128/JB.185.24.7213-7221.2003 |
| [13] |
WANG G Y, ZHAO G, CHAO X Y, et al. The characteristic of virulence, biofilm and antibiotic resistance of Klebsiella pneumoniae[J]. Int J Environ Res Public Health, 2020, 17(17): 6278. DOI:10.3390/ijerph17176278 |
| [14] |
王孝友, 杨睿, 沈克飞, 等. 兔肺炎克雷伯氏菌的分离与鉴定[J]. 中国兽医杂志, 2012, 48(2): 43-44. WANG X Y, YANG R, SHEN K F, et al. Isolation and identification of Klebsiella pneumoniae in rabbits[J]. Chinese Journal of Veterinary Medicine, 2012, 48(2): 43-44. (in Chinese) |
| [15] |
孙雪岩, 刘玉梅, 张天琪, 等. 兔源性肺炎克雷伯氏菌的研究现状及进展[J]. 中国养兔杂志, 2021(3): 24-29. SUN X Y, LIU Y M, ZHANG T Q, et al. Research status and progress of rabbit-derived Klebsiella pneumoniae[J]. Chinese Journal of Rabbit Farming, 2021(3): 24-29. (in Chinese) |
| [16] |
郝中香, 廖红, 刘丹, 等. 扭角羚肺炎克雷伯氏菌的分离鉴定[J]. 中国畜牧兽医, 2015, 42(1): 203-208. HAO Z X, LIAO H, LIU D, et al. Isolation and identification of K. pneumoniae in takin[J]. China Animal Husbandry & Veterinary Medicine, 2015, 42(1): 203-208. (in Chinese) |
| [17] |
许皓, 刘建荣, 王力欣, 等. 貂源肺炎克雷伯氏菌的分离与鉴定[J]. 吉林畜牧兽医, 2021, 42(3): 4-7. XU H, LIU J R, WANG L X, et al. Isolation and identification of Klebsiella pneumoniae from mink[J]. Jilin Animal Husbandry and Veterinary Medicine, 2021, 42(3): 4-7. (in Chinese) |
| [18] |
郭定宗, 胡薛英, 周诗其, 等. 金丝猴肺炎克雷伯氏菌及埃希氏大肠杆菌败血症的病理学观察[J]. 华中农业大学学报, 2001, 20(1): 60-62. GUO D Z, HU X Y, ZHOU S Q, et al. Pathological observation of septicemia on a golden monkey infected by Klebsiell pneumoniae and Escherichia coli[J]. Journal of Huazhong Agricultural University, 2001, 20(1): 60-62. (in Chinese) |
| [19] |
张诗渝. 肺炎克雷伯杆菌的分离鉴定及其对小鼠的致病性研究[D]. 南京: 南京农业大学, 2013. ZHANG S Y. Isolation and identification of Klebsiella pneumoniae and study on pathogenicity to mice[D]. Nanjing: Nanjing Agricultural University, 2013. (in Chinese) |
| [20] |
YOUNG T M, BRAY A S, NAGPAL R K, et al. Animal model to study Klebsiella pneumoniae gastrointestinal colonization and host-to-host transmission[J]. Infect Immun, 2020, 88(11): e00071-20. |
| [21] |
IWAHI T, ABE Y, NAKAO M, et al. Role of type 1 fimbriae in the pathogenesis of ascending urinary tract infection induced by Escherichia coli in mice[J]. Infect Immun, 1983, 39(3): 1307-1315. DOI:10.1128/iai.39.3.1307-1315.1983 |
| [22] |
HOLDEN V I, BREEN P, HOULE S, et al. Klebsiella pneumoniae siderophores induce inflammation, bacterial dissemination, and HIF-1αstabilization during pneumonia[J]. mBio, 2016, 7(5): e01397-16. |
| [23] |
CANO V, MARCH C, INSUA J L, et al. Klebsiella pneumoniae survives within macrophages by avoiding delivery to lysosomes[J]. Cell Microbiol, 2015, 17(11): 1537-1560. DOI:10.1111/cmi.12466 |
| [24] |
YOSHIDA K, MATSUMOTO T, TATEDA K, et al. Induction of interleukin-10 and down-regulation of cytokine production by Klebsiella pneumoniae capsule in mice with pulmonary infection[J]. J Med Microbiol, 2001, 50(5): 456-461. DOI:10.1099/0022-1317-50-5-456 |
| [25] |
HOLDEN V I, BACHMAN M A. Diverging roles of bacterial siderophores during infection[J]. Metallomics, 2015, 7(6): 986-995. |
| [26] |
XUE J, TAN B, YANG S Y, et al. Influence of cAMP receptor protein (CRP) on bacterial virulence and transcriptional regulation of allS by CRP in Klebsiella pneumoniae[J]. Gene, 2016, 593(1): 28-33. |
| [27] |
YU W L, KO W C, CHENG K C, et al. Comparison of prevalence of virulence factors for Klebsiella pneumoniae liver abscesses between isolates with capsular K1/K2 and non-K1/K2 serotypes[J]. Diagn Microbiol Infect Dis, 2008, 62(1): 1-6. |
| [28] |
张志翔, 王文豪, 张奕菲, 等. 一例兔场肺炎克雷伯氏菌和多杀性巴氏杆菌混合感染的诊断及治疗[J]. 中国养兔杂志, 2022(2): 6-10. ZHANG Z X, WANG W H, ZHANG Y F, et al. Diagnosis and treatment of Klebsiella pneumoniae and Pasteuscidae[J]. Chinese Journal of Rabbit Farming, 2022(2): 6-10. (in Chinese) |
(编辑 范子娟)



