2. 南京农业大学动物医学院单分子纳米生物学实验室, 南京 210095;
3. 中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室, 哈尔滨 150069;
4. 兽用生物制品(泰州)国泰技术创新中心, 泰州 225300
2. College of Veterinary Medicine, Nanjing Agricultural University, Single Molecule Nanometry Laboratory (Sinmolab), Nanjing 210095, China;
3. State Key Laboratory of Veterinary Biotechnology, Harbin Veterinary Research Institute, Chinese Academy of Agricultural Sciences, Harbin 150069, China;
4. GuoTai (Taizhou) Center of Technology Innovation for Veterinary Biologicals, Taizhou 225300, China
非洲猪瘟是由非洲猪瘟病毒(African swine fever virus,ASFV)感染引起猪的一种急性、热性和高度致死性传染病[1],急性病死率高达100%[2],为世界动物卫生组织(OIE) 规定必须通报的动物传染病,也是我国的一类动物传染病和优先防范的重要外来疫病[3]。ASF进入亚洲给全球养猪产业造成了巨大经济损失[4]。ASFV感染包括急性、亚急性、慢性和无症状的病毒携带这四种类型,临床特征多表现为高热、出血和皮肤紫绀等,剖检可见以脾为主的、累及多器官的充血、肿大和出血等。但这些症状与猪瘟(classical swine fever,CSF)、猪繁殖与呼吸综合征(porcine reproductive and respiratory syndrome,PRRS)极为相似,所以需要借助灵敏有效的检测手段加以确诊[5]。此外,目前尚无安全有效的疫苗来预防ASF。因此,借助快速敏感的早期检测技术,在感染现场第一时间作出准确诊断是ASF防控的关键。
近几年,一些适合现场快速检测的高新技术,如等温扩增、免疫层析技术和微流控芯片等已用于ASFV的检测研究[6-7]。哈登楚日亚等[8]利用重组酶聚合酶扩增技术, 针对ASFV B646 L/P72基因建立了实时荧光重组酶聚合扩增方法。吴海涛等[9]基于胶体金免疫层析技术制备了ASFV抗原蛋白检测胶体金试纸条。上海速芯生物科技有限公司研发出一款可准确、快速检测ASFV的微流控芯片快速检测试剂盒[10]。本研究团队利用重组酶聚合酶扩增技术结合侧向层析技术开发了ASFV核酸检测量子点试纸条[11]。此外,由中国动物卫生与流行病学中心等单位研制的ASFV荧光微球检测试纸条(二类)和北京森康生物技术开发有限公司等单位研制的ASFV荧光等温扩增检测试剂盒(三类)已获批新兽药。上述方法很好地实现了ASFV分子或抗原的敏感检测,但由于目前临床上常需要对ASFV进行抗原和抗体同步检测来确认感染。因此,建立新型血清学诊断方法用以满足ASF现场早期、灵敏、快速诊断的要求成为急需。
猪感染ASFV后血清抗体最早在8~12 d才开始转阳[12],无法完全满足ASFV感染的早期诊断。由口鼻上皮和相关固有层组成的保护性黏膜被认为是宿主对抗ASFV的第一道防线,可引起黏膜免疫反应[13-14]。与普通抗体相比,分泌型免疫球蛋白A(sIgA)作为参与黏膜免疫最主要的效应因子,具有亲和力更高、稳定性更好、在机体外分泌道中分泌时间更早等特点,因此具备成为ASFV早期诊断靶标的潜力。量子点免疫试纸条技术基于抗原抗体的特异性反应,结合量子点荧光强度强、生物相容性好、荧光寿命长等优良特性,在病原菌现场诊断中显示出了广阔的应用前景。本研究筛选ASF早期抗原p30蛋白作为检测工具,以口腔液中的ASFV sIgA抗体作为检测靶标,开发ASFV sIgA抗体量子点免疫荧光检测试纸条。该检测方法灵敏度高、稳定性好、反应时间短、检出时间早、操作简单,可以为ASF的防控提供技术参考。
1 材料与方法 1.1 试验材料1.1.1 生物样本来源 100份ASFV阴性口腔液临床样本为江苏省农业科学院兽医研究所2018年以前采集保存的猪口腔液样本。16份采自4头ASFV人工感染猪(肌注105 HAD50 HLJ/18)接种后第20、22、24和26天的灭活阳性口腔液样本和灭活的血清样本。经商品化血清抗体ELISA检测试剂盒(金诺百泰生物技术有限公司,批号:20210646)检测为阳性(见OSID补充材料)。12份采自ASFV人工感染猪(口鼻接种104 HAD50 HLJ/18)的不同时间点的灭活口腔液样本和灭活的血清样本。2份采自2头ASFV同居感染猪感染后第22天的灭活阳性口腔液样本,同居感染通过与4头肌注106 TCID50 SD/DY-I/21或HLJ/HRB1/20于接种第1天共饲养实现。上述样本均由哈尔滨兽医研究所提供。用于特异性鉴定试验的伪狂犬病病毒(pseudorabies virus,PRV)、CSFV和PRRSV阳性口腔液标准品由江苏省农业科学院兽医研究所保藏。
1.1.2 主要仪器与试剂 荧光免疫分析仪(杭州中翰盛泰生物技术股份有限公司),肠激酶(北京碧云天生物技术有限公司)亲水性CdSe/ZnS QDMs(武汉珈源量子点技术开发有限公司),1-乙基-3-(3-二甲氨基丙基)氯化碳二酰亚胺(EDC)和蔗糖(美国Sigma-Aldrich),N-羟基琥珀酰亚胺(NHS)和牛血清白蛋白(BSA)(上海阿拉丁生化科技股份有限公司),鼠抗猪IgA-Sc片段抗体、兔抗鸡IgY和鸡IgY蛋白(美国Bethyl),硝化棉(NC)膜、吸收垫和样品垫(英国Whatman)。
1.2 试验方法1.2.1 p30重组蛋白制备 1) 利用无缝克隆技术构建pET32a-p30重组载体;2)利用原核表达系统在大肠杆菌BL21中以0.4 mmol·L-1 IPTG诱导p30重组蛋白表达,16 ℃培养18 h;3)利用Ni亲和层析柱纯化带有His标签的p30重组蛋白;4)利用肠激酶切除经pET32a载体重组表达自带的Trx-tag、His-tag和S-tag标签,并再次利用Ni亲和层析柱纯化酶切后p30重组蛋白;5)经PBS透析和超滤浓缩管浓缩获得无标签的p30重组蛋白;6)利用Western blot验证制备的p30重组蛋白的免疫原性。
1.2.2 QDM-p30和QDM-兔抗鸡IgY探针制备 参照实验室已建立的QDM与蛋白质的偶联条件制备量子点荧光探针[15]。首先,100 μL的羧基修饰的QDMs被添加至含20 mg·mL-1EDC和20 mg·mL-1 NHS的20 mmol·L-1 MES缓冲液(2-[N-morpholino] ethanesulfonic acid,pH 6)中,于37 ℃孵育15 min。接着以10 000 g离心活化后的羧基修饰QDMs 20 min,再以100 mL MES缓冲液(0.02 mol·L-1,pH 8.00)重悬。分别加入14 μg p30重组蛋白和10 μg兔抗鸡IgY,在37 ℃下孵育2 h,加入4 mL 10% BSA溶液封闭微球表面未结合的羧基。以10 000 g离心10 min后,用200 mL PB(磷酸盐缓冲液,0.02 mol·L-1,pH 7)缓冲液重悬QDM-p30和QDM-兔抗鸡IgY探针,4 ℃避光保存备用。
1.2.3 量子点免疫试纸条制备与检测体系建立 1) 制备检测线(T线)为鼠抗猪IgA-Sc片段抗体,质控线(C线)为鸡IgY蛋白的侧向流免疫试纸条,并将QDM-兔抗鸡IgY质控探针均匀的喷于NC膜上,免疫试纸条干燥后于室温下保存备用;2)取7 μL待检口腔液样本与1 μL QDM-p30检测探针经62 μL样本稀释液(含1%脱脂乳的PBS,pH 7.4)混合后,全部加至试纸条的样品垫上,室温下静置反应15 min后,待检样品中经QDM-p30捕获的ASF sIgA抗体被固定于T线上的鼠抗猪IgA-Sc片段抗体再次捕获(图 1),通过检测量子点荧光信号实现样本中抗体水平的定性及定量检测。检测结果可通过微型手持紫外灯定性观察,也可利用荧光免疫分析仪定量分析。
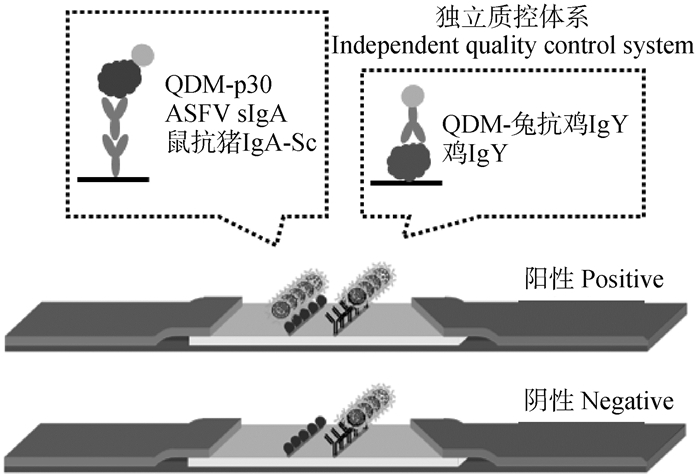
|
QDM.量子点微球 QDM. Quantum dot microsphere 图 1 ASFV sIgA抗体量子点免疫试纸条检测原理 Fig. 1 Schematic diagram of QDM-based immunostrip for ASFV sIgA antibody detection |
1.2.4 Cutoff值确定 利用建立的方法检测本实验室保藏的100份ASFV阴性口腔液临床样本,计算所有样本的T线荧光平均值和标准差值,再通过公式cutoff值=平均值+3×标准差确立该方法的Cutoff值。此外,使用于37 ℃加速老化1个月的试纸条检测100份ASFV阴性口腔液临床样本,计算所有样本的C线荧光平均值和标准差值,以把最小C值包含在内的计算值作为试纸条检测成立值。将T线位置观测到显著条带且T值大于等于cutoff值,C线位置观测到显著条带且值大于等于成立值作为阳性判定标准。
1.2.5 灵敏度检测 将热灭活ASFV阳性口腔液进行2倍梯度稀释至1/2、1/4、1/8、1/16、1/32、1/64和1/128,利用建立的方法进行3次重复检测,确定该方法敏感性。热灭活ASFV阳性口腔液采自ASFV人工感染猪(口鼻接种104 HAD50 HLJ/18)接种后第22天(DPI22)的口腔液样本,由哈尔滨兽医研究所提供。经OIE颁布的qPCR方法(Ct值为27.042)和商品化血清抗体ELISA检测试剂盒(金诺百泰生物技术有限公司,批号:20210646)检测均为阳性(见OSID补充材料)。
1.2.6 特异性验证 利用建立的方法重复三次检测PRV、CSFV、PRRV标准阳性口腔液,验证该方法的检测特异性。PBS作为空白对照,热灭活ASFV阳性口腔液(口鼻接种104 HAD50 HLJ/18,DPI 22)作为阳性对照。此外,检测热灭活ASFV Ⅰ型天然弱毒株SD/DY-I/21感染阳性口腔液和热灭活ASFV Ⅱ型天然弱毒株HLJ/HRB1/20感染阳性口腔液鉴定本研究方法对ASFV天然弱毒株的特异性。
1.2.7 临床样本检测效能评价 利用建立的方法检测16份人工感染ASFV HLJ/18猪的热灭活ASFV阳性口腔液临床样本和20份ASFV阴性口腔液临床样本。另外,分别利用建立的方法和商品化血清抗体ELISA检测试剂盒(金诺百泰生物技术有限公司,批号:20210646)检测人工感染ASFV后不同时间点的口腔液样本和血清样本,比较病毒最早检出时间。
2 结果 2.1 ASFV p30抗原蛋白的制备利用原核表达系统在大肠杆菌BL21中诱导pET32a-p30表达,再经Ni柱亲和层析纯化带有Trx、S和His标签的p30重组蛋白,蛋白相对分子质量约为50 ku。结果如图 2A所示,重组蛋白被含250 mmol·L-1咪唑的洗脱液(PBS,pH 7.9)集中洗脱。经PBS透析去除咪唑后,再利用肠激酶切除经pET32a载体重组表达自带的标签蛋白(Trx、S和His标签,约14 ku)。酶切产物经Ni柱纯化,含有His的标签蛋白被结合在层析柱上。结果如图 2B所示,酶切后p30重组蛋白(约36 ku)蛋白被含50 mmol·L-1咪唑的洗脱液集中洗脱。利用Western blot验证制备的p30重组蛋白的免疫原性,结果如图 2C所示:由于切除了载体标签,制备获得的p30重组蛋白不能与His单抗反应;制备获得的p30重组蛋白能够与p30单抗和热灭活ASFV阳性口腔液产生单一反应条带,具备良好的免疫原性。
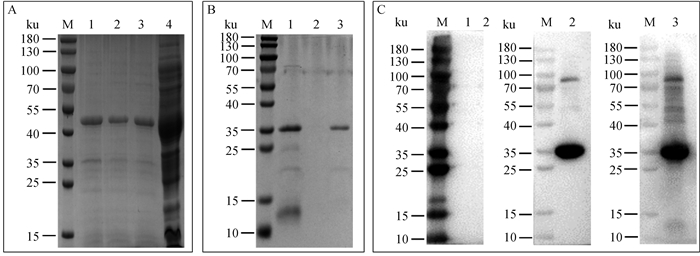
|
A. pET32a-p30重组蛋白的纯化SDS-PAGE结果(M.180 ku蛋白质相对分子质量标准;1~3. 含250 mmol·L-1咪唑的洗脱液洗脱产物;4. 流穿液);B. pET32a-p30重组蛋白的标签酶切与纯化SDS-PAGE结果(M.180 ku蛋白质相对分子质量标准;1. pET32a-p30重组蛋白经肠激酶酶切后产物;2. 肠激酶酶切产物流穿液;3. 含50 mmol·L-1咪唑的洗脱液洗脱产物);C. 肠激酶酶切纯化后p30重组蛋白Western blot结果(M. 180 ku蛋白质相对分子质量标准;1. 兔抗鼠His单抗为一抗;2. 兔抗鼠p30单抗为一抗;3. 热灭活ASFV阳性口腔液为一抗) A. SDS-PAGE results of purified pET32a-p30 recombinant protein (M.180 ku protein marker; 1-3. Elution products containing 250 mmol·L-1 imidazole; 4. Flow through liquid); B. SDS-PAGE results of label digested and purified pET32a p30 recombinant protein (M.180 ku protein marker; 1. The product of pET32a p30 recombinant protein after enterokinase digestion; 2. Enterokinase digestion and logistics penetration; 3. Elution products containing 50 mmol·L-1 imidazole elution solution); C. Western blot results of p30 recombinant protein purified by enterokinase digestion (M. 180 ku protein marker; 1. Rabbit anti mouse His monoclonal antibody as primary antibody; 2. Rabbit anti mouse p30 monoclonal antibody as primary antibody; 3. Heat inactivated ASFV positive oral fluid as primary antibody) 图 2 ASFV p30抗原蛋白制备 Fig. 2 Preparation of recombinant protein ASFV p30 |
利用开发的ASFV sIgA抗体量子点免疫荧光试纸条检测本实验室保藏的100份ASFV阴性口腔液临床样本。如图 3所示,100份ASFV阴性口腔液临床样本的T均值为552.4,标准差为258.3,cutoff值为1 327。C均值为9 120,标准差为2 517,其中最小C值为4 598,当C均值减去2倍标准差时(4 086),最小C值包含在内,因此设定当C值大于等于4 086时试验成立。
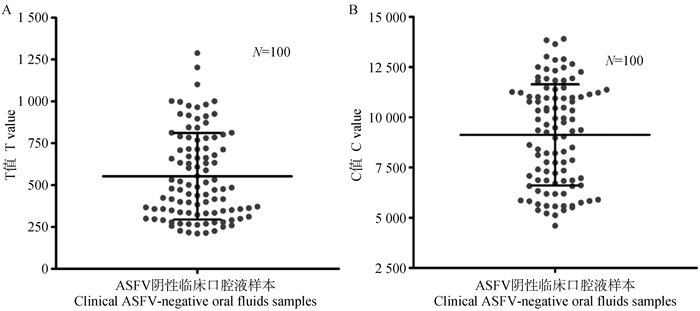
|
A. 100份临床阴性样本检测T值;B. 100份临床阴性样本检测C值 A. T values of 100 clinical negative samples; B. C value of 100 clinical negative samples 图 3 100份ASFV临床阴性口腔液样本检测结果 Fig. 3 Detection results of 100 clinical ASFV-negative oral fluid samples |
利用开发的ASFV sIgA抗体量子点免疫荧光试纸条检测梯度稀释的ASFV阳性口腔液。如图 4所示,本研究建立的检测方法可实现口腔液中ASFV黏膜抗体sIgA的高灵敏性检测,最低检测限为1:64。此时T线的平均值为2 037,高于cutoff值为1 327的阳性判定标准。所有样品的C线值均位于大于4 086。
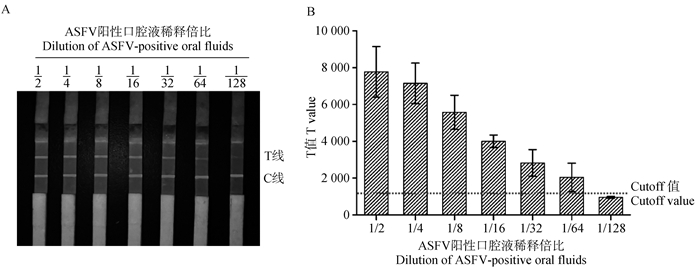
|
A. 量子点免疫试纸条检测ASFV阳性口腔液结果;B. 量子点免疫试纸条检测ASFV阳性口腔液荧光强度T值统计分析结果。虚线指示cutoff值 A. Quantum dot immunoassay strip detection of ASFV positive oral fluid results; B. Statistical analysis results of the fluorescence intensity T value of ASFV positive oral fluid detected by quantum dot immunoassay strips. The dashed line indicates the cutoff value 图 4 灵敏度检测结果 Fig. 4 Sensitivity test results |
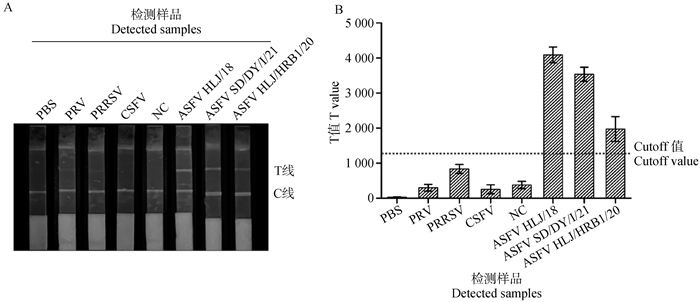
利用开发的ASFV sIgA抗体量子点免疫荧光试纸条检测PRV、CSFV、PRRSV阳性口腔液标准品,ASFV强毒株HLJ/18感染口腔液,ASFV弱毒株SD/DY-I/21感染口腔液,以及ASFV弱毒株HLJ/HRB1/20感染口腔液鉴定特异性。PBS作为空白对照。结果如图 5所示,本研究建立的检测方法与PRV、PRRSV和CSFV不存在交叉反应,该方法能够特异性检测不同亚型、不同毒力的ASFV sIgA抗体。
|
A. 量子点免疫试纸条检测PRV、PRRSV、CSFV、ASFV阳性口腔液和ASFV阴性口腔液(NC)结果;B.量子点免疫试纸条检测PRV、PRRSV、CSFV、ASFV阳性口腔液和ASFV阴性口腔液(NC)荧光强度T值统计分析结果。PBS为空白对照,虚线指示cutoff值 A. The results of PRV, PRRSV, CSFV, ASFV positive oral fluid and ASFV negative oral fluid (NC) detection using quantum dot immunoassay strips; B. Statistical analysis results of fluorescence intensity T values of PRV, PRRSV, CSFV, ASFV positive oral fluid, and ASFV negative oral fluid (NC) detected by quantum dot immunoassay strips. PBS is a blank control, the dashed line indicating the cutoff value 图 5 特异性检测结果 Fig. 5 Specificity test results |
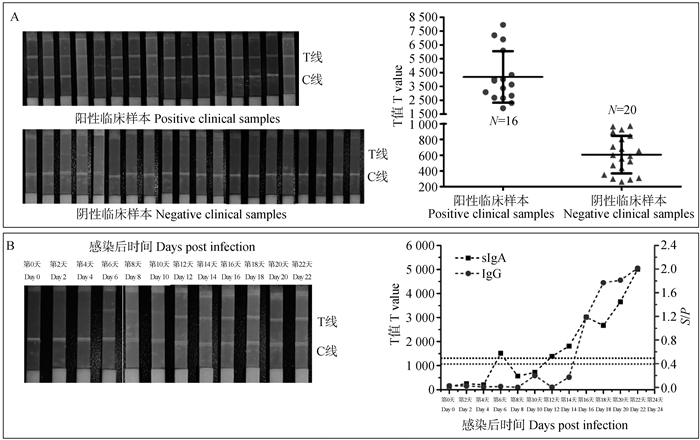
利用开发的ASFV sIgA抗体量子点免疫荧光试纸条检测本实验室保藏的20份ASFV阴性口腔液临床样本和16份ASFV阳性口腔液样本。如图 6A所示,本研究建立的检测方法能够实现口腔液中ASFV sIgA抗体的特异性检测。此外,分别利用本研究建立的方法和商品化血清抗体ELISA检测试剂盒检测人工感染ASFV不同时间点的口腔液样本和血清样本,发现本研究建立方法最早可于感染后第6天检出,显著早于商品化试剂盒第16天的最早转阳时间(图 6B)。
|
A. 量子点免疫试纸条检测ASFV阴性和阳性临床口腔液样本结果;B.量子点免疫试纸条和商品化血清抗体ELISA检测试剂盒检测人工感染ASFV不同时间点的口腔液样本和血清样本结果(深色虚线指示量子点免疫试纸条方法的cutoff值,浅色虚线指示商品化血清抗体ELISA检测试剂盒的cutoff值) A. The results of quantum dot immunoassay strips for detecting ASFV negative and positive clinical oral fluid samples; B. The results of using quantum dot immunoassay strips and commercialized serum antibody ELISA detection kits to detect oral fluid samples and serum samples artificially infected with ASFV at different time points (Dark dashed line indicate the cutoff value of the quantum dot immunoassay strip method, light dashed line indicate the cutoff value of the commercialized serum antibody ELISA detection kit) 图 6 临床样本检测结果 Fig. 6 Clinical samples test results |
目前,ASFV流行形式复杂。表现为亚急性、长潜伏或持续性感染的ASFV Ⅰ型和Ⅱ型天然弱毒株对ASFV防控构成了严重威胁。在感染现场第一时间作出准确诊断仍是ASF防控的首要关键。血清学诊断无需核酸提取和扩增、假阳性率、操作便捷,较病毒核酸检测更适应现场即时检验的需求。因此,开发敏感、快速、高效的ASFV抗体即时检测方案对助益ASF防控十分必要。
基于全病毒抗原或重组表达抗原(如p72、p54、p30等)的ELISA方法是世界动物卫生组织(OIE)推荐的ASF抗体检测方法。Gimenez-Lirola等[12]在ASFV早期抗体检测中利用免疫荧光珠分析(multiple fluorescent beads immunoassay,FMIA)比较了三种ASFV抗原蛋白p30、p54和p72,发现当以p30作为包被抗原时可在接种后8~12 d感染猪的血清和口腔液中检测到特异性抗体。袁芳峰等[16]基于p30蛋白建立一种敏感性好、重复性强的ASFV抗体检测阻断ELISA方法。ELISA是目前实验室最常用的ASFV血清抗体检测方法, 由于其操作繁琐,耗时长,依赖仪器等限制,在缺乏实验室条件的猪场中应用受限。基于胶体金、乳胶微球和时间分辨率荧光微球(time-resolved fluorescent microspheres)的侧向流免疫层析技术被越来越多地应用于猪场ASFV抗体的POCT检测。万英等[17]和张欣雨等[18]开发了ASFV胶体金免疫检测试纸条。Sastre等[19]开发了基于衣壳蛋白VP72的乳胶微球免疫层析试纸条用于ASFV和CSFV的血清抗体检测。李成飞等[20]以截短的p54作为靶标抗原,开发了ASFV血清抗体荧光微球免疫试纸条。但是,上述试纸条方法的敏感性以及对于ASFV临床早期诊断仍待进一步提高。
与石墨烯、增频纳米粒子和荧光染料相比,量子点具有激发宽、发射窄、量子产率高、光化学稳定性和生物相容性好等优点,在提高生物制品检测敏感性方面展现出了巨大的应用潜力[21-23]。此外,与离散的量子点相比,量子点聚合微球(QDMs)往往具有更高的荧光信号、较强的反光子漂白性能和光化学稳定性。sIgA抗体是宿主黏膜部分应对感染首先产生的免疫抗体。本团队靶向黏膜抗体成功研制了国际首个猪肺炎支原体sIgA-ELISA抗体检测试剂盒(新兽药证字4号,2018)。该试剂盒不仅实现了猪肺炎支原体的早期诊断,还解决了猪气喘病活疫苗与灭活疫苗缺乏临床快速评估手段的问题[24]。此外,黏膜抗体IgA作为猪流行性腹泻病毒抗体检测靶标的ELISA试剂盒也于近期获得了批准文号(新兽药证字04号,2023)。可见,针对黏膜抗体IgA的检测具有良好的应用前景和商业化潜能。本研究将侧向流免疫层析技术的高特异性,与QDMs的超敏感性以及黏膜sIgA抗体的早期性相结合,开发了一种靶向ASFV黏膜抗体sIgA检测的量子点荧光试纸条(图 1)。经检测,该方法对ASFV sIgA抗体检测灵敏度高、特异性好,对ASFV阳性口腔液的最低检出稀释度可达1:64(图 4),且适用于不同亚型、不同毒力的ASFV sIgA抗体检测(图 5)。相较于市场上普遍使用的血清IgG抗体检测,口腔液sIgA检测无需侵入式样本采集,耗时更短,能在室温条件下、约20 min内完成目标样本的检测,可满足亚急性感染、慢性感染和临床健康ASF康复猪场的“拔牙清除”需求。此外,利用本研究方法检测ASFV人工感染猪口腔液中sIgA抗体时,最早于感染后第6天出现转阳,继抗体水平短暂下降后,再于感染后第12天起检测到稳定的阳性结果(图 6B)。这可能是由于口腔液中黏膜抗体均一性较差,或动物饮水、饮食等行为稀释了口腔液样本抗体含量导致的。值得注意的是,考虑到此次检测样本数量有限,该方法的最早检出时间仍需进一步的检验。
4 结论本研究基于QDMs-p30检测探针开发了量子点免疫试纸条,实现了口腔液中ASFV sIgA抗体灵敏且特异的POCT诊断,填补了市场上ASFV黏膜抗体检测方法空白。与商品化ASFV抗体检测ELISA试剂盒相比,应用该方法检测不同时间点的口腔液样本,最早可于人工感染后第6天检出阳性,显著早于血清抗体ELISA检测试剂盒第16天的最早检出时间。考虑到其灵敏度高、特异性好、操作便捷、处理速度快(整个过程约20 min)、检出时间早和能现场即时检验等优点,本研究开发的口腔液中ASFV sIgA抗体量子点荧光检测试纸条是猪场ASF现场筛查的一种潜在工具。
| [1] |
聂赟彬, 乔娟. 非洲猪瘟发生对我国生猪产业发展的影响[J]. 中国农业科技导报, 2019, 21(1): 11-17. NIE Y B, QIAO J. Impact of African swine fever on the development of pig industry in China[J]. Journal of Agricultural Science and Technology, 2019, 21(1): 11-17. DOI:10.13304/j.nykjdb.2018.0601 (in Chinese) |
| [2] |
COSTORD S, MUR L, LUBROTH J, et al. Epidemiology of African swine fever virus[J]. Virus Res, 2013, 173(1): 191-197. DOI:10.1016/j.virusres.2012.10.030 |
| [3] |
ALEJO A, MATAMOROS T, GUERRA M, et al. A proteomic atlas of the African swine fever virus Particle[J]. J Virol, 2018, 92(23): e01293-18. |
| [4] |
SÁNCHEZ-CORDÓN P J, MONTOYA M, REIS A L, et al. African swine fever: a re-emerging viral disease threatening the global pig industry[J]. Vet J, 2018, 233: 41-48. DOI:10.1016/j.tvjl.2017.12.025 |
| [5] |
DIXON L K, SUN H, ROBERTS H. African swine fever[J]. Antiviral Res, 2019, 165: 34-41. DOI:10.1016/j.antiviral.2019.02.018 |
| [6] |
JAMES H E, EBERT K, MCGONIGLE R, et al. Detection of African swine fever virus by loop-mediated isothermal amplification[J]. J Virol Methods, 2010, 164(1-2): 68-74. DOI:10.1016/j.jviromet.2009.11.034 |
| [7] |
JAUSET-RUBIO M, SVOBODOVÁ M, MAIRAL T, et al. Ultrasensitive, rapid and inexpensive detection of DNA using paper based lateral flow assay[J]. Sci Rep, 2016, 6: 37732. DOI:10.1038/srep37732 |
| [8] |
哈登楚日亚, 樊晓旭, 赵永刚, 等. 非洲猪瘟病毒实时荧光重组酶聚合酶扩增技术(RPA)检测方法的建立[J]. 中国畜牧兽医, 2017, 44(11): 3270-3277. HADENG C R, FAN X X, ZHAO Y G, et al. Establishment of a real-time fluorescent recombinase polymerase amplification (RPA) for the detection of African swine fever virus[J]. China Animal Husbandry & Veterinary Medicine, 2017, 44(11): 3270-3277. DOI:10.16431/j.cnki.1671-7236.2017.11.023 (in Chinese) |
| [9] |
吴海涛, 成大荣, 吴萌, 等. 非洲猪瘟病毒胶体金免疫层析试纸条的研制[J]. 黑龙江畜牧兽医, 2018(17): 126-128, 238. WU H T, CHENG D R, WU M, et al. Development of a colloidal gold immunochromatographic test strip for the detection of African swine fever virus[J]. Heilongjiang Animal Science and Veterinary Medicine, 2018(17): 126-128, 238. DOI:10.13881/j.cnki.hljxmsy.2017.09.0190 (in Chinese) |
| [10] |
上海速芯生物科技有限公司. 非洲猪瘟的快速检测——速芯科技[J]. 食品安全导刊, 2019(25): 42-43. Superchip Technology. The rapid detection of African swine fever——iMole Tec[J]. China Food Safety Magazine, 2019(25): 42-43. DOI:10.16043/j.cnki.cfs.2019.25.010 (in Chinese) |
| [11] |
WEN X Y, XIE Q Y, LI J H, et al. Rapid and sensitive detection of African swine fever virus in pork using recombinase aided amplification combined with QDMs-based test strip[J]. Anal Bioanal Chem, 2022, 414(13): 3885-3894. DOI:10.1007/s00216-022-04030-6 |
| [12] |
GIMÉNEZ-LIROLA L G, MUR L, RIVERA B, et al. Detection of african swine fever virus antibodies in serum and oral fluid specimens using a recombinant protein 30 (P30) dual matrix indirect ELISA[J]. PLoS One, 2016, 11(9): e0161230. DOI:10.1371/journal.pone.0161230 |
| [13] |
REVILLA Y, PÉREZ-NÚÑEZ D, RICHT J A. African swine fever virus biology and vaccine approaches[J]. Adv Virus Res, 2018, 100: 41-74. |
| [14] |
SÁNCHEZ E, PÉREZ-NÚÑEZ D, REVILLA Y. Mechanisms of entry and endosomal pathway of african swine fever virus[J]. Vaccines (Basel), 2017, 5(4): 42. DOI:10.3390/vaccines5040042 |
| [15] |
LI J H, BAI Y, LI F, et al. Rapid and ultra-sensitive detection of African swine fever virus antibody on site using QDM based-ASFV immunosensor (QAIS)[J]. Anal Chim Acta, 2022, 1189: 339187. DOI:10.1016/j.aca.2021.339187 |
| [16] |
YUAN F F, PETROVAN V, GIMENEZ-LIROLA L G, et al. Development of a blocking enzyme-linked immunosorbent assay for detection of antibodies against african swine fever virus[J]. Pathogens, 2021, 10(6): 760. DOI:10.3390/pathogens10060760 |
| [17] |
WAN Y, SHI Z W, PENG G, et al. Development and application of a colloidal-gold dual immunochromatography strip for detecting African swine fever virus antibodies[J]. Appl Microbiol Biotechnol, 2022, 106(2): 799-810. DOI:10.1007/s00253-021-11706-z |
| [18] |
ZHANG X Y, LIU X Y, WU X D, et al. A colloidal gold test strip assay for the detection of African swine fever virus based on two monoclonal antibodies against P30[J]. Arch Virol, 2021, 166(3): 871-879. DOI:10.1007/s00705-020-04915-w |
| [19] |
SASTRE P, PEREZ T, COSTA S, et al. Development of a duplex lateral flow assay for simultaneous detection of antibodies against African and Classical swine fever viruses[J]. J Vet Diagn Invest, 2016, 28(5): 543-549. |
| [20] |
LI C F, HE X L, YANG Y, et al. Rapid and visual detection of African swine fever virus antibody by using fluorescent immunochromatography test strip[J]. Talanta, 2020, 219: 121284. |
| [21] |
王宗花, 高艳丽, 张菲菲, 等. 量子点在分析检测中的应用进展[J]. 分析科学学报, 2012, 28(1): 119-125. WANG Z H, GAO Y L, ZHANG F F, et al. Applications of quantum dot in analysis and detection[J]. Journal of Analytical Science, 2012, 28(1): 119-125. (in Chinese) |
| [22] |
BAO M D, JENSEN E, CHANG Y, et al. Magnetic bead-quantum dot (MB-Qdot) clustered regularly interspaced short palindromic repeat assay for simple viral DNA detection[J]. ACS Appl Mater Interfaces, 2020, 12(39): 43435-43443. |
| [23] |
ACHADU O J, ABE F, LI T C, et al. Molybdenum trioxide quantum dot-encapsulated nanogels for virus detection by surface-enhanced raman scattering on a 2D substrate[J]. ACS Appl Mater Interfaces, 2021, 13(24): 27836-27844. |
| [24] |
BAI Y, GAN Y, HUA L Z, et al. Application of a sIgA-ELISA method for differentiation of Mycoplasma hyopneumoniae infected from vaccinated pigs[J]. Vet Microbiol, 2018, 223: 86-92. |
(编辑 白永平)



