2. 西藏农牧学院动物科学学院 西藏高原饲料加工工程研究中心 西藏高原生态草牧业协同创新中心, 林芝 860000;
3. 齐全农牧集团股份有限公司, 遂宁 629000
2. Collaborative Innovation Centre of Ecological Grassland Animal Husbandry in Tibet Plateau, Tibetan Plateau Feed Processing Engineering Research Centre, College of Animal Science, Tibet Agricultural and Animal Husbandry University, Linzhi 860000, China;
3. Complete Agriculture and Animal Husbandry Group Co., Ltd., Suining 629000, China
纤维最初被认为是动物不能消化的植物细胞壁成分[1]。在传统畜牧业中,纤维一直被认为是降低猪生长性能和营养物质消化率的抗营养因子。然而,最近的研究表明,纤维不仅会增加猪的饱腹感,而且在促进动物肠道发育和生理功能等方面发挥着至关重要的作用[2-3]。日粮中加入适量的纤维可以降低饲料成本,使生长育肥猪的肠道菌群产生高纤维耐受性,进而提高纤维的消化能力。不同比例的纤维具有不同的理化性质,纤维在日粮中的含量会影响其调节肠道微生物的潜力[4-5]。先前的研究发现,日粮中添加5%的麦麸或者玉米麸皮对于猪的生长性能、免疫功能以及肠道微生物是有益的[6]。然而,也有研究指出,日粮中添加10%麦麸对猪的生长性能和肠道菌群没有显著影响[7]。因此,纤维在生长育肥猪中的应用仍需要深入探索。
纤维在畜牧业的应用已经比较广泛,对于猪的研究主要集中在预防仔猪腹泻以及母猪便秘,而对生长育肥猪胴体性状和肉品质影响的研究报道较少。因此,本研究旨在探究高纤维对生长育肥猪生长性能、肉品质、肠道形态以及肠道菌群的影响,以期为降低生产成本,提高畜产品经济效益及高纤维在育肥猪中的应用提供理论依据。
1 材料与方法 1.1 试验设计及试验日粮试验选取72头初始体重为(48.83±0.49)kg、健康的杜×长×大三元杂交生长猪,随机分为2组,每组4个重复,每个重复9头猪。对照组(CON)饲喂基础日粮,高纤维组(HF)饲喂含15%麦麸的高纤维日粮。试验日粮参照NRC(2012)猪营养需要标准进行配制,日粮的组成及营养水平见表 1。
|
|
表 1 试验日粮组成及营养水平 Table 1 Ingredient composition and nutrient levels of the diets |
试验在陕西省延安市洛川生猪养殖示范基地进行。养殖场具备通风、卫生良好的饲养环境,试验前对圈舍进行熏蒸消毒(甲醛∶高锰酸钾=2∶1)5 d,熏蒸结束后开门窗透气。试验期为84 d,1~6周对照组饲喂基础日粮,高纤维组饲喂麦麸含量为15%的高纤维日粮;7~12周两组统一饲喂高纤维日粮,研究高纤维日粮对育肥猪的影响以及育肥猪对高纤维日粮是否具有适应性。生长育肥猪自由采食和饮水。每天打扫圈舍,保持猪舍干燥、通风,记录猪只健康状况。试验结束时,分别从两组中随机选择7头猪进行屠宰。
1.3 测定指标及方法1.3.1 生长性能 试验第1、22、43、64、85天晨饲前对猪空腹称重,计算每头猪的平均日增重(ADG)。试验过程中每天记录投放饲料量、余料量及损料量,计算平均日采食量(ADFI)、料重比(F/G)。
1.3.2 肉品质性状 试验结束后进行屠宰,参照NY/T 821—2004《猪肌肉品质测定技术规范》取背最长肌测定大理石纹、肉色、pH45 min、pH24 h、失水率等胴体肉品质指标。
1.3.3 肌纤维横截面积 对4%多聚甲醛溶液固定的猪背最长肌进行修块和组织脱水、石蜡包埋、切片、脱蜡、苏木精-伊红(HE)染色、脱水、中性树胶封片,在显微镜下测定肌纤维横截面积。
1.3.4 肌纤维类型基因表达水平 育肥猪屠宰后立刻取背最长肌放到液氮中进行冻存,将组织样本从液氮取出少许提取组织RNA,用核酸蛋白检测仪测定RNA浓度。逆转录按照PrimeScript® RT reagent Kit Perfect Real Time说明书操作,实时荧光定量PCR所用cDNA的合成按照TaKaRa反转录试剂盒说明书进行操作。取一定量的总RNA,用特异的RT引物在10 μL的反应体系中合成cDNA第一链。将反转录产物做3~4倍稀释,用于后续Real time-qPCR反应检测肌纤维类型基因表达水平。
应用Primer Premier 5.0软件,按照引物设计的基本原则,设计相关基因的PCR扩增引物,以β-actin作为内参基因,肌纤维类型基因的引物序列由公司(生工生物,Invitrogen等)合成,引物序列见表 2。
|
|
表 2 引物序列信息 Table 2 Primer sequence information |
PCR反应程序按照SYBR® Premix Ex TaqTMII说明书操作。PCR反应体系10 μL:SYBR® Premix Ex Taq TM II(2×) 5 μL,RT product 1 μL,PCR Forward Primer(10 μmol·L-1) 0.5 μL,PCR Reverse Primer(10 μmol·L-1) 0.5 μL,RNase Free dH2O 3 μL。PCR反应程序:95 ℃预变性30 s; 95 ℃变性5 s,60 ℃退火30 s,70 ℃延伸10 min,共40个循环。采用2-ΔΔCt计算基因的相对表达量。
1.4 回肠肠道形态取4%多聚甲醛固定后的回肠组织包埋在石蜡中,每个样品的3个横截面以5 μm厚度切片置于载玻片上,并进行苏木精-伊红染色。选取10个完整的绒毛视野,使用图像处理和分析系统(Image-J)在40倍组合放大率的光学显微镜下测量肠段的绒毛高度和隐窝深度,并计算绒毛高度/隐窝深度(V/C)值。
1.5 回肠黏膜屏障功能相关基因mRNA表达水平通过实时聚合酶链式反应(PCR)分析基因的表达。每个样品进行3次重复的实时PCR反应,以β-actin作内参基因,本试验所检测基因的引物信息见表 2,所有基因表达均通过公式2-ΔΔCt计算,并用Western blot测定紧密连接蛋白表达水平。
1.6 回肠黏膜杯状细胞数量回肠组织样本用4%多聚甲醛固定,石蜡包埋切片后用高碘酸希夫法染色(PAS染色)。高倍镜下(100×和200×)每张切片选择5个典型的视野,用NiKon(Ni-U)正置显微镜照进行拍照,然后对杯状细胞计数(Image Pro Plus 6.0)。
1.7 盲肠和结肠微生物多样性及其代谢产物采用16 S rRNA基因的高通量测序技术,将序列进行拼接、过滤、鉴定并去除嵌合体后,得到有效数据,在此基础上进行划分分类操作单元(OTU)、多样性及差异性分析。使用Qiime软件(Version 1.9.1)对样品Alpha多样性进行评估,其中Chao1指数用于衡量物种数量多少,Shannon指数和Simpson指数用于评判物种多样性,Shannon指数越大,Simpson指数越小,说明菌群多样性更高。断奶仔猪肠道微生物群落差异分析利用R软件进行T检验并作图。在杭州景杰生物科技股份有限公司对盲肠和结肠内容物中乙酸、丙酸、异丁酸、丁酸、异戊酸、戊酸浓度进行测定。
1.8 统计方法利用Microsoft Excel 2013整理原始试验数据。采用SPSS 17.0进行单因素方差分析。试验结果以“平均值±SEM”表示,P<0.05表示差异显著,0.05<P<0.10表示有差异趋势。
2 结果 2.1 高纤维日粮对生长育肥猪生长性能的影响由表 3可知,高纤维组和对照组生长育肥猪的初始体重无显著差异(P>0.05),在试验第1~3周,高纤维组第3周末重、ADG都显著低于对照组(P<0.05),F/G较对照组显著增加(P<0.05);在试验第4~6周,与对照组相比,高纤维组的F/G有降低的趋势(P=0.082);在试验第7~9周,高纤维组第九周末重显著高于对照组(P<0.05),ADG有增加的趋势(P=0.055);在试验的10~12周,高纤维组第12周末重(P=0.071)和ADG(P=0.081)均有增加的趋势;在整个试验过程中,与对照组相比高纤维组ADG显著升高(P<0.05),ADFI和F/G无显著差异。
|
|
表 3 高纤维日粮对生长育肥猪生长性能的影响 Table 3 Effects of high fiber diet on growth performance of growing-finishing pigs |
由表 4可知,与对照组相比,高纤维组pH24 h显著增加(P<0.05);pH45 min、大理石纹、肉色、失水率在各组间均无显著差异。
|
|
表 4 高纤维饲粮对育肥猪常规肉品质的影响 Table 4 Effects of high fiber diet on routine meat quality of finishing pigs |
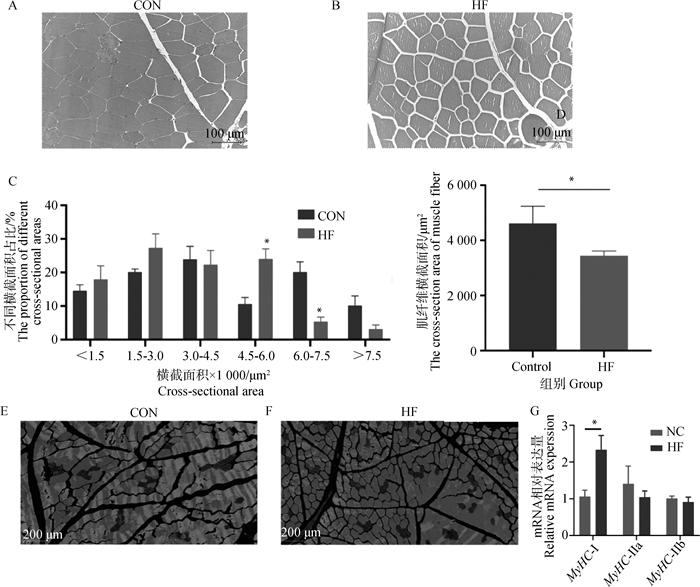
如图 1A~D,与对照组相比,高纤维组猪背最长肌的肌纤维横截面积显著减小(P<0.05),高纤维组肌纤维横截面积在4.5~6.0×1 000 μm2范围内占比显著高于对照组(P<0.05),横截面积在6.0~7.5×1 000 μm2范围内的占比显著低于对照组(P<0.05)。由图 1E~G可知,高纤维组猪肌肉中的MyHC Ⅰ型肌纤维mRNA基因表达水平显著高于对照组(P<0.05),MyHC Ⅱa型肌纤维mRNA基因表达水平有低于对照组的趋势。
|
A. 对照组背最长肌中肌纤维横截面积HE染色;B. 高纤维组背最长肌中肌纤维横截面积HE染色;C. 背最长肌肌纤维不同横截面积占比;D. 背最长肌肌纤维横截面积平均值;E~G. 猪背最长肌肌纤维类型相关基因表达。*表示差异显著(P<0.05),**表示差异及显著(P<0.01)。下同 A. HE staining of cross-sectional area of muscle fibers in longissimus dorsi muscle in control group; B. HE staining of cross-sectional area of muscle fibers in longissimus dorsi muscle in high fiber group; C. Proportion of different muscle fiber cross-sectional area of longissimus dorsi muscle in pigs; D. The mean value of muscle fiber cross-sectional area of longissimus dorsi muscle; E-G. Expression of genes related to muscle fiber type of longissimus dorsi muscle. * indicates a significant difference(P < 0.05), ** indicates extremely significant difference(P < 0.01).The same as below 图 1 高纤维日粮对生长育肥猪肉色及肌纤维特性的影响 Fig. 1 Effects of high fiber diet on color and muscle fiber properties of growing-finishing pigs |
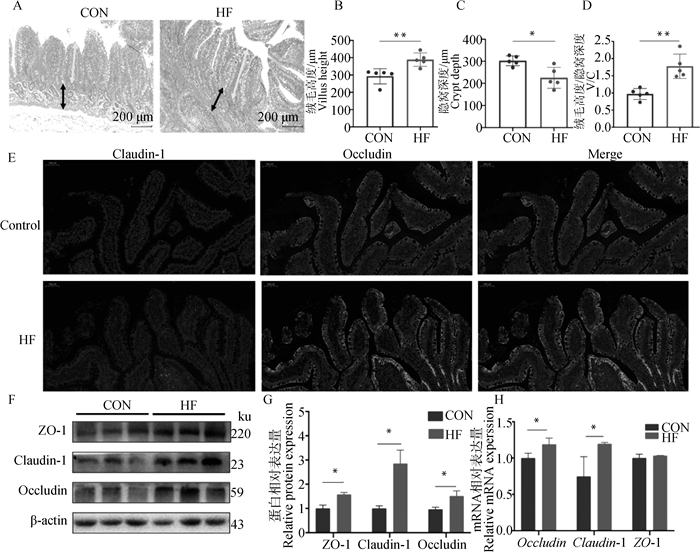
由图 2A~D可知,高纤维组回肠的绒毛高度极显著增加(P<0.01),隐窝深度显著降低(P<0.05),回肠绒毛高度/隐窝深度比值极显著高于对照组(P<0.01)。
|
A. 回肠切片HE染色;B~D. 回肠的绒毛高度、隐窝深度和绒毛高度/隐窝深度比值;E. 紧密连接蛋白的免疫荧光染色(标尺=100 μm);F~G. 紧密连接蛋白表达水平;H. 紧密连接蛋白mRNA表达水平 A. Ileal sections stained with HE; B-D. Villus height, crypt depth and villus height to crypt depth ratio of ileum; E. Immunofluorescence staining of tight junction protein (Bar=100 μm); F-G. Expression level of tight junction protein; H. Tight junction protein mRNA expression level 图 2 高纤维日粮对生长育肥猪回肠形态和物理屏障功能的影响 Fig. 2 Effects of high fiber diets on ileal morphology and physical barrier function in growing-finishing pigs |
由图 2F、2G可知,Western blot结果显示HF组ZO-1、Occludin和Claudin-1的蛋白表达显著上调(P<0.05),从图E的荧光染色中也能观察到相同结果。RT-qPCR的结果表明(图 2H),HF组Occludin和Claudin-1的mRNA表达水平显著提高(P<0.05)。
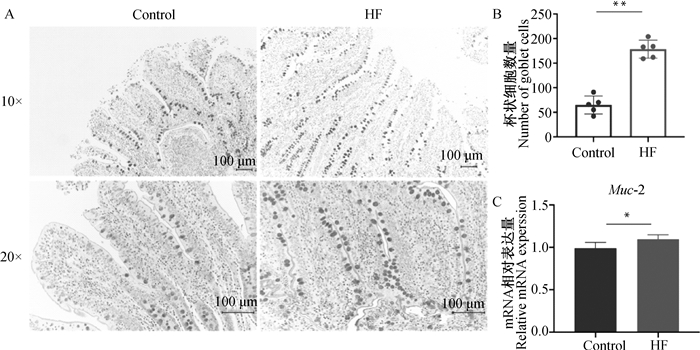
2.4 高纤维日粮对肠道化学屏障功能的影响由图 3A、B可知,与对照组相比,高纤维组杯状细胞的数量极显著增加(P<0.01)。由图 3C可知,主要由杯状细胞分泌的Muc-2的mRNA表达水平在高纤维组显著上调(P<0.05)。
|
A. 回肠切片PAS染色;B. 回肠黏膜上皮杯状细胞数量;C. 回肠Muc-2 mRNA表达水平 A. PAS staining in ileal slices; B. Number of goblet cells in ileal mucosa; C. Expression level of Muc-2 mRNA in ileum 图 3 高纤维日粮对生长育肥猪肠道化学屏障功能的影响 Fig. 3 Effect of high fiber diet on intestinal chemical barrier function in growing-finishing pigs |
由表 5可知,与对照组相比,高纤维组结肠的Shannon指数有增加的趋势(P=0.065)。
|
|
表 5 猪盲肠、结肠食糜微生物α-多样性指数 Table 5 The α-diversity of microorganisms in the digesta samples from cecum and colons of pigs in the different two groups |
通过在门和属水平上对盲肠和结肠的微生物分析,发现高纤维日粮改变了盲肠和结肠微生物的组成。如图 4A~B、E~F所示,与对照组相比,高纤维组显著增加了盲肠厚壁菌门(P<0.05)和变形菌门(P<0.05)的相对丰度,极显著降低了拟杆菌门的相对丰度(P<0.01);在结肠中,高纤维组螺旋菌门的相对丰度极显著低于对照组(P<0.01)。如图 4C~D、G~H所示,在盲肠中,高纤维组梭菌属的相对丰度显著高于对照组(P<0.05),而链球菌属显著低于对照组(P<0.05);在结肠中,高纤维组芽孢杆菌属的相对丰度极显著高于对照组(P<0.01),而链球菌属的相对丰度极显著低于对照组(P<0.01)。

|
A、E. 盲肠微生物在门水平的相对丰度;B、F. 结肠微生物在门水平的相对丰度;C、G. 盲肠微生物在属水平的相对丰度; D、H. 结肠微生物在属水平的相对丰度;I.盲肠内容物中短链脂肪酸的浓度; J. 结肠内容物中短链脂肪酸的浓度 A, E. Relative abundance of microorganisms at the phylum level in the cecum. B, F. Relative abundance of microorganisms at the phylum level in the colon; C, G. Relative abundance of microorganisms at genus level in the cecum; D, H. Relative abundance of microorganisms at genus level in the colon; I. Concentration of short-chain fatty acids in the contents of cecum; J. Concentration of short-chain fatty acids in the contents of colon. 图 4 高纤维日粮对生长育肥猪肠道菌群组成及其代谢产物的影响 Fig. 4 Effects of high fiber diets on the composition and metabolites of intestinal flora in growing-finishing pigs |
本试验检测了盲肠和结肠内容物中短链脂肪酸的浓度。如图 4I所示,在盲肠中,和对照组相比,高纤维组显著增加乙酸(P<0.05)、丙酸(P<0.05)、丁酸(P<0.05)的浓度;在结肠中(图 4J),高纤维组显著增加了乙酸(P<0.05)、丙酸(P<0.05)、丁酸(P<0.05)、戊酸(P<0.05)和异戊酸(P<0.05)的浓度。
3 讨论 3.1 高纤维日粮对生长育肥猪生长性能的影响随着研究的深入,纤维开始广泛用于猪日粮中。先前的研究表明,高纤维的摄入通常会降低猪的生长速度[8]。Laitat等[9]研究发现,当饲喂高纤维日粮时,猪生长性能的下降通常出现在生长期,而不是育肥期。Morales等[10]研究结果显示,猪在生长过程中需要一段时间来适应高纤维日粮,而后才能消耗足够的纤维来补偿日粮能量的缺少。本试验中,在1~3周高纤维组与对照组相比,第3周末重、日增重降低且料肉比升高,这表明在生长期饲喂高纤维日粮,前期猪的生长性能会下降;但在4~6周,与对照组相比,高纤维组料肉比有降低的趋势;在试验第7~9周,高纤维组第九周末重显著高于对照组,日增重有增加的趋势;在9~12周,高纤维组第12周末重和日增重均有增加的趋势;在整个试验过程中,与对照组相比高纤维组日增重显著升高,这说明在生长期使用高纤维日粮能在后期改善生长育肥猪的生长性能。在本试验中,试验全程和试验各阶段日粮处理均不影响平均日采食量。Da Silva等[11]研究发现,添加纤维饲料导致的日粮体积增加,使肠道有强烈填充感而导致生长猪采食量的下降。但是在生长育肥猪中,高纤维日粮往往不会出现这样的情况。Agyekum等[12]研究发现,饲喂高纤维组日粮的生长育肥猪的采食量没有减少。这与本试验研究结果一致。
3.2 高纤维日粮对生长育肥猪肉品质的影响在育肥猪日粮中添加适当的纤维可以提高生长性能和胴体质量,而不会影响肉质[13-14]。本试验结果表明,纤维水平不影响育肥猪的肉色,大理石纹等指标。Bee等[15]研究发现,屠宰时肌肉糖原的储存和宰后糖酵解的速率会影响宰后pH下降的速率和程度,进而影响肉质。糖酵解纤维含量比例增加和氧化纤维含量减少导致死后pH迅速下降和肉变白,如果pH下降过快,会导致肌肉失水,肉色不新鲜,营养价值下降[16]。本试验中,高纤维组的pH24 h显著高于对照组,说明高纤维可以降低其pH下降的速度。
高纤维日粮可以通过降低猪肉中的糖酵解的发生,从而来改善肌肉纤维组成[17]。猪的肌肉纤维分为快肌纤维和慢肌纤维,快肌纤维又分为快氧化型(肌球蛋白对应MyHC Ⅱa)、快降解型(MyHC Ⅱb)和中间型(MyHC Ⅱx),慢肌纤维对应慢氧化型(MyHC I)。他们与不同的葡萄糖利用方式有关,肌纤维的类型和组成比例的不同直接影响着肌肉的脂质含量、颜色和功能[18]。本试验中,高纤维日粮组的MyHC I的mRNA水平显著增加,同时MyHC IIa的mRNA水平有降低的趋势。由于猪在生长中不同类型的肌肉纤维可以相互转化[19],本试验在生长期添加高纤维日粮可以改善育肥猪的肉质,这可能与糖酵解肌纤维向氧化肌纤维的转化有关。
3.3 高纤维日粮对生长育肥猪回肠形态和屏障功能的影响完整的形态结构对肠道功能至关重要,高纤维日粮因其吸水力强、较难消化,可刺激消化道黏膜,促进胃肠道的发育[20]。肠绒毛高度被认为是判断营养吸收表面积的标志,而隐窝深度可以反映上皮细胞的增殖情况[21]。Huang等[22]得出结论,V/C比值的增加有利于抵抗饲料中存在的对肠道屏障功能的入侵。在本研究中,HF组的回肠绒毛高度更长,回肠的V/C比值更高,说明生长期高纤维日粮改善了育肥猪的回肠形态,使吸收营养物质能力增强,这可能是高纤维组生长性能改善的原因之一。
肠道由单层柱状上皮细胞排列,被认为是最大的免疫器官,在肠道健康中起着关键作用。除了在营养吸收中的重要作用外,肠上皮细胞提供动态屏障来抑制细菌、病原体和膳食抗原对黏膜组织的侵袭[23]。紧密连接蛋白(ZO-1、Occludin和Claudin-1)在维持肠道屏障完整性和有效防止肠道细菌和抗原沿上皮细胞扩散方面起着关键作用[24]。紧密连接(TJ)是一种多功能复合物,可在靠近顶端表面的相邻上皮细胞之间形成密封[25]。TJ不是静态屏障,而是高度动态的结构,它们可以限制病原体、调节营养物质的进入,从而调节上皮的屏障功能。紧密连接蛋白是高度组织化的结构,可有效阻挡有害物质的入侵。Chen等[26]研究表明,可溶性纤维组和不溶性纤维组均上调ZO-1、Occludin、Claudin-1、Muc-1和Muc-2基因表达,下调IL-1β和TNF-α基因表达。这与本研究一致。因此,在生长期添加高纤维日粮通过上调回肠紧密连接蛋白ZO-1、Occludin和Claudin-1的表达水平改善了育肥猪的肠道物理屏障功能。
杯状细胞合成且分泌黏蛋白,是肠黏膜屏障的主要成分[27]。黏蛋白是一种大分子糖蛋白,形成凝胶状结构[28]。其中,Muc-2主要由小肠中的杯状细胞产生,是肠道黏蛋白层的重要结构成分,可防止管腔病毒感染[28],Lien等[29]研究表明,高纤维日粮会增加胃肠道黏蛋白的分泌能力。在本试验中,高纤维日粮显著增加了杯状细胞的数量,同时显著上调了Muc-2 mRNA水平,表明黏蛋白分泌增加,而Muc-2表达水平的上调可能会改善肠上皮屏障的防御功能。综上所述,高纤维日粮一定程度上改善了育肥猪肠道的化学屏障功能。
3.4 高纤维日粮对生长育肥猪肠道菌群及其代谢产物的影响肠道微生物在调节宿主生理和新陈代谢方面发挥着重要作用,包括营养利用、生物利用度、能量状态和免疫系统发育[30]。饮食是调节肠道内微生物组成的重要因素[31]。日粮纤维可能是肠道微生物群组成的主要驱动因素[32]。本试验中,高纤维组结肠的Shannon指数有增加的趋势,说明其微生物多样性增加。高纤维组显著增加了盲肠厚壁菌门和变形菌门的相对丰度,降低了拟杆菌门的相对丰度。厚璧菌门可产生短链脂肪酸和脂质产物,促进机体脂肪的沉积[33]。在盲肠中,高纤维组梭菌属的相对丰度显著增加,而链球菌属显著低于对照组;在结肠中,高纤维组芽孢杆菌属的相对丰度极显著高于对照组,而链球菌属的相对丰度极显著低于对照组。日粮纤维促进有益菌如芽孢杆菌的生长,抑制潜在致病菌如链球菌的生长。以上结果表明,高纤维日粮改变了盲肠和结肠菌群的组成,改善了育肥猪的肠道健康。
纤维是细菌发酵的主要底物,它可以通过支持更多样化的细菌群落和增加SCFA的浓度来调节黏膜屏障功能[34-35]。Keeney和Finlay[36]研究表明,由肠道微生物产生的最终代谢物SCFA可改善肠道屏障功能。肠道屏障功能的改善可能归因于麦麸对肠道菌群及其代谢物SCFA的调节[37]。Shang等[38]研究表明,麦麸可使回肠的Occludin mRNA表达水平升高,且盲肠中丁酸和总SCFA增加,微生物组成的改善和丁酸的增加可能是麦麸组肠道屏障功能增强的原因。本研究中高纤维组增加了盲肠和结肠中的SCFA浓度,这可能是其改善肠道屏障功能的原因。乙酸已被证明通过诱导黏蛋白缺陷小鼠的黏蛋白分泌来预防炎症性肠病[39],这表明高纤维组乙酸浓度增加可能是Muc-2 mRNA水平增加的原因之一。本试验中,高纤维组增加了盲肠和结肠中丁酸的浓度,Matheus等[40]研究表明,丁酸可通过上调CLDN-1基因表达抑制高脂饮食诱导的肠上皮屏障破坏。在本研究中,SCFA浓度的增加可能是高纤维日粮在调节肠道屏障功能更优异的原因之一。
4 结论饲喂含15%麦麸日粮在前3周会对生长育肥猪的生长产生负面影响,而在试验后期和全期具有改善生长性能的作用;对育肥猪的肉品质没有不利影响,且能降低肌纤维横截面积,促进慢肌纤维相关基因的表达;同时可使纤维降解菌丰度增加、潜在致病菌丰度降低,SCFA浓度增加从而改善肠道形态和屏障功能。
| [1] |
TROWELL H. Definition of dietary fiber and hypotheses that it is a protective factor in certain diseases[J]. Am J Clin Nutr, 1976, 29(4): 417-427. DOI:10.1093/ajcn/29.4.417 |
| [2] |
KOH A, DE VADDER F, KOVATCHEVA-DATCHARY P, et al. From dietary fiber to host physiology: short-chain fatty acids as key bacterial metabolites[J]. Cell, 2016, 165(6): 1332-1345. DOI:10.1016/j.cell.2016.05.041 |
| [3] |
王晓佳. 膳食纤维对母猪肠道的作用[J]. 湖南饲料, 2021(3): 44-45. WANG X J. Effect of dietary fiber on intestinal tract of sows[J]. Hunan Feed, 2021(3): 44-45. (in Chinese) |
| [4] |
PI Y, HU J, BAI Y, et al. Effects of dietary fibers with different physicochemical properties on fermentation kinetics and microbial composition by fecal inoculum from lactating sows in vitro[J]. J Sci Food Agric, 2021, 101(3): 907-917. DOI:10.1002/jsfa.10698 |
| [5] |
李丽娟, 师凤华, 谭木秀, 等. 膳食纤维调节肠道菌群的作用机制研究进展[J]. 中国现代医生, 2020, 58(36): 188-192. LI L J, SHI F H, TAN M X, et al. Progress in the mechanism of dietary fiber in regulating intestinal flora[J]. China Modern Doctor, 2020, 58(36): 188-192. (in Chinese) |
| [6] |
ZHAO J B, LIU P, WU Y, et al. Dietary fiber increases butyrate-producing bacteria and improves the growth performance of weaned piglets[J]. J Agric Food Chem, 2018, 66(30): 7995-8004. DOI:10.1021/acs.jafc.8b02545 |
| [7] |
YU C Y, ZHANG S H, YANG Q, et al. Effect of high fibre diets formulated with different fibrous ingredients on performance, nutrient digestibility and faecal microbiota of weaned piglets[J]. Arch Anim Nutr, 2016, 70(4): 263-277. DOI:10.1080/1745039X.2016.1183364 |
| [8] |
岳隆耀. 猪的膳食纤维营养与应用概述[J]. 中国畜牧杂志, 2018, 54(1): 26-34. YUE L Y. Dietary fiber nutrition and its application in swine nutrition[J]. Chinese Journal of Animal Science, 2018, 54(1): 26-34. DOI:10.19556/j.0258-7033.2018-01-026 (in Chinese) |
| [9] |
LAITAT M, ANTOINE N, CABARAUX J F, et al. Influence of sugar beet pulp on feeding behavior, growth performance, carcass quality and gut health of fattening pigs[J]. Biotechnol Agron Soc Environ, 2015, 19(1): 20-31. |
| [10] |
MORALES A, GRAGEOLA F, GARCÍA H, et al. Performance, serum amino acid concentrations and expression of selected genes in pair-fed growing pigs exposed to high ambient temperatures[J]. J Anim Physiol Anim Nutr (Berl), 2014, 98(5): 928-935. DOI:10.1111/jpn.12161 |
| [11] |
DA SILVA C S, VAN DEN BORNE J J G C, GERRITS W J J, et al. Effects of dietary fibers with different physicochemical properties on feeding motivation in adult female pigs[J]. Physiol Behav, 2012, 107(2): 218-230. DOI:10.1016/j.physbeh.2012.07.001 |
| [12] |
AGYEKUM A K, WOYENGO T A, SLOMINSKI B A, et al. Effects of formulating growing pig diet with increasing levels of wheat-corn distillers dried grains with solubles on digestible nutrient basis on growth performance and nutrient digestibility[J]. J Anim Physiol Anim Nutr (Berl), 2014, 98(4): 651-658. DOI:10.1111/jpn.12112 |
| [13] |
HARRIS E K, MELLENCAMP M A, JOHNSTON L J, et al. Effect of time interval between the second Improvest® dose and slaughter and corn dried distillers grains with solubles feeding strategies on carcass composition, primal cutout, and pork quality of immunologically castrated pigs[J]. Meat Sci, 2017, 127: 13-20. DOI:10.1016/j.meatsci.2017.01.003 |
| [14] |
GRAHAM A B, GOODBAND R D, TOKACH M D, et al. The interactive effects of high-fat, high-fiber diets and ractopamine HCl on finishing pig growth performance, carcass characteristics, and carcass fat quality[J]. J Anim Sci, 2014, 92(10): 4585-4597. DOI:10.2527/jas.2013-7434 |
| [15] |
BEE G, BIOLLEY C, GUEX G, et al. Effects of available dietary carbohydrate and preslaughter treatment on glycolytic potential, protein degradation, and quality traits of pig muscles[J]. J Anim Sci, 2006, 84(1): 191-203. DOI:10.2527/2006.841191x |
| [16] |
KIM G D, JEONG J Y, JUNG E Y, et al. The influence of fiber size distribution of type ⅡB on carcass traits and meat quality in pigs[J]. Meat Sci, 2013, 94(2): 267-273. DOI:10.1016/j.meatsci.2013.02.001 |
| [17] |
LI Y J, LI J L, ZHANG L, et al. Effects of dietary energy sources on Post mortem glycolysis, meat quality and muscle fibre type transformation of finishing pigs[J]. PLoS One, 2015, 10(6): e0131958. DOI:10.1371/journal.pone.0131958 |
| [18] |
JOO S T, KIM G D, HWANG Y H, et al. Control of fresh meat quality through manipulation of muscle fiber characteristics[J]. Meat Sci, 2013, 95(4): 828-836. DOI:10.1016/j.meatsci.2013.04.044 |
| [19] |
PETTE D, STARON R S. Myosin isoforms, muscle fiber types, and transitions[J]. Microsc Res Tech, 2000, 50(6): 500-509. DOI:10.1002/1097-0029(20000915)50:6<500::AID-JEMT7>3.0.CO;2-7 |
| [20] |
JOHANSEN H N, KNUDSEN K E B. Effects of reducing the starch content in oat-based diets with cellulose on jejunal flow and absorption of glucose over an isolated loop of jejunum in pigs[J]. Br J Nutr, 1994, 72(5): 717-729. DOI:10.1079/BJN19940074 |
| [21] |
DING X Q, LI H Y, WEN Z W, et al. Effects of fermented tea residue on fattening performance, meat quality, digestive performance, serum antioxidant capacity, and intestinal morphology in fatteners[J]. Animals (Basel), 2020, 10(2): 185. |
| [22] |
HUANG C W, LEE T T, SHIH Y C, et al. Effects of dietary supplementation of Chinese medicinal herbs on polymorphonuclear neutrophil immune activity and small intestinal morphology in weanling pigs[J]. J Anim Physiol Anim Nutr (Berl), 2012, 96(2): 285-294. DOI:10.1111/j.1439-0396.2011.01151.x |
| [23] |
LI X, MAO M Y, ZHANG Y N, et al. Succinate modulates intestinal barrier function and inflammation response in pigs[J]. Biomolecules, 2019, 9(9): 486. DOI:10.3390/biom9090486 |
| [24] |
ULLUWISHEWA D, ANDERSON R C, MCNABB W C, et al. Regulation of tight junction permeability by intestinal bacteria and dietary components[J]. J Nutr, 2011, 141(5): 769-776. DOI:10.3945/jn.110.135657 |
| [25] |
FARQUHAR M G, PALADE G E. Junctional complexes in various epithelia[J]. J Cell Biol, 1963, 17(2): 375-412. DOI:10.1083/jcb.17.2.375 |
| [26] |
CHEN T T, CHEN D W, TIAN G, et al. Soluble fiber and insoluble fiber regulate colonic microbiota and barrier function in a piglet model[J]. Biomed Res Int, 2019, 2019: 7809171. |
| [27] |
ALLAIRE J M, MORAMPUDI V, CROWLEY S M, et al. Frontline defenders: goblet cell mediators dictate host-microbe interactions in the intestinal tract during health and disease[J]. Am J Physiol Gastrointest Liver Physiol, 2018, 314(3): G360-G377. DOI:10.1152/ajpgi.00181.2017 |
| [28] |
HOLLINGSWORTH M A, SWANSON B J. Mucins in cancer: protection and control of the cell surface[J]. Nat Rev Cancer, 2004, 4(1): 45-60. DOI:10.1038/nrc1251 |
| [29] |
LIEN K A, SAUER W C, HE J M. Dietary influences on the secretion into and degradation of mucin in the digestive tract of monogastric animals and humans[J]. J Anim Feed Sci, 2001, 10(2): 223-245. DOI:10.22358/jafs/67980/2001 |
| [30] |
CUMMINGS J H, ANTOINE J M, AZPIROZ F, et al. PASSCLAIM-Gut health and immunity[J]. Eur J Nutr, 2004, 43(Suppl 2): ii118-ii173. |
| [31] |
ZHANG H L, VAN DER WIELEN N, VAN DER HEE B, et al. Impact of fermentable protein, by feeding high protein diets, on microbial composition, microbial catabolic activity, gut health and beyond in pigs[J]. Microorganisms, 2020, 8(11): 1735. DOI:10.3390/microorganisms8111735 |
| [32] |
HEINRITZ S N, WEISS E, EKLUND M, et al. Intestinal microbiota and microbial metabolites are changed in a pig model fed a high-fat/low-fiber or a low-fat/high-fiber diet[J]. PLoS One, 2016, 11(4): e0154329. DOI:10.1371/journal.pone.0154329 |
| [33] |
NIU Q, LI P H, HAO S S, et al. Dynamic distribution of the gut microbiota and the relationship with apparent crude fiber digestibility and growth stages in pigs[J]. Sci Rep, 2015, 5(1): 9938. DOI:10.1038/srep09938 |
| [34] |
MADSEN K, CORNISH A, SOPER P, et al. Probioticbacteria enhance murine and human intestinal epithelial barrier function[J]. Gastroenterology, 2001, 121(3): 580-591. DOI:10.1053/gast.2001.27224 |
| [35] |
CANFORA E E, JOCKEN J W, BLAAK E E. Short-chain fatty acids in control of body weight and insulin sensitivity[J]. Nat Rev Endocrinol, 2015, 11(10): 577-591. DOI:10.1038/nrendo.2015.128 |
| [36] |
KEENEY K M, FINLAY B B. Enteric pathogen exploitation of the microbiota-generated nutrient environment of the gut[J]. Curr Opin Microbiol, 2011, 14(1): 92-98. DOI:10.1016/j.mib.2010.12.012 |
| [37] |
DESAI M S, SEEKATZ A M, KOROPATKIN N M, et al. A dietary fiber-deprived gut microbiota degrades the colonic mucus barrier and enhances pathogen susceptibility[J]. Cell, 2016, 167(5): 1339-1353. DOI:10.1016/j.cell.2016.10.043 |
| [38] |
SHANG Q H, LIU H S, WU D, et al. Source of fiber influences growth, immune responses, gut barrier function and microbiota in weaned piglets fed antibiotic-free diets[J]. Anim Nutr, 2021, 7(2): 315-325. DOI:10.1016/j.aninu.2020.12.008 |
| [39] |
KUMAR M, KISSOON-SINGH V, CORIA A L, et al. Probiotic mixture VSL#3 reduces colonic inflammation and improves intestinal barrier function in Muc2 mucin-deficient mice[J]. Am J Physiol Gastrointest Liver Physiol, 2017, 312(1): G34-G45. DOI:10.1152/ajpgi.00298.2016 |
| [40] |
MATHEUS V A, MONTEIRO L C S, OLIVEIRA R B, et al. Butyrate reduces high-fat diet-induced metabolic alterations, hepatic steatosis and pancreatic beta cell and intestinal barrier dysfunctions in prediabetic mice[J]. Exp Biol Med (Maywood), 2017, 242(12): 1214-1226. DOI:10.1177/1535370217708188 |
(编辑 范子娟)



