我国是世界养猪第一大国,生猪出栏和猪肉消费量都常居世界之首。近年来随着国家经济的迅速发展,人民生活水平的日益提高,消费者对健康美味猪肉的需求在不断增加。猪肉品质主要受肌内脂肪(intramuscular fat,IMF)含量,肌纤维数量、直径及类型,风味物质含量等因素影响,其中,IMF含量与猪肉的感官品质和食用品质密切相关,直接影响着肉的风味、多汁性、嫩度和色泽[1]。因此,提高IMF含量有助于提升猪肉品质,具有较高的经济价值。
在肌肉早期发育阶段,来源于中胚层的间充质干细胞首先增殖,然后分化为成肌源性谱系细胞或者成纤维/成脂源性谱系细胞。成肌源性谱系细胞进一步发育成肌卫星细胞(muscle satellite cells,MUSCs),成纤维/成脂源性谱系细胞发育成FAPs细胞[2]。Joe等[3]鉴定到FAPs细胞的特异表面抗原为干细胞抗原-1(SCA-1)和造血祖细胞抗原CD34,随后在小鼠和人类肌肉细胞中又鉴别到FAPs细胞的一个特有表面抗原标记PDGFRα[4]。Du等[5]利用流式分选肉牛肌肉间质血管碎片细胞(stromal vascular fractions, SVFs)中的PDGFRα阳性细胞,成功分离出牛FAPs细胞,并在体外诱导分化为脂肪细胞,因此PDGFRα可作为鉴定FAPs细胞的标记蛋白。研究表明, IMF含量主要由肌内脂肪细胞的数量和大小决定[6],且FAPs细胞是小鼠和人[7]肌肉再生过程中肌内脂肪细胞的主要来源。Kruk等[8]发现,限制安格斯牛维生素A的摄入提高了FAPs的细胞增殖能力,导致IMF含量和大理石纹相应增加,提示FAPs的细胞增殖能力与IMF含量和大理石纹正相关。另有研究表明,FAPs细胞在猪背最长肌的SVFs中所占比重大于半腱肌,背最长肌比半腱肌更早出现肌内脂肪且脂肪含量更多[9]。进一步研究发现,过氧化物酶体增殖物激活受体γ(PPARγ)的激活剂噻唑烷二酮在背最长肌的含量显著高于半腱肌。PPARγ是脂肪生成的关键转录调控因子,其激活促进FAPs向脂肪细胞分化[10],从而增强了骨骼肌SVFs的脂肪生成,提示增强FAPs细胞的成脂分化能力能够提高猪肉中的IMF含量。
苏淮猪是南京农业大学养猪研究所自主培育的国家级瘦肉型猪新品种,含有25%的淮猪血统和75%的大白猪血统,继承了大白猪生长速度快和淮猪肉质好等优良特点。近年发现苏淮猪的IMF含量降低,因此利用FAPs细胞开展与猪IMF沉积相关的研究,可为通过分子育种技术提高苏淮猪猪肉IMF含量及其肉品质性状提供理论基础。获得纯度比较高的猪FAPs细胞是开展IMF沉积相关研究的前提,然而目前鲜有关于猪FAPs细胞的研究报道。猪骨骼肌MUSCs和前体脂肪细胞大多使用差速贴壁法进行分离纯化[11],FAPs细胞具有较强的贴壁能力[12],提示也可以通过差速贴壁法对猪FAPs细胞进行分离纯化。因此本研究拟利用PDGFRα抗体通过免疫荧光评价不同差速贴壁时间分离的FAPs细胞的纯度,以期确定分离高纯度猪FAPs细胞的最佳差速贴壁时间。然后研究猪FAPs细胞在体外传代过程中的成脂能力和基因表达模式变化,研究结果有望为开发能维持猪FAPs细胞体外成脂能力的培养基配方提供参考。
1 材料与方法 1.1 试验材料1.1.1 试验样品 本研究涉及到的动物试验均经南京农业大学实验动物管理委员会批准(许可证号:SYXK(苏)2017-0031)。本试验动物为1日龄苏淮公猪,来源于江苏省淮安市淮阴新淮种猪场(中国,江苏,淮安),通过鼻咽拭子采样进行非洲猪瘟核酸检测为阴性后,带回实验室进行细胞分离。
1.1.2 试验使用仪器及设备 超净工作台,离心机,水浴摇床,CO2细胞培养箱,倒置(荧光)显微镜,NanoDrop 2000紫外分光光度计,高压灭菌的剪刀、镊子、止血钳、手术刀柄、刀片,离心管,培养皿(10 cm直径),T25细胞培养瓶等。
1.1.3 试验试剂 磷酸盐缓冲液PBS(Hyclone)、DMEM培养基(Hyclone)、DMEM-F12培养基(Gibco)、澳洲胎牛血清FBS(Gibco)、100×青霉素-链霉素溶液(双抗,Gibco)、胰蛋白酶(Gibco)、谷氨酸钠GlutaMAX(Gibco)、非必需氨基酸NEAA(Gibco)、丙酮酸钠SP(Gibco)、胰岛素INS(Thermo Fisher)、生长因子bFGF(Gibco)购自赛默飞世尔科技(中国)有限公司;Ⅰ型胶原酶(Sigma)、地塞米松DEX(Sigma)、3-异丁基-1-甲基黄嘌呤IBMX(Sigma)、油红O染液(Sigma)购自西格玛奥德里奇(上海)贸易有限公司;三碘甲状腺原氨酸T3(源叶)、吲哚美辛INN(Macklin)、罗格列酮RSG (Macklin)、转铁蛋白TRF(源叶)、BODIPY(Glpbio)、DAPI(Biosharp)购自南京艾瑞思生物技术有限公司;生物素Biotin(生工)、泛酸Pantothenic Acid(生工)购自生工生物工程(上海)股份有限公司;anti-PDGFRα抗体(Affinity,Rabbit,AF0241)、Cy3标记山羊抗兔IgG(Beyotime,A0516)购自南京伟沃生物科技有限公司。
1.2 试验方法1.2.1 苏淮猪背最长肌混合细胞的分离及其FAPs细胞纯度的鉴定 将1日龄苏淮仔猪颈部放血处死后用1%新洁尔灭清洗干净,用手术刀沿背中心划开,剥离脊椎两侧的背最长肌,用含2%的双抗PBS清洗2次后,剪碎成泥,使用2倍组织体积的0.28% Ⅰ型胶原酶水浴振荡消化1.5~2 h,离心收集组织沉淀,添加3倍体积0.25%胰蛋白酶消化30~45 min。使用孔径100、70和40 μm的分样筛依次过滤消化好的组织悬液,收集滤液,加入含10% FBS的DMEM终止消化,离心收集沉淀,PBS清洗后用全价培养基(含1% GlutaMAX、1% NEAA、1% SP、0.02% bFGF、20% FBS、1%双抗和76% DMEM/F12的培养基)重悬细胞,移至T25细胞培养皿内混匀,置于CO2细胞培养箱(37℃,5% CO2)中培养。待细胞差速贴壁不同时间段后(30 min、1 h、90 min、2 h),吸出上清液,添加全价培养基继续培养,获得原代细胞,然后通过anti-PDGFRα免疫荧光检测FAPs细胞的纯度。
1.2.2 细胞免疫荧光检测 将灭菌的细胞爬片放置于24孔板内,接种适宜数量FAPs细胞。待细胞融合密度达60%~80%时,用PBS洗3次;加4%多聚甲醛室温固定10~15 min,PBS洗3次后加0.3% TritonX-100室温通透10 min,PBS洗3次后利用5% BSA室温封闭1 h。添加稀释后的anti-PDGFRα一抗,4℃过夜孵育,PBS洗3次后室温孵育二抗Cy3标记山羊抗兔IgG 1 h,PBS洗3次后加入DAPI避光染色5 min。最后利用抗荧光淬灭剂封片,置于荧光显微镜下观察拍照。
1.2.3 FAPs细胞诱导分化 6孔板接种适宜数量FAPs细胞,待细胞融合密度大于80%后,用PBS洗3次,每孔加2 mL诱导培养基(含1 μg·mL-1 INS、100 μmol·L-1 IBMX、2 μg·mL-1 DEX、5 nmol·L-1 T3、125 μmol·L-1 INN、33 μmol·L-1 Biotin、1 μmol·L-1 RSG、17 μmol·L-1 Pantothenic Acid、1 μg·mL-1 TRF、10% FBS、1%双抗和89% DMEM/F12的培养基),每2 d更换一次诱导培养基。在诱导成脂第4天更换为维持培养基(含1 μg·mL-1 INS、5 nmol·L-1 T3、1 μmol·L-1 RSG、10% FBS、1%双抗和89% DMEM/F12的培养基)[13],每2 d更换一次维持培养基,直到第8天,完成诱导成脂分化。
1.2.4 油红O染色 FAPs细胞诱导成脂分化后用PBS洗3次,添加4%多聚甲醛室温固定。PBS洗3次后,每孔加入油红O工作液(使用前将油红O染液与双蒸水以3∶2的比例配制成工作液,静置1 h后用3层过滤纸过滤2~3次,即配即用),避光染色1 h。PBS洗3次后加入1 mL PBS,在倒置显微镜下观察染色情况。
1.2.5 BODIPY染色 将24孔板内诱导成脂分化的FAPs细胞用4%多聚甲醛室温固定,PBS洗3次,每孔加入BODIPY工作液(使用前将BODIPY浓缩液与PBS以1∶2 500的比例进行稀释,即配即用),避光染色15 min,PBS洗3次后加入DAPI避光染色15 min。最后利用抗荧光淬灭剂封片,在荧光显微镜下观察拍照。
1.2.6 甘油三酯含量测定 使用RIPA裂解FAPs细胞,提取总蛋白,利用BCA法测定蛋白浓度。分别加蒸馏水、校准品(2.26 mmol·L-1)和样本各10 μL至1 000 μL酶剂工作液中,37℃孵育10 min后使用酶标仪分别检测510 nm处的吸光度,利用如下公式计算甘油三酯含量(mmol·gprot-1):
| $ \begin{aligned} & \frac{\text { 甘油三酯含量 }}{\left(\mathrm{mmol} \cdot \operatorname{gprot}^{-1}\right)}=\frac{\text { 样本 } O D \text { 值 - 空白 } O D \text { 值 }}{\text { 校准 } O D \text { 值 }- \text { 空白 } O D \text { 值 }} \\ & \text { 校准品浓度。\ 待测样本蛋白浓度 } \\ & \left(\mathrm{mmol} \cdot \mathrm{L}^{-1}\right)^{\div}\left(\text {gprot } \cdot \mathrm{L}^{-1}\right) 。\\ & \end{aligned} $ |
1.2.7 总RNA提取与质量检测 贴壁细胞经PBS清洗2次后,加入1 mL Trizol涡旋混匀。加入200 μL三氯甲烷颠倒混匀,室温静置3 min后离心,吸取上清液约550 μL置于新离心管中。加入等量异丙醇,颠倒混匀后室温静置30 min后离心,保留RNA沉淀。75%乙醇洗涤2次,残留液体吹干后加入适量DEPC水溶解RNA。上下颠倒混匀后55℃水浴10 min,迅速置于冰上,使用NanoDrop 2000紫外分光光度计检测RNA浓度和纯度。
1.2.8 RNA-Seq文库构建与测序 RNA样品质检合格后进行cDNA文库的构建,具体包括RNA反转、cDNA片段化、末端修复、A尾添加、接头连接、磁珠纯化和PCR富集等步骤,使用Qubit 3.0对文库定量后,用Agilent Tapestation 2200对文库片段大小进行质控,采用Q-PCR方法对文库的有效浓度进行准确定量(文库有效浓度>2 nmol·L-1)。然后把不同文库等量混合,利用Illumina平台进行双端测序(paired-end)。
1.2.9 测序数据分析 将测序得到的Raw reads进行质控,去除带接头的、低质量的reads,得到Clean reads。使用STAR比对软件将reads比对到猪Sus Scrofa 11.1参考基因组,然后通过FeatureCounts功能模块对每个基因的reads数进行统计,并根据基因长度进行标准化。利用DEseq2软件鉴别差异表达基因。差异表达基因的检出条件为校正P值(Padj) < 0.001且log2(fold change)≥1。依据差异基因表达量,利用R软件Pheatmap程序包对差异基因进行聚类分析。利用DAVID(database for annotation,visualization,and integrated discovery)数据库对差异表达基因进行GO分类和KEGG通路富集分析,显著富集阈值为富集度count≥2且矫正P < 0.05。
1.2.10 荧光定量PCR验证 利用NCBI Primer-BLAST(https://www.ncbi.nlm.nih.gov/tools/primer-blast/)在线工具设计引物(表 1),引物由北京擎科生物科技有限公司合成。利用反转录试剂盒将RNA反转录为cDNA,以猪GAPDH基因作为内参,对筛选到的差异基因进行实时荧光定量检测。
|
|
表 1 荧光定量PCR引物信息 Table 1 Primers for RT-qPCR |
1.2.11 数据统计分析 荧光定量试验通过2-ΔΔCt法计算目的基因相对表达量。所有试验数据采用SPSS 20.0软件进行方差分析和差异显著性检验,使用GraphPad Prism 8软件对试验结果进行图像化处理。数据结果均用“平均值±标准误(Mean±SE)”表示。
2 结果 2.1 评价不同差异贴壁时间分离的猪背最长肌混合细胞中FAPs细胞的纯度为了研究不同差速贴壁时间分离的猪背最长肌混合细胞中FAPs细胞纯度,本研究首先利用酶消化法获得1日龄苏淮公猪背最长肌混合细胞(图 1),在差速贴壁30 min、1 h、90 min和2 h后,使用FAPs细胞特异表面抗原蛋白PDGFRα抗体,通过免疫荧光对细胞PDGFRα阳性率进行评价。结果如图 2所示,差速贴壁30 min分离的细胞中PDGFRα阳性率极显著高于其余3个试验组(P<0.001),且随贴壁时间的增加,分离得到的细胞中PDGFRα阳性率降低。说明差速贴壁30 min能获得纯度较高的FAPs细胞,其纯度可达(74.76±2.73)%。
|
图 1 苏淮猪背最长肌分离的原代细胞形态(100×) Fig. 1 The morphology of primary cells isolated from Suhuai pig longissimus dorsi muscle(100×) |
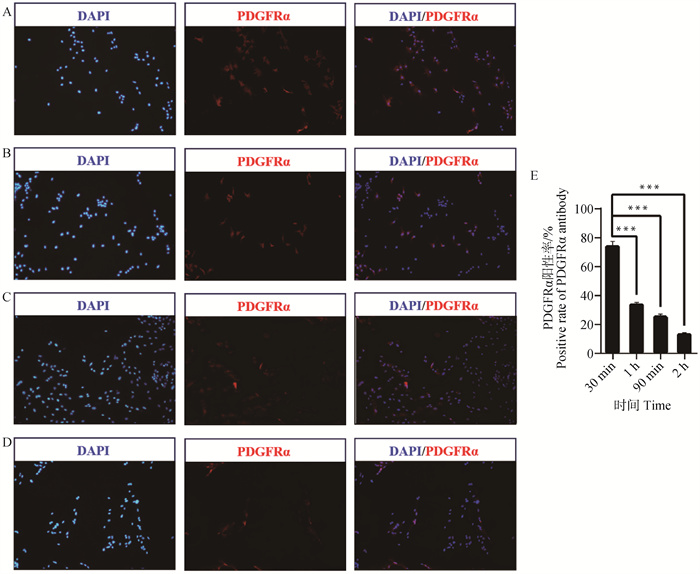
|
A. 差速贴壁30 min细胞免疫荧光染色结果(100×);B. 差速贴壁1 h细胞免疫荧光染色结果(100×);C. 差速贴壁90 min细胞免疫荧光染色结果(100×);D. 差速贴壁2 h细胞免疫荧光染色结果(100×);E. 4组差速贴壁时间PDGFRα阳性率比较。蓝色为DAPI细胞核染色,红色为PDGFRα染色。横坐标为细胞差速贴壁时间,纵坐标为PDGFRα阳性率,***表示差异极显著(P < 0.001), 下同 A. Immunofluorescence staining result of 30 min differential adherent cells; B. Immunofluorescence staining result of 1 h differential adherent cells; C. Immunofluorescence staining result of 90 min differential adherent cells; D. Immunofluorescence staining result of 2 h differential adherent cells; E. Comparison of positive rate of PDGFRα in 4 groups of differential adhesion time. Blue show DAPI, nuclear staining, Red show PDGFRα staining. The x-axis represents cell differential adhesion time, the y-axis represents positive rate of PDGFRα, *** indicate P < 0.001, the same as below 图 2 不同差速贴壁时间对FAPs细胞纯度的影响 Fig. 2 Effect of differential adhesion time on the purity of FAPs cells |
2.2.1 体外不同代数苏淮猪FAPs的PDGFRα阳性率比较 在体外培养苏淮猪FAPs细胞的过程中,发现随着传代次数的增加,FAPs的细胞形态发生改变,并且增殖速度明显下降。为了评价不同代数FAPs细胞的纯度,将原代FAPs细胞(P0)传代,比较在P1、P3和P5代时FAPs细胞中的PDGFRα阳性率,结果如图 3所示。与P1代相比,P3代FAPs细胞中的PDGFRα阳性率显著下降(P<0.05),P5代极显著下降(P<0.01);与P3代相比,P5代极显著下降(P<0.01),表明FAPs细胞在体外培养过程中,其纯度不断降低。

|
A. 不同代数FAPs细胞免疫荧光染色结果(100×);B. 不同代数FAPs细胞PDGFRα阳性率比较。蓝色为DAPI细胞核染色,红色为PDGFRα染色。横坐标为细胞代数,纵坐标为PDGFRα阳性率,*表示差异显著(P < 0.05),**表示差异极显著(P < 0.01) A. Immunofluorescence staining results of FAPs with different generations (100×); B. Comparison of positive rate of PDGFRα in FAPs of different generations. Blue show DAPI, nuclear staining, Red show PDGFRα staining. The x-axis represents cell generation, the y-axis represents positive rate of PDGFRα antibody, * indicate P < 0.05, ** indicate P < 0.01 图 3 体外不同代数FAPs细胞PDGFRα阳性率比较 Fig. 3 Comparison of positive rate of PDGFRα of FAPs cultured in vitro in different generations of Suhuai pig |
2.2.2 体外不同代数苏淮猪FAPs细胞成脂分化能力的比较 为评价体外不同代数苏淮猪FAPs细胞成脂分化能力。对P1、P3和P5代FAPs细胞进行成脂诱导分化,分别使用油红O染液和BODIPY荧光染料对其进行脂质染色,并收集蛋白进行甘油三酯含量检测,结果如图 4所示。苏淮猪P1代FAPs细胞油红O染色(图 4A)和BODIPY染色(图 4B)效果均好于P3和P5代细胞,且甘油三酯含量极显著高于另两组(图 4C,P<0.001)。表明P1代FAPs细胞具有较强的成脂分化能力,在显微镜下脂滴清晰可见,且分布比例较高,而P3和P5代的成脂分化能力显著下降。

|
A. 油红O染色结果,红色为脂滴(100×);B. BODIPY染色结果,绿色为脂滴(100×);C. 不同代数FAPs细胞甘油三酯含量比较。横坐标为细胞代数,纵坐标为甘油三酯含量 A. Oil red O staining, lipid droplet showed in red(100×); B. BODIPY staining, lipid droplet showed in green (100×); C. Comparison of triglyceride content in different generations of FAPs. The x-axis represents cell generation, the y-axis represents triglyceride content 图 4 体外不同代数苏淮猪FAPs细胞的油红O染色、BODIPY染色及甘油三酯含量比较 Fig. 4 Oil Red O staining, BODIPY staining and triglyceride content of FAPs cultured in vitro in different generations of Suhuai pig |
2.3.1 体外不同代数苏淮猪FAPs转录组测序数据统计 为了研究传代次数对苏淮猪FAPs成脂能力的影响,本研究利用RNA-Seq比较了P1、P3和P5代FAPs细胞的基因表达模式,每组3个生物学重复,收集细胞后提取RNA,质检合格后构建文库,然后送公司测序。结果显示,每个样品Clean Q30比例均在90%以上,Clean Q20比例均在96%以上,符合生物信息学分析要求(表 2)。
|
|
表 2 RNA-Seq数据统计 Table 2 RNA-Seq data statistics |
2.3.2 体外不同代数苏淮猪FAPs转录组测序数据PCA聚类分析 PCA聚类分析显示(图 5),RNA-Seq送测的每组3个重复样品均聚集到一起。表明其重复性较好。
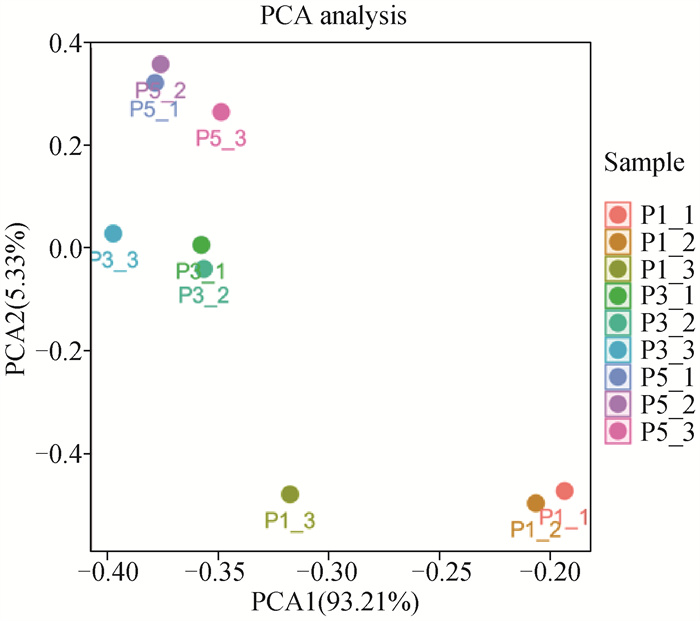
|
图 5 体外不同代数苏淮猪FAPs测序数据PCA聚类分析 Fig. 5 PCA cluster analysis of sequencing data from FAPs cultured in vitro in different generations of Suhuai pig |
2.3.3 体外不同代数苏淮猪FAPs细胞差异表达基因的鉴定 以Padj < 0.001且log2(fold change)≥1为条件,筛选差异表达基因。P3与P1代FAPs细胞相比,共鉴定到2 716个差异表达基因,其中显著上调基因1 226个,显著下调基因1 490个(图 6A和图 6D);P5与P1代相比,共有3 753个差异表达基因,其中显著上调基因1 787个,显著下调基因1 996个(图 6B和图 6E);P5与P3代相比,共有441个差异表达基因,其中显著上调基因349个,显著下调基因92个(图 6C和图 6F)。P5与P3代相比,鉴定到的差异基因较少,表明其基因表达模式更相似。
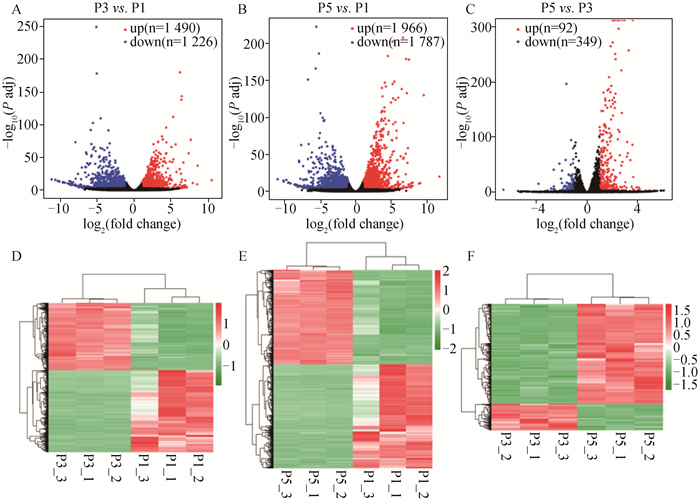
|
A. P3与P1代FAPs细胞差异表达基因火山图;B. P5与P1代FAPs细胞差异表达基因火山图;C. P5与P3代FAPs细胞差异表达基因火山图;D. P3与P1代FAPs细胞差异表达基因聚类热图;E. P5与P1代FAPs细胞差异表达基因聚类热图;F. P5与P3代FAPs细胞差异表达基因聚类热图 A. The volcano map of DEGs in P3 versus P1; B. The volcano map of DEGs in P5 versus P1; C. The volcano map of DEGs in P5 versus P3; D. Clustering heatmap of DEGs in P3 versus P1; E. Clustering heatmap of DEGs in P5 versus P1; F. Clustering heatmap of DEGs in P5 versus P3 图 6 体外不同代数苏淮猪FAPs细胞差异表达基因火山图和聚类热图 Fig. 6 Volcano map and clustering heatmap of DEGs from FAPs cultured in vitro in different generations of Suhuai pig |
2.3.4 P3与P1代FAPs细胞差异表达基因功能富集分析 P3与P1代FAPs细胞相比,差异上调基因主要富集于PI3K-AKT、HIF-1、GnRH、FoxO、cGMP-PKG和cAMP等KEGG信号通路(图 7A);锌离子、ATP结合、膜构成和胞质等GO条目(图 7B)。差异下调基因主要富集于Rap1、DNA复制、错配修复、碱基切除修复和核苷酸切除修复等KEGG信号通路(图 7C);转译、核糖体构成、细胞外隙和钙离子结合等GO条目(图 7D)。
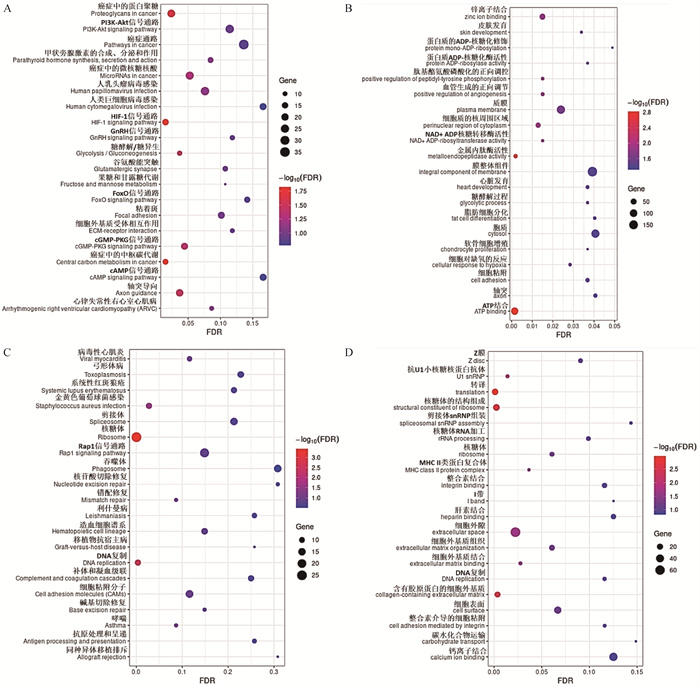
|
A. P3与P1代FAPs细胞差异上调表达基因KEGG分析气泡图;B. P3与P1代FAPs细胞差异上调表达基因GO分析气泡图;C. P3与P1代FAPs细胞差异下调表达基因KEGG分析气泡图;D. P3与P1代FAPs细胞差异下调表达基因GO分析气泡图 A. KEGG analysis bubble map of up-regulated DEGs in P3 versus P1; B. GO analysis bubble map of up-regulated DEGs in P3 versus P1; C. KEGG analysis bubble map of down-regulated DEGs in P3 versus P1; D. GO analysis bubble map of down-regulated DEGs in P3 versus P1 图 7 P3与P1代FAPs细胞差异表达基因KEGG和GO分析气泡图 Fig. 7 KEGG and GO analysis bubble maps of DEGs in P3 versus P1 FAPs cells |
2.3.5 P5与P1代FAPs细胞差异表达基因功能富集分析 P5与P1代FAPs细胞相比,差异上调基因主要富集于轴突导向、粘着斑、PI3K-AKT、Rap1、HIF-1、FoxO和AMPK等KEGG信号通路(图 8A);锌离子、ATP、Laminin结合、RNA聚合酶Ⅱ对转录的正向调控、整合素介导的信号通路等GO条目(图 8B)。差异下调基因主要富集于核糖体、代谢途径、DNA复制、错配修复、碱基切除修复和核苷酸切除修复等KEGG信号通路(图 8C);转译、核糖体构成、线粒体和细胞核等GO条目(图 8D)。
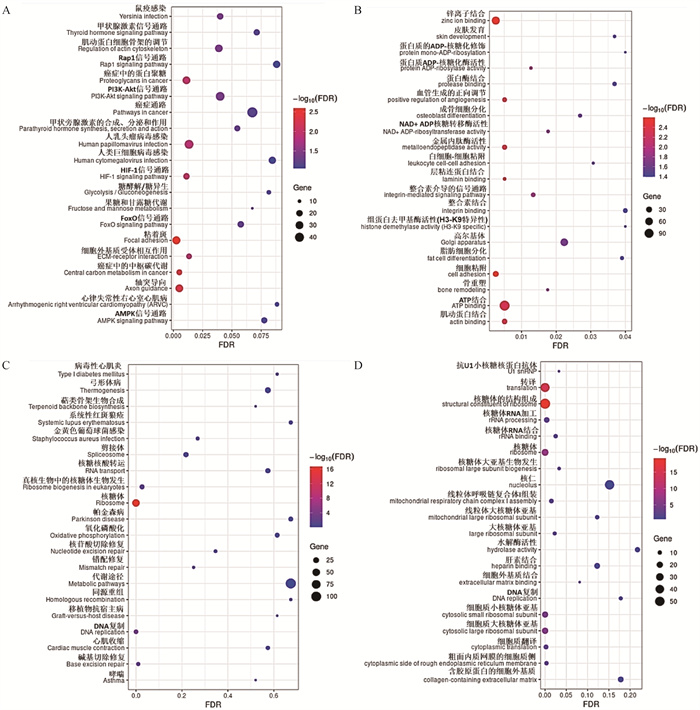
|
A. P5与P1代FAPs细胞差异上调表达基因KEGG分析气泡图;B. P5与P1代FAPs细胞差异上调表达基因GO分析气泡图;C. P5与P1代FAPs细胞差异下调表达基因KEGG分析气泡图;D. P5与P1代FAPs细胞差异下调表达基因GO分析气泡图 A. KEGG analysis bubble map of up-regulated DEGs in P5 versus P1; B. GO analysis bubble map of up-regulated DEGs in P5 versus P1; C. KEGG analysis bubble map of down-regulated DEGs in P5 versus P1; D. GO analysis bubble map of down-regulated DEGs in P5 versus P1 图 8 P5与P1代FAPs细胞差异表达基因KEGG和GO分析气泡图 Fig. 8 KEGG and GO analysis bubble maps of DEGs in P5 versus P1 FAPs cells |
2.3.6 P3、P5与P1相比共同差异表达基因富集的KEGG信号通路 鉴于P5和P3代FAPs细胞的基因表达模式比较相近,将P3与P1代以及P5与P1代鉴定的差异基因进行共有基因分析,发现1 102个共有差异上调基因(图 9A),主要富集于PI3K-AKT、HIF-1、FoxO、cGMP-PKG等信号通路(图 9C),其中胰岛素受体底物1(IRS1)、叉头转录因子3(FOXO3)、表皮生长因子受体(EGFR)、成纤维细胞生长因子1(FGF1)、细胞周期素G2(CCNG2)基因在以上通路中富集;共同差异下调表达基因1 234个(图 9B),主要富集于DNA复制、错配修复、碱基切除修复和核苷酸切除修复信号通路(图 9D),其中集落刺激因子1受体(CSF1R)、信号诱导增殖相关1型2(SIPA1L2)基因在以上通路中富集。
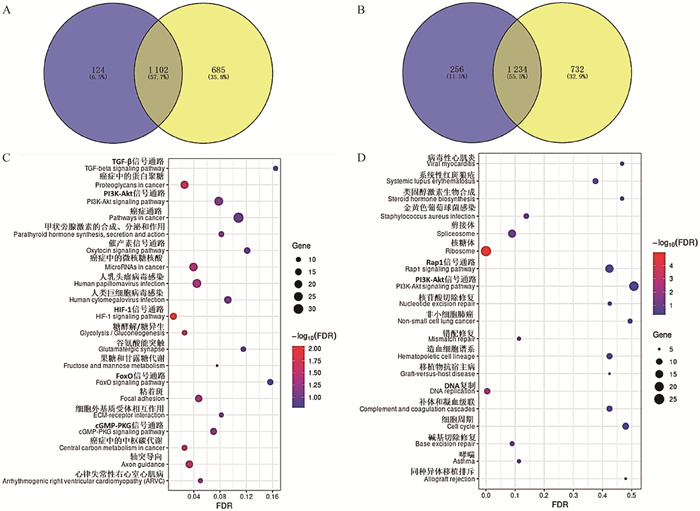
|
A. P3与P1(蓝色)和P5与P1(黄色)共有差异上调表达基因维恩图;B. P3与P1(蓝色)和P5与P1(黄色)共有差异下调表达基因维恩图;C. P5与P1和P3与P1共有差异上调表达基因KEGG分析气泡图;D. P5与P1和P3与P1共有差异下调表达基因KEGG分析气泡图 A. Venn diagram of common up-regulated DEGs both in P3 versus P1 (blue) and P5 versus P1 (yellow); B. Venn diagram of common down-regulated DEGs both in P3 versus P1 (blue) and P5 versus P1 (yellow); C. KEGG analysis bubble map of common up-regulated DEGs both in P5 versus P1 and P3 versus P1; D. KEGG analysis bubble map of common down-regulated DEGs both in P5 versus P1 and P3 versus P1 图 9 P3与P1和P5与P1共有差异表达显著基因KEGG信号通路 Fig. 9 KEGG signaling pathways of DEGs both in P3 versus P1 and P5 versus P1 |
2.3.7 P5与P3代FAPs细胞差异表达基因功能富集分析 P5与P3代FAPs细胞相比,差异上调基因主要富集于PI3K-AKT、Ras、cGMP-PKG、NOD-like和MAPK等KEGG信号通路(图 10A),其中TNF-α诱导蛋白3(TNFAIP3)、双调蛋白(AREG)、成纤维细胞生长因子1(FGF1)、成纤维细胞生长因子9(FGF9)基因在以上通路中富集;GO富集分析发现差异上调基因主要富集于质膜组成、细胞外隙、Laminin、胰岛素样生长因子结合、Ⅰ型干扰素信号通路和非典型Wnt信号通路等条目(图 10B)。
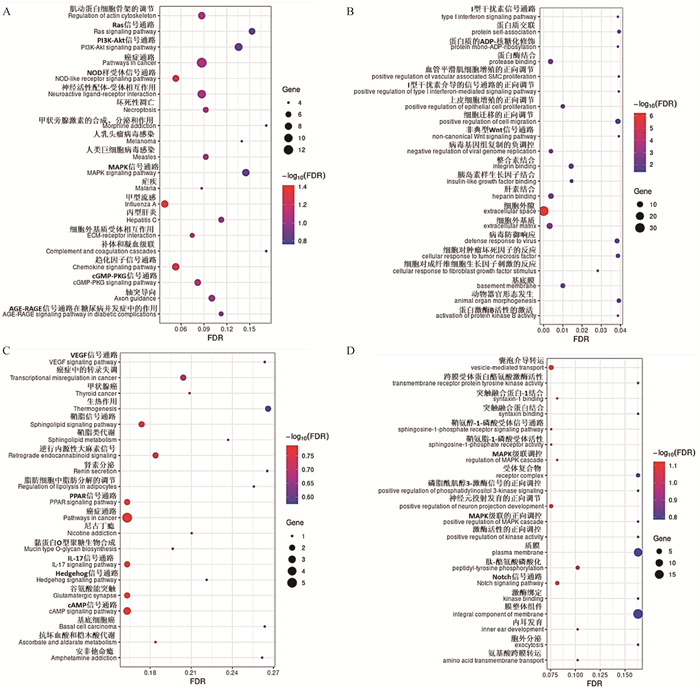
|
A. P5与P3代FAPs细胞差异上调表达基因KEGG分析气泡图;B. P5与P3代FAPs细胞差异上调表达基因GO分析气泡图;C. P5与P3代FAPs细胞差异下调表达基因KEGG分析气泡图;D. P5与P3代FAPs细胞差异下调表达基因GO分析气泡图 A. KEGG analysis bubble map of up-regulated DEGs in P5 versus P3; B. GO analysis bubble map of up-regulated DEGs in P5 versus P3; C. KEGG analysis bubble map of down-regulated DEGs in P5 versus P3; D. GO analysis bubble map of down-regulated DEGs in P5 versus P3 图 10 P5与P3代FAPs细胞差异表达基因KEGG和GO分析气泡图 Fig. 10 KEGG and GO analysis bubble maps of DEGs in P5 versus P3 FAPs cells |
差异下调基因主要富集于脂肪细胞中脂肪分解的调节、VEGF、PPAR、IL-17、cAMP和鞘脂等KEGG信号通路(图 10C),其中过氧化物酶体增殖物激活受体γ(PPARγ)、脂质运载蛋白2(LCN2)、CCAAT增强子结合蛋白α(C/EBPα)基因在以上通路中富集;GO富集分析发现差异下调基因主要富集于磷脂酰肌醇3-激酶信号的正向调控、MAPK级联的正向调控、鞘氨醇-1-磷酸受体和Notch信号通路等GO条目(图 10D)。
2.4 荧光定量PCR验证进一步对其中7个DEGs进行RT-qPCR验证,如图 11所示,4个基因(IRS1、FGF9、TNFAIP3、AREG)随细胞传代次数增加表达量上调,3个基因(CSF1R、C/EBPα、PPARγ)随细胞传代次数增加表达量下调,其表达量变化趋势与转录组测序结果一致。
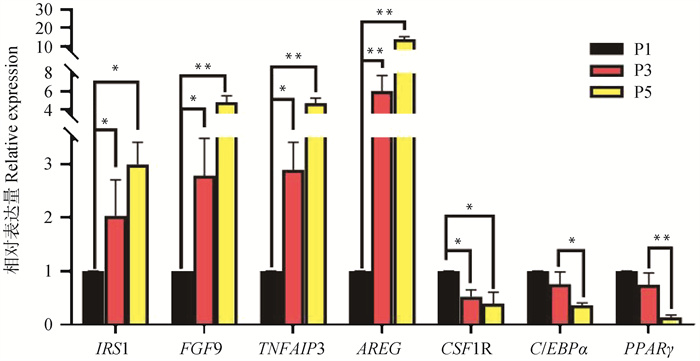
|
图 11 体外不同代数苏淮猪FAPs差异表达基因qPCR验证 Fig. 11 qPCR verification of DEGs from FAPs cultured in vitro in different generations of Suhuai pig |
单细胞转录组测序发现, 骨骼肌由肌管细胞、肌卫星细胞、FAPs细胞、血管内皮细胞等多种细胞类群组成,每类细胞群在调节肌肉的动态平衡与肌肉再生方面发挥着不同的作用。在健康的肌肉中,FAPs细胞并不具有肌肉再生潜力,但其可通过与肌卫星细胞互作来维持肌肉组织稳态并协助肌卫星细胞应对肌肉损伤[14]。
FAPs细胞位于肌纤维间隙,具有双重分化潜能,既可以分化为储存脂肪的脂肪细胞,又可以分化为表达I型胶原蛋白的纤维细胞,研究表明FAPs细胞在IMF的沉积过程中发挥重要作用[15]。为在体外研究FAPs细胞的成脂分化能力,需要分离纯度较高的细胞。目前在人和小鼠上主要使用流式细胞分选技术结合荧光标记的特异性抗体来分离鉴定FAPs细胞[16-18],然而这些流式抗体在猪上的特异性差,难以用于高纯度猪FAPs细胞的分离,因此需要探究其他分离方法。
早期研究利用差速贴壁法在体外成功分离培养了小型猪的脂肪间质干细胞[19]。目前,猪骨骼肌卫星细胞的分离也采用差速贴壁2 h的方法进行纯化,有关FAPs细胞的分离技术大部分是基于流式的,是否可通过差速贴壁分离出FAPs细胞有待研究。考虑到大部分脂肪细胞在0.5~3 h内即可完成贴壁过程,且30 min内贴壁的细胞数少,为了尽可能区分肌卫星细胞,本研究选择了30 min、1 h、90 min和2 h四个不同的差速贴壁时间,利用FAPs的表面特异抗原PDGFRα对分离的细胞纯度进行鉴定。结果显示,30 min贴壁的细胞中PDGFRα阳性率极显著高于其他3组,后续成脂分化能力的评价试验也表明差速贴壁30 min的细胞符合FAPs的特征,表现出较强的成脂分化能力。因此,采用差速贴壁30 min可获得纯度较高的猪FAPs细胞,本试验提供了一种在猪上分离较高纯度FAPs的简便方法。
3.2 关于体外不同代数FAPs细胞基因表达模式变化的分析在试验过程中发现,猪FAPs在体外传代过程中其增殖速度减慢、成脂分化能力降低,且表型变化主要发生在P1到P3阶段,为研究其原因,利用RNA-Seq比较了不同代数FAPs细胞的基因表达模式变化。
P3与P1代差异基因KEGG分析表明,差异上调基因主要富集到PI3K-AKT、HIF-1、GnRH、FoxO、cGMP-PKG和cAMP等信号通路,其中PI3K-AKT、HIF-1、FoxO和cGMP-PKG信号通路在P5阶段也表达上调,说明在FAPs细胞体外培养过程中,这些通路被激活,其中IRS1、FOXO3、CCNG2、EGFR、FGF1等差异基因在以上通路中富集。研究发现, IRS1丝氨酸残基的磷酸化可通过激活Ras-MAPK和PI3K-AKT信号级联反应来抑制AKT的磷酸化激活[20],导致受AKT负调控的转录因子FOXO的表达增加[21]。FOXO可以通过激活细胞周期抑制因子p27和p21,以及失活细胞周期蛋白c-Myc和Cyclin D1来抑制细胞增殖[22]。CCNG2在非肥胖人群脂肪组织中表达更高,能诱使生长抑制因子p53高表达,导致细胞周期停滞,因此其可作为细胞周期的抑制因子,负调控脂肪细胞增殖和脂肪细胞功能[23]。Zhong等[23]首次证明,EGFR-PI3K-AKT-mTOR通路的激活可以在蛋白水平上正向调节缺氧诱导因子1(HIF-1)。Regazzetti等[24]研究发现,高水平的HIF-1抑制胰岛素受体酪氨酸的磷酸化,从而抑制人脂肪细胞和3T3-L1脂肪细胞中的胰岛素信号通路,并最终抑制脂肪细胞分化。Wang等[25]利用吴茱萸胺刺激3T3-L1脂肪细胞中EGFR的酪氨酸磷酸化,从而激活EGFR-PKCa-ERK信号通路,并发现脂肪生成受到抑制,因此EGFR能够通过调节下游基因的表达来抑制脂肪细胞分化。高浓度的FGF1能够促进成纤维细胞增殖[26],同时显著降低组织中脂肪细胞的数量[27],并通过激活BMP信号通路来抑制脂肪细胞的成脂分化[28]。
P3与P1代差异基因KEGG分析表明,差异下调基因主要富集到DNA复制、错配修复、碱基切除修复和核苷酸切除修复等信号通路,这些信号通路在P5阶段也表达下调,其中CSF1R和SIPA1L2基因在以上通路中富集。研究发现,在缺失CSF1R表达的小鼠中,脂肪细胞的凋亡速度加快并且增殖受到抑制,在注射CSF1R后脂肪组织的退化得到缓解[29],表明CSF1R对脂肪细胞的生存和增殖起重要作用。Chen等[30]发现,使用鸢尾素能够激活Rap1-PI3K-AKT信号通路,其处理组的SIPA1L2表达水平降低,促进肌卫星细胞成骨分化,其后在高脂肪组心脏组织中检测到SIPA1L2高表达[31],提示SIPA1L2与脂肪含量存在一定的正相关性。
此外,P5与P3代相比,在差异上调基因富集的通路中额外鉴定到NOD-like、MAPK和非典型Wnt信号通路,其中包括TNFAIP3、AREG、FGF1、FGF9差异基因;在差异下调基因富集的通路中鉴定到VEGF、PPAR、Notch以及IL-17信号通路,其中包括PPARγ、C/EBPα、LCN2差异基因。TNFAIP3在肥胖人群的脂肪细胞中高表达[32],体外试验表明,TNFAIP3可抑制脂肪生成的关键标志物AP2的表达,导致分化的3T3-L1细胞中脂质积累减少[33],表明TNFAIP3是一种脂肪生成抑制剂。分离哺乳动物皮下高表达AREG基因的前体脂肪细胞群,发现无论在体外还是在体内,前体脂肪细胞都表现出抗脂肪生成功能,后续的多组学和功能研究证明AREG通过抑制视黄酸信号通路对PPAR的正向调控,从而抑制脂肪生成[34]。FGF-FGFR信号传导可以调节脂肪细胞分化基因的表达[35],Huang等[36]研究表明,FGF9与FGFR2相互作用,通过调节PPARγ和前脂肪细胞因子1(Pref1)来抑制山羊肌内脂肪细胞分化。PPARγ是人和小鼠等动物脂肪生成的关键转录调控因子,能够直接调控脂肪细胞分化和脂类代谢相关基因的表达[37]。过表达PPARγ可使胚胎成纤维细胞和成肌细胞转分化为脂肪细胞[38]。C/EBPα和PPARγ均是成脂标志基因,C/EBPα参与诱导PPARγ的表达,并且C/EBPα和PPARγ都能够通过正反馈循环诱导彼此的表达,从而促进和维持脂肪细胞分化状态[39]。缺乏C/EBPα会导致小鼠体外成脂分化中的胰岛素抵抗并阻碍体内白色脂肪组织的形成[40]。LCN2是一种在脂质稳态中起作用的细胞因子,Guo等[41]发现LCN2的缺乏降低了从小鼠SVFs中分离的脂肪细胞的分化能力,进一步研究发现LCN2的降低导致脂肪组织中TGF-β的上升,TGF-β抑制脂肪细胞成脂的作用增强,说明LCN2在脂肪细胞分化过程中发挥正向调控作用。
4 结论本研究发现,差速贴壁30 min可从猪背最长肌消化的混合细胞中获得纯度较高的FAPs细胞。在体外传代过程中,猪FAPs细胞的体外增殖和成脂分化能力均下降。RNA-Seq结果表明, IRS1、FOXO3、CCNG2、EGFR、FGF1基因的表达随着FAPs细胞传代次数增加持续上调,这些基因可抑制细胞的增殖和成脂分化能力,并使细胞表现出向成纤维细胞分化的趋势;再者,CSF1R和SIPA1L2基因的表达随着FAPs细胞传代次数增加持续下降,潜在的抑制了FAPs细胞的增殖。通过比较FAPs细胞P3到P5代的转录模式,发现可抑制成脂分化的TNFAIP3、AREG、FGF1、FGF9基因表达上调,而可促进成脂分化的LCN2以及成脂标记基因PPARγ和C/EBPα基因表达下调,提示这一阶段成脂分化能力进一步降低。综上所述,FAPs细胞在体外培养过程中发生了较大的基因表达模式的改变,研究结果有望为开发能维持猪FAPs细胞体外成脂能力的培养基配方提供参考。
| [1] |
WOOD J D, ENSER M, FISHER A V, et al. Fat deposition, fatty acid composition and meat quality: a review[J]. Meat Sci, 2008, 78(4): 343-358. DOI:10.1016/j.meatsci.2007.07.019 |
| [2] |
DU M, WANG B, FU X, et al. Fetal programming in meat production[J]. Meat Sci, 2015, 109: 40-47. DOI:10.1016/j.meatsci.2015.04.010 |
| [3] |
JOE A W B, YI L, NATARAJAN A, et al. Muscle injury activates resident fibro/adipogenic progenitors that facilitate myogenesis[J]. Nat Cell Biol, 2010, 12(2): 153-163. DOI:10.1038/ncb2015 |
| [4] |
UEZUMI A, FUKADA S, YAMAMOTO N, et al. Identification and characterization of PDGFRα+ mesenchymal progenitors in human skeletal muscle[J]. Cell Death Dis, 2014, 5(4): e1186. DOI:10.1038/cddis.2014.161 |
| [5] |
DU M, HUANG Y, DAS A K, et al. Meat Science and Muscle Biology Symposium: manipulating mesenchymal progenitor cell differentiation to optimize performance and carcass value of beef cattle[J]. J Anim Sci, 2013, 91(3): 1419-1427. DOI:10.2527/jas.2012-5670 |
| [6] |
LI X, FU X, YANG G, et al. Review: enhancing intramuscular fat development via targeting fibro-adipogenic progenitor cells in meat animals[J]. Animal, 2020, 14(2): 312-321. DOI:10.1017/S175173111900209X |
| [7] |
AGLEY C C, ROWLERSON A M, VELLOSO C P, et al. Human skeletal muscle fibroblasts, but not myogenic cells, readily undergo adipogenic differentiation[J]. J Cell Sci, 2013, 126(Pt 24): 5610-5626. |
| [8] |
KRUK Z A, BOTTEMA M J, REYES-VELIZ L, et al. Vitamin A and marbling attributes: intramuscular fat hyperplasia effects in cattle[J]. Meat Sci, 2018, 137: 139-146. DOI:10.1016/j.meatsci.2017.11.024 |
| [9] |
CHEN F F, WANG Y Q, TANG G R, et al. Differences between porcine longissimus thoracis and semitendinosus intramuscular fat content and the regulation of their preadipocytes during adipogenic differentiation[J]. Meat Sci, 2019, 147: 116-126. DOI:10.1016/j.meatsci.2018.09.002 |
| [10] |
MOLINA T, FABRE P, DUMONT N A. Fibro-adipogenic progenitors in skeletal muscle homeostasis, regeneration and diseases[J]. Open Biol, 2021, 11(12): 210110. DOI:10.1098/rsob.210110 |
| [11] |
DENG B, ZHANG F, WEN J H, et al. The transcriptomes from two adipocyte progenitor cell types provide insight into the differential functions of MSTN[J]. Genomics, 2020, 112(5): 3826-3836. DOI:10.1016/j.ygeno.2020.01.024 |
| [12] |
AYKAN A, OZTURK S, SAHIN I, et al. The effects of hydrogen sulfide on adipocyte viability in human adipocyte and adipocyte-derived mesenchymal stem cell cultures under ischemic conditions[J]. Ann Plast Surg, 2015, 75(6): 657-665. DOI:10.1097/SAP.0000000000000595 |
| [13] |
CHAPMAN M A, MUKUND K, SUBRAMANIAM S, et al. Three distinct cell populations express extracellular matrix proteins and increase in number during skeletal muscle fibrosis[J]. Am J Physiol Cell Physiol, 2017, 312(2): C131-C143. DOI:10.1152/ajpcell.00226.2016 |
| [14] |
JUDSON R N, LOW M, EISNER C, et al. Isolation, culture, and differentiation of fibro/adipogenic progenitors (FAPs) from skeletal muscle[M]//RYALL J G. Skeletal Muscle Development. New York: Humana Press, 2017: 93-103.
|
| [15] |
UEZUMI A, FUKADA S I, YAMAMOTO N, et al. Mesenchymal progenitors distinct from satellite cells contribute to ectopic fat cell formation in skeletal muscle[J]. Nat Cell Biol, 2010, 12(2): 143-152. DOI:10.1038/ncb2014 |
| [16] |
WOSCZYNA M N, BISWAS A A, COGSWELL C A, et al. Multipotent progenitors resident in the skeletal muscle interstitium exhibit robust BMP-dependent osteogenic activity and mediate heterotopic ossification[J]. J Bone Miner Res, 2012, 27(5): 1004-1017. DOI:10.1002/jbmr.1562 |
| [17] |
ALECOVA B, GATTO S, ETXANIZ U, et al. Dynamics of cellular states of fibro-adipogenic progenitors during myogenesis and muscular dystrophy[J]. Nat Commun, 2018, 9(1): 3670. DOI:10.1038/s41467-018-06068-6 |
| [18] |
TAHA M F, HEDAYATI V. Isolation, identification and multipotential differentiation of mouse adipose tissue-derived stem cells[J]. Tissue Cell, 2010, 42(4): 211-216. DOI:10.1016/j.tice.2010.04.003 |
| [19] |
CHEN M, CHOI S, WEN T, et al. A p53-phosphoinositide signalosome regulates nuclear AKT activation[J]. Nat Cell Biol, 2022, 24(7): 1099-1113. DOI:10.1038/s41556-022-00949-1 |
| [20] |
ZHANG H B, DOMMA A J, GOODRUM F D, et al. The akt forkhead box O transcription factor axis regulates human cytomegalovirus replication[J]. mBio, 2022, 13(4): e0104222. DOI:10.1128/mbio.01042-22 |
| [21] |
BLOEDJES T A, DE WILDE G, MAAS C, et al. AKT signaling restrains tumor suppressive functions of FOXO transcription factors and GSK3 kinase in multiple myeloma[J]. Blood Adv, 2020, 4(17): 4151-4164. DOI:10.1182/bloodadvances.2019001393 |
| [22] |
GARRIDO-SÁNCHEZ L, DEL MAR ROCA-RODRÍGUEZ M, FERNÁNDEZ-VELEDO S, et al. CCNG2 and CDK4 is associated with insulin resistance in adipose tissue[J]. Surg Obes Relat Dis, 2014, 10(4): 691-696. DOI:10.1016/j.soard.2013.12.011 |
| [23] |
ZHONG H, CHILES K, FELDSER D, et al. Modulation of hypoxia-inducible factor 1alpha expression by the epidermal growth factor/phosphatidylinositol 3-kinase/PTEN/AKT/FRAP pathway in human prostate cancer cells: implications for tumor angiogenesis and therapeutics[J]. Cancer Res, 2000, 60(6): 1541-1545. |
| [24] |
REGAZZETTI C, PERALDI P, GRÉMEAUX T, et al. Hypoxia decreases insulin signaling pathways in adipocytes[J]. Diabetes, 2009, 58(1): 95-103. DOI:10.2337/db08-0457 |
| [25] |
WANG T, WANG Y X, YAMASHITA H. Evodiamine inhibits adipogenesis via the EGFR-PKCα-ERK signaling pathway[J]. FEBS Lett, 2009, 583(22): 3655-3659. DOI:10.1016/j.febslet.2009.10.046 |
| [26] |
WANG S P, CAO S, ARHATTE M, et al. Adipocyte Piezo1 mediates obesogenic adipogenesis through the FGF1/FGFR1 signaling pathway in mice[J]. Nat Commun, 2020, 11(1): 2303. DOI:10.1038/s41467-020-16026-w |
| [27] |
JONKER J W, SUH J M, ATKINS A R, et al. A PPARγ-FGF1 axis is required for adaptive adipose remodelling and metabolic homeostasis[J]. Nature, 2012, 485(7398): 391-394. DOI:10.1038/nature10998 |
| [28] |
SCHALL N, GARCIA J J, KALYANARAMAN H, et al. Protein kinase G1 regulates bone regeneration and rescues diabetic fracture healing[J]. JCI Insight, 2020, 5(9): e135355. DOI:10.1172/jci.insight.135355 |
| [29] |
O'BRIEN J, MARTINSON H, DURAND-ROUGELY C, et al. Macrophages are crucial for epithelial cell death and adipocyte repopulation during mammary gland involution[J]. Development, 2012, 139(2): 269-275. DOI:10.1242/dev.071696 |
| [30] |
CHEN T Q, PENG Y, HU W J, et al. Irisin enhances chondrogenic differentiation of human mesenchymal stem cells via Rp1/PI3K/AKT axis[J]. Stem Cell Res Ther, 2022, 13(1): 392. DOI:10.1186/s13287-022-03092-8 |
| [31] |
GENG X, IRVIN M R, HIDALGO B, et al. An exome-wide sequencing study of lipid response to high-fat meal and fenofibrate in Caucasians from the GOLDN cohort[J]. J Lipid Res, 2018, 59(4): 722-729. DOI:10.1194/jlr.P080333 |
| [32] |
AI L Y, XU Q Q, WU C W, et al. A20 Attenuates FFAs-induced lipid accumulation in nonalcoholic steatohepatitis[J]. Int J Biol Sci, 2015, 11(12): 1436-1446. DOI:10.7150/ijbs.13371 |
| [33] |
AI L Y, WANG X H, CHEN Z W, et al. A20 reduces lipid storage and inflammation in hypertrophic adipocytes via p38 and Akt signaling[J]. Mol Cell Biochem, 2016, 420(1-2): 73-83. DOI:10.1007/s11010-016-2768-0 |
| [34] |
ZACHARA M, RAINER P Y, HASHIMI H, et al. Mammalian adipogenesis regulator (Areg) cells use retinoic acid signalling to be non-and anti-adipogenic in age-dependent manner[J]. EMBO J, 2022, 41(18): e108206. DOI:10.15252/embj.2021108206 |
| [35] |
BEENKEN A, MOHAMMADI M. The FGF family: biology, pathophysiology and therapy[J]. Nat Rev Drug Discov, 2009, 8(3): 235-253. DOI:10.1038/nrd2792 |
| [36] |
HUANG K, WANG Y, ZHU J J, et al. Regulation of fibroblast growth factor 9 on the differentiation of goat intramuscular adipocytes[J]. Anim Sci J, 2021, 92(1): e13627. DOI:10.1111/asj.13627 |
| [37] |
MANCA C, PINTUS S, MURRU E, et al. Fatty acid metabolism and derived-mediators distinctive of PPAR-α activation in obese subjects post bariatric surgery[J]. Nutrients, 2021, 13(12): 4340. DOI:10.3390/nu13124340 |
| [38] |
TAKAHASHI J, TAKAHASHI N, TADAISHI M, et al. Valerenic acid promotes adipocyte differentiation, adiponectin production, and glucose uptake via its PPARγ ligand activity[J]. ACS Omega, 2022, 7(51): 48113-48120. DOI:10.1021/acsomega.2c06120 |
| [39] |
EL-JACK A K, HAMM J K, PILCH P F, et al. Reconstitution of insulin-sensitive glucose transport in fibroblasts requires expression of both PPARγ and C/EBPα[J]. J Biol Chem, 1999, 274(12): 7946-7951. DOI:10.1074/jbc.274.12.7946 |
| [40] |
SHARMA N, KAUR R, YADAV B, et al. Transient delivery of A-C/EBP protein perturbs differentiation of 3T3-L1 cells and induces preadipocyte marker genes[J]. Front Mol Biosci, 2020, 7: 603168. |
| [41] |
GUO H, BAZUINE M, JIN D Z, et al. Evidence for the regulatory role of lipocalin 2 in high-fat diet-induced adipose tissue remodeling in male mice[J]. Endocrinology, 2013, 154(10): 3525-3538. DOI:10.1210/en.2013-1289 |
(编辑 郭云雁)



