捻转血矛线虫(Haemonchus contortus)寄生于反刍动物第四胃,以吸食宿主血液为生,破坏胃黏膜,引发贫血等临床症状,导致动物生长缓慢,重症可致死亡,广泛分布于全球各地,给畜牧业发展带来严重危害[1-2]。
磷脂酰肌醇转移蛋白(phosphatidylinositol transfer protein,PITP)是一类能够在膜之间转移磷脂酰肌醇(phosphatidylinositol, PI)的脂质转移蛋白[3],参与质膜上普遍存在的由G蛋白偶联受体介导的磷脂酰肌醇信号通路,该信号通路中4, 5-二磷酸磷脂酰肌醇(phosphatidylinositol 4, 5-bisphosphate, PIP2)是由PI依次通过磷脂酰肌醇4-激酶(phosphatidylinositol 4-kinase, PI4K)和磷脂酰肌醇4-磷酸5-激酶(phosphatidylinositol 4-phosphate 5-kinase, PI4P5K)两种脂质激酶的磷酸化而产生,最终磷脂酶C(phospholipase C, PLC)消耗的是PI,而PI是在内质网上转化而成,这2种激酶又都位于质膜上,因此将PI运送至质膜至关重要,通常认为可以通过PITP来进行运输[4-5]。已有研究证明PITPα亚型能够维持PIP2的水解以支持该通路的信号传导[6-7],并与催化PIP2生成的PI4P5K一起发挥作用[8-9],还发现其为胞吐过程所需的关键因子[9-10]。目前已发现定位于感觉神经元突触的秀丽隐杆线虫PITP同源物能够通过转运PI使该通路成功合成二酰基甘油(diacylglycerol, DG),从而调节突触传递,调节味觉、嗅觉等多种感觉刺激产生的效应行为[11],同时该蛋白能够通过磷脂酰肌醇-4-磷酸(phosphatidylinositol 4-phosphate,PI4P)和磷脂酸(phosphatidic acid,PA)控制DG的产量,限制蛋白激酶C(protein kinase C, PKC)的活性,引起缺氧后边缘行为的快速恢复等神经效应[12]。
实验室前期从捻转血矛线虫外泌体蛋白质谱分析结果中鉴定出了磷脂酰肌醇转移蛋白,但对其分泌原因与作用机制尚不清楚。本文根据NCBI上发布的HCPITP的核苷酸序列,克隆表达了该基因,并对重组蛋白的功能进行了初步研究,以期为深入了解虫体与宿主间的相互作用奠定基础。
1 材料与方法 1.1 试验材料1.1.1 试验动物与虫体 山羊,6~8月龄,购自江苏省海门市,饲养于南京农业大学实验动物中心。捻转血矛线虫(南京分离株)保存于南京农业大学兽医寄生虫病学研究室。6周龄SPF雌性SD大鼠(约200 g)购自北京维通利华实验动物公司,饲养于南京农业大学实验动物中心。
1.1.2 主要试剂与材料 大肠杆菌DH5α和BL21(DE3)工程菌与pET-28a(+)原核表达载体保存于本实验室;RNA isolater、HiScript Ⅲ反转录试剂购自南京诺唯赞公司;限制性内切酶EcoRⅠ和XhoⅠ、PrimeSTAR高保真DNA聚合酶购自宝生物工程有限公司;HRP标记Rabbit Anti-Goat IgG、HRP标记Goat Anti-Rat IgG购自南京巴傲得公司;DAB显色试剂盒购自天根生物公司;qPCR试剂盒购自北京全式金公司;淋巴细胞分离液购自天津灏洋公司;RPMI 1640培养基、双抗溶液购自Gibco公司;Cell Counting Kit-8(CCK-8)为美国GlpBio公司产品;Cy3标记山羊抗大鼠IgG购自碧云天公司。引物由通用生物公司合成。
1.2 HCPITP基因的克隆与表达1.2.1 引物设计与合成 根据NCBI中HCPITP的CDS序列(CDJ90012.1)设计引物,选择酶切位点EcoRⅠ和XhoⅠ,引物如下:5′-CG-GAATTC ATGATTGTCAAAGAATATCGTGT-CGTT-3′(HCPITP F),5′-CCCTCGAGTTATGTAGCGGTCATTCCTCGCA-3′(HCPITP R),下划线部分的序列表示酶切位点。
1.2.2 目的基因的扩增与原核表达质粒的构建 TRIzol法提取捻转血矛线虫成虫总RNA,反转录合成cDNA,用引物HCPITP F和R进行PCR扩增,反应程序设置为98 ℃变性10 s,55 ℃退火15 s,72 ℃延伸10 s,循环35次。胶回收PCR产物,用EcoR Ⅰ和Xho Ⅰ将该产物和pET-28a(+)质粒分别进行双酶切。酶切产物4 ℃连接过夜,转化大肠杆菌DH5α。重组菌培养12~16 h,双酶切与测序鉴定。阳性质粒命名为pET-28a-HCPITP。
1.2.3 重组蛋白HCPITP的表达及纯化 将pET-28a-HCPITP转化至大肠杆菌BL21 (DE3),挑取单菌落37 ℃,180 r·min-1振荡培养7~8 h至菌液OD600 nm值为0.4~0.6,加入IPTG至其终浓度为1 mmol·L-1,继续振荡培养5 h,SDS-PAGE分析蛋白分布情况。用镍柱纯化重组蛋白。
1.2.4 重组蛋白HCPITP多克隆抗体的制备 将500 μg重组蛋白与等体积弗氏完全佐剂混合乳化,对2只雌性SD大鼠多点皮下注射进行初次免疫;两周后,将400 μg重组蛋白与等体积弗式不完全佐剂混合乳化,进行第二次免疫;此后每周免疫一次,直至四免,方法与二免一致。四免10 d后,心脏采血,收集血清。
1.2.5 重组蛋白HCPITP的Western blot分析 将重组蛋白进行SDS-PAGE,转印至PVDF膜,50 g·L-1脱脂奶37 ℃封闭1 h,分别将感染捻转血矛线虫的山羊血清与未感染的山羊血清作为一抗(1∶100稀释),4 ℃孵育过夜,将Rabbit Anti-Goat IgG作为二抗(1∶5 000稀释),37 ℃孵育1 h,DAB试剂盒显色。
1.3 HCPITP基因阶段性转录水平分析筛选并优化引物,使目的基因与内参基因引物扩增效率一致,如表 1所示。TRIzol法分别提取捻转血矛线虫雌虫、雄虫、第三期幼虫、虫卵等阶段虫体的总RNA,反转录合成cDNA,进行qPCR,反应程序设置为94 ℃预变性30 s,之后94 ℃ 5 s和60 ℃ 30 s,循环40次。用2-ΔΔCt法分析HCPITP基因在不同发育阶段的转录情况。以雌虫转录水平为参照分析数据。
|
|
表 1 qPCR引物 Table 1 The Primers of qPCR |
1.4.1 山羊PBMCs的分离 山羊颈静脉采集抗凝血,按照淋巴细胞分离液说明书分离山羊PBMCs,台盼蓝染色观察活细胞占95%以上,用含1%双抗和10%胎牛血清的RPMI 1640培养基调整细胞浓度至106个·mL-1,用于后续试验。
1.4.2 重组蛋白HCPTIP与山羊PBMCs的结合 细胞悬液中加入重组蛋白(终浓度10 μg·mL-1) 作为试验组,加等量PBS作阴性对照组,37 ℃,50 mL·L-1CO2孵育2~3 h。离心收集细胞,用4%多聚甲醛固定15 min,用50 g·L-1BSA于37 ℃封闭1 h,以大鼠抗HCPITP血清为一抗(1∶100稀释)4 ℃孵育过夜,以Cy3标记的山羊抗大鼠IgG为二抗(1∶500稀释)37 ℃孵育1 h,DAPI染色,滴加抗荧光淬灭封片液后封片,激光共聚焦显微镜观察并拍照。
1.4.3 重组蛋白HCPITP对山羊PBMCs增殖的影响 设置阳性组、阴性组和试验组,在阳性组与试验组中加入ConA溶液(工作浓度10 μg·mL-1),37 ℃,50 mL·L-1CO2条件下孵育24 h刺激细胞。然后,在试验组中加重组蛋白HCPITP(终浓度分别为10、20、40、80 μg·mL-1),在阴性组中加入和终浓度为10 μg·mL-1的蛋白相同体积的PBS,继续孵育24 h。加CCK-8后再孵育4 h,测定OD450nm,计算增殖指数。
1.4.4 重组蛋白HCPITP对山羊PBMCs模式识别受体转录水平的影响 选择山羊模式识别受体中属于Toll样受体(Toll-like receptors, TLRs)家族的Toll样受体1~10(Toll-like receptors1 ~ Toll-like receptors 10,TLR1~TLR10),属于核苷酸结合寡聚化结构域样受体[nucleotide-binding oligomerization domain(NOD)-like receptors, NLRs]家族中的NLR家族含CARD结构蛋白4(NLR family CARD domain-containing protein 4, NLRC4),属于C型凝集素受体(C-type lectin receptor, CLRs)家族的C型凝集素结构域家族4成员D(C-type lectin domain family 4, member D, CLEC4D)、C型凝集素结构域家族4成员E(C-type lectin domain family 4, member E, CLEC4E)和属于维甲酸诱导基因-I样受体(retinoic-acid-inducible gene I(RIG-I)-like receptors, RLRs)家族的黑色素瘤分化相关基因5 (melanoma differentiation-associated gene 5, MDA5),按照GenBank中这14种PRRs的基因与β-肌动蛋白(β-Actin)基因的核苷酸序列,设计qPCR引物并优化,引物信息见表 2。
|
|
表 2 山羊模式识别受体qPCR引物 Table 2 The Primers of Goat Pattern Recognition Receptor for qPCR |
设置试验组与阴性对照组,在试验组中加重组蛋白(终浓度分别为10、20、40、80 μg·mL-1),阴性对照组中加入和终浓度为10 μg·mL-1的蛋白等量的PBS,37 ℃、50 mL·L-1CO2孵育24 h。TRIzol法分别提取各孔细胞总RNA,合成cDNA,进行qPCR反应,反应程序同“1.3”。
1.4.5 重组蛋白HCPITP对山羊PBMCs细胞因子转录水平的影响 选择本实验室早期筛选的山羊细胞因子白细胞介素2(interleukin-2,IL-2)、干扰素-γ(interferon-γ,IFN-γ)、白细胞介素6(interleukin-6,IL-6)、白细胞介素17(interleukin-17,IL-17)、白细胞介素10(interleukin-10,IL-10)、转化生长因子-β1(transforming growth factor-β1,TGF-β1)、白细胞介素4(interleukin-4,IL-4)编码基因以及内参基因β-Actin的qPCR引物,优化后进行后续试验。引物信息见表 3。
|
|
表 3 山羊细胞因子qPCR引物 Table 3 The Primers of Goat Cytokine for qPCR |
以“1.4.4”中合成的cDNA为模板进行qPCR,反应程序同“1.3”。
1.4.6 数据统计分析 用SPSS软件对数据进行单因素方差分析(one-way ANOVA)与邓肯多重范围检验(Duncan multiple-range test),用小写字母表示各组间的差异,相同字母代表差异不显著(P>0.05),不同字母代表差异显著(P < 0.05),用Graphpad Prism软件制图,结果表示为“x±s”。
2 结果 2.1 HCPITP蛋白预测分析根据该蛋白氨基酸序列,在线预测其理论等电点为6.14,分子量31.1 ku,无跨膜区与信号肽,以仅含一个PITP结构域的单域蛋白质存在,主要运送磷脂酰肌醇(非囊泡形式),该蛋白与磷脂酰肌醇(PI)复合物的三级结构如图 1B所示。选取了其他10个物种的PITP用MEGA11软件构建进化树(图 1A),显示与秀丽隐杆线虫PITP的亲缘关系最相近。

|
A.HCPITP进化树分析;B.PITP与磷脂酰肌醇复合物的三级结构,扫描文章首页OSID码可查看彩图 A. Phylogenetic tree of HCPITP; B. Tertiary structure of PITP and phosphatidylinositol complex, the color picture can be found by scanning the OSID code on the front page of the article 图 1 HCPTIP进化树分析及PITP与磷脂酰肌醇复合物的三级结构 Fig. 1 HCPTIP phylogenetic tree analysis and tertiary structure of PITP and phosphatidylinositol complex |
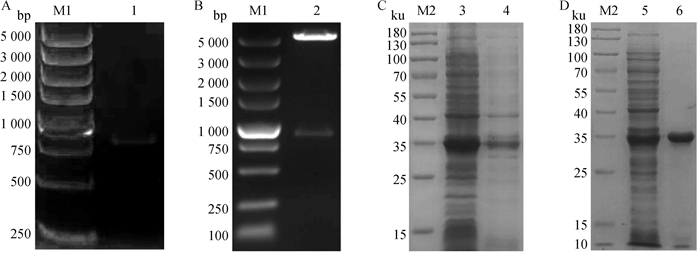
琼脂糖凝胶电泳验证扩增产物,观察到816 bp处有单一条带(图 2A),双酶切鉴定重组质粒pET-28a-HCPITP,在相应位置分别观察到载体与目的基因条带(图 2B),重组蛋白主要分布于上清(图 2C),蛋白纯化效果良好,大小约为35 ku(图 2D)。
|
A.HCPITP基因PCR扩增;B. 重组质粒pET-28a-HCPITP的双酶切鉴定;C. 重组蛋白HCPITP的分布情况;D. 重组蛋白HCPITP的纯化效果。M1. DL5000 DNA相对分子质量标准;1. PCR扩增产物;2. 重组质粒经EcoR I和Xho I双酶切;M2. 蛋白质相对分子质量标准;3. HCPITP在上清的分布情况;4. HCPITP在包涵体的分布情况;5. HCPITP主要分布于上清;6. HCPITP的纯化结果 A. PCR amplification of HCPITP gene; B. Identification of pET-28a-HCPITP digested by restriction endonuclease; C. Distribution of recombinant protein HCPITP; D. Purification of recombinant proteins HCPITP. M1. DL5000 DNA marker; 1. PCR amplification product; 2. The recombinant plasmid was digested by EcoR I and Xho I; M2. Protein marker; 3. Distribution of HCPITP in supernatant; 4. Distribution of HCPITP in inclusion bodies; 5. HCPITP is mainly distributed in the supernatant; 6. Purification results of HCPITP 图 2 HCPITP基因克隆表达及蛋白表达纯化 Fig. 2 HCPITP gene cloning and expression and protein purification |
Western blot结果显示在35 ku左右有一特异性条带,而阴性对照无条带(图 3),说明该重组蛋白具有良好的反应原性,能够被感染山羊免疫系统所识别。

|
M.蛋白质相对分子质量标准;1.重组蛋白HCPITP与山羊阳性血清的Western blot分析;2.重组蛋白HCPITP与山羊阴性血清的Western blot分析 M. Protein marker; 1. Western blot analysis of recombinant proteins HCPITP with goat positive serum; 2. Western blot analysis of recombinant proteins HCPITP with goat negative serum 图 3 重组蛋白HCPITP Western blot分析 Fig. 3 Western blot analysis of recombinant proteins HCPITP |
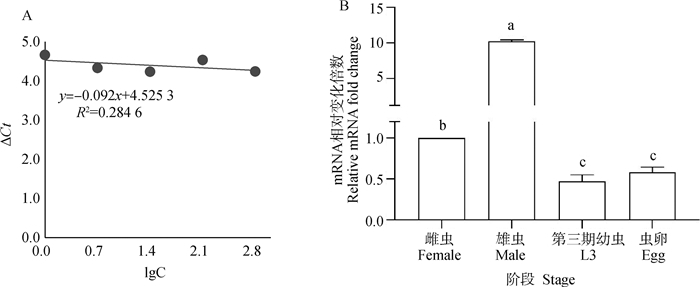
反应体系中HCPITP引物浓度为0.21 μmol·L-1时,其扩增效率与内参基因一致,以ΔCt(HCPITP Ct值-内参基因Ct值)为纵坐标,虫体cDNA浓度梯度的lg值为横坐标,制作散点图,趋势线方程为y=-0.092x+4.525 3,R2=0.284 6,|斜率| < 0.1(图 4A),确定引物符合2-ΔΔCt法的应用要求,能够用以检测HCPITP基因转录水平。
|
A. cDNA不同稀释梯度下β-tubulin与HCPITP之间ΔCt变化;B. HCPITP基因在捻转血矛线虫不同发育阶段转录水平变化。差异显著性用小写字母表示,字母相同即为差异不显著(P>0.05),字母不相同即为差异显著(P < 0.05) A. Changes of ΔCt between β-tubulin and HCPITP under different dilution gradients of cDNA; B. Transcriptional changes of HCPITP gene in different developmental stages of Haemonchus contortus. The significance of the difference is indicated by lowercase letters, the same letter means the difference is not significant (P>0.05), and the different letter means the difference is significant (P < 0.05) 图 4 引物筛选结果及HCPITP转录水平阶段性分析 Fig. 4 Results of primer screening and phased analysis of HCPITP transcript levels |
HCPITP基因在捻转血矛线虫不同发育阶段的转录水平有显著差异(P < 0.05),在雌虫、雄虫、第三期幼虫和虫卵中的相对转录水平分别为1、10.2、0.47和0.58。
2.5 重组蛋白HCPITP与山羊PBMCs结合间接免疫荧光结果显示,Cy3标记(红色荧光)的山羊抗大鼠抗体成功识别了结合HCPITP的大鼠多抗,并观察到与DAPI染色(蓝色荧光)的PBMCs共定位,而阴性对照组未见红色荧光(图 5),表明HCPITP能与山羊PBMCs结合。

|
HCPITP.重组蛋白; Control.阴性对照; DAPI.细胞核染色蓝色荧光;Cy3.二抗标记红色荧光;Merge.红蓝荧光通道叠加。扫描文章首页OSID码可查看彩图 HCPITP. Recombinant protein; Control. Negative control; DAPI. Nuclear staining (blue fluorescence); Cy3. Secondary antibody labeled red fluorescence; Merge. Red and blue fluorescence channel overlay. The color pictures can be found by scanning the OSID code on the front page of the article 图 5 重组蛋白HCPITP与山羊PBMCs的体外结合 Fig. 5 In vitro binding of recombinant proteins HCPITP to goat PBMCs |
与阴性对照组相比,ConA刺激后能够显著促进PBMCs增殖(P < 0.05),而重组蛋白HCPITP能够显著抑制ConA对PBMCs增殖的促进作用(P < 0.05),其中10 μg·mL-1蛋白浓度组与其他浓度组相比抑制幅度较小(图 6)。

|
差异显著性用小写字母表示,字母相同即为差异不显著(P>0.05),字母不相同即为差异显著(P < 0.05) The significance of the difference is indicated by lowercase letters, the same letter means the difference is not significant (P>0.05), and the different letter means the difference is significant (P < 0.05) 图 6 重组蛋白HCPITP对山羊PBMCs增殖的影响 Fig. 6 Effects of recombinant proteins HCPITP on the proliferation of goat PBMCs |
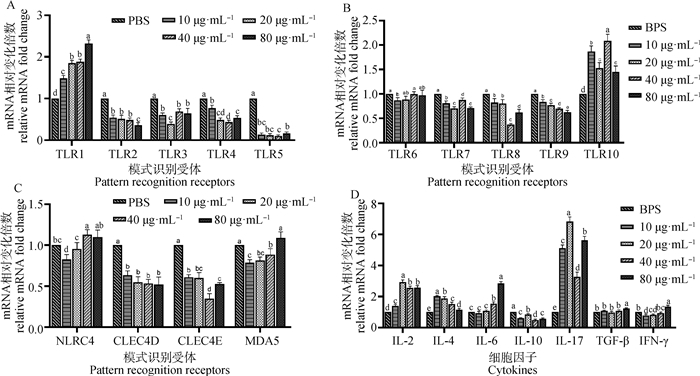
与阴性对照组相比,重组HCPITP能显著抑制TLR2-TLR5、TLR7-TLR9、CLEC4D与CLEC4E的表达(P < 0.05),其中对TLR5的抑制作用最大,对TLR9的抑制作用随浓度升高而增强,对于NLRC4与MDA5,10 μg·mL-1时明显抑制(P < 0.05)。HCPITP显著提升TLR1和TLR10的转录水平(P < 0.05),其中对TLR1的作用呈剂量依赖性(图 7A~C)。
|
差异显著性用小写字母表示,字母相同即为差异不显著(P>0.05),字母不相同即为差异显著(P < 0.05) The significance of the difference is indicated by lowercase letters, the same letter means the difference is not significant (P>0.05), and the different letter means the difference is significant (P < 0.05) 图 7 重组蛋白HCPITP对山羊PBMCs模式识别受体(A~C)、细胞因子(D)转录水平的影响 Fig. 7 Effects of recombinant protein HCPITP on the PRRs (A-C), cytokines (D) transcription level in goat PBMCs |
与阴性对照组相比,HCPITP对IL-2、IL-4和IL-17都具有显著刺激作用(P < 0.05),其中对IL-17的刺激效果最明显,对IL-4的作用随浓度升高而减弱。重组蛋白浓度为40和80 μg·mL-1时能显著提升IL-6(P < 0.05)表达。该蛋白能够显著抑制IL-10的转录水平(P < 0.05)。重组蛋白浓度为80 μg·mL-1时可刺激TGF-β的转录。浓度为10和20 μg·mL-1时显著抑制IFN-γ的转录,但80 μg·mL-1时显著刺激其表达(P < 0.05)。(图 7D)。
3 讨论随着捻转血矛线虫抗药性的产生与发展[13-15],研究捻转血矛线虫与宿主间相互作用、鉴定对宿主具有免疫调节能力的虫体蛋白、筛选新的疫苗候选抗原对该病的免疫预防具有重要意义。
本试验从前期通过质谱鉴定到的蛋白中选取了HCPITP,分析了该基因在虫体不同发育阶段的转录情况,目前认为HCPITP的作用主要是负责转运磷脂酰肌醇以保证磷脂酰肌醇信号通路中PIP2的足量供应[8],在虫卵和第三期幼虫中转录水平极低,推测可能是由于虫体并未发育到入侵寄生的活跃阶段,致表达量较低,为后续的功能研究提供参考依据。
Western blot分析显示HCPITP具有良好的反应原性,间接免疫荧光试验也验证了其与山羊PBMCs的结合,已有研究证明,捻转血矛线虫多种重组蛋白抗原能够与山羊PBMCs在体外结合并引起一系列免疫系统的变化效应[16-18],因而进一步探究了HCPITP对山羊PBMCs功能的影响。结果表明HCPITP能够显著抑制ConA对PBMCs增殖作用,抑制结果与阴性对照组无明显差异,说明该重组蛋白可能能够抑制宿主的免疫反应[19-21],推测或许与免疫逃避有关,需要进一步研究。
PRRs作为寄生虫入侵时遭遇的第一道防线,将寄生虫携带或分泌的病原体相关分子模式(pathogen-associated molecular patterns, PAMPs)作为其配体进行识别,触发下游的先天免疫反应,主要分为TLRs、RLRs、CLRs和NLRs四大类[22-25]。HCPITP作用于PBMCs后,TLR2~TLR9、NLRC4、CLEC4D、CLEC4E、MDA5的转录水平表现为显著抑制或无明显变化,其中TLR5的水平最低,可能是该受体主要以细菌的鞭毛蛋白为配体[26],与寄生虫的关联度较低的原因,TLR1与TLR10转录水平都显著提升,其中TLR1的提升呈剂量依赖性,故HCPITP可能主要通过TLR1与TLR10激活下游先天免疫反应,某些寄生虫先天免疫的文献也报道了类似情况[27-29]。
辅助性T细胞(Th)在受到抗原刺激后能够分化成不同的效应T细胞亚群,这些亚群又能够分泌不同的细胞因子谱,指示免疫调节的不同方向[30-33]。PBMCs细胞因子转录水平变化情况显示,Treg细胞相关的细胞因子IL-10与TGF-β表现为抑制或无明显变化,炎症因子IL-6呈剂量依赖性升高,IL-17又一直处于较高的转录水平,据此推测HCPITP对PBMCs的“促炎性”可能随着浓度的升高而增强。对于IL-2和IL-4,HCPITP的提升作用显著,其中IL-2一直处于较高的水平,而蛋白对IL-4的作用随浓度升高而减弱,同时IFN-γ水平又有随浓度逐渐提升的趋势,已经有研究证明IL-2能够决定抗原激活的CD4+T细胞向Th1或向Th2转化的命运[34-35],推测在HCPITP作用于PBMCs时,IL-2一直在维持Th1型与Th2型免疫反应的平衡,随着浓度的升高,表现出了从Th2型逐渐偏向Th1型的倾向,如果属实,这也证明了抗原对T细胞分化的诱导并不是一成不变的,可能由于浓度、时间或其他条件的变化,导致免疫调节的主要方向发生改变[31]。
综上所述,HCPITP对PBMCs可能具有免疫调节作用。由于该蛋白是捻转血矛线虫外泌体蛋白,推测虫体可能通过调节外泌体中该蛋白的携带量,靶向作用于宿主免疫细胞,灵活调节宿主免疫反应,从而达到免疫逃避的效果,但相关机制的可能性仍需进一步研究。
4 结论捻转血矛线虫HCPITP基因的转录具有明显的阶段差异性,HCPITP重组蛋白能够抑制ConA对山羊外周血单个核细胞的增殖,对山羊细胞因子IL-2、IL-4、IL-6和IL-17以及模式识别受体TLR1和TLR10的转录具有促进作用。
| [1] |
ALI R, ROOMAN M, MUSSARAT S, et al. A systematic review on comparative analysis, toxicology, and pharmacology of medicinal plants against Haemonchus contortus[J]. Front Pharmacol, 2021, 12: 644027. DOI:10.3389/fphar.2021.644027 |
| [2] |
ZENEBE S, FEYERA T, ASSEFA S. In vitro anthelmintic activity of crude extracts of aerial parts of Cissus quadrangularis L. and leaves of Schinus molle L. against Haemonchus contortus[J]. Biomed Res Int, 2017, 2017: 1905987. |
| [3] |
HSUAN J, COCKCROFT S. The PITP family of phosphatidylinositol transfer proteins[J]. Genome Biol, 2001, 2(9): REVIEWS3011. |
| [4] |
COCKCROFT S, GARNER K. Potential role for phosphatidylinositol transfer protein (PITP) family in lipid transfer during phospholipase C signalling[J]. Adv Biol Regul, 2013, 53(3): 280-291. DOI:10.1016/j.jbior.2013.07.007 |
| [5] |
MICHELL R H. Inositol phospholipids and cell surface receptor function[J]. Biochim Biophys Acta, 1975, 415(1): 81-147. DOI:10.1016/0304-4157(75)90017-9 |
| [6] |
THOMAS G M H, CUNNINGHAM E, FENSOME A, et al. An essential role for phosphatidylinositol transfer protein in phospholipase C-mediated inositol lipid signaling[J]. Cell, 1993, 74(5): 919-928. DOI:10.1016/0092-8674(93)90471-2 |
| [7] |
KAUFFMANN-ZEH A, THOMAS G M H, BALL A, et al. Requirement for phosphatidylinositol transfer protein in epidermal growth factor signaling[J]. Science, 1995, 268(5214): 1188-1190. DOI:10.1126/science.7761838 |
| [8] |
HAY J C, FISETTE P L, JENKINS G H, et al. ATP-dependent inositide phosphorylation required for Ca2+-activated secretion[J]. Nature, 1995, 374(6518): 173-177. DOI:10.1038/374173a0 |
| [9] |
FENSOME A, CUNNINGHAM E, PROSSER S, et al. ARF and PITP restore GTPγS-stimulated protein secretion from cytosol-depleted HL60 cells by promoting PIP2 synthesis[J]. Curr Biol, 1996, 6(6): 730-738. DOI:10.1016/S0960-9822(09)00454-0 |
| [10] |
HAY J C, MARTIN T F J. Phosphatidylinositol transfer protein required for ATP-dependent priming of Ca2+-activated secretion[J]. Nature, 1993, 366(6455): 572-575. DOI:10.1038/366572a0 |
| [11] |
IWATA R, ODA S, KUNITOMO H, et al. Roles for class ⅡA phosphatidylinositol transfer protein in neurotransmission and behavioral plasticity at the sensory neuron synapses of Caenorhabditis elegans[J]. Proc Natl Acad Sci U S A, 2011, 108(18): 7589-7594. DOI:10.1073/pnas.1016232108 |
| [12] |
ABERGEL Z, SHAKED M, SHUKLA V, et al. The phosphatidylinositol transfer protein PITP‐1 facilitates fast recovery of eating behavior after hypoxia in the nematode Caenorhabditis elegans[J]. FASEB J, 2021, 35(1): e21202. |
| [13] |
CHAPARRO J J, VILLAR D, ZAPATA J D, et al. Multi-drug resistant Haemonchus contortus in a sheep flock in Antioquia, Colombia[J]. Vet Parasitol Reg Stud Reports, 2017, 10: 29-34. |
| [14] |
DOS SANTOS J M L, VASCONCELOS J F, FROTA G A, et al. Quantitative molecular diagnosis of levamisole resistance in populations of Haemonchus contortus[J]. Exp Parasitol, 2019, 205: 107734. DOI:10.1016/j.exppara.2019.107734 |
| [15] |
DUARTE E R, MATIAS A D, BASTOS G A, et al. Anthelmintic efficacy of trichlorfon and blood parameters of young lambs infected with Haemonchus contortus[J]. Vet Parasitol, 2019, 272: 40-43. DOI:10.1016/j.vetpar.2019.06.015 |
| [16] |
WANG W, WANG S, ZHANG H, et al. Galectin Hco-gal-m from Haemonchus contortus modulates goat monocytes and T cell function in different patterns[J]. Parasit Vectors, 2014, 7: 342. DOI:10.1186/1756-3305-7-342 |
| [17] |
EHSAN M, GADAHI J A, LU M M, et al. Recombinant elongation factor 1 alpha of Haemonchus contortus affects the functions of goat PBMCs[J]. Parasite Immunol, 2020, 42(5): e12703. |
| [18] |
WEN Z H, ALEEM M T, AIMULAJIANG K, et al. The GT1-TPS structural domain protein from Haemonchus contortus could Be suppressive antigen of goat PBMCs[J]. Front Immunol, 2022, 12: 787091. DOI:10.3389/fimmu.2021.787091 |
| [19] |
MOLL H. Dendritic cells and host resistance to infection[J]. Cell Microbiol, 2003, 5(8): 493-500. DOI:10.1046/j.1462-5822.2003.00291.x |
| [20] |
JACOBS H J, ASHMAN K, MEEUSEN E. Humoral and cellular responses following local immunization with a surface antigen of the gastrointestinal parasite Haemonchus contortus[J]. Vet Immunol Immunopathol, 1995, 48(3-4): 323-332. DOI:10.1016/0165-2427(95)05439-D |
| [21] |
GILL H S. Cell-mediated immunity in merino lambs with genetic resistance to Haemonchus contortus[J]. Int J Parasitol, 1994, 24(5): 749-756. DOI:10.1016/0020-7519(94)90131-7 |
| [22] |
KAWAI T, AKIRA S. Toll-like receptors and their crosstalk with other innate receptors in infection and immunity[J]. Immunity, 2011, 34(5): 637-650. |
| [23] |
REHWINKEL J, GACK M U. RIG-I-like receptors: their regulation and roles in RNA sensing[J]. Nat Rev Immunol, 2020, 20(9): 537-551. |
| [24] |
DROUIN M, SAENZ J, CHIFFOLEAU E. C-type lectin-like receptors: head or tail in cell death immunity[J]. Front Immunol, 2020, 11: 251. |
| [25] |
DUXBURY Z, WU C H, DING P T. A Comparative overview of the intracellular guardians of plants and animals: NLRs in innate immunity and beyond[J]. Annu Rev Plant Biol, 2021, 72: 155-184. |
| [26] |
HAYASHI F, SMITH K D, OZINSKY A, et al. The innate immune response to bacterial flagellin is mediated by Toll-like receptor 5[J]. Nature, 2001, 410(6832): 1099-1103. |
| [27] |
YIN F Y, LIU J L, GAO S D, et al. Exploring the TLR and NLR signaling pathway relevant molecules induced by the Theileria annulata infection in calves[J]. Parasitol Res, 2018, 117(10): 3269-3276. |
| [28] |
SIMONE O, BEJARANO M T, PIERCE S K, et al. TLRs innate immunereceptors and Plasmodium falciparum erythrocyte membrane protein 1 (PfEMP1) CIDR1α-driven human polyclonal B-cell activation[J]. Acta Trop, 2011, 119(2-3): 144-150. |
| [29] |
ZHANG F K, HOU J L, GUO A J, et al. Expression profiles of genes involved in TLRs and NLRs signaling pathways of water buffaloes infected with Fasciola gigantica[J]. Mol Immunol, 2018, 94: 18-26. |
| [30] |
RAPHAEL I, NALAWADE S, EAGAR T N, et al. T cell subsets and their signature cytokines in autoimmune and inflammatory diseases[J]. Cytokine, 2015, 74(1): 5-17. |
| [31] |
O'SHEA J J, PAUL W E. Mechanisms underlying lineage commitment and plasticity of helper CD4+ T cells[J]. Science, 2010, 327(5969): 1098-1102. |
| [32] |
THORNTON A M, SHEVACH E M. Suppressor effector function of CD4+CD25+ immunoregulatory T cells is antigen nonspecific[J]. J Immunol, 2000, 164(1): 183-190. |
| [33] |
SHEVACH E M. CD4+CD25+ suppressor T cells: more questions than answers[J]. Nat Rev Immunol, 2002, 2(6): 389-400. |
| [34] |
LIAO W, LIN J X, LEONARD W J. IL-2 family cytokines: new insights into the complex roles of IL-2 as a broad regulator of T helper cell differentiation[J]. Curr Opin Immunol, 2011, 23(5): 598-604. |
| [35] |
LIAO W, LIN J X, WANG L, et al. Modulation of cytokine receptors by IL-2 broadly regulates differentiation into helper T cell lineages[J]. Nat Immunol, 2011, 12(6): 551-559. |
(编辑 白永平)



